一種李斯特菌增菌培養基及制備方法與流程
本發明公開了一種選擇性增菌培養基,屬于微生物學領域。
背景技術:
李斯特菌是一類兼性細胞內生長的革蘭陽性菌。目前李斯特菌屬共有17個種,其中致病性的李斯特菌有單增李斯特菌和伊氏李斯特菌,能引起人和動物的李斯特菌病,是重要的食源性人獸共患病原菌。臨床表現為人和動物的腦膜炎、敗血癥及孕婦流產、發熱性胃腸炎等,臨床死亡率較高。該菌廣泛存在于土壤、肉制品及水產品等中,能在高鹽、低溫、干燥等各種條件下生存,主要通過污染的食品傳播。20世紀80年代以來,單增李斯特菌在歐美國家多次暴發流行;我國各地食品監測結果顯示單增李斯特菌污染在食品中普遍存在,并曾在云南、福建、浙江等省引起禽畜間的感染暴發。
關于致病性李斯特菌的診斷,已經建立了許多方法。其中分離培養鑒定的方法仍是診斷的金標準。目前應用較多的分離培養方法是歐洲標準化委員會(eniso)的方法以及美國食品與藥品管理局(fda)的方法,中國也有自己的李斯特菌分離培養方法。這些方法可以對食品中含量較少的致病性李斯特菌進行增菌富集,使其達到可檢測的水平,從而對食品中的李斯特菌進行分離檢測以及后續實驗。
雖然eniso的分離方法可以將樣品中較低量的致病性李斯特菌進行分離培養檢測,但是非致病性李斯特菌和其他環境細菌也會存在于樣品中。由于非致病性李斯特菌以及其他環境細菌對增菌培養基有更好的適應性,在增菌培養基增菌培養的過程中,非致病性李斯特菌以及其他環境細菌的過快生長會掩蓋致病性李斯特菌的存在,從而造成假陰性檢測結果,會對人類健康造成嚴重隱患。另外目前分離培養李斯特菌的方法都需要兩步增菌過程,非常繁瑣費時。因此,本發明的目的就是提供一種李斯特菌增菌培養基,與目前廣泛應用的增菌培養基相比,擁有更有效的選擇性,更高的靈敏度,更簡單的培養分離步驟以及更短的培養分離時間。
技術實現要素:
基于上述發明目的,本發明首先提供了一種用于致病性李斯特菌選擇性分離的培養基,其特征在于,所述培養基含有β-d-阿洛糖。
在一個優選的技術方案中,所述培養基還含有胰蛋白胨、蛋白胨、牛肉浸粉、氯化鈉、磷酸氫二鈉。
在一個更為優選的技術方案中,所述組分以如下的質量體積千分比的配比溶于水中:
在一個尤為優選的技術方案中,所述培養基的ph值為7.1~7.3。
在一個最為優選的技術方案中,所述組分以質量體積千分比的配比為:
優選地,上述培養基還含有添加劑:鹽酸吖啶黃、萘啶酮酸和氯化鋰。
在一個優選的技術方案中,在所述培養基中,鹽酸吖啶黃的濃度為9.375mg/l,萘啶酮酸的濃度為7.5mg/l,氯化鋰的濃度為2.25g/l。
其次,本發明還提供了一種用于致病性李斯特菌選擇性分離的培養基的配制方法,所述方法包括以下步驟:
(1)按以下質量體積千分比的配比將各組分溶于水中:
(2)調節ph值為7.1~7.3;
(3)高壓滅菌。在一個優選的技術方案中,在步驟(1)中,所述培養基還含有添加劑:鹽酸吖啶黃、萘啶酮酸和氯化鋰。
在一個更為優選的技術方案中,在步驟(1)中,所述培養基中的鹽酸吖啶黃的濃度為9.375mg/l,萘啶酮酸的濃度為7.5mg/l,氯化鋰的濃度為2.25g/l。
本發明的有益效果在于:由于本發明的新型李斯特菌增菌培養基采用含有β-d-阿洛糖的基礎培養基和濃度較低的添加劑,與傳統培養基相比添加劑濃度降低25%,如此添加劑對致病性李斯特菌的損傷作用減小,有利于致病性李斯特菌在增菌培養過程中生長。與傳統的增菌培養基相比,本發明提供的培養基在分離致病性李斯特菌時靈敏度提高了16%,并且減少了一次培養步驟,縮短了48小時的培養時間。
附圖說明
圖1.三種細菌利用阿洛糖的biolog表型芯片檢測結果圖;
圖2.三種細菌在阿洛糖基礎培養基中的生長速率曲線圖;
圖3.三種細菌在阿洛糖基礎培養基中培養24小時后濃度目測圖;
圖4.伊氏李斯特菌(pam)與無害李斯特菌(lin)在含添加劑的新型增菌培養基中生長狀況對比柱狀圖;
圖5.三種細菌在含添加劑的新型增菌培養基與傳統增菌培養基中的生長狀況對比柱狀圖;
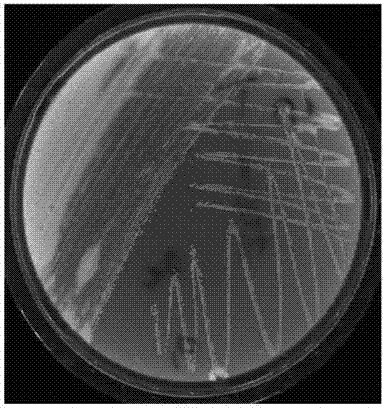
圖6.含添加劑的新型增菌培養基增菌后單增李斯特菌的分離結果;
圖7.傳統增菌培養基增菌后單增李斯特菌的分離結果
具體實施方式
下面結合具體實施例來進一步描述本發明,本發明的優點和特點將會隨著描述而更為清楚。但這些實施例僅是范例性的,并不對本發明的保護范圍構成任何限制。
實施例1.致病性李斯特菌和無害李斯特菌對生化底物的利用比較
1.菌株
單增李斯特菌參考株(atcc-baa-678,egd-e),無害李斯特菌參考株(atcc-baa-680,lin),伊氏李斯特菌參考株(atcc-baa-679,pam)。
2.試劑
biolog實驗所需試劑,包括氯化鎂、氯化鈣、精氨酸、谷氨酸、左旋胱氨酸、5’-尿苷酸鈉、酵母提取物、吐溫-80、雙蒸水、biolog顯色染料dyemix-f。
3.培養基配制
將氯化鎂、氯化鈣、精氨酸、谷氨酸、左旋胱氨酸、5’-尿苷酸鈉、酵母提取物、吐溫-80、雙蒸水按照biolog提供的操作程序制備成添加劑,然后將添加劑與biolog公司提供的培養液if-0agn/gp,顯色染料dyemix-f混合,制備出用于biolog實驗的培養基。
4.細菌培養
單增李斯特菌參考株(atcc-baa-678,egd-e)、無害李斯特菌參考株(atcc-baa-680,lin)、伊氏李斯特菌參考株(atcc-baa-679,pam)分別在腦心培養基上培養24小時,然后挑取菌落在生理鹽水中稀釋到特定濃度。
5.biolog表型芯片檢測
利用biolog表型芯片(美國biolog公司)觀察致病性李斯特菌(單增李斯特菌和伊氏李斯特菌)與無害李斯特菌(非致病)對阿洛糖利用的差異。將等量的單增李斯特菌、伊氏李斯特菌、無害李斯特菌的菌懸液分別接種到biolog表型芯片(pm2a)上,37℃培養48小時,利用genⅲomnilog(美國biolog公司)讀取三種菌對表型芯片上各種物質利用的差異。
結果如圖1所示,面積代表致病性李斯特菌與無害李斯特菌對表型芯片中底物的利用情況,深色代表致病性李斯特菌與無害李斯特菌對底物利用的差異情況,淺色代表致病性李斯特菌與無害李斯特菌對底物的共同利用情況。箭頭處的阿洛糖,致病性李斯特菌可以利用,而無害李斯特菌不可以利用。
實施例1顯示能否利用β-d-阿洛糖是致病性李斯特菌與無害李斯特菌的一個重要生化特性,因此本發明設計含有β-d-阿洛糖的增菌培養基,并將其用于致病性李斯特菌的選擇性分離和培養。
β-d-阿洛糖,中文名稱為β-d-阿洛糖,英文名稱:beta-d-allose,英文別名:d-allose,d-allopyranose,beta-d-allopyranose,cas:2595-97-3,einecs:219-994-4,分子式:c6h12o6,分子量:180.1559,相對密度:1.732g/cm3,沸點:410.8℃(760mmhg),閃點:202.2℃,蒸汽壓:1.83e-08mmhg(25)℃,分子式為:
實施例2.基礎增菌培養基的設計和配制
根據實施例1的實驗結果,將β-d-阿洛糖作為培養基的碳水化合物,并添加其他營養和化學成分基礎上,設計如下的基礎培養基配方并進行配制:
以上組分溶于1000ml蒸餾水,調節ph值到7.2,混勻后121℃滅菌15min,冷卻后放于4℃備用。
實施例3.基礎增菌培養基中細菌的生長速率對比
1.菌株
單增李斯特菌參考株(atcc-baa-678,egd-e),無害李斯特菌參考株(atcc-baa-680,lin),伊氏李斯特菌參考株(atcc-baa-679,pam)。
2.試劑
同實施例2。
3.培養基配制
按照實施例2配制。
4.細菌培養
單增李斯特菌參考株(atcc-baa-678,egd-e)、無害李斯特菌參考株(atcc-baa-680,lin)、伊氏李斯特菌參考株(atcc-baa-679,pam)在液體腦心培養基中培養至od=0.6,然后用磷酸鹽緩沖液(pbs)倍比稀釋至特定濃度。
5.生長速率測定
分別接種等量的單增李斯特菌、伊氏李斯特菌、無害李斯特菌到三個含有5ml阿洛糖基礎增菌培養基的od管,每隔3小時,取出100μl培養液,用pbs稀釋、涂板、計數,最后計算24小時內三種菌在阿洛糖基礎增菌培養基中的生長速率并比較(圖2)。如圖所示,相同條件下,阿洛糖基礎增菌培養基中單增李斯特菌的生長速率最快,伊氏李斯特菌的生長速率次之,無害李斯特菌的生長速率最慢。
實施例4.基礎增菌培養基中細菌24小時生長濃度對比
1.菌株
單增李斯特菌參考株(atcc-baa-678,egd-e),無害李斯特菌參考株(atcc-baa-680),伊氏李斯特菌參考株(atcc-baa-679,pam)。
2.試劑
同實施例2。
3.培養基配制
按照實施例2配制。
4.細菌培養
單增李斯特菌參考株(atcc-baa-678,egd-e)、無害李斯特菌參考株(atcc-baa-680,lin)、伊氏李斯特菌參考株(atcc-baa-679,pam)分別在腦心培養基上培養24小時,然后挑取菌落在pbs中稀釋到特定濃度。
5.生長速率測定
分別接種等量的單增李斯特菌、伊氏李斯特菌、無害李斯特菌到三個含有等量阿洛糖基礎增菌培養基的od管,相同條件下培養24小時,取出后測od值,并用肉眼觀察三者濁度有明顯差別(圖3)。如圖3所示,含有單增李斯特菌的od管濁度最高,含有伊氏李斯特菌的od管濁度次之,含有無害李斯特菌的od管濁度最低。
實施例5.含有添加劑的培養基配制
1.鹽酸吖啶黃溶液
0.1g鹽酸吖啶黃溶于10ml蒸餾水,震蕩混勻,配制成10g/l鹽酸吖啶黃溶液,4℃保存備用。
2.萘啶酮酸溶液
0.1g萘啶酮酸溶于8ml蒸餾水,然后滴加1mol/l的naoh溶液,直至萘啶酮酸完全溶解,然后定容到10ml,配制成10g/l的萘啶酮酸溶液,4℃保存備用。
3.氯化鋰溶液
3g氯化鋰溶于10ml蒸餾水,配制成300g/l氯化鋰溶液,4℃保存備用。
4.在實施例2配制的基礎增菌培養基中加入適量添加劑,最終增菌培養基中鹽酸吖啶黃的濃度為9.375mg/l,萘啶酮酸的濃度為7.5mg/l,氯化鋰的濃度為2.25g/l。
實施例6.含有添加劑的增菌培養基中伊氏李斯特菌(pam)與無害李斯特菌(lin)生長狀況觀測
1.菌株
伊氏李斯特菌參考株(atcc-baa-679,pam),無害李斯特菌參考株(atcc-baa-680)。
2.試劑
同實施例2,實施例5。
3.培養基配制
基礎培養基加入不同濃度添加劑。
4.細菌培養
伊氏李斯特菌參考株(atcc-baa-679,pam),無害李斯特菌參考株(atcc-baa-680,lin)分別在腦心培養基上培養24小時,然后挑取菌落在pbs中稀釋到特定濃度。
5.生長速率測定
將制備好的無害李斯特菌與伊氏李斯特菌的混合菌懸液(無害李斯特菌:伊氏李斯特菌=10:1),分別接種到含有不同添加劑濃度(0×,0.25×,0.5×,0.75×,1.0×,以傳統的half-fraser培養基中的添加劑濃度作為標準)的新型李斯特菌增菌培養基中,培養24小時后,分別計算各個增菌培養基中無害李斯特菌與伊氏李斯特菌的比例,確定最優添加劑濃度(圖4)。如圖4所示,為保證混合培養后伊氏李斯特菌的菌含量高于無害李斯特菌,同時確保添加劑對雜菌的抑制效果不會明顯減弱,最終確定添加劑的濃度為0.75×。新型李斯特菌增菌培養基中添加劑的濃度與傳統的half-fraser增菌培養基中相比減少了25%。
實施例7.新型李斯特菌增菌培養基與傳統增菌培養基(half-fraser增菌培養基)對混合菌液的增菌培養效果比較
1.菌株
單增李斯特菌參考株(atcc-baa-678,egd-e),無害李斯特菌參考株(atcc-baa-680),伊氏李斯特菌參考株(atcc-baa-679,pam)。
2.試劑
同實施例2,half-fraser李斯特菌增菌培養基(oxiod)。
3.培養基配制
按照實施例5配制含添加劑的李斯特菌增菌培養基;按照廠家(oxiod)要求配制half-fraser增菌培養基。
4.細菌培養
單增李斯特菌參考株(atcc-baa-678,egd-e)、無害李斯特菌參考株(atcc-baa-680,lin)、伊氏李斯特菌參考株(atcc-baa-679,pam)分別在腦心培養基上培養24小時,然后挑取菌落在pbs中稀釋到特定濃度。
5.兩種增菌培養基分離效果比較
將致病性李斯特菌(單增李斯特菌,伊氏李斯特菌)與無害李斯特菌的混合菌懸液分別接種到新型增菌培養基與傳統half-fraser增菌培養基中,按照各自要求的培養條件,培養相同時間后,比較兩種增菌培養基中致病性李斯特菌與無害李斯特菌的菌含量差異(圖5)。如圖5所示,伊氏李斯特菌與無害李斯特菌混合培養后,新型增菌培養基(laeb)中伊氏李斯特菌的菌含量高于無害李斯特菌,而傳統增菌培養基(half-fraser)中只有無害李斯特菌存在;單增李斯特菌與無害李斯特菌混合培養后,新型增菌培養基(laeb)中只有單增李斯特菌存在沒有無害李斯特菌,而傳統增菌培養基(half-fraser)中單增李斯特菌與無害李斯特菌的菌含量接近。
實施例8.含有添加劑的增菌培養基對模擬樣本中致病性李斯特菌的分離培養
1.菌株
單增李斯特菌參考株(atcc-baa-678,egd-e),無害李斯特菌參考株(atcc-baa-680)。
2.試劑
胰蛋白胨、蛋白胨、牛肉浸粉購自sigma公司,β-d-阿洛糖購自adamas公司,氯化鈉磷酸氫二鈉為國產分析純。fraser增菌培養基購自oxide公司;鹽酸吖啶黃、萘啶酮酸、氯化鋰購自美國amresco公司。
3.培養基配制
按照實施例5配制含添加劑的新型李斯特菌增菌培養基;按照廠家(oxiod)要求配制half-fraser與fraser增菌培養基。
4.細菌培養
將上述兩種細菌(單增李斯特菌,無害李斯特菌)分別接種到5ml腦心培養液中培養至od600=0.6,用pbs稀釋為不同濃度的菌懸液。
5.樣品制備
從市場采購的新鮮豬肉,經eniso方法(樣品在half-fraser與fraser培養基中經過兩次增菌培養后,接種一環菌液到李斯特菌顯色培養基,觀察顯色培養基上有無典型的李斯特菌菌落)鑒定不含有李斯特菌,加入單增李斯特菌和無害李斯特菌的混合菌液(菌含量比為1:10)。混勻后將標本均分為兩份,一份加入到新型李斯特菌增菌培養基中培養24h后經顯色培養基分離鑒定,另一份用eniso推薦的方法分離培養鑒定。
6.細菌分離培養結果
經新型李斯特菌增菌培養基培養后,顯色培養基上絕大部分為單增李斯特菌菌落(圖6);經過傳統的增菌培養基(half-fraser和fraser培養基)培養后,顯色培養基上單增李斯特菌菌落只占細菌總量的少數(圖7),并且新型李斯特菌增菌培養基只需要一步增菌(24小時),比傳統的增菌分離方法減少了48小時。
實施例9.新型增菌培養基與傳統增菌培養基(half-fraser)對模擬樣本中致病性李斯特菌的分離效果比較
1.菌株
單增李斯特菌分離株(lm-082,lm-630,lm-716),無害李斯特菌分離株(lin-010,lin-039),伊氏李斯特菌分離株(liv-012,liv-020)。
2.試劑
胰蛋白胨、蛋白胨、牛肉浸粉購自sigma公司,β-d-阿洛糖購自adamas公司,氯化鈉磷酸氫二鈉為國產分析純。fraser增菌培養基購自oxide公司;鹽酸吖啶黃、萘啶酮酸、氯化鋰購自美國amresco公司。
3.培養基配制
按照實施例5配制含添加劑的新型李斯特菌增菌培養基;按照廠家(oxiod)要求配制half-fraser與fraser增菌培養基。
4.細菌培養
將上述7株細菌(單增李斯特菌,無害李斯特菌,伊氏李斯特菌)分別接種到5ml腦心培養液中培養至od600=0.6,用pbs稀釋為不同濃度的菌懸液。
5.樣品制備
從市場采購的新鮮豬肉和牛肉,經eniso方法(樣品在half-fraser與fraser培養基中經過兩次增菌培養后,接種一環菌液到李斯特菌顯色培養基,觀察顯色培養基上有無典型的李斯特菌菌落)鑒定不含有李斯特菌,將肉切碎,隨機分為50份,分別加入致病性李斯特菌和無害李斯特菌的混合菌液(菌含量比為1:10)。混勻后將每份模擬標本均分為兩份,一份加入到新型李斯特菌增菌培養基中培養24h后經顯色培養基分離鑒定,另一份用eniso推薦的方法分離培養鑒定。
6.兩種培養基分離效果比較
利用新型增菌培養基,50份模擬標本中有43份分離到致病性李斯特菌,分離率為86%;利用傳統增菌培養基,50份模擬標本中有35份分離到致病性李斯特菌,分離率為70%。新型李斯特菌增菌培養基對致病性李斯特菌分離培養的靈敏度比傳統增菌培養基提高了16%。
- 還沒有人留言評論。精彩留言會獲得點贊!