發生上皮間質化的循環腫瘤干細胞在肺癌增殖、耐藥及轉移疾病中的應用的制作方法
本發明涉及醫藥技術領域,具體地說,是發生上皮間質化的循環腫瘤干細胞在肺癌增殖、耐藥及轉移疾病中的應用。
背景技術:
近5年中因惡性腫瘤造成的死亡在全球死亡疾病譜中一直居于首位,而因惡性腫瘤死亡的患者中又以肺癌患者人數居多。根據病理類型可將肺癌分為兩大類,分別是小細胞肺癌(smallcelllungcancer,sclc)和非小細胞肺癌(non-smallcelllungcancer,nsclc)。眾所周知,癌癥患者往往死于癌癥轉移所造成的并發癥,而不是原發腫瘤本身。既往臨床資料表明,不止中晚期的肺癌患者會出現轉移,即使是接受過根治性治療的早期肺癌患者,仍會有很高的概率出現復發和轉移。
癌癥的轉移是一個包含了很多關鍵事件復雜過程:理論上腫瘤細胞需要首先從原發病灶中分離,突破基底膜結構,然后通過自身發生變形遷移進入血液循環;或者由于其他原因直接進入血管或淋巴系統,之后還需要在血液中成功存活并停留在靶器官處,重新進行自我復制并最終形成臨床可見的遠處轉移病灶。隨著實時定量聚合酶鏈式反應(quantitativereal-timepolymerasechainreaction,qrt-pcr)、流式細胞術、密度梯度離心、免疫磁珠分選等技術的出現,人們在大多數癌癥患者的外周血中檢測出了腫瘤細胞,并把這種存在于血液循環中的腫瘤細胞被稱為循環腫瘤細胞(circulatingtumorcells,ctcs)。ctcs的發現部分驗證了關于腫瘤轉移機制的“種子與土壤”的假說,并促使我們從一個新的視角對腫瘤轉移這個概念進行思考,循環腫瘤細胞是聯系腫瘤原發灶和轉移灶之間的橋梁,通過對腫瘤循環腫瘤細胞進行研究,可以對腫瘤轉移的生物學機制獲得更好的認識。
研究者認為,即使不是全部,腫瘤原發灶也是ctcs的重要來源之一,據估算,癌癥患者體內大約存在有8000~120000個循環腫瘤細胞。患者外周血中ctcs數量越多,患者生存時間越短。但這些ctcs的性狀之間存在著較大的差異,有的是單個細胞,有的是細胞團,有的與血細胞之間關系密切,還有一部分是沒有活力的死細胞。考慮到ctcs數量與臨床轉移灶之間的巨大差距,有理由推測,真正能成功定植在靶器官并最終成為新的轉移灶的ctcs應該只是這些細胞中某種亞型。因此腫瘤干細胞的學說近來逐漸引起研究者們的重視,該理論認為,不是所有的腫瘤細胞都有形成腫瘤的能力,腫瘤組織的不斷增長是由于腫瘤干細胞自我復制和分化的結果。目前,這一猜測已在動物模型上得到了部分驗證,實驗結果表明,大部分ctcs在進入循環系統不久之后便已死亡,只有約0.01%-2.5%的ctcs可以形成轉移灶。而某些表達正常干細胞標志的如cd44、cd133的乳腺癌細胞亞群則擁有與正常干細胞相似的特性,并且具有更強的成瘤能力。
臨床檢測結果表明,在非小細胞肺癌患者外周血中的一部分循環腫瘤細胞發生了上皮間質轉化(epithelial-to-mesenchymaltransition,emt)。emt是指上皮細胞間緊密連接蛋白表達量減少,細胞微絲、骨架蛋白表達量增加;同時細胞形態由上皮細胞形態(細胞間緊密連接,有極性)向間質細胞形態(細胞便為紡錘形,變形和移動能力增強)轉變。現有結果表明,當腫瘤細胞發生emt后,其侵襲轉移能力增加、凋亡減少、對常規化療藥物或靶向治療藥物的抵抗性均明顯增強。
根據上述理論和實驗結果,我們推測,這些nsclc患者外周血中發生了emt的循環腫瘤細胞亞群很可能是就是肺癌腫瘤干細胞所在的亞群。如果能對此種細胞進行表型和基因型特性的深入研究,可以極大的促進我們對腫瘤轉移相關機制的認識,并為新的抗癌藥物的研發提供潛在的治療靶點。但由于此類細胞數量稀少,受目前技術手段和倫理的限制,我們難以獲得足夠的樣本或對臨床患者進行長期的連續觀測。因此,我們嘗試制作一種可連續觀測腫瘤進展情況的人肺腺癌原位移植動物模型。從模型上分離發生emt的ctcs,檢測并比較其與原始腫瘤細胞的生物學特性和基因差異,探究emt和ctcs在肺癌轉移過程中所扮演的角色和作用。為ctcs和emt的研究提供新的研究思路和方法,并對肺癌的診斷和治療提供一定的理論基礎和研究方向。
技術實現要素:
本發明的目的是針對現有技術中的不足,提供一種人肺腺癌bclb/c裸鼠肺原位移植腫瘤模型的建立方法。
本發明的第二個目的是,提供一種肺腺癌循環腫瘤細胞的制備方法。
本發明的第三個目的是,提供一種肺腺癌發生上皮間質化的循環腫瘤細胞的制備方法。
本發明的第四個目的是,提供一種發生上皮間質化的循環腫瘤細胞。
本發明的第五個目的是,提供一種發生上皮間質化的循環腫瘤細胞的應用。
本發明的第六個目的是,提供一種抑制肺癌轉移的藥物。
本發明的第七個目的是,提供檢測發生上皮間質化的循環腫瘤細胞的試劑的一種新用途。
為實現上述目的,本發明采取的技術方案是:一種人肺腺癌bclb/c裸鼠肺原位移植腫瘤模型的建立方法,所述的建立方法包括以下步驟:(1)制備肺腺癌高轉移細胞/基質膠混合物,(2)麻醉bclb/c裸鼠,(3)經過bclb/c裸鼠的肋骨間隙注射肺腺癌高轉移細胞與基質膠的混合物。
步驟(1)為:基質膠提前一天由-20℃保存至4℃,并在冰盒上進行下述操作:倒置相差顯微鏡下觀察見細胞系占培養瓶底面積80-90%時,消化并使用1×pbs重懸細胞,計數后與基質膠按照1:2的比例進行混合,使細胞終濃度為105/20μl。
為實現上述第二個目的,本發明采取的技術方案是:一種肺腺癌循環腫瘤細胞的制備方法,所述的制備方法包括以下步驟:(1)利用綠色熒光蛋白(gfp)標記標記腫瘤細胞;(2)建立人肺腺癌bclb/c裸鼠肺原位移植腫瘤模型;(3)在bclb/c裸鼠外周血中獲得循環腫瘤細胞。
為實現上述第三個目的,本發明采取的技術方案是:一種肺腺癌發生上皮間質化的循環腫瘤細胞的制備方法,所述的制備方法包括以下步驟:(1)建立人肺腺癌bclb/c裸鼠肺原位移植腫瘤模型;(2)在bclb/c裸鼠外周血中獲得循環腫瘤細胞;(3)利用流式細胞儀分離獲得發生上皮間質化的循環腫瘤細胞。
步驟(2)為:在荷瘤成功7天后,對bclb/c裸鼠取血,并裂解和去除紅細胞。
步驟(3)為:加入epcam抗體,室溫避光孵育20分鐘,期間每隔10分鐘重懸細胞1次,隨后使用流式細胞儀進行檢測、分選出epcam(-)/gfp(+)的細胞亞群。
為實現上述第四個目的,本發明采取的技術方案是:上述制備方法制得的發生上皮間質化的循環腫瘤細胞。
為實現上述第五個目的,本發明采取的技術方案是:所述的發生上皮間質化的腫瘤循環細胞作為腫瘤干細胞的應用。
為實現上述第六個目的,本發明采取的技術方案是:一種抑制肺癌轉移的藥物,所述的藥物可抑制上皮間質化的循環腫瘤細胞。
為實現上述第七個目的,本發明采取的技術方案是:檢測發生上皮間質化的循環腫瘤細胞的試劑在制備預測肺癌的耐藥、復發或轉移的試劑中的應用。
本發明優點在于:
1、本發明建立了可重復檢測外周血中ctcs的肺原位移植瘤bclb/c裸鼠模型。
2、本發明在bclb/c裸鼠肺原位移植瘤外周血中分離出發生了emt的肺癌細胞pc-9emt并成功進行了體外培養。
3、本發明通過細胞學實驗證明pc-9emt細胞同時具有間質細胞和干細胞的特征。
附圖說明
附圖1:穩定表達gfp熒光蛋白的pc-9h細胞的獲得和人肺腺癌原位移植小鼠模型的建立。a:穩定表達gfp熒光蛋白的pc-9h細胞。b-d:人肺腺癌原位移植小鼠模型的建立過程。
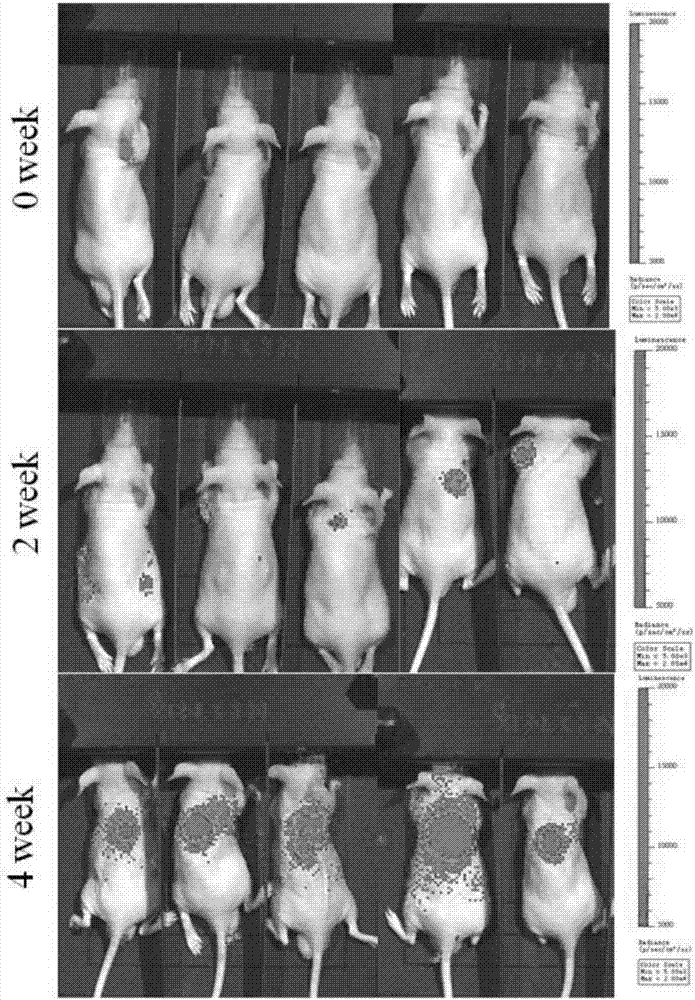
附圖2:利用pc-9h(gfp)細胞建立的人肺腺癌原位移植bclb/c裸鼠模型腫瘤生長情況的連續觀測。
附圖3:人肺腺癌原位移植bclb/c裸鼠模型在不同時間段利用流式細胞儀對外周血中循環腫瘤細胞的進行檢測與分選。a:bclb/c裸鼠荷瘤后7天。b:bclb/c裸鼠荷瘤后14天。c:bclb/c裸鼠荷瘤后21天。d:對bclb/c裸鼠外周血中發生emt的循環腫瘤細胞進行分選。
附圖4:pc-9l,pc-9h,pc-9emt三種細胞在倒置相差顯微鏡下分別在放大40倍、100倍和200倍時的的形態。
附圖5:pc-9l,pc-9h,pc-9emt三種細胞成瘤在bclb/c裸鼠體內成瘤能力的比較。
附圖6:pc-9l、pc-9h和pc-9emt三種細胞epcam蛋白表達水平免疫熒光實驗結果。
附圖7:pc-9l、pc-9h和pc-9emt三種細胞cdh1蛋白表達水平免疫熒光實驗結果。
附圖8:pc-9l、pc-9h和pc-9emt三種細胞vim蛋白表達水平免疫熒光實驗結果。
附圖9:pc-9l、pc-9h和pc-9emt三種細胞中cdh1、epcam、vim、蛋白表達水平的免疫印跡實驗結果。
附圖10:pc-9l、pc-9h和pc-9emt三種細胞的transwell實驗結果。
附圖11:利用cck8原理檢測并繪制的pc-9l、pc-9h和pc-9emt三種細胞在正常培養狀態和加入不同濃度奧沙利鉑后的增長曲線圖。
附圖12:pc-9l、pc-9h和pc-9emt三種細胞的克隆形成實驗結果。箭頭處標示的是pc-9h細胞克隆形成實驗中展現出間質細胞形態的克隆細胞團。
附圖13:pc-9l、pc-9h和pc-9emt三種細胞的成球培養實驗結果。
附圖14:pc-9l、pc-9h和pc-9emt三種細胞周期實驗結果。
附圖15:pc-9l、pc-9h和pc-9emt三種細胞凋亡實驗結果。
具體實施方式
下面結合附圖對本發明提供的具體實施方式作詳細說明。
實驗材料
雄性bclb/c裸鼠(訂購于華東師范大學動物實驗中心)
穩定表達luciferase的人肺腺癌pc-9細胞系(在本文中的名稱為pc-9l)
利用pc-9l細胞對bclb/c裸鼠進行左心室注射并挑選轉移灶分離培養,反復篩選六次后得到的肺腺癌高轉移細胞pc-9h
293t細胞
(一)實驗儀器
液氮罐(型號:xc20,chartmve公司,美國)
超凈工作臺(thermo公司,美國)
溫度可調節式電加熱恒溫水浴箱(上海躍進醫療器械有限公司,中國)
37℃恒溫co2培養箱(heraeus公司,德國)
倒置相差顯微鏡(型號:ix70,olympus公司,日本)
-80℃深低溫冰箱(青島海爾公司,中國)
小型高速離心機(江蘇正基儀器有限公司,中國)
高速冷凍離心機(eppendorf公司,德國)
大型高速離心機(eppendorf公司,德國)
小動物活體成像儀(calperlifescience公司,美國)
高通量流式細胞儀(merckmillipore公司,德國)
全自動發光分析儀(美國,bmgbiotech公司)
小型漩渦振蕩器(江蘇其林醫用儀器廠,中國)
高壓蒸汽消毒器(上海新諾儀器廠,中國)
溫度可調式恒溫干燥烘箱(中國,上海通用醫療器械廠)
電子天平(中國,上海良平儀器公司)
(二)實驗耗材
2ml細胞凍存管(貨號:430659,corning公司,美國)
2ml紙質凍存盒(貨號:bs-20-tb100s,biosharp公司,中國)
細胞計數板(南京建成生物工程研究所,中國)
手動計數器(山東五岳體育器材有限公司,中國)
96孔板(貨號:3599,corning公司,美國)
24孔板(貨號:3524,corning公司,美國)
12孔板(貨號:3513,corning公司,美國)
6孔板(貨號:3516,corning公司,美國)
6cm培養皿(貨號:430166,corning公司,美國)
10cm培養皿(貨號:4301667,corning公司,美國)
透氣可旋蓋細胞培養瓶(貨號:430639,corning公司,美國)
巴氏吸管(貨號:bs-qt-005,corning公司,美國)
微量注射器(25μl,上海高鴿工貿有限公司,中國)
200μleppendorf(ep)管(貨號:pcr-05-c,axygen公司,美國)
1.5mleppendorf(ep)管(貨號:mtc-150-c,axygen公司,美國)
5mleppendorf(ep)管(貨號:mtc-200-c,axygen公司,美國)
15ml離心管(貨號:430791,corning公司,美國)
50ml離心管(貨號:430829,corning公司,美國)
封口膜(貨號:cz-06720,parafilm公司,美國)
(三)實驗試劑
1640培養基(貨號:31800022,gibco,invitrogen公司,美國)
dmem高糖培養基(貨號:12100046,gibco,invitrogen公司,美國)
胎牛血清(fetalbovineserμm,fbs)(貨號:s158g-500,biowest公司,法國)
青霉素g鈉鹽(貨號:0242-25mu,amresco公司,美國)
硫酸鏈霉素(貨號:0382-10g,amresco公司,美國)
0.25%胰酶含edta(貨號:25200,gibco,invitrogen公司,美國)
gfp+puro慢病毒(試用裝,漢恒生物,中國)
lipofitertm脂質體轉染試劑(貨號:hb-trlf-1000,漢恒生物,中國)
紅細胞裂解液(產品編號c3702,碧云天公司,中國)
epcam抗體(貨號:324208,biolegend公司,美國)
磷酸緩沖鹽溶液(phosphatebuffersaline,pbs)(貨號:g0002,谷歌生物公司,中國)
異氟烷(上海雅培制藥有限公司,中國)
金霉素眼膏(南京白敬宇制藥有限責任公司,中國)
d-熒光素酶鉀鹽(上海aokchem公司,中國)
肝素鈉注射液(江蘇萬邦生化醫藥股份有限公司,中國)
二甲亞砜(dimethylsulfoxide,dmso)(貨號:sbj-0844,南京森貝伽生物科技有限公司,中國)
基質膠(貨號:356234,bd公司,美國)
實施例1:人肺腺癌pc-9h細胞系的復蘇、體外傳代培養與凍存
(一)pc-9h細胞系的復蘇
從液氮罐中取出pc-9h細胞凍存管,在37℃恒溫水浴箱中進行復溫,當凍存管中內容物完全融化后,使用小型離心機122g離心6分鐘。棄去上清液,使用含有10%fbs的1640培養基重懸細胞。轉置于細胞培養瓶中并放入在37℃,5%co2可調式恒溫培養箱中培養。24小時后換液。
(二)pc-9h細胞系的體外傳代培養
倒置相差顯微鏡下觀察見pc-9h細胞系占培養瓶底面積80-90%時,進行傳代操作。首先,丟棄細胞培養瓶中舊培養基并使用1×pbs沖洗兩遍,隨后加入500μl胰酶,37℃孵育3分鐘,倒置相差顯微鏡下觀察見細胞變圓或漂浮后加入500μlfbs中和胰酶,之后使用小型離心機以112g離心6分鐘。丟棄上清后加入含10%fbs的1640培養基重懸細胞,按照1:2或1:3的比率加入細胞培養瓶中。之后把細胞放入37℃,5%co2可調式恒溫培養箱中培養。
(三)pc-9h細胞系的凍存
倒置相差顯微鏡下觀察見pc-9h細胞系占培養瓶底面積80-90%時,進行凍存操作。首先,丟棄細胞培養瓶中舊培養基并使用1×pbs沖洗兩遍,隨后加入500μl胰酶,37℃孵育3分鐘,倒置相差顯微鏡下觀察見細胞變圓或漂浮后加入500μlfbs中和胰酶,之后使用小型離心機以112g離心6分鐘。丟棄上清后加入1.5ml混合好的凍存液(含fbs和dmso,比值為9:1)并轉置到凍存管中。用封口膜封緊凍存管口并做好標記,之后把細胞放入程序性細胞降溫盒中并在-80℃深低溫冰箱內過夜,第二天把凍存管轉置于液氮罐中,長期保存。
實施例2:gfp慢病毒感染人肺腺癌pc-9h細胞系
(一)檢測gfp-pour慢病毒滴度
1、細胞準備
倒置相差顯微鏡下觀察見293t細胞將生長狀態良好,巴氏吸管吸盡培養基,1×pbs沖洗兩遍后,加入胰酶500μl,37℃消化1分鐘,加入500μlfbs中和胰酶,112g離心6分鐘。棄上清后用1ml含10%fbs的dmem培養基重懸細胞。利用細胞技術板計數并稀釋細胞密度至1×105/ml,加入96孔細胞培養板,每孔100μl,每列6個副孔。培養板周圍使用1×pbs水封后放入37℃,5%co2可調式恒溫培養箱中培養。
2、病毒感染
24小時后,準備10個ep管,每管加入90μl培養液,第一個ep管中加入10μl病毒原液,混勻后,吸取10μl加入第二個ep管。以此類推,做十個稀釋度(10-10-8)。并加入細胞培養板中。每孔100μl。
3、更換細胞培養液
48小時后,棄掉細胞培養板中含有病毒的培養液,每孔再加入100μl含10%fbs的dmem培養液。
4、觀察結果與病毒滴度計算
96-120小時后在激光掃描共聚焦顯微鏡下觀察結果。尋找帶綠色熒光細胞最少的孔并依據公式計算病毒滴度。
公式:滴度(pfu/ml)=熒光細胞數×病毒稀釋倍數×103。
(二)慢病毒感染pc-9h細胞
1、moi值的選定
參考漢恒生物網站中慢病毒感染不同細胞的moi值,選擇30作為感染pc-9h細胞的moi值。
2、細胞準備
倒置相差顯微鏡下觀察見293t細胞將生長狀態良好,巴氏吸管吸盡培養基,1×pbs沖洗兩遍后,加入胰酶500μl,37℃消化1分鐘,加入500μlfbs中和胰酶,1000g離心6分鐘。棄上清后用1ml含10%fbs的1640培養基重懸細胞。利用細胞技術板計數并稀釋細胞密度至1×105/ml,加入24孔細胞培養板,每孔500μl,放入37℃,5%co2可調式恒溫培養箱中培養。
3、病毒感染
24小時后,倒置相差顯微鏡下觀察pc-9h細胞密度在50~70%時,即可進行病毒感染。棄去舊培養24孔細胞培養板內舊培養基并加入polybrene濃度為6ug/ml的含10%fbs的1640培養基,每孔400μl。再加入病毒原液,每孔100μl。感染24小時后用含10%fbs的1640培養基換液。
實施例3:和帶有gfp標簽的pc-9h的細胞的挑選與體外培養
1、帶有gfp標簽的pc-9h的細胞的挑選
慢病毒感染后72小時,通過激光掃描共聚焦顯微鏡觀察pc-9h細胞的gfp表達效率,在顯微鏡下用槍頭挑取亮度最亮的5個細胞團轉置于新的24孔細胞培養板內,含10%fbs的1640培養基在37℃,5%co2可調式恒溫培養箱中培養,取名為pc-9h(gfp)。
2、根據pc-9h(gfp)細胞生長情況對細胞進行傳代并適時凍存,使用的培養基是添加了10%fbs的1640培養基,傳代與凍存的方法參見實施例1。
實施例4:bclb/c裸鼠的肺原位移植腫瘤模型的建立與觀察
1、pc-9h(gfp)/基質膠混合物的制備
基質膠提前一天由-20℃保存在4℃,并在冰盒上進行下述操作:
倒置相差顯微鏡下觀察見pc-9h(gfp)細胞系占培養瓶底面積80-90%時,消化并使用1×pbs重懸細胞,計數后與基質膠按照1:2的比例進行混合,使細胞終濃度為105/20μl。根據實驗需要準備兩倍體積的混合物。
2、bclb/c裸鼠的麻醉
六周齡雄性bclb/c裸鼠使用3%濃度的異氟烷進行誘導麻醉,誘導麻醉成功后使用1.5-2%的濃度進行麻醉維持。
3、bclb/c裸鼠肺原位移植腫瘤模型的建立
bclb/c裸鼠采取左側或者右側臥位,在右側肩胛骨約3mm處做一約5mm的垂直于身體長軸的橫切口,用有齒鑷鈍性分離皮下肌肉組織,直至肋骨暴露,此時,透過肋骨間隙的胸膜和肌肉可輕易觀察小鼠肺的呼吸運動,這時使用微量注射器經過肋骨間隙注射20μlpc-9h(gfp)細胞與基質膠的混合物,針尖注射深度約3mm。隨后使用可吸收縫線對切口進行縫合。皮膚表面涂抹金霉素眼膏預防感染。對照組小鼠給予pbs與基質膠的混合物作為對照。
4、bclb/c裸鼠肺原位移植腫瘤模型的活體成像監測。
每周采用ivis200活體成像系統觀察pc-9h(gfp)在bclb/c裸鼠體內的生長和轉移情況。稱取d-熒光素酶鉀鹽并用無菌的1×pbs溶解,終濃度為30mg/ml。bclb/c小鼠用異氟烷麻醉,成像前每只小鼠腹腔注射150μl,5分鐘后進行顯像操作。
實施例5:小鼠外周血循環腫瘤細胞的的鑒定、分離與體外培養
1、bclb/c裸鼠的內眥取血
在bclb/c裸鼠肺原位移植模型制造后第7天和第15天,經活體成像系統確認成功荷瘤后的bclb/c裸鼠使用異氟烷麻醉(麻醉和活體成像操作步驟見實施例4)。麻醉成功后采集者左手捏緊bclb/c裸鼠頭部皮膚并輕輕壓迫頸部兩側,使眼球向外突出,右手捏取無菌毛細玻璃管(肝素鈉浸潤)經內眥眼眶后壁向喉頭方向旋轉刺入。有突破感時稍后退,使血液經由被割裂的眼眶靜脈后靜脈叢滴入1.5mlep管內(肝素鈉浸潤),取血量約200μl。之后拔除毛細包立管并用擰干的75%乙醇棉球壓迫止血。
2、bclb/c裸鼠外周血中循環腫瘤細胞的鑒定與分離
1、紅細胞的裂解與去除
血液樣本加入1ml的紅細胞裂解液,輕輕吹打混勻,然后靜置裂解5分鐘。隨后再以500g離心5分鐘(4℃),棄紅色上清。離心效果更佳。如果發現紅細胞裂解不完全,重復上述步驟一次。隨后使用1ml的1×pbs重懸洗滌細胞,500g離心3分鐘,棄上清。細胞洗滌2次后,使用100μl的1×pbs重懸細胞。
2、發生emt的pc-9h(gfp)細胞的檢測與分選
實驗組待測樣本中加入5μlepcam抗體,對照組樣本加入10μlepcam抗體,室溫避光孵育20分鐘,期間每隔10分鐘重懸細胞1次。隨后使用流式細胞儀進行檢測,分選的目標亞群為epcam(-)/gfp(+)的發生了emt的細胞亞群。并命名為pc-9emt。
3、循環腫瘤細胞的體外培養。
根據pc-9emt細胞生長情況對細胞進行傳代并適時凍存,使用的是添加了10%fbs的1640培養基,傳代與凍存的方法參見實施例1。
實施例6:pc-9l,pc-9h,pc-9emt三種細胞肺原位注射法成瘤能力的比較
1、bclb/c裸鼠的分組
15只六周齡雄性bclb/c裸鼠按照1-15的順序進行編號,利用excel生成15個隨機數,按照隨機數由小到大的順序將bclb/c裸鼠分為3組,每組5只。分別為pc-9l組、pc-9h組和pc-9emt組。
2、三組bclb/c裸鼠肺原位移植腫瘤模型的建立及活體成像檢測
使用pc-9l、pc-9h和pc-9emt三種細胞分別對相應組別的bclb/c裸鼠進行造模并觀察,試驗方法見實施例4。
實施例7:pc-9l、pc-9h、pc-9emt三種細胞蛋白免疫印跡實驗
(一)細胞總蛋白樣品的制備
倒置相差顯微鏡下觀察細胞約占培養瓶底面積80-90%時,棄掉舊培養基,使用1×pbs沖洗2遍后加入配置好的細胞裂解液1ml,冰上裂解細胞30分鐘,每十分鐘震蕩一次,確保裂解完全,裂解完成后轉置于1.5mlep管中,1200g離心10分鐘,吸取上清轉置于新的1.5mlep管內,并做好標記。裂解液配方如下:
(二)細胞總蛋白樣品濃度的測定制備
1、按照說明書使用蛋白標準配置液和1×pbs對bca蛋白定量檢測試劑盒中蛋白標準品進行稀釋,使用濃度為0.5mg/ml。
2、使用濃度的標準品按照0、1、2、4、8、12、16、20μl加入96孔細胞培養板,每個3副孔,并使用1×pbs補足20μl,每個濃度3副孔。
3、待測樣本使用pbs稀釋10倍后,加入96孔細胞培養板,每個3副孔。
4、按照說明書配置bca工作液,每孔加入200μl,37℃恒溫孵箱孵育30分鐘后使用熒光計數器測量各孔在562nm處的od值,根據標準品的od值繪制標準曲線并根據樣本的od值計算樣本蛋白濃度。
5、使用1×pbs和5*蛋白上樣緩沖液稀釋蛋白樣品,使其終濃度為2.5ug/μl,95℃變性15分鐘,-20℃保存。
(三)sds-page凝膠電泳
1、洗凈wb所需玻璃板和電泳槽,晾干后進行組裝,并測試水密性是否良好。
2、根據目的條帶的分子量大小,選擇利用sds-page凝膠制備試劑盒配置12%分離膠和濃縮膠,先配分離膠,灌膠后使用異丙醇壓平,待分離膠凝固后再配置濃縮膠,灌膠后插入梳子。兩種膠的配方如下:
3、待上層膠凝固后,拔去梳子并使用細針對上層膠進行修整,之后把變性后的蛋白樣品在95℃下活化2分鐘,混勻后每孔上樣20μl,最邊上兩孔使用10μl預染蛋白marker上樣。
4、使用ddh2o稀釋電泳緩沖液粉末至使用濃度,加入電泳槽中,恒壓80v進行電泳,直至溴酚藍跑出凝膠。
(四)轉膜
1、拆開電泳儀,在ddh2o中撬開玻璃板,除去濃縮膠并使凝膠在水中平衡30秒。
2、使用快速蛋白轉膜儀,按照陰極至陽極分別是負極轉膜海綿→sds-page凝膠→浸泡過電轉緩沖液的pvdf膜→正極轉膜海綿的順序配置轉膜三明治,放入轉膜抽屜中,選擇midi模式,轉膜15分鐘。
(五)pvdf膜的封閉、抗體孵育和顯影
1、打開抽屜,可見蛋白marker清晰轉印在pvdf膜上,做好標記后使膜依次浸泡在電轉緩沖液和tbst中各30秒,之后使用3%bsa在搖床上進行封閉1小時。
2、根據目的條帶的位置對膜進行裁剪并做好標記后分別放入wb孵育盒中,抗體按照說明書推薦濃度用一抗稀釋液稀釋后分別加入對應的膜上,在搖床上4℃孵育過夜。
3、回收一抗,使用tbst洗膜三次,每次10分鐘,再加入二抗稀釋液稀釋的相應種屬的二抗。稀釋濃度為1:1000,搖床上室溫孵育1小時。
4、回收二抗,使用tbst洗膜三次,每次10分鐘,之后把膜放在干凈玻璃板上,加入配置好的ecl發光液進行顯影。
實施例8:pc-9l,pc-9h,pc-9emt三種細胞免疫熒光染色實驗
1、于超凈工作臺內,打開六孔板,蓋玻片使用酒精燈滅菌,冷卻后放入六孔板中。
2、倒置相差顯微鏡下觀察細胞的占培養瓶底面積80-90%時,按照實施例1的方法消化并重懸細胞,將細胞懸液滴加至蓋玻片上,置于co2濃度為5%的培養箱中于37℃培養2-4小時至細胞固著,然后再加入2ml含10%fbs的1640培養基繼續培養約6小時。
3、倒去培養基,用1×pbs洗3次,每次5分鐘。之后使用通用型組織固定液固定30分鐘,
4、吸去固定液,使用1×pbs洗3次,每次5分鐘;之后加入100μl破膜液,室溫孵育10分鐘;吸去破膜液,pbs洗3次,每次5分鐘。
5、棄pbs后每張切片加入50μl稀釋的一抗覆蓋組織,4℃過夜。
6、1×pbs洗三次,每次5分鐘。棄pbs后每張切片加100μl相應種屬的熒光二抗,室溫下避光孵育45分鐘。
7、1×pbs洗3次,每次5分鐘(避光)。棄pbs后每張切片加100μlhochest33258,室溫下避光孵育10分鐘。
8、1×pbs洗3次,每次5分鐘,切片稍干后用抗熒光淬滅封片劑封片,4℃避光拍照。
實施例9:pc-9l、pc-9h、pc-9emt三種細胞的克隆形成實驗
倒置相差顯微鏡下觀察細胞的占培養瓶底面積80-90%時,按照實施例1的方法消化并重懸細胞,之后加入6孔細胞培養板中,每孔細胞約104個,每個樣本3副孔。每三天更換培養基并觀察細胞狀態,在10~14天后顯微鏡下尋找細胞數≥50個的克隆并計數。
實施例10:pc-9l,pc-9h,pc-9emt三種細胞的成球培養實驗
(一)腫瘤干細胞培養基的的配方如下,保存在4℃:
(二)倒置相差顯微鏡下觀察細胞的占培養瓶底面積80-90%時,按照實施例1的方法消化并重懸細胞,之后加入低粘附性6孔細胞培養板中,每孔細胞約104個,每個樣本3副孔。每三天離心管內靜置15-30分鐘后半量更換培養基,之后使用槍頭輕微輕柔吹打數次,10~14天后顯微鏡下尋找細胞球,拍照并計數。
實施例11:pc-9l、pc-9h、pc-9emt三種細胞的增殖與耐藥實驗
(一)pc-9l、pc-9h、pc-9emt三種細胞鋪板
倒置相差顯微鏡下觀察細胞的占培養瓶底面積80-90%時,按照實施例1的方法消化并重懸細胞,計數并調整細胞密度為105/ml,之后加入96孔細胞培養板中,每孔100μl,每個樣本5副孔,最外圍使用1×pbs水封,之后在37℃,5%co2可調式恒溫培養箱中培養24小時。
(二)使用奧沙利鉑對三種細胞進行處理
倒置相差顯微鏡下觀察細胞貼壁后,使用添加了10%fbs的1640培養基對奧沙利鉑進行稀釋,使其終濃度分別為50μmol/l、10μmol/l和5μmol/l。使用上述溶液替換96孔細胞培養板中舊培養基。
(三)使用cck8法檢測檢測細胞活性
在加藥前和加藥后24小時、48小時、72小時后各取一塊板進行檢測。
1、在細胞培養液中直接加入10μlvita-orange細胞活性檢測液輕微震蕩保證充分混合,避免氣泡產生。
2、于37℃培養箱中培養至顏色變為橙色并分別在1小時、1.5小時和2小時用熒光計數器測量各孔在450nm處od的值,并記錄。
實施例12:pc-9l,pc-9h,pc-9emt三種細胞細胞周期實驗
(一)pc-9l、pc-9h、pc-9emt三種細胞樣品制備
1、倒置相差顯微鏡下觀察細胞的占培養瓶底面積70-80%時,按照實施例1的方法消化并使用1×pbs洗滌兩次,然后使用1ml1×pbs重懸細胞。
2、使用cellcyclestainingkit進行試驗,首先加入1mldnastainingsolution和10μlpermeabilizationsolution,漩渦震蕩5秒,室溫避光孵育30分鐘。
(二)使用流式細胞儀進行檢測并繪制細胞周期圖
實施例13:pc-9l,pc-9h,pc-9emt三種細胞細胞凋亡實驗
(一)pc-9l、pc-9h、pc-9emt三種細胞樣品制備
同實施例12第(一)節。
(二)使用tunelbrightredapoptosisdetectionkit對細胞進行處理
1、在細胞中加入5ml含1%通用型組織固定液的1×pbs,冰上放置20分鐘。
2、細胞在4℃300g離心10分鐘,去上清并且重懸于5mlpbs。重復洗一次并把細胞重懸在0.5ml1×pbs中。
3、細胞置于含0.2%
4、300g離心10分鐘,棄上清后把細胞重懸于5ml1×pbs中,相同條件下再次洗滌細胞,并使用80μl被ddh2o稀釋至1×的equilibrationbuffer重懸,室溫孵育5分鐘。
5、冰上融解brightred標記混合物,并依照下表準備足量的tdt孵育緩沖液。
細胞在300g離心10分鐘后去上清并把沉淀重懸在50μltdt孵育緩沖液中。37℃孵育60分鐘,避免光照。期間每隔15分鐘用移液器輕輕吹打重懸
6、加入1ml20mmedta終止反應。
7、細胞300g離心10分鐘,去上清后把細胞重懸于1ml含0.2%
(三)用流式細胞儀分析細胞。brightred的紅色熒光波長為測量620±20nm
實施例14:pc-9l,pc-9h,pc-9emt三種細胞的transwell實驗
(一)pc-9l、pc-9h、pc-9emt三種細胞鋪板
倒置相差顯微鏡下觀察細胞的占培養瓶底面積80-90%時,按照實施例1的方法消化并使用不含fbs的1640培養基重懸細胞并計數,上室中每孔加入105個細胞(200μl),下室中加入含fbs的1640培養基600μl,設置3副孔。分別在24小時、48小時、72小時各取一板檢測。
(二)transwell檢測
1、1×pbs沖洗上室2次,使用棉簽擦洗小室上層細胞,再次用1×pbs沖洗2次。
2、使用通用型組織固定液固定20分鐘,之后倒置風干10-15分鐘。
3、使用0.1%龍膽紫染色15分鐘,隨后使用ddh2o沖洗2次。
4、吸盡上室液體并風干后鏡下拍照細胞并計數。
實驗結果
1、獲得了發生emt的人肺腺癌ctcs并命名為pc-9emt
首先,我們通過gfp-pour慢病毒感染了具有較高轉移能力的人肺腺癌細胞系pc-9h,得到了可表達gfp熒光蛋白的pc-9h(gfp)細胞,隨后我們利用基質膠與pc-9h(gfp)混合后,通過對bclb/c裸鼠進行肺原位注射的方法模擬正常情況下肺癌腫瘤細胞從原發灶脫落入血形成ctcs的過程。(圖1)我們通過小動物活體成像系統可以觀察到,肺癌細胞在bclb/c裸鼠的體內發生擴增與轉移。
流式細胞分析結果則表明,在荷瘤成功約7天后,即可在bclb/c裸鼠外周血中檢測到循環腫瘤細胞。隨著時間增加,bclb/c裸鼠的外周血中ctcs的數量也在增加。且ctcs由兩種細胞亞群細胞組成,一部分為發生了emt的細胞亞群,另一部分為未發生emt的細胞亞群。我們利用流式細胞儀把發生了emt的肺癌細胞亞群進行了分選并成功進行了體外培養,命名為pc-9emt。(圖2,圖3)
2、pc-9l、pc-9h和pc-9emt三種細胞形態的觀察與比較
通過倒置相差顯微鏡觀察pc-9l,pc-9h,pc-9emt三種細胞形態,可以看出pc-9l呈現出典型的上皮細胞形態,細胞較大,成多邊形,且易聚集成團;梭形或紡錘形細胞少見,呈零星分布。pc-9h細胞中則出現較多的梭形或紡錘形細胞,單個上皮樣細胞體積較pc-9l細胞要小,細胞聚集程度低于pc-9l。pc-9emt細胞則多數為間質細胞形態或處于上皮—間質細胞形態,典型上皮細胞形態少見,在細胞未長滿之前較少出現細胞間緊密接觸的情況。(圖4)
3、pc-9l、pc-9h和pc-9emt三種細胞小鼠體內成瘤能力的比較
在獲得pc-9emt細胞后,為了比較pc-9l、pc-9h和pc-9emt這三種細胞的惡性程度,我們把三種細胞分別接種的bclb/c裸鼠體內,并利用活體熒光成像系統追蹤它們bclb/c裸鼠體內的生長情況,結果表明,三種細胞均有在bclb/c裸鼠體內成瘤的能力,其在小鼠體內成瘤能力的大小由高到低分別為pc-9emt、pc-9h和pc-9l;此外接受pc-9emt接種的小鼠兩例出現了肺內轉移,一例出現了全身轉移。(圖5)
4、pc-9emt細胞確實是發生了emt的肺癌細胞
判斷細胞是否發生了emt通常有兩種方法,一種是細胞形態學層面上的鑒定,觀察細胞是否具有間質細胞的形態,另一種是分生物學層面上的鑒定,即觀察細胞是否低表達上皮細胞分子生物學標志如cdh1蛋白和epcam蛋白,并同時高表達間質細胞分子生物學標識如vim蛋白。與pc-9l和pc-9h相比,pc-9emt細胞在細胞形態方面更接近間質細胞形態。通過免疫熒光技術和蛋白免疫印跡對三種細胞的epcam、cdh1和vim蛋白的表達量進行了檢測。免疫熒光實驗結果表明epcam和cdh1兩種蛋白在pc-9l、pc-9h、pc-9emt三種細胞中表達量是逐漸降低的(圖6,圖7),而vim蛋白的表達量則逐漸升高(圖8)。但在pc-9l的細胞中有零星高表達vim蛋白的細胞存在(圖8)。蛋白免疫印跡實驗結果顯示,與pc-9l細胞相比,cdh1蛋白表達水平pc-9h中僅略有降低,在pc-9emt中明顯降低。epcam蛋白則在38kd處和42kd處各有一條條帶,pc-9h細胞在兩處均有大量表達;pc-9l細胞在42kd處有大量表達,38kd處少量表達;pc-9emt細胞則僅在42kd處有少量表達。三種細胞均不同程度的表達vim蛋白,以pc-9emt細胞表達最高,pc-9h細胞vim蛋白表達量略低于pc-9emt細胞,pc-9l細胞表達量最低。(圖9)上述結果從分子生物學的角度再次證明了pc-9emt細胞確實是發生了emt的細胞。隨后我們利用transwell法檢測了三種細胞的運動遷徙的能力,結果表明pc-9emt和pc-9h細胞均具有極強的遷移能力,后者略低于前者;pc-9l細胞的遷移能力則較低。(圖10)
5、pc-9emt具有干細胞的特征
我們利用cck8法檢測了pc-9l、pc-9h和pc-9emt三種細胞的增殖能力和對肺癌常見化療藥物奧沙利鉑的敏感性。從增殖曲線圖我們可以看出,在接種24小時后,三種細胞即開始出現細微差別,pc-9emt細胞的增殖速度和對奧沙利鉑的耐受力遠遠高于pc-9l和pc-9h細胞,pc-9h的增殖能力比pc-9l細胞略高,但仍然對奧沙利鉑敏感。(圖11)克隆形成實驗結果表明,pc-9emt的細胞較易形成單克隆細胞團,pc-9h細胞可以形成兩種不同形態的單克隆細胞團,pc-9l只能形成少量單克隆細胞團。在成球試驗中,pc-9l細胞無法形成細胞球,pc-9h細胞可以形成少量形態致密的細胞球,pc-9emt則可以形成大量的疏松形態的細胞球。(圖12,圖13)從細胞周期實驗結果可以看出在pc-9emt細胞中處于s2期的細胞所占的比例要明顯高于pc-9l和在pc-9h細胞。同時在正常培養的狀態下pc-9l細胞的自然凋亡率要高于pc-9emt和pc-9h細胞,pc-9emt和pc-9h的凋亡水平無明顯差異。(圖14,圖15)
以上所述僅是本發明的優選實施方式,應當指出,對于本技術領域的普通技術人員,在不脫離本發明方法的前提下,還可以做出若干改進和補充,這些改進和補充也應視為本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!