一種低溫堿性果膠裂解酶及其編碼基因和應用的制作方法
本發明屬于分子生物學技術領域,具體而言,涉及一種低溫堿性果膠裂解酶及其編碼基因與應用。
背景技術:
果膠酶是催化水解果膠質的一類復雜的酶的總稱。果膠酶來源非常廣泛,如細菌,酵母菌,真菌和放線菌素。堿性蛋白主要來自芽孢桿菌屬。
果膠酶的分類可以遵循以下四個標準:(1)果膠、果膠酸或低聚半乳糖醛酸是否為其優先底物;(2)這些底物是被反式消去作用還是水解;(3)切割方式是任意的還是發生在末端方向;(4)作用適宜ph(酸性或堿性果膠酶)。
以果膠為底物的酶可分為果膠酯酶和果膠解聚酶兩大類。果膠酯酶隨機切除甲酯化果膠中的甲酯,果膠解聚酶則降解果膠糖苷鍵。果膠解聚酶根據酶的作用機理又可分為果膠水解酶和果膠裂解酶。果膠水解酶專一性的水解果膠糖苷鍵,形成飽和低聚半乳糖醛酸;果膠裂解酶催化果膠半乳糖醛酸殘基的c-4和c-5位上發生氫的反式消去完成糖苷鍵的裂解,產生不飽和低聚半乳糖醛酸,分子結構中的不飽和共軛體系可在a235產生吸收峰。
果膠酶的潛在用途包括果汁和葡萄酒的提取和澄清,蔬菜的浸漬,棉織物的沖洗,亞麻的脫膠,植物纖維的脫膠,咖啡和茶發酵,家禽飼料,油提取和預處理含有果膠物質的廢水。對于棉纖維的紡織加工和生物清洗,植物韌皮纖維的脫膠,植物纖維的浸漬,生物漂白和造紙,其中高溫高ph過程是常見的。可以專門針對非纖維素材料,減少或消除使用苛性化學物質,降低環境負荷,同時保持原料的完整性和強度,并且與常規堿性工藝一樣有效。因此,使用果膠酶的酶法是這一努力中潛在的有價值的候選者,因為它們可以減少目前使用的有毒化學物質的量。
技術實現要素:
本發明所要解決的技術問題是提供一種新的低溫堿性果膠裂解酶與其編碼基因及其應用。
為了實現本發明的目的,發明人通過大量試驗研究并不懈努力,最終獲得了如下技術方案:
一種低溫堿性果膠裂解酶,該裂解酶具有seqidno.1所示的氨基酸序列;或該裂解酶是在seqidno.1所示的氨基酸序列基礎上缺失、替換、插入或/和添加一個至幾個氨基酸的保守性突變而獲得的保守性變異體。
需要說明的是,本發明所提供的果膠裂解酶屬于果膠裂解酶6超家族,是一種能以β-消除反應的方式,作用于以聚半乳糖醛酸、蘋果來源果膠、橙皮來源果膠、或不同酯化程度果膠,完成糖苷鍵的裂解,產生不飽和低聚半乳糖醛酸的果膠酶。seqidno.1所示的氨基酸序列由330個氨基酸殘基組成。
為了使上述果膠裂解酶蛋白質便于純化,可在上述的氨基酸序列組成的蛋白質的氨基末端或羧基末端連接上如表1所示的標簽。
表1標簽的序列
上述果膠裂解酶蛋白質可以人工合成,也可先合成其編碼基因,再進行生物表達得到。上述中的果膠裂解酶蛋白質的編碼基因可通過將seqidno.1所示的氨基酸序列中,缺失、置換、插入或添加一個至幾個并保持原有酶活性,或者連上表1所示的標簽的編碼序列得到。
一種低溫堿性果膠裂解酶的編碼基因,該基因編碼:
(a)具有seqidno.1所示的氨基酸序列的蛋白質;或
(b)具有衍生自缺失、替換、插入/和添加一個至幾個氨基酸的seqidno.1所示的氨基酸序列并具有果膠酶活性的蛋白質。
進一步,所述低溫堿性果膠裂解酶的編碼基因為(i)、(ii)或(iii)的dna分子:
(i)具有seqidno.2所示的核苷酸序列的dna分子;
(ii)在嚴格條件下與(i)所述的核苷酸序列雜交且編碼具有果膠酶活性的蛋白質的dna分子;
(iii)與(i)或(ii)所述的核苷酸序列具有90%以上同源性的核苷酸序列的dna分子。
seqidno.2所示的核苷酸序列由993個核苷酸組成。
例如:在進行分子雜交的過程中,可以為在6×ssc、質量分數為0.5%的sds的溶液中,在65℃下雜交,然后用2×ssc,質量分數為0.1%的sds和1×ssc、質量分數為0.1%的sds各洗膜一次。其中sds的中文名稱為十二烷基硫酸鈉,1×ssc包括0.15mol/lnacl和0.015mol/l檸檬酸;sds以及不同濃度倍數的ssc均為本領域的常用試劑。
含有上述任一所述編碼基因的重組載體、表達盒、轉基因細胞系或重組菌也屬于本發明的保護范圍。
本發明提供一種重組載體,該重組載體包含上述的低溫堿性果膠裂解酶的編碼基因。具體的,所述重組載體為將上述任一所述編碼基因插入出發載體(例如:pet26b)的多克隆位點得到的重組表達載體。可用現有的表達載體構建含有所述基因的重組表達載體。使用所述基因構建重組表達載體時,在其轉錄起始核苷酸前可加上任何一種增強型啟動子或組成型啟動子,它們可單獨使用或與其它的啟動子結合使用;此外,使用本發明的基因構建重組表達載體時,還可使用增強子,包括翻譯增強子或轉錄增強子,這些增強子區域可以是atg起始密碼子或鄰接區域起始密碼子等,但必需與編碼序列的閱讀框相同,以保證整個序列的正確翻譯。所述翻譯控制信號和起始密碼子的來源是廣泛的,可以是天然的,也可以是合成的。翻譯起始區域可以來自轉錄起始區域或結構基因。
本發明還提供一種轉化體,該轉化體包含上述的重組載體。轉化體可以為重組菌,例如,將上述任一所述編碼基因插入出發載體(例如:pet26b載體)的多克隆位點得到的重組表達載體轉化至大腸桿菌bl21(de3),得到重組菌。
本發明還提供一種引物對,用于擴增上述的低溫堿性果膠裂解酶的編碼基因全長及其任意片段。例如:引物對的序列如seqidno.3和seqidno.4所示。
上述任一所述蛋白質、上述任一所述編碼基因、上述任一所述重組表達載體、所述表達盒、轉基因細胞系或重組菌中的任意一種在降解以聚半乳糖醛酸、蘋果來源果膠、橙皮來源果膠、或不同程度酯化的果膠中的應用也屬于本發明的保護范圍。
一種上述的低溫堿性果膠裂解酶在裂解果膠糖苷鍵中的應用。例如:用于裂解以聚半乳糖醛酸、蘋果來源果膠、橙皮來源果膠、或不同程度酯化的果膠等。
在具體應用的過程中,可以采用下面的方法:以聚半乳糖醛酸、蘋果來源果膠、橙皮來源果膠、或不同程度酯化的果膠為底物,在堿性ph條件,利用低溫堿性果膠裂解酶對聚半乳糖醛酸、來源于蘋果和橙皮的果膠或不同程度酯化的果膠進行酶解。
所述的酶解條件包括:反應體系的溫度0-60℃,優選為30℃,反應體系的ph值為7.0-11.0,優選為10.0。
本發明還提供一種生產低溫堿性果膠裂解酶的方法,該方法包括:首先培養上述的轉化體,該轉化體經培養后能分泌表達低溫堿性果膠裂解酶至胞外,然后在培養產物中收集低溫堿性果膠裂解酶即可。
本發明的果膠裂解酶對聚半乳糖醛酸(pga)有很好的酶活,實驗表明:本發明提供的低溫堿性果膠裂解酶,以pga為底物,在30℃、ph為10.0的條件下具有最高的酶活性,為78.75u/mg蛋白;該酶在20-35℃溫度范圍內,酶活均較高;在ph9.0至ph10.5的ph值范圍內,酶活均較高。該酶在ph9.0-10.5的條件下保持24h,依然有60%以上的酶活性,具有很好的ph耐受性。
與現有技術相比,本發明提供的果膠酶屬于果膠裂解酶,能以β-消除反應的方式,作用于以聚半乳糖醛酸、蘋果來源果膠、橙皮來源果膠、或不同程度酯化果膠,完成糖苷鍵的裂解,產生不飽和低聚半乳糖醛酸的果膠酶。并且該果膠裂解酶與其他已表征的果膠裂解酶的氨基酸序列相比,相似性不大于66.29%。本發明所述低溫堿性果膠裂解酶最適天然底物為來源于橙皮的果膠,且具有在堿性ph條件下活性高的特性。
附圖說明
圖1為pel1蛋白純化前后的sds-page電泳圖。
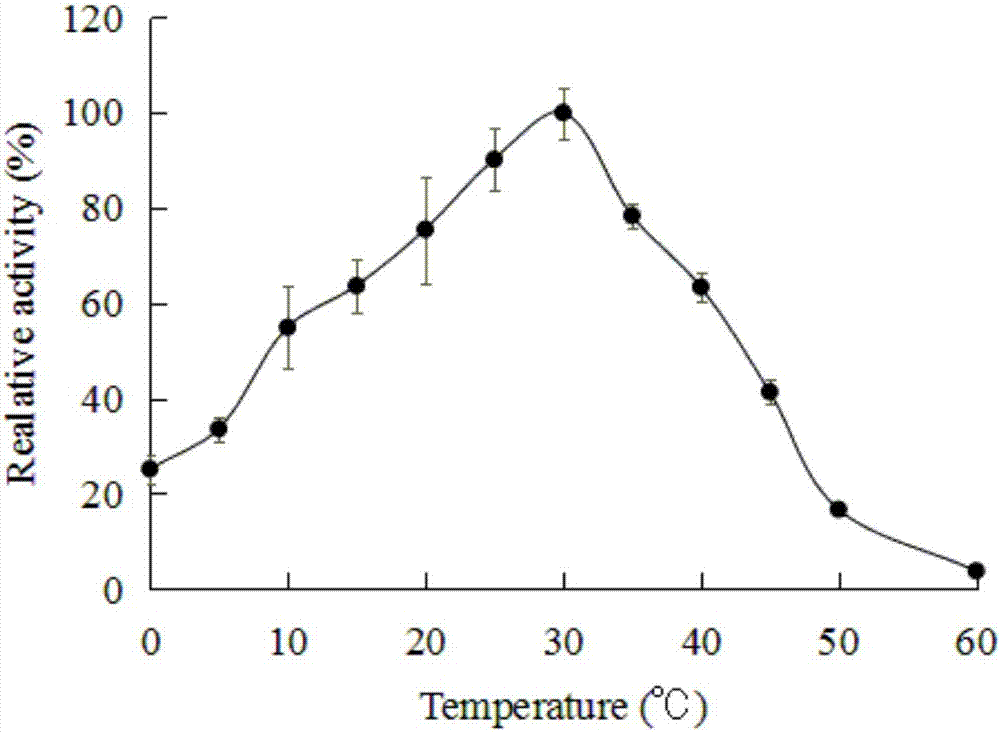
圖2為實施例1制備的低溫堿性果膠裂解酶的活性隨溫度變化的結果。
圖3為實施例1制備的低溫堿性果膠裂解酶的活性隨ph變化的結果。
具體實施方式
以下結合附圖對本發明的原理和特征進行描述,所舉實例只用于解釋本發明,并非用于限定本發明的范圍。
下述實施例中所使用的實驗方法如無特殊說明,均為常規方法。
下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。
實施例1、蛋白及基因的制備與功能
1、兼性嗜冷菌massiliaeurypsychrophila(保藏于“中國典型培養物保藏中心chinacenterfortypeculturecollection,其保藏號為cctccs2016709)。總dna的提取:采用兼性嗜冷菌m.eurypsychrophila,取其新鮮濕菌體20克,懸于10毫升50mmtris緩沖液中(ph8.0),加入少量溶菌酶和8毫升0.25mmedta(ph8.0),混勻后37℃放置20min;之后加入2毫升質量分數為10%的sds,55℃放置5min,分別用等體積酚、氯仿各抽提一次;取最后一次的上清溶液,加入2倍體積乙醇,回收dna沉淀,分別用70%乙醇洗兩次后,沉淀真空干燥,溶于0.5毫升te緩沖液(ph8.0,10mmtris,1mmedta)。
2、合成seqidno.2所示的核苷酸序列
根據seqidno.2所示的核苷酸序列設計引物對如下:
正向引物:5′-ctgccatggatgggccggtgg-3′,如seqidno.3所示;
反向引物:
5′-gtgctcgagttactgggccaggttgg-3′,如seqidno.4所示;
正向引物的下劃線部分為ncoi的酶切位點,反向引物的下劃線部分為xhoi酶切位點。
以兼性嗜冷菌m.eurypsychrophila的總dna為模板,用設計的引物對進行pcr擴增。
pcr反應體系:
pcr反應條件:98℃預變性30s,然后98℃變性10s,55℃退火5s,72℃延伸5s,25個循環,最后72℃延伸5s。
pcr產物用質量分數為0.7%的瓊脂糖凝膠電泳檢測產量和特異性,并用dna純化試劑盒(超薄離心柱型,天根公司生產)純化。將純化的pcr產物進行測序,結果表明pcr產物的序列包括seqidno.2所示1-993位,并將其命名為pel1dna片段。
3、重組表達載體的構建
1)將上述測序正確的pcr產物或人工合成的片段用ncoi和xhoi雙酶切,瓊脂糖電泳回收酶切產物。
2)將質粒pet26b(cat.n069864-3,novogen)用ncoi和xhoi雙酶切,瓊脂糖電泳回收酶切產物。
3)將步驟1)的酶切產物和步驟2)的酶切產物進行連接,連接產物電擊轉化大腸桿菌dh5α后涂布于含有50μg/ml卡那霉素的lb平板,37℃過夜培養,將得到的轉化子用上述的正向引物和反向引物進行菌落pcr,篩選到含有pel1基因的重組菌,提取重組菌的質粒,進行測序驗證,結果表明,在pet26b的ncoi和xhoi酶切位點之間插入了pel1dna片段,該片段包括seqidno.2的自5′端起第1至993位的核苷酸,插入方向正確,將該重組質粒命名為pet26b-pel1。
4、工程菌的制備
將質粒pet26b-pel1電擊轉化大腸桿菌bl21(de3)(cat.n0cd601,全式金公司)后涂布于含有50μg/ml卡那霉素的lb平板,37℃過夜培養,得到含有質粒pet26b-pel1的工程菌,記作bl21/pet26b-pel1。
用pet26b代替pet26b-pel1,轉化大腸桿菌bl21(de3),步驟同上,得到含有pet26b的重組菌,作為對照菌。將轉入pet26b的陽性重組菌記作bl21/pet26b。
5、低溫堿性果膠裂解酶的制備和純化
gehitrapdesalting、gehitrapspff純化柱購自gehealthcare公司,產品目錄號分別為17-1408-01、17-5053-01。
將上述步驟4制備的陽性重組菌bl21/pet26b-pel1培養于含有50μg/ml卡那霉素的lb培養基中,37℃培養3h;od600=0.6時,加入iptg至其在lb培養基中的終濃度0.5mm,轉至18℃繼續培養16h。
在3800rpm、15min條件下離心收集上清液,將上清液用脫鹽柱gehitrapdesalting進行脫鹽處理,用溶液c(50mmtris-hcl,ph7.0)進行洗脫,得到的洗脫液再過陰離子交換柱gehitrapspff,先用溶液d(20mmtris-hcl,ph7.5)洗脫雜蛋白,再用溶液e(20mmtris-hcl,0.5mnacl,ph7.5)洗脫目的蛋白,最后再用脫鹽柱gehitrapdesalting進行脫鹽處理,用溶液f(50mmglycine-naoh,ph10.0)進行洗脫,得到pel1純酶液。
將步驟4制備的對照菌采用相同的步驟進行培養和純化,得到的溶液作為對照酶液。
sds-page電泳顯示純化的pel1蛋白的分子量約為35kda,符合理論推斷的34.7kda。結果如圖1所示,圖1中,泳道m表示蛋白分子量標準(250,150,100,75,50,37,25,20,15kda);泳道1表示大腸桿菌bl21/pet26b-pel1發酵上清液;泳道2表示gedesalting脫鹽柱純化后的pel1蛋白;泳道3表示陽離子交換柱gehitrapspff純化后的pel1蛋白;泳道4表示再次經過gedesalting脫鹽柱純化后的pel1蛋白。可以看出已經獲得了純化的pel1蛋白。同時進行了對照組的實驗,但對照組并沒有得到目的蛋白。
實施例2、以聚半乳糖醛酸為底物驗證蛋白功能
酶活單位定義為1min內催化產生1μmol不飽和半乳糖醛酸所需的酶量。
(一)最適溫度
用ph10.0的50mmglycine-naoh緩沖液稀釋實施例1的步驟5中的pel1純酶液,用稀釋后的酶液進行酶活測定。將稀釋后的酶液記作稀釋酶液。
溶液a組成:由50mm,ph10.0glycine-naoh緩沖液和聚半乳糖醛酸溶液組成;聚半乳糖醛酸在溶液a中的濃度為0.2g/100ml。
實驗組:活性測定反應體系為2.02ml,由2ml溶液a和0.02ml稀釋酶液;反應體系的ph值為10.0;反應體系在特定溫度范圍(0-60℃)內溫育15min后,加入3ml0.03mol/l磷酸緩沖液終止反應,測定od235。
結果如圖2所示。圖2表明,低溫堿性果膠裂解酶具有果膠裂解酶活性。在30℃條件下,低溫堿性果膠裂解酶具有最高的酶活性,為78.75u/mg蛋白;將此溫度下的酶活反應體系的吸光值作為相對活性100%,其他溫度下酶活反應體系的吸光值與此最高酶活體系的吸光值的比值作為相對活性。在10-40℃條件下均具有60%以上的活性。
對照組:以對照菌bl21/pet26b獲得的蛋白(記作對照酶液)進行上述實驗,結果不管在哪個溫度條件下,對照酶液都沒有降解聚半乳糖醛酸的活性。
實驗設3次重復,結果一致。
(二)最適ph
如下各組中的稀釋酶液均是用各組中的緩沖液稀釋實施例1的步驟5中的pel1純酶液得到的。
實驗組:活性測定反應體系為2.02ml,分別由2ml溶液b(b1、b2、b3、b4、b5、b6、b7、b8、b9或b10)和0.02ml稀釋酶液組成;
溶液b1的組成:50mmtris-hcl緩沖液和聚半乳糖醛酸(polygalacturonicacid)組成;聚半乳糖醛酸在溶液b1中的濃度為0.2g/100ml;溶液b1的ph值為7.0。
溶液b2的組成:與溶液b1的組成相同,不同的是溶液b2的ph值為7.5。
溶液b3的組成:與溶液b1的組成相同,不同的是溶液b3的ph值為8。
溶液b4的組成:與溶液b1的組成相同,不同的是溶液b4的ph值為8.5。
溶液b5的組成:與溶液b1的組成相同,不同的是溶液b5的ph值為9。
溶液b6的組成:與溶液b1的組成相同,不同的是將50mmtris-hcl緩沖液替換為50mmglycine-naoh緩沖液。溶液b6的ph值為9.0。
溶液b7的組成:與溶液b1的組成相同,不同的是將50mmtris-hcl緩沖液替換為50mmglycine-naoh緩沖液。溶液b6的ph值為9.5。
溶液b8的組成:與溶液b1的組成相同,不同的是將50mmtris-hcl緩沖液替換為50mmglycine-naoh緩沖液。溶液b6的ph值為10.0。
溶液b9的組成:與溶液b1的組成相同,不同的是將50mmtris-hcl緩沖液替換為50mmglycine-naoh緩沖液。溶液b6的ph值為10.5。
溶液b10的組成:不同的是將50mmtris-hcl緩沖液替換為50mmglycine-naoh緩沖液。溶液b6的ph值為11。
將反應體系在30℃,溫育15min后,加入3ml0.03mol/l磷酸緩沖液終止反應,測定od235。實驗設三次重復。
結果如圖3所示。
低溫堿性果膠裂解酶pel1在ph為7至11.0之間的條件下均具有低溫堿性果膠裂解酶的活性,即可以降解聚半乳糖醛酸。
表明低溫堿性果膠裂解酶在ph10.0條件下具有最高酶活性,為78.75u/mg蛋白。以此最高酶活性體系的吸光值作為相對活性100%,其它反應體系的吸光值與此最高酶活性體系的吸光值的比值作為各自的相對活性。
對照組:以對照菌bl21/pet26b獲得的蛋白(記作對照酶液)進行上述實驗,結果不管在哪個ph條件下,對照酶液都沒有降解聚半乳糖醛酸的活性。
實驗設3次重復,結果一致。
(三)酶熱穩定性
用ph10.0的50mmglycine-naoh緩沖液稀釋實施例1的步驟5中的pel1純酶液,用稀釋后的酶液以聚半乳糖醛酸為底物進行酶活測定。將稀釋后的酶液記作稀釋酶液。
將稀釋酶液在30℃水浴放置30分鐘,每隔5min取樣測定酶的殘余活性。結果顯示,酶在30℃處理15分鐘喪失15%活性,30分鐘后喪失了30%活性。本發明所述的低溫堿性果膠裂解酶的酶解溫度為0-60℃,優選為10-40℃。
(四)ph耐受性
將稀釋酶液分別在ph8、9、9.5、10、10.5和11條件下放置24h后,以聚半乳糖醛酸為底物測定殘余酶活。結果顯示ph9-11條件下仍然具有60%以上的相對酶活。說明該酶具有良好的ph耐受性。
(五)底物特異性
將稀釋酶液分別在相同濃度(質量分數為0.2%)的不同底物條件下進行酶活測定,底物分別為以聚半乳糖醛酸、蘋果來源果膠、橙皮來源果膠、或不同酯化程度的果膠、木聚糖、可溶性淀粉。
以聚半乳糖醛酸為底物測得酶活為參比(100%),對木聚糖和可溶性淀粉都沒有酶活性。對于天然底物,該酶對橙皮來源的果膠酶活比較高。
以上所述僅為本發明的較佳實施例,并不用以限制本發明,凡在本發明的精神和原則之內,所作的任何修改、等同替換、改進等,均應包含在本發明的保護范圍之內。
sequencelisting
<110>湖北大學
<120>一種低溫堿性果膠裂解酶及其編碼基因和應用
<160>4
<170>patentinversion3.5
<210>1
<211>330
<212>prt
<213>兼性嗜冷菌(massiliaeurypsychrophila)
<400>1
metaspglyprovalglytyrglyalaalathrthrglyglyglyasn
151015
lysalaalavalasnvalserserleualaaspmetalaalalysile
202530
lysalatyrserglyserglyglyleuvalleuasntyrthrglylys
354045
pheaspphealaserilelysaspvalcysalaglntrplyslyspro
505560
alaglnthrleugluilelysglylysasnaspilethrilearggly
65707580
alaalaaspserseralaasnpheglyileargilevalglyaspser
859095
serasnvalilevalglnasnmetthrileglyleuleuglnglygly
100105110
gluaspalaaspserileserilegluglythrserserglylyspro
115120125
serlysvaltrpileasphisasnthrilephealaserilelysser
130135140
cysproglyalaglyaspalaserpheaspglyglyileaspmetlys
145150155160
lysglyalaasnhisilethrvalsertyrasntyrvaltyrasntyr
165170175
glnlysvalalaleuasnglytyrserglulysaspthrleuasnala
180185190
glyserleuthrthrtyrhisasnasnargphegluasnvallysser
195200205
argleuproleuleuargtyrglylysalahisilepheasnasntyr
210215220
pheglyasnvalaspthrserglyileasnvalargmetglyalamet
225230235240
alaleuvalgluserasntyrphegluasnvalargasnprovalthr
245250255
serargaspseralalysleuglytyrtrpaspleuargserasnphe
260265270
valglyserglyilethrtrpglyalaprogluaspglyiletyrala
275280285
asnalathrasptrplysthrthrlysalatyrglyprothrglytyr
290295300
asntyrthralaseralaalaalaglyvallysalalysalaileala
305310315320
thralaglyalaargthrasnleualagln
325330
<210>2
<211>993
<212>dna
<213>兼性嗜冷菌(massiliaeurypsychrophila)
<400>2
atggatgggccggtgggctacggcgccgccaccacgggcggtggcaacaaggccgccgtg60
aacgtatcttcgctggccgacatggccgccaagatcaaggcgtattcgggtagcggcggc120
ctggtactgaactacaccggcaagttcgacttcgccagcatcaaggatgtctgcgcacag180
tggaagaagccggcccagaccctggaaatcaagggcaagaacgacatcacgatccgcggc240
gcggccgattcgtccgccaacttcggcatccgtatcgtgggcgattcgagcaacgtgatc300
gtgcagaacatgaccatcggcctgctgcagggtggcgaagacgccgactcgatctcgatc360
gaaggcacgtcgagcggcaagccaagcaaggtctggatcgaccacaacaccattttcgct420
tcgatcaagtcgtgccctggcgcgggcgatgcctcgttcgacggcggcatcgacatgaag480
aagggcgccaaccacatcaccgtgtcgtacaactacgtgtacaactaccagaaggtggcg540
ctcaatggttacagcgaaaaggacaccctcaatgccggatcgctgaccacctaccacaac600
aaccgcttcgagaacgtcaagtcgcgcctgccgctgctgcgttacggtaaagcccacatc660
ttcaacaactacttcggcaacgtggacacctcgggcatcaatgtgcgcatgggcgcgatg720
gcgctggtcgaatcgaactacttcgagaacgtcaggaacccggtcacctcgcgcgacagc780
gccaaactcgggtactgggacctgcgcagcaacttcgtcggcagcggcattacctggggc840
gcgccggaagacggcatttacgccaatgccaccgactggaagaccaccaaggcctacggc900
ccgaccggctacaactacaccgccagcgcggctgcgggcgtgaaagcgaaagccatcgcc960
accgccggtgcgcgcaccaacctggcccagtaa993
<210>3
<211>21
<212>dna
<213>人工序列
<400>3
ctgccatggatgggccggtgg36
<210>4
<211>26
<212>dna
<213>人工序列
<400>4
cagctcgagttactgggccaggttgg43
- 還沒有人留言評論。精彩留言會獲得點贊!