一種檢測登革病毒和寨卡病毒的雙重熒光定量RT?PCR試劑盒的制作方法
本發明屬生物技術領域,涉及一種熒光定量rt-pcr檢測試劑盒,具體涉及一種一步法雙重實時熒光定量rt-pcr在同一個反應管內檢測人或蚊標本中登革病毒和寨卡病毒的核酸檢測方法,可應用于登革病毒和寨卡病毒引起暴發疫情的實驗室應急診斷、快速篩查、臨床診斷及登革病毒和寨卡病毒的流行病學的研究。
背景技術:
登革病毒(denguevirus,denv)和寨卡病毒(zikavirus,zikv)均屬于黃病毒科,黃病毒屬,基因組為單股正鏈rna。denv依抗原性不同分為4種血清型:denv-1、denv-2、denv-3和denv-4,同一型別不同毒株可存在抗原差異,且各個型別之間抗原性存在一定的交叉。寨卡病毒依據基因型分為:亞洲型和非洲型兩個基因型。登革病毒感染的天然宿主包括人和蚊子等,主要通過埃及伊蚊和白紋伊蚊等媒介昆蟲傳播。寨卡病毒在非人靈長類動物和蚊媒之間循環,人屬于偶然宿主,且普遍易感,該病毒主要通過伊蚊傳播,埃及伊蚊為主要傳播媒介,而白紋伊蚊和非洲伊蚊等伊蚊也可傳播,還存在母嬰垂直傳播、性傳播和血液傳播等方式。我國處于亞熱帶區域,南方部分地區(如廣東和廣西等)是埃及伊蚊和白紋伊蚊等蚊媒的流行地區,特別是伊蚊高發的夏秋季節,面臨登革病毒和寨卡病毒暴發流行的高危地區。
登革病毒和寨卡病毒均廣泛流行于熱帶和亞熱帶國家和地區,超過125個國家和地區出現登革病毒感染,70%感染人群發生在亞太地區,正逐漸向世界各地蔓延。寨卡病毒在非洲、亞洲、美洲和太平洋島國地區均有該病暴發流行,疫情呈快速蔓延趨勢。我國于1978年首次在廣東佛山發現該病毒,以后在海南、廣西、福建、浙江、云南等地均有發現,特別是2014年廣東省登革熱流行呈現近二十年來的高峰,感染人數超過4萬,數人死亡;2015年臺灣登革熱流行造成超過3萬人感染,死亡140多人。寨卡病毒于1947年首次在烏干達的恒河猴體內被發現,1952年在烏干達和坦桑尼亞的人體中分離到。2007年以前,全球僅報告14例寨卡病毒病散發病例,2007年首次在太平洋島國密克羅尼西亞的雅普島發現寨卡病毒暴發疫情。2015年巴西出現寨卡病毒的暴發流行,其后超過46個國家和地區有疫情報道,我國于2016年出現多例輸入性寨卡病毒感染病例,疫情存在全球蔓延趨勢。
登革病毒感染多數為無癥狀的隱性感染,發病者主要臨床特征為登革熱(denguefever,df)、登革出血熱(denguehemorrhagicfever,dhf)和登革休克綜合征(dengueshocksyndrome,dss),出現后兩者臨床癥狀的死亡率較高。由于登革病毒易于發生變異且有4個血清型別,初次感染者恢復期的血清抗體僅對該血清型起到一定的保護作用,對其他血清型病毒感染不僅沒有交叉保護作用,反而能夠增強病毒的感染,導致更為嚴重的臨床癥狀。寨卡病毒感染無癥狀者常見,僅約20%感染者出現癥狀,主要臨床表現為低熱、關節痛及皮膚斑丘疹等,不易于登革熱等發熱出疹的病毒性疾病區別。此外寨卡病毒具有極強的嗜神經性,其感染與格林-巴利綜合征、新生兒小頭畸形癥存在一定關聯,本病病死率低,感染后可獲得終身免疫。
目前,尚無安全有效的疫苗被批準應用。控制傳播媒介、防止蚊蟲叮咬是防治登革病毒和寨卡病毒感染的重要措施,早診斷、早治療是降低死亡率的有效手段。登革病毒和寨卡病毒的檢測主要通過病毒培養、血清學檢測、病毒核酸檢測等方法。實時熒光定量pcr技術以其全封閉單管擴增、簡便快捷、重復性好、實時定量、污染少等優勢,克服了以往臨床診斷的缺陷,具有高度的特異性和敏感性,為臨床診斷提供了準確可靠的實驗室依據,可作為一種臨床病原診斷的有效、快速的檢測手段。
由于登革病毒和寨卡病毒感染患者的臨床癥狀及其相似不易于區別,且實驗室中多為檢測登革病毒或寨卡病毒的單色實時熒光定量rt-pcr試劑,因此本研究針對登革病毒(denv-1、denv-2、denv-3和denv-4)和寨卡病毒(亞洲型和非洲型)高度保守且型間存在較小差異的非結構蛋白編碼區分別設計登革病毒和寨卡病毒通用型高特異性的引物探針。采用單管一步法雙重實時熒光定量rt-pcr,能夠單管內一次反應同時檢測出登革病毒和寨卡病毒,不僅極大的節省了試劑耗材,縮短了檢測時間,同時具有極高的特異性和靈敏度。
技術實現要素:
本發明的目的是提供一種用于登革病毒和寨卡病毒通用型檢測的一步法雙重熒光定量rt-pcr檢測試劑盒。本試劑盒包含定量rt-pcr反應液、酶混合液、引物探針混合液、標準品(denv和zikv)、強陽性對照品(denv和zikv,質粒拷貝數均為2×106copies/ml)、弱陽性對照品(denv和zikv,質粒拷貝數均為2×104copies/ml)、陰性對照品。盒內設有容器孔,分別放置定量rt-pcr反應液管、酶混合液管、引物探針混合液管、標準品管(denv和zikv)、強陽性對照品管(denv和zikv)、弱陽性對照品管(denv和zikv)、陰性對照品管。
強、弱陽性對照為包含denv和zikv的保守區基因序列的高、低濃度的陽性質粒樣品。其中denv和zikv高濃度質粒(即強陽性對照品)的拷貝數均為2×106copies/ml,而低濃度(即弱陽性對照品)質粒的拷貝數均為2×104copies/ml。
其中定量rt-pcr反應液管包含:pcr反應緩沖液管(含氯化鎂和三磷酸脫氧核糖核苷酸混合物等)、酶混合液管(含耐熱taqdna聚合酶、rna酶抑制劑和mmlv逆轉錄酶等)、引物探針混合液管(兩組引物和相應的兩種不同熒光標記的探針),且引物探針混合液管需為棕色管。陰性對照為高溫高壓滅菌的depc(焦碳酸二乙酯)處理水,陽性對照為denv和zikv的陽性質粒樣品。
雙重熒光定量rt-pcr檢測用上游引物和下游引物以及相應的特異性探針序列如下:
上游引物denv-f:5’-gactagyggttagaggagacccctc-3’
下游引物denv-r:5’-gcgytctgtgcctggawtgat-3’
特異性探針denv-p:5’-fam-agaccagagatcctgctgt-mgb-3’
上游引物zikv-f:5’-gactgggtaccaactgggagaac-3’
下游引物zikv-r:5’-ggtcgttctcctcaatccacac-3’
特異性探針zikv-p:5’-hex-gaaagggagaatggatgac-mgb-3’
其中denv特異性探針的5’端采用fam熒光標記,zikv特異性探針的5’端采用hex熒光標記;denv和zikv特異性探針的3’端的熒光淬滅標記物均采用mgb熒光染料標記。
上述標準品包括denv、zikv標準品,其保守區基因序列如下:
denv標準品序列為:
gactagcggttagaggagacccctcccatcactgacaaaacgcagcaaaaaagggggcccgaagccaggaggaagctgtactcctggtggaaggactagaggttagaggagacccccccaacacaaaaacagcatattgacgctgggaaagaccagagatcctgctgtctctgcaacatcaatccaggcacagagcgc
zikv標準品序列為:
gactgggtaccaactgggagaaccacctggtcaatccatggaaagggagaatggatgaccactgaggacatgctcatggtgtggaatagagtgtggattgaggagaacgacc
本發明提供的熒光定量試劑盒需于-20℃儲存,盡量減少反復凍融;引物探針混合液需避光條件保存。
本發明的另一個目的是提供上述的雙重熒光定量rt-pcr檢測試劑盒在檢測denv和zikv核酸中的應用。
本發明試劑盒的使用方法:在每次標本檢測中均應設立陽性對照和陰性對照。標準品用takara公司的easydilution(貨號:9160)稀釋為1×102-1×107copies/ml。
樣本核酸的提取:取200μl血清、血漿或尿液樣本加到ep管中,進行核酸提取。核酸提取采用qiagen公司的qiaampviralrnaminikit或qiagenrneasyminikit,按照試劑盒說明書進行提取,取5μl已抽提的待測樣品核酸作為模板。
核酸的檢測:取5ul已抽提的待測樣品核酸作為模板。反應總體積為25μl,其中定量rt-pcr反應液12.5μl,酶混合液1μl,引物探針混合液(20μmol/l,包含兩組特異性引物和相應的兩種熒光探針)共3μl,模板5μl,加水補足至25μl。在abi7500熒光定量pcr儀(或者其他雙色熒光及以上的pcr儀)上進行檢測,反應參數為:反轉錄50℃,20min;95℃5min熱啟動,然后95℃15s,60℃45s,在60℃進行雙重熒光檢測,共進行40個循環。
熒光定量結果報告:①denv、zikv檢測的各自ct值對應相應的熒光標記的病毒,檢測樣本ct值為40、0和無數值時,報告為陰性。②檢測樣本ct值<35時,報告為相應病毒陽性。③檢測樣本ct值≥35且小于40的樣本,建議復檢,復檢結果ct值<38者,且熒光曲線較好,依據②的判斷標準報告為相應病毒陽性。根據所獲得的標準曲線,計算待測標本denv或者zikv的病毒量(copies/ml)。
本發明的有益之處是:運用一步法實時熒光定量rt-pcr技術,采用denv和zikv高度特異的引物和熒光標記探針,研制用于denv和zikv檢測的雙重熒光定量rt-pcr檢測試劑盒。該發明是通過一個rt-pcr反應,可以從血清、血漿和/或尿液標本中同時檢測出是否有denv和zikv的存在,比單重熒光定量pcr方法更便捷迅速、節約成本。同時,對檢測的病毒進行實時準確定量,根據病毒感染的滴度,為臨床上患者提供早期診斷,為臨床治療方案的制定提供參考依據;可應用于denv和zikv引起暴發疫情的實驗室應急診斷、快速篩查、臨床診斷及流行病學的研究。
附圖說明
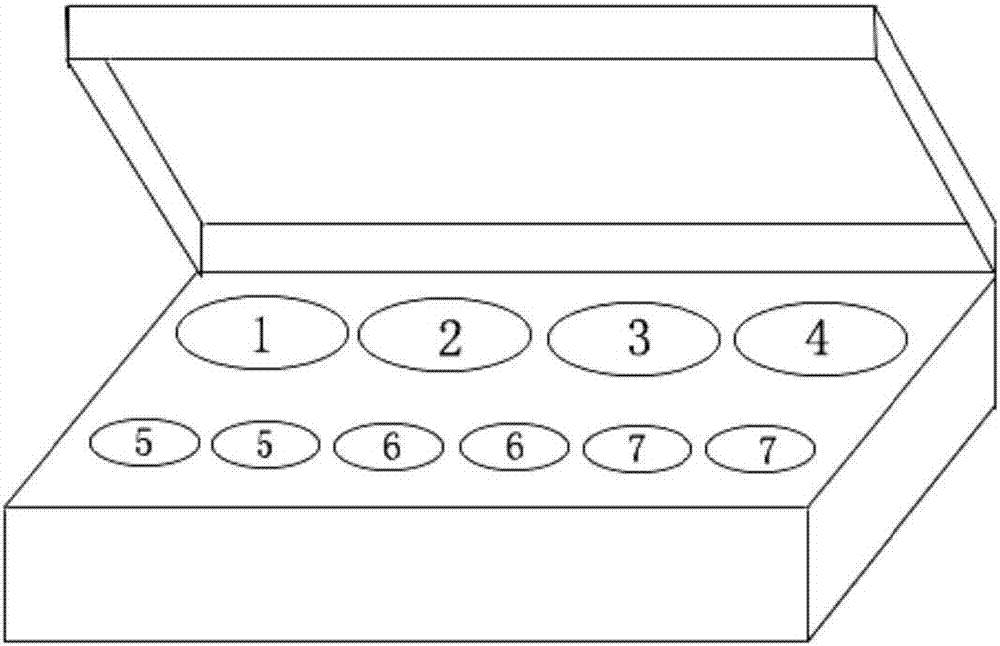
圖1為本試劑盒結構示意圖,其中1為定量rt-pcr反應液管,2為酶混合液管,3為引物探針混合液管,4為陰性對照品管,5為標準品管(denv、zikv,共2管),6為強陽性對照品管(denv、zikv,共2管),7為弱陽性對照品管(denv、zikv,共2管)。
圖2為本試劑盒檢測denv的靈敏度,從左到右(1-6)依次為107、106、105、104、103、102copies/ml。
圖3為本試劑盒denv標準品實時熒光定量rt-pcr產物凝膠電泳示意圖,電泳條帶大小約77bp,其中lanem為dl2000marker,lane1-6分別為denv標準品(107copies/ml)十倍梯度稀釋后實時熒光定量rt-pcr產物,lane7為陰性對照。
圖4為本試劑盒檢測zikv的靈敏度,從左到右(1-6)依次為107、106、105、104、103、102copies/ml。
圖5為本試劑盒zikv標準品實時熒光定量rt-pcr產物凝膠電泳示意圖,電泳條帶大小約81bp,其中lanem為dl2000marker,lane1-6分別為zikv標準品(107copies/ml)十倍梯度稀釋后實時熒光定量rt-pcr產物,lane7為陰性對照。
具體實施方式
下面具體實施例結合附圖對本發明進行進一步闡述本發明,但這些實施例僅限于說明本發明而不限制本發明的范圍。
實施例1
一種檢測denv和zikv的雙重實時熒光定量rt-pcr檢測試劑盒,包含:定量rt-pcr反應液、酶混合液、引物探針混合液、標準品(denv、zikv)、強陽性對照品(denv、zikv)、弱陽性對照品(denv、zikv)、陰性對照品。本試劑盒盒體設有容器孔,與試劑盒各組分對應。盒體設有容器孔,分別用于放置定量rt-pcr反應液管(標號1)、酶混合液管(標號2)、引物探針混合液管(標號3)、陰性對照品管(標號4)、標準品管(包括denv、zikv標準品,共2管,標號5)、強陽性對照品管(包括denv、zikv陽性對照品,共2管,標號6)、強陽性對照品管(包括denv、zikv陽性對照品,共2管,標號7),如圖1所示。
強、弱陽性對照為包含denv和zikv的保守區基因序列的高、低濃度的陽性質粒樣品。其中denv和zikv高濃度質粒(即強陽性對照品)的拷貝數均為2×106copies/ml,而低濃度(即弱陽性對照品)質粒的拷貝數均為2×104copies/ml。
其中定量rt-pcr反應液管包含:pcr反應緩沖液管(含氯化鎂和三磷酸脫氧核糖核苷酸混合物等)、酶混合液管(含耐熱taqdna聚合酶、rna酶抑制劑和mmlv逆轉錄酶等)、引物探針混合液管(兩組引物和相應的兩種不同熒光標記的探針),且引物探針混合液管需為棕色管。陰性對照為高溫高壓滅菌的depc(焦碳酸二乙酯)處理水,陽性對照為denv和zikv的陽性質粒樣品。
雙重熒光定量rt-pcr檢測用上游引物和下游引物以及相應的特異性探針序列如下:
上游引物denv-f:5’-gactagyggttagaggagacccctc-3’
下游引物denv-r:5’-gcgytctgtgcctggawtgat-3’
特異性探針denv-p:5’-fam-agaccagagatcctgctgt-mgb-3’
上游引物zikv-f:5’-gactgggtaccaactgggagaac-3’
下游引物zikv-r:5’-ggtcgttctcctcaatccacac-3’
特異性探針zikv-p:5’-hex-gaaagggagaatggatgac-mgb-3’
其中denv特異性探針的5’端采用fam熒光標記,zikv特異性探針的5’端采用hex熒光標記;denv和zikv特異性探針的3’端的熒光淬滅標記物均采用mgb熒光染料標記。
上述標準品包括denv、zikv標準品,其保守區基因序列如下:
denv標準品序列為:
gactagcggttagaggagacccctcccatcactgacaaaacgcagcaaaaaagggggcccgaagccaggaggaagctgtactcctggtggaaggactagaggttagaggagacccccccaacacaaaaacagcatattgacgctgggaaagaccagagatcctgctgtctctgcaacatcaatccaggcacagagcgc
zikv標準品序列為:
gactgggtaccaactgggagaaccacctggtcaatccatggaaagggagaatggatgaccactgaggacatgctcatggtgtggaatagagtgtggattgaggagaacgacc
本發明提供的熒光定量試劑盒需于-20℃儲存,盡量減少反復凍融;引物探針混合液需避光條件保存。
實施例2
1材料與方法
1.1臨床標本與病毒核酸:
denv和zikv的陽性臨床樣本由浙江省湖州市疾病預防控制中心和浙江省疾病預防控制中心提供,疑似樣本來源于浙江省湖州市第一人民醫院、浙江省湖州市中心醫院和浙江省內其他幾家醫院疑似患者的血漿、血清和或尿液標本,樣本采集后運送至實驗室。另外,其他與發熱出疹相關的病毒如麻疹病毒、風疹病毒、道病毒71型、柯薩奇病毒a16型和柯薩奇病毒a6型,及甲型、乙型流感病毒等病毒的陽性核酸由浙江省湖州市疾病預防控制中心和浙江省湖州市第一人民醫院提供。
1.2引物與探針
從ncbi基因庫下載了涵蓋國內外denv亞型和zikv基因型的多條基因序列。利用mega6.06軟件對其進行同源性比較,確定以上病毒基因組的保守區。使用primerexpress3.0軟件在其保守區設計高度特異性的引物與taqman-mgb探針,引物和探針序列均通過blast驗證,具有較好特異性。引物和探針序列如下,:
上游引物denv-f:5’-gactagyggttagaggagacccctc-3’
下游引物denv-r:5’-gcgytctgtgcctggawtgat-3’
特異性探針denv-p:5’-fam-agaccagagatcctgctgt-mgb-3’
上游引物zikv-f:5’-gactgggtaccaactgggagaac-3’
下游引物zikv-r:5’-ggtcgttctcctcaatccacac-3’
特異性探針zikv-p:5’-hex-gaaagggagaatggatgac-mgb-3’
以上引物和探針委托上海輝睿生物科技有限公司合成。
1.3病毒核酸的提取與標準品定量標準:
吸取200μl血清、血漿或尿液上清加入到ep管中,采用qiagen公司的qiaampviralrnaminikit或qiagenrneasyminikit,按照試劑盒說明書進行提取,取5ul已抽提的待測樣品核酸作為模板。
合成各基因標準品片段,將其連接到質粒載體pmdtm19-tsimplevector(takara公司)。轉化后培養。鑒定后提取質粒dna,利用nanodropnd-2000spectrophotometer測量質粒dna的濃度,確定dna的拷貝數作為標準品定量母液。根據實驗需要,將標準品定量母液稀釋至所需最高濃度,并做十倍稀釋至最低濃度,低溫保存備用。
1.4雙重實時熒光定量rt-pcr反應體系和條件的優化:
反應總體積為25μl,其中定量rt-pcr反應液12.5μl,酶混合液1μl,引物探針混合液(20μmol/l,包含兩種病毒的特異性引物和相應的兩種熒光探針)共3.0μl,模板5μl,depc水補足至25μl。在abi7500熒光定量pcr儀上進行檢測,反應參數為:反轉錄50℃,20min;95℃5min熱啟動,然后95℃15s,60℃45s,在60℃進行雙重熒光檢測,共進行40個循環。結果判斷:選擇熒光檢測模式fam、hex熒光基線調整取3-15個循環的熒光信號平均值,閾值設定以閾值線剛好超過陰性對照品的最高點,樣本呈典型的擴增曲線,判斷為陽性。無典型的擴增曲線,判斷為陰性。體系的優化試驗,在以相同濃度陽性核酸為模板的反應體系中,引物濃度從1~20μm,探針濃度從1~20μm,采用矩陣法優選引物和探針的最佳濃度,根據最低ct值和最高熒光強度增加值(δrn)選擇最佳引物和探針濃度。
1.5雙重實時熒光定量rt-pcr特異性、敏感性和重復性試驗
分別選擇denv和zikv的陽性核酸(均通過基因測序鑒定)和其他與發熱出疹相關的病毒如麻疹病毒、風疹病毒、道病毒71型、柯薩奇病毒a16型和柯薩奇病毒a6型,及甲型和乙型流感病毒等病毒的陽性核酸,用雙重實時熒光定量rt-pcr驗證本方法的特異性;對已標定拷貝數(copies/ml)的denv合成片段(107copies/ml)和zikv合成片段(107copies/ml)分別稀釋后,平行進行熒光pcr反應,比較其靈敏度。此外,對每一個指定濃度的陽性核酸稀釋液作3次重復檢測,得到的ct值計算其標準差和變異系數,驗證該方法的重復性。
2結果
2.1雙重實時熒光定量rt-pcr反應體系及條件
該方法的反應總體積為25μl,其中定量rt-pcr反應液12.5μl,酶混合液1μl,引物探針混合液(20μmol/l,包含兩組特異性引物和相應的兩種熒光探針)共3μl,模板5μl,depc水補足至25μl。在abi7500熒光定量pcr儀上進行檢測,反應參數為:反轉錄50℃,20min;95℃5min熱啟動,然后95℃15s,60℃45s,在60℃進行雙重熒光檢測,共進行40個循環。可獲得最低ct值和最高熒光強度。
2.2特異性試驗
本發明建立的一步法雙重熒光定量rt-pcr方法對denv和zikv具有極好的特異性,能完全檢出近期采集的臨床陽性標本。本發明中的雙重引物探針與其他發熱出疹相關的病毒:麻疹病毒、風疹病毒、道病毒71型、柯薩奇病毒a16型和柯薩奇病毒a6型,及甲型和乙型流感病毒等病毒的陽性核酸均無交叉反應。
2.3敏感性試驗
對denv和zikv敏感性檢測試驗,將已標定拷貝數(copies/ml)的denv合成片段(107copies/ml)、zikv合成片段(107copies/ml)分別十倍梯度稀釋后,用本試劑盒進行檢測,結果該方法檢測敏感性分別達到102、102copies/ml。結果參見圖2(zikv)、圖4(denv)。取實時熒光定量rt-pcr產物3μl,120v恒壓電泳20min,凝膠成像系統拍照。結果參見圖3(zikv)、圖5(denv)。其中lanem為dl2000marker,lane1-6分別為片段(108copies/ml)十倍梯度稀釋后實時熒光定量rt-pcr產物,lane7為陰性對照。,電泳條帶單一,亮度梯度分明,說明本試劑特異性好,定量結果相對準確。
2.4重復性試驗
分別取denv合成片段(終濃度為106copies/ml)、zikv合成片段(106copies/ml)按10倍梯度稀釋成3個不同的濃度,對每一個濃度的樣本作3個重復檢測,結果不同核酸濃度各自的檢測ct值標準差在0.091~0.266之間,變異系數均低于1.0%,具有較好的重復性(結果見表1)。
表1雙重實時熒光定量rt-pcr檢測合成核酸的重復性試驗
實施例3
采用本試劑盒對臨床樣本的檢測:denv(4份)和zikv(2份)的陽性臨床樣本由浙江省湖州市疾病預防控制中心和浙江省疾病預防控制中心提供,疑似樣本來源于浙江省湖州市第一人民醫院、浙江省湖州市中心醫院和浙江省內其他幾家醫院疑似患者的血漿、血清和或尿液標本總共325份。采用本方法中的雙重實時熒光定量rt-pcr對收集到的標本進行驗證,檢測結果如下:denv陽性4份,陽性率1.2%;zikv陽性2份,陽性率0.6%。檢測陽性結果與其已報告結果符合度達100%。
<110>湖州市第一人民醫院
<120>一種檢測登革病毒和寨卡病毒的雙重熒光定量rt-pcr試劑盒
<160>8
<210>1
<211>25
<212>dna
<213>人工序列
<220>
<223>根據denv基因保守區序列設計的pcr檢測上游引物序列
<400>1
gactagyggttagaggagacccctc25
<210>2
<211>21
<212>dna
<213>人工序列
<220>
<223>根據denv基因保守區序列設計的pcr檢測下游引物序列
<400>2
gcgytctgtgcctggawtgat21
<210>3
<211>27
<212>dna
<213>人工序列
<220>
<223>根據denv基因保守區序列設計的taqman-mgb熒光定量檢測探針序列
<400>3
agaccagagatcctgctgt19
<210>4
<211>198
<212>dna
<213>人工序列
<220>
<223>根據denv基因設計的熒光定量檢測標準品序列
<400>4
gactagcggttagaggagacccctcccatcactgacaaaacgcagcaaaaaagggggcccgaagccaggaggaagctgtactcctggtggaaggactagaggttagaggagacccccccaacacaaaaacagcatattgacgctgggaaagaccagagatcctgctgtctctgcaacatcaatccaggcacagagcgc198
<210>5
<211>23
<212>dna
<213>人工序列
<220>
<223>根據zikv基因保守區序列設計的pcr檢測上游引物序列
<400>5
gactgggtaccaactgggagaac23
<210>6
<211>22
<212>dna
<213>人工序列
<220>
<223>根據zikv基因保守區序列設計的pcr檢測下游引物序列
<400>6
ggtcgttctcctcaatccacac22
<210>7
<211>19
<212>dna
<213>人工序列
<220>
<223>根據zikv基因保守區序列設計的taqman-mgb熒光定量檢測探針序列
<400>7
gaaagggagaatggatgac19
<210>8
<211>113
<212>dna
<213>人工序列
<220>
<223>根據zikv基因保守區序列設計的熒光定量檢測標準品序列
<400>8
gactgggtaccaactgggagaaccacctggtcaatccatggaaagggagaatggatgaccactgaggacatgctcatggtgtggaatagagtgtggattgaggagaacgacc113
- 還沒有人留言評論。精彩留言會獲得點贊!