一株釀酒酵母及其用于提高葡萄酒酯類物質含量的用途的制作方法
本發明屬于微生物領域,涉及一株釀酒酵母及其用于提高葡萄酒酯類物質含量的用途。
背景技術:
葡萄酒是以鮮葡萄或葡萄汁為原料,經酵母菌等發酵釀制而成的,酒精度不低于7.0%的酒精飲品。
葡萄酒是極具個性的飲品,不同產區的酒風格特征各不相同,這種差異性也正是葡萄酒的魅力所在。而目前我國的葡萄酒產品同質化嚴重,很少有能夠代表產地特色的優質產品,其中最突出的就是香氣質量差、缺乏產區特征,這也成為制約我國葡萄和葡萄酒產業發展的主要因素之一。
釀酒酵母作為葡萄酒發酵過程中的主導菌株,對葡萄酒品質,特別是在其產地香氣特征的表現上起著決定性作用。其中由釀酒酵母代謝產生的酯類化合物是葡萄酒果香的主要來源,且不同的酯類物質在香氣感知時相互之間具有累加效應,故在一定閾值范圍內酯類化合物濃度的增加可以增強人們對葡萄酒果香的感知,進而提高葡萄酒的特征香氣。
因此,針對性地開展產地特色的增香型葡萄酒酵母菌種選育從根本上提升葡萄酒的香氣質量,對提高我國葡萄酒產品的市場競爭力有著重要意義。
技術實現要素:
本發明提供了一株釀酒酵母,采用該菌株釀造葡萄酒,可以提高其中的酯類物質含量,從而可以提高葡萄酒的品質。
本發明用于提高葡萄酒酯類物質含量的菌株為釀酒酵母(saccharomycescerevisiae)sw1009,它屬于子囊菌亞門(ascomycota)、半子囊菌綱(hemiascomycetes)、酵母目(saccharomycetales)、酵母科(saccharomycetaceae)。該菌株已于2017年3月20日保藏于中國微生物菌種保藏管理委員會普通微生物中心(簡稱cgmcc,地址:北京市朝陽區北辰西路1號院3號,中國科學院微生物研究所),保藏號為cgmccno.13440。
本發明提供的釀酒酵母菌株sw1009是在葡萄表皮篩選的1株耐受性較好,能產生較多酯類物質的酵母菌,通過wl培養基聚類培養得到。在wl培養基中培養時,四周乳白色,中間突出較大,略顯綠色,不透明,生長旺盛,菌落較大,在ypd固體培養基上培養時,菌株呈現米白色,該菌株在ypd液體培養基中28℃培養時,6h即可啟動發酵,11h即可充滿倒立杜氏小管。
本發明還提供了采用釀酒酵母菌株sw1009發酵生產葡萄酒的方法,其特征是,
1)挑取釀酒酵母sw1009菌株接種于ypd液體培養基,26~30℃恒溫振蕩培養18~32小時,得到種子液;
2)然后將種子液接種于預冷的葡萄汁(預先冷至6~8℃)中(接種量為0.5×106~3×106cfu/ml),于6~8℃下保持2-3天后,再對發酵醪液持續升溫至17~19℃;
3)將發酵醪液于17~19℃下恒溫發酵5~6天后,再將發酵醪液持續升溫至26~28℃,于該溫度下恒溫發酵直至發酵醪比重介于0.992-0.995之間時,發酵結束。
本發明還提供了該釀酒酵母菌株sw1009在提高酯類物質含量方面的用途。
實驗證明,該釀酒酵母菌株sw1009具有發酵力強、耐受性好(酒精耐受性和二氧化硫耐受性)、酯類物質含量高等優勢。采用該菌株發酵赤霞珠葡萄生產葡萄酒,產酒精度為12.79%(v/v),酯類物質總量為19.77mg/l(相同條件下發酵的商業酵母71b和d254酵母分別產生15.68mg/l,17.00mg/l),主要酯類化合物為乙酸乙酯、乙酸-2-苯乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯和月桂酸乙酯,經感官評價可給葡萄酒增加成熟漿果的香氣,因此它可以提高葡萄酒的品質。同時本發明的發酵工藝簡單,對于葡萄酒生產廠家來說不需要另外添加新的設備,因此在葡萄酒行業上具有良好的應用前景。
附圖說明
圖1為菌株在wl培養基上的形態圖;
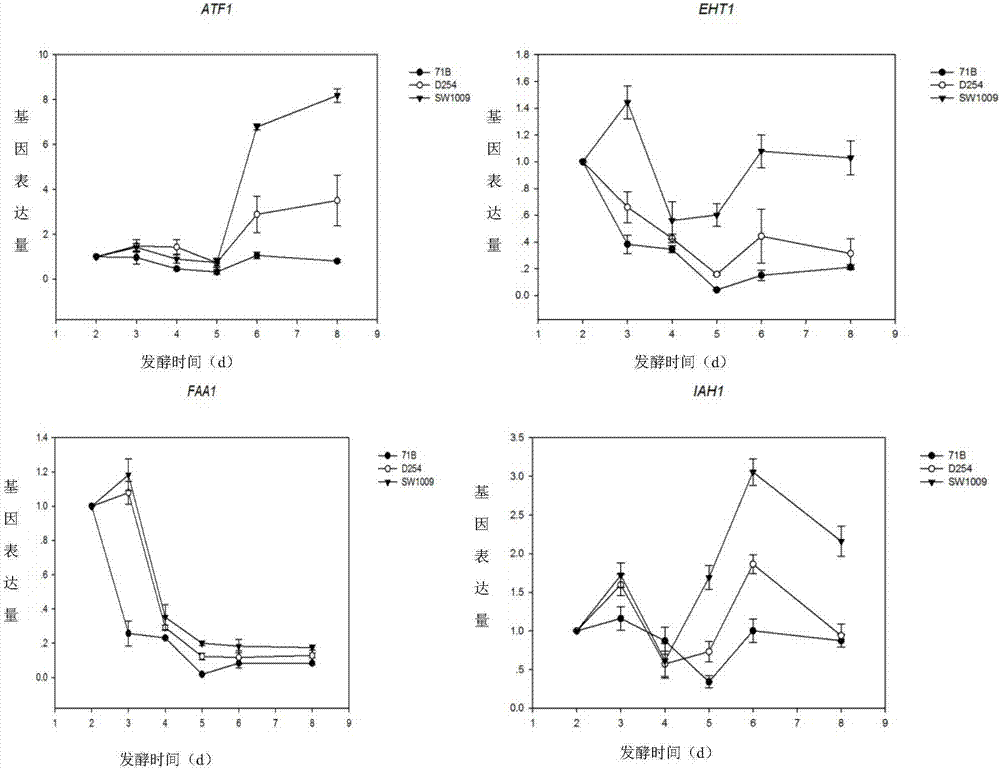
圖2為菌株發酵過程中酯類相關基因(atf1、faa1、eht1和iah1)表達量的變化趨勢圖;
圖3為菌株發酵結束后葡萄酒的gc-ms離子流色譜圖。
具體實施方式
下面結合附圖對本發明的技術方案作進一步的說明,但并不局限于此,凡是對本發明技術方案進行修改或者等同替換,而不脫離本發明技術方案的精神和范圍,均應涵蓋在本發明的保護范圍中。
實施例1:釀酒酵母菌株sw1009的分離和鑒定
1.葡萄表皮酵母菌富集
取約20g完整的葡萄(煙臺,赤霞珠葡萄)于100ml無菌水中,搖床170rpm室溫富集30min。
2.酵母菌的分離純化
將上述富集液體取1ml加入9ml無菌水中,進行梯度稀釋,分別稀釋到10-1到10-4不同濃度,吸取濃度梯度為10-1到10-4的菌液各0.1ml涂布于加入氯霉素(100mg/l)的wl培養基平板,28h培養7d,對平板菌落進行拍照,挑取不同形態特征單菌落接種于ypd固體培養基斜面,28h培養1d進行純化,4℃保存,并且進行測序。本發明中的酵母在wl培養基的形態特征見圖1。
3.高產酯釀酒酵母的初篩
將步驟1)所得到的菌株進行發酵力和耐受性(酒精耐受性和二氧化硫耐受性)試驗,釀酒酵母菌株sw1009的發酵力和耐受性結果見表1-2,將得到的耐受性較好的菌株,使用赤霞珠進行發酵試驗,進一步選取酯類含量較高的菌株進行鑒定。同時在實驗過程中選取富產酯的商品酵母菌株71b和工業生產中常用的商品酵母菌株d254為對照。
3.1菌株發酵力分析
取10mlypd液體培養基分裝于試管,放入倒置的杜氏發酵管(確保充滿液體培養基并無氣泡),121℃滅菌20min。待培養基冷卻后,培養基中加入100mg/l的氯霉素,用竹簽挑取少許酵母菌體接入上述滅菌ypd液體培養基中,28℃靜置培養,每隔4h觀察一次,記錄酵母菌的起始發酵時間和氣體充滿杜氏管的時間。實驗結果見表1。
表1酵母菌株發酵力實驗結果
3.2菌株酒精耐受性分析
取10mlypd液體培養基分裝于試管,放入倒置的杜氏發酵管(確保充滿液體培養基并無氣泡),121℃滅菌20min。待培養基冷卻后,在超凈工作臺中,用移液槍補加100mg/l的氯霉素,并且加入無水乙醇,使培養基中乙醇體積分數分別為12%(v/v),用竹簽挑取少許酵母菌體接入上述滅菌ypd液體培養基中,28℃靜置培養7d,記錄酵母菌生長發育情況,將耐受12%(v/v)酒精度的酵母,繼續接種于14%(v/v)的ypd液體培養基中培養,隨后依次進行16%(v/v)、18%(v/v)、20%(v/v)酵母菌耐受性分析。實驗結果見表2。
表2酵母菌株耐受性實驗結果
3.3菌株二氧化硫耐受性分析
取10mlypd液體培養基分裝于試管,放入倒置的杜氏發酵管(確保充滿液體培養基并無氣泡),121℃滅菌20min。待培養基冷卻后,在超凈工作臺中,用移液槍補加100mg/l的氯霉素,并且加入偏重亞硫酸鉀水溶液(其濃度為50%的so2溶液),使培養基中so2濃度為300mg/l,用竹簽挑取少許酵母菌體接入上述滅菌ypd液體培養基中,28℃靜置培養7d,記錄酵母菌生長發育情況,將耐受300mg/lso2的酵母,繼續接種于400mg/lso2的ypd液體培養基中培養,隨后依次進行500mg/l和600mg/l酵母菌耐受性分析。實驗結果見表2。
將得到的耐受性較好的菌株,使用赤霞珠進行發酵試驗,進一步選取酯類含量較高的菌株sw1009進行鑒定。
4.菌株sw1009鑒定
4.1微生物學特性:在wl培養基中培養時,四周乳白色,中間突出較大,略顯綠色,不透明,生長旺盛,菌落較大,在ypd固體培養基上培養時,菌株呈現米白色。
4.2分子生物學鑒定
對菌株sw1009進行26s測序,得到以下結果(seqno.1):gaggaaaagaaaccaaccgggattgccttagtaacggcgagtgaagcggcaaaagctcaaatttgaaatctggtaccttcggtgcccgagttgtaatttggagagggcaactttggggccgttccttgtctatgttccttggaacaggacgtcatagagggtgagaatcccgtgtggcgaggagtgcggttctttgtaaagtgccttcgaagagtcgagttgtttgggaatgcagctctaagtgggtggtaaattccatctaaagctaaatattggcgagagaccgatagcgaacaagtacagtgatggaaagatgaaaagaactttgaaaagagagtgaaaaagtacgtgaaattgttgaaagggaagggcatttgatcagacatggtgttttgtgccctctgctccttgtgggtaggggaatctcgcatttcactgggccagcatcagttttggtggcaggataaatccataggaatgtagcttgcctcggtaagtattatagcctgtgggaatactgccagctgggactgaggactgcgacgtaagtcaaggatgctggcataatggttatatgcagcccgtct。
然后將其sw1009菌株26s序列與其他菌株進行比對,比對結果如表3所示。
表3sw1009菌株26s序列比對結果
從表3可以看出:本發明的sw1009菌株的26s序列,與genbank中的收錄的13株釀酒酵母saccharomycescerevisiae的相似度均為99%,且其微生物特性符合釀酒酵母種的描述。鑒于以上結果,將sw1009菌株鑒定為釀酒酵母saccharomycescerevisiae。該菌株已經于2017年3月20日保藏于中國微生物菌種保藏管理委員會普通微生物中心(簡稱cgmcc,地址:北京市朝陽區北辰西路1號院3號,中國科學院微生物研究所),保藏號為cgmccno.13440。
實施例2:
1.赤霞珠葡萄發酵試驗
1)配制ypd液體培養基,成分(g/l):酵母膏(或酵母浸粉)10,蛋白胨20,葡萄糖20,其余為是水;ph6.5±0.2;將配制的ypd液體培養基分裝于100ml三角瓶,每瓶50ml,121℃滅菌20min。
2)挑取釀酒酵母sw1009菌株接種于ypd液體培養基,放置于恒溫培養振蕩器,28℃,170r/min培養24h,取100μl菌體懸浮液稀釋200倍,取稀釋液10μl于血球計數板,顯微鏡下計數,每個菌體計數三次。
3)計數結束后按照1×106cfu/ml的接種量接種于破碎赤霞珠葡萄汁(商業酵母71b和d254按照說明書操作),接種結束后放置于8℃下保持溫度2天,再對發酵醪液持續升溫至18℃,于18℃下恒溫發酵5天后,再將發酵醪液持續升溫至26℃,于該溫度下恒溫發酵。
發酵過程監控發酵醪的比重,待發酵醪比重(相對于20℃的水的比重)介于0.992-0.995之間時,發酵結束。經檢測,sw1009產酒精度為12.79%(v/v),同樣的發酵條件下71b產酒精度12.5%(v/v),d254產酒精度12.84%(v/v)。
2.赤霞珠葡萄酒香氣成分的采集
將上述發酵產生的香氣化合物使用ctc自動進樣器進行前處理,取8ml葡萄酒于20ml的頂空進樣瓶,頂空瓶中提前放入2g的氯化鈉,頂空瓶在agitator中預熱10min,后通過dvb/car/pdms萃取頭萃取50min,吸取香氣物質,最后進去安捷倫7890b氣相色譜進樣口,解析10min。
3.gc-ms分析條件
采用5977a質譜儀進行分析,不分流模式進樣,恒流模式,柱流量0.8ml/min,程序升溫,初始溫度40℃,以1℃min升到45℃,保持2min,以3℃/min升到84℃,保持2min,以3℃/min升到120℃,保持3min,以3℃/min升到200℃,以5℃/min升到230℃,運行時間71.667min,msd傳輸線250℃,質譜選擇scan模式進行掃描。
赤霞珠葡萄酒的香味成分的gc-ms離子流色圖譜如圖3所示,赤霞珠葡萄酒的香味成分的分析結果見表4。它與商業酵母71b和d254的香氣成分含量比較見表5。
表4sw1009發酵赤霞珠葡萄酒酯類物質
表5不同酵母發酵赤霞珠葡萄酒酯類物質比較
從表1-2可以看出:相比現有的商用酵母71b和d254,本發明的釀酒酵母菌株sw1009的發酵力和二氧化硫耐受性略有提高;酒精耐受性提高明顯,比商用酵母71b提高6%,比商用酵母d254提高4%,提高幅度分別為42.8%和25%。
從表5可以看出:相比現有的商用酵母71b和d254,本發明的釀酒酵母菌株sw1009的酯類物質成分的總含量提高明顯,比商用酵母71b提高4.09%,比商用酵母d254提高2.77%;提高幅度分別為26.08%和16.29%。從表5還可以看出:本發明的葡萄酒中共檢測出18種酯類物質,主要酯類物質成分為:乙酸乙酯、己酸乙酯、辛酸乙酯,癸酸乙酯和乙酸-2-苯乙酯。相比商用酵母71b和d254,本發明的釀酒酵母菌株sw1009釀造的葡萄酒的辛酸乙酯、己酸乙酯和乙酸-2-苯乙酯含量明顯提高,尤其是辛酸乙酯的含量較高,分別提高了3.8%和2.92%。辛酸乙酯有似白蘭地的香氣并有甜味,己酸乙酯是具有曲香、菠蘿香型的香氣,乙酸苯乙酯是一種帶有密甜底香的玫瑰香氣,三者對提高葡萄酒的香氣都有重要作用,因此本發明提高了葡萄酒的品質。
4.發酵過程酯類相關基因相對表達量分析乙酸乙酯、乙酸-2-苯乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯和月桂酸乙酯。
發酵過程中取樣,共取6個點,使用全式金公司試劑盒對釀酒酵母rna進行提取,并且進行cdna合成,以及熒光定量pcr分析,實驗結果見圖2。其中atf1編碼釀酒酵母(saccharomycescerevisiae)中1種醇乙酰轉移酶(aatase),此酶參與乙酸酯的生成;iah1是最終的酯酶基因,一個由ala85-cys86-ser87-ala88-gly89組成的假定活性位點序列,參與乙酸酯的水解;酵母中乙酯的形成通過乙醇o-酰基轉移酶催化,該酶主要由eht1和eeb1基因編碼;乙基酯生物合成受其前體物質中鏈脂肪酸(mcfas)濃度的直接影響,同時也受長鏈脂肪酸酰基coa的濃度調控,faa1基因編碼酰基coa合成酶,調控長鏈酰基coa的合成。由圖2可以看出,發酵過程中,釀酒酵母菌株sw1009的4個與酯類相關的基因表達量處于較高的表達量狀態。
sequencelisting
<110>山東省農業科學院農產品研究所
<120>一株釀酒酵母及其用于提高葡萄酒酯類物質含量的用途
<130>0
<160>1
<170>patentinversion3.3
<210>1
<211>587
<212>dna
<213>釀酒酵母(saccharomycescerevisiae)sw1009的26s序列
<400>1
gaggaaaagaaaccaaccgggattgccttagtaacggcgagtgaagcggcaaaagctcaa60
atttgaaatctggtaccttcggtgcccgagttgtaatttggagagggcaactttggggcc120
gttccttgtctatgttccttggaacaggacgtcatagagggtgagaatcccgtgtggcga180
ggagtgcggttctttgtaaagtgccttcgaagagtcgagttgtttgggaatgcagctcta240
agtgggtggtaaattccatctaaagctaaatattggcgagagaccgatagcgaacaagta300
cagtgatggaaagatgaaaagaactttgaaaagagagtgaaaaagtacgtgaaattgttg360
aaagggaagggcatttgatcagacatggtgttttgtgccctctgctccttgtgggtaggg420
gaatctcgcatttcactgggccagcatcagttttggtggcaggataaatccataggaatg480
tagcttgcctcggtaagtattatagcctgtgggaatactgccagctgggactgaggactg540
cgacgtaagtcaaggatgctggcataatggttatatgcagcccgtct587
- 還沒有人留言評論。精彩留言會獲得點贊!