一種谷胱甘肽熒光探針及其制備方法和應用與流程
本發明涉及一種檢測細胞中谷胱甘肽的熒光探針及其制備方法和應用,屬于有機小分子熒光探針領域。
背景技術:
氨基酸是構成蛋白質的基本物質,并且與生物的生命活動有著密切的聯系。半胱氨酸(cysteine,cys)、同型半胱氨酸(homocysteine,hcy)和谷胱甘肽(glutataione,gsh)是生物體內常見的巰基化合物,在維持生物的正常生理活動中起著重要的作用。醫學研究表明不正常的生理濃度可能引起很多疾病,比如腎功能衰竭、老年癡呆癥、帕金森疾病、心血管疾病、冠心病、肌肉損傷、皮膚松弛等,它們在生物體內含量變化可以作為這些疾病診斷的依據。因此,在生理條件下高選擇性、高靈敏性地檢測小分子生物硫醇是非常重要的,當前已引起廣泛的關注及深入研究。
目前已經應用的技術包括高效液相色譜法、毛細管電泳法、電化學檢測、光學分析和質譜鑒定,這些方法僅可以在體外監測半胱氨酸、同型半胱氨酸和谷胱甘肽。熒光分子探針不僅靈敏度高選擇性好,而且能夠在活細胞中檢測分析物,所以研究者們開始關注將熒光分子探針的這項技術應用于對體外和活細胞內的半胱氨酸、同型半胱氨酸和谷胱甘肽進行監測或者細胞熒光成像。目前已經報導了多種基于化學反應的該類熒光探針,例如michael加成和親核取代反應等。在這些方法中,利用michael加成使熒光恢復是一種特別有效的方法。由于這三種氨基酸都含有巰基(-sh)并且在結構和反應活性上相差較小,所以這類熒光探針很難將谷胱甘肽和半胱氨酸/同型半胱氨酸區分開,因此研發能夠識別谷胱甘肽的熒光探針是很有必要的。
技術實現要素:
針對現有探針對半胱氨酸、同型半胱氨酸和谷胱甘肽區分度不夠的問題,本發明提供一種反應靈敏、檢測限低、特異性好的可檢測細胞谷胱甘肽的熒光探針co-gsh,可用于評價和研究細胞內谷胱甘肽的生理功能。
本發明的另一目的是提供一種簡便地合成上述谷胱甘肽的熒光探針co-gsh的方法。
本發明還提供了一種上述熒光探針對溶液和細胞內細胞器微環境中的粘度進行傳感檢測的應用。
為實現上述目的,本發明采用如下技術方案。
一種谷胱甘肽熒光探針co-gsh,具有如式(i)所示的結構:
一種上述熒光探針co-gsh的制備方法,采用以下步驟:
(1)將4-二乙胺基水楊醛與丙二酸二乙酯加入乙醇、哌啶,加熱回流,除溶劑后,得化合物7-二乙胺基香豆素-3-甲酸乙酯;
(2)將濃鹽酸、冰乙酸加入7-二乙胺基香豆素-3-甲酸乙酯中回流,冷卻后將反應液倒入冰水中,減壓過濾得7-二乙胺基香豆素;
(3)將三氯氧磷加入到二甲基甲酰胺(dmf)中攪拌,然后加入7-二乙胺基香豆素加熱反應,反應液冷卻后倒入冰水中,調ph,減壓過濾得7-二乙胺基香豆素-3-甲醛;
(4)7-二乙胺基香豆素-3-甲醛與4-硝基苯乙酮在乙醇中加熱回流,生成(e)-7-二乙胺基-3-(3-(4-硝基苯基)-3-橋氧基)香豆素,簡稱co-gsh。
合成路線如下:
所述制備方法中,4-二乙胺基水楊醛與丙二酸二乙酯的摩爾比為1:1.2-1.8;濃鹽酸、冰乙酸與7-二乙胺基香豆素-3-甲酸乙酯的摩爾比為10-15:10-15:1;三氯氧磷、dmf與7-二乙胺基香豆素的摩爾比為1:1:1.5-1.8;7-二乙胺基香豆素-3-甲醛與4-硝基苯乙酮的摩爾比為1:1.1-1.5。
所述制備方法中,步驟(1)的反應溫度為80℃;步驟(2)的反應溫度為105℃,反應時間為10-16h;步驟(3)的反應溫度為60℃,ph為6.8-7.5;步驟(4)的反應溫度為80℃。
所述制備方法中,步驟(2)與步驟(3)的冰水體積為反應液的1-2倍。
一種上述熒光探針用于溶液和細胞中gsh含量檢測的應用。
上述應用,熒光探針co-gsh應用于溶液時的激發波長為430nm,發射波長為480nm和600nm應用于細胞時的激發波長為488nm,發射波段為500-550nm和625-675nm;熒光檢測的時間為反應40min后。
本發明所述檢測gsh的熒光探針co-gsh本身由于7-二乙胺基與羰基之間組成強推拉電子體系使探針的熒光發射在600nm左右,當探針與gsh分子作用后,化合物co-gsh的與gsh發生michael加成反應,導致探針共軛體系變短,使得熒光藍移。識別機理如下:
gsh基團結構為:
本發明具有以下優點:
本發明的co-gsh熒光探針是一種簡單,快速,靈敏的gsh特異性檢測試劑;在低濃度下即可特異與gsh反應,抗多種活性氧、氨基酸及含巰基化合物的干擾;在生物分子檢測領域具有廣闊的應用前景。
附圖說明
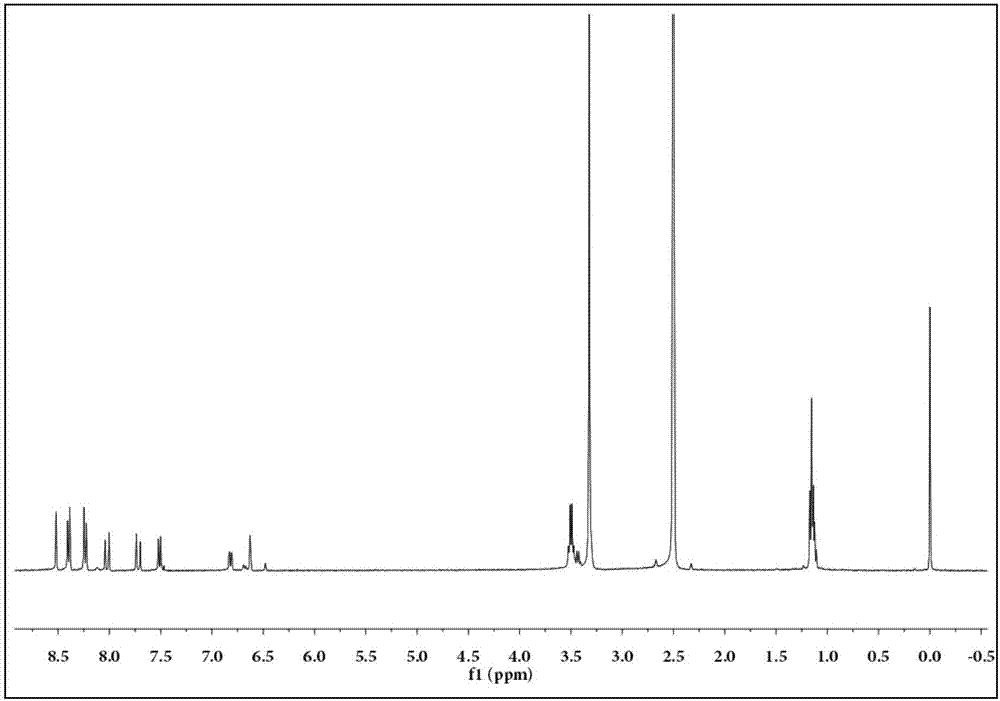
圖1為co-gsh的1hnmr譜圖;
圖2為co-gsh熒光探針對不同分子或離子的選擇性;
圖3為不同濃度的gsh下co-gsh的熒光強度與波長;
圖4為co-gsh的熒光波長隨gsh作用時間的變化;
圖5為co-gsh熒光探針對細胞內源性gsh熒光圖像。
具體實施方式
下面結合實施例和附圖對本發明做進一步說明,但本發明不受下述實施例的限制。
實施例1co-gsh熒光探針的合成:
(1)在100ml圓底燒瓶中,加入4-二乙胺基水楊醛0.01mol,丙二酸二乙酯0.015mol,再加入乙醇20ml、哌啶250μl,80℃加熱回流,減壓蒸除溶劑,得7-二乙胺基香豆素-3-甲酸乙酯;
(2)將7-二乙胺基香豆素-3-甲酸乙酯(0.012mol)中加入10ml濃鹽酸、10ml冰乙酸105℃回流12h,反應結束冷至室溫后,將反應液倒入冰水中,析出大量固體,減壓過濾得到7-二乙胺基香豆素,產率81.9%;
(3)氮氣保護下將2ml三氯氧磷加入到2mldmf中,在室溫下攪拌30min,然后將7-二乙胺基香豆素(0.01mol)加入,在60℃下反應6h,反應結束后將反應液于冰水中,調ph至7左右,析出固體,減壓過濾得到7-二乙胺基香豆素-3-甲醛,產率67%;
(4)將7-二乙胺基香豆素-3-甲醛(0.011mol)與4-硝基苯乙酮(0.013mol)加入到20ml乙醇中,80℃回流12h,冷卻至室溫,減壓過濾得到紅色固體,即(e)-7-二乙胺基-3-(3-(4-硝基苯基)-3-橋氧基)香豆素,簡稱co-gsh,產率77%;co-gsh的1hnmr譜圖如圖1所示:1hnmr(400mhz,dmso)δ8.52(s,1h),8.38(t,j=14.2hz,2h),8.33–8.17(m,2h),8.02(d,j=15.4hz,1h),7.72(d,j=15.4hz,1h),7.49(t,j=15.3hz,1h),6.82(dd,j=9.0,2.4hz,1h),6.64(t,j=7.0hz,1h),3.59–3.44(m,6h),1.11(dd,j=26.3,14.0,7.0hz,4h)。
實施例2co-gsh熒光探針對不同分子或離子的選擇性
將實施例1中co-gsh熒光探針配制成濃度為1mm的母液。
將下列物質br-,clo-,cu2+,f-,fe2+,h2o2,hclo,hg2+,hpo42-,mg2+,n3-,na+,na2s,nahs,no2-,no3-,oac-,onoo-,s2o32-,scn-,so42-,zn2+,單線態氧,羥基自由基,gsh,hcy,cys以磷酸緩沖液(0.01mm,ph=7.4)配制成5ml濃度為40mm的母液。
取28支試管,分別加入25μl探針母液、225μldmso和各離子或分子的母液,對照以等量水代替干擾物質;用磷酸緩沖液(0.01mm,ph=7.4)定容至5ml,使各離子或氨基酸的終濃度為3mm,活性氧和活性氮的終濃度為100mm。各溶液搖勻后進行熒光檢測(λex=430nm,λem=600nm);40min后再次檢測(λex=430nm,λem=480nm)。以480nm熒光強度與600nm熒光強度的比值為縱坐標,以不同分子或離子為橫坐標作圖2;其中,1-28分別為co-gsh,br-,clo-,cu2+,f-,fe2+,h2o2,hclo,hg2+,hpo42-,mg2+,n3-,na+,na2s,nahs,no2-,no3-,oac-,onoo-,s2o32-,scn-,so42-,zn2+,單線態氧,羥基自由基,gsh,hcy,cys。由圖2可以發現,其他離子或分子的加入對i480/i600比值幾乎沒有影響,而gsh的加入使i480/i600比值升高,即gsh的加入使co-gsh的熒光發生藍移。
實施例3不同濃度的gsh下co-gsh的熒光強度與波長變化
配制10ml濃度為100mmgsh的母液,并用水稀釋為1-9mm共17個等差濃度,以水為對照。將實施例2中co-gsh母液稀釋為5μm,分別加入不同濃度的gsh,反應40min后進行熒光檢測(λex=430nm,λem=600-480nm),檢測各體系中熒光強度,以熒光強度-gsh濃度作曲線,如圖3所示。由圖可知,當gsh濃度為最低的試驗濃度(1mm)下,co-gsh即有熒光響應;隨著gsh濃度的增加,反應體系不但熒光強度增強,發射波長也發生藍移,當gsh濃度達到9mm時,反應體系熒光強度在480nm達到飽和狀態。
實施例4co-gsh的熒光波長隨gsh作用時間的變化
以實施例1中co-gsh母液配制5μm探針溶液,以實施例2中gsh母液配制0.3mm溶液。兩者混合后進行熒光檢測(λex=430nm,λem=600nm,λem=480nm),以加入等量水的co-gsh溶液為對照,每2min測定一次,測定60min,測定各體系中隨時間變化的熒光強度,以480nm熒光強度與600nm熒光強度的比值為縱坐標,以作用時間為橫坐標作圖4。反應40min后,反應體系熒光強度i480/i600比值變化趨于平緩,接近飽和狀態。
實施例5co-gsh熒光探針對內源性gsh細胞成像
將本發明熒光探針co-gsh應用于hela細胞中進行熒光成像,得圖5,具體操作步驟如下:
(1)將兩份密度為3×105個/ml的hela細胞在溫度為37℃,co2濃度為5%的培養箱中培養至細胞貼壁;
(2)取一份細胞,加n-乙基馬來酰亞胺(nem)孵育30min后,再加5μmco-gsh孵育40min,用pbs緩沖液沖洗細胞3次,制樣后在熒光顯微鏡下明場成像得圖a),紅通道(625-675nm)成像得圖b),綠通道(500-550nm)成像圖c),明場、紅、綠通道疊加得圖d);
(3)取另一份細胞,加5μmco-gsh孵育40min后,用pbs緩沖液沖洗細胞3次,制樣后在熒光顯微鏡下明場成像得圖e),紅通道成像得圖f),綠通道成像圖g),明場、紅、綠通道疊加得圖h)。
由于nem與巰基殘基反應,使gsh巰基烷基化,不能與熒光探針co-gsh反應,由圖5可知,表現在熒光成像圖像中,添加nem的疊加圖像為橘紅色,而未添加nem的疊加圖像為淺綠色;這說明,熒光探針co-gsh可以與細胞內源gsh反應,并使co-gsh發射波長發生明顯的藍移。
- 還沒有人留言評論。精彩留言會獲得點贊!