一種廢棄生物質資源化方法與流程
技術領域:
本發明屬于生物質新能源技術領域,具體涉及一種利用微生物實現廢棄生物質資源化的工藝。
背景技術:
:
隨著世界范圍化石能源的日益枯竭,開發與利用可再生能源成為當務之急。與以葡萄糖和淀粉為代表的第一代生物質相比,以農林廢棄物為代表的第二代生物質避免了成本上升、與人爭糧、與糧爭地的問題,成為最適合的替代能源之一。木質纖維素作為農林廢棄物的有效成分,是地球上最豐富、最廉價的可再生資源。其主要由纖維素、半纖維素和木質素組成。其中纖維素是由d-葡萄糖通過β-1,4糖苷鍵聯結而成的長鏈分子,長鏈分子進一步通過氫鍵等作用力形成具有高度結晶區的超分子穩定結構。同時,半纖維素和木質素緊密鑲嵌在纖維素周圍。廢棄生物質結構復雜且穩定,使其對化學和生物降解均具有天然的頑抗性。
鑒于木質纖維素的復雜頑抗性,其開發利用的首要環節是預處理,即采用物理、化學或生物法破壞并去除表面木質素和半纖維素,留下纖維素渣應用于后續酶解和生物轉化。目前,已有人采用真菌法或真菌-化學聯合預處理實現了木質素的深度去除。但真菌生長所需時間過長(10~50天),不利于工藝擴大化和商業化。與真菌相比,細菌的數量雖然較少,但可大大縮短生物處理接種時間(<7天),因此采用細菌替代真菌進行廢棄生物質預處理具有重要意義。目前,國內外尚無細菌強化廢棄生物質堿法預處理的相關報道。
在廢棄生物質預處理過程中,還會產生大量的含木質素成分的黑液,這部分木質素通常會被丟棄或焚燒,其資源化潛力被嚴重忽視,不僅造成了生物質中近1/3碳資源的浪費,也帶來了潛在的環境污染。此外,傳統預處理的單一產品線生物精煉工藝導致目標產品的成本過高,難以擴大。不少研究提出整合預處理、酶解和發酵的一步轉化法,簡化了工藝流程,但未能解決木質素資源浪費的問題。因此,預處理黑液的資源化是提高廢棄生物質利用率和工藝經濟性的重要途徑。
事實上,對于廢棄生物質預處理后形成的渣和黑液,目前尚無同時實現兩者的深度去除和資源化的方法。
為解決上述問題,本發明提出了一種廢棄生物質資源化方法(工藝流程如附圖1所示),即利用一株木質素降解菌(cupriavidusbasilensisb-8)應用于堿法預處理后,不僅可深度去除預處理渣中的殘留木質素并將其資源化形成聚羥基脂肪酸酯,還可顯著提高廢棄生物質預處理的酶解效率。同時,將該株菌應用于預處理黑液中,進一步實現了黑液中木質素的利用和資源化。此外,cupriavidusbasilensisb-8資源化產生的聚羥基脂肪酸酯具有類似于合成塑料的物化特性及合成塑料所不具備的生物可降解性、生物相容性、光學活性、壓電性、氣體相隔性等許性能,在包裝材料、組織工程材料、緩釋材料、電學材料以及醫療材料方面有廣闊的應用前景。
總的來說,本發明提出的一種廢棄生物質資源化的方法可顯著推動廢棄生物質的開發和利用。
技術實現要素:
:
為了解決現有廢棄生物質中木質素資源浪費的問題,提高廢棄生物質的利用率,本發明提供了一種利用木質素降解菌實現廢棄生物質資源化的方法。
本發明的技術方案為:
一種廢棄生物質資源化方法,具體步驟如下:
(1)堿法預處理:將廢棄生物質加入氫氧化鈉溶液中,加熱處理后,過濾分離,分別獲得黑液和堿處理濕渣;堿處理濕渣清洗至ph呈中性,烘干至恒重,即得堿處理干渣;
(2)堿處理黑液生物資源化:將木質素降解菌cupriavidusbasilensisb-8,保藏編號為cgmccno.4240接種于含步驟(1)得到的黑液的無菌培養基中,培養后,收集菌體,采用甲醇-氯仿法提取菌體內的聚羥基脂肪酸酯;
(3)堿處理干渣的生物處理和資源化:將木質素降解菌cupriavidusbasilensisb-8,保藏編號為cgmccno.4240接種于含步驟(1)得到的堿處理干渣的無菌培養基中,培養后,過濾分離得堿-生物處理濕渣及上層清液,堿-生物處理濕渣清洗,烘干至恒重,得到堿-生物處理干渣,清液經離心收集菌體;將離心收集的菌體采用甲醇-氯仿法提取菌體內的聚羥基脂肪酸酯;
(4)堿-生物處理干渣資源化:將堿-生物處理干渣酶解,得到糖。
步驟(1)所述的廢棄生物質包括水稻秸稈,玉米秸稈,甘蔗渣或柳枝稷等,將廢棄生物質粉碎后20-100目過篩,超純水清洗兩遍,于60℃烘干至恒重。
步驟(1)將廢棄生物質按固液比為1:10-1:20(g/ml)加入濃度為0.5-2.0%的氫氧化鈉溶液中,靜置于120-125℃恒溫環境中10-60min后,過濾分離,分別獲得黑液和堿處理濕渣;堿處理濕渣用超純水清洗至ph呈中性,烘干至恒重,即堿處理干渣。
步驟(2)將木質素降解菌cupriavidusbasilensisb-8,保藏編號為cgmccno.4240接種于含步驟(1)得到的黑液的無菌培養基中,培養后培養1-2天后,收集菌體,采用甲醇-氯仿法提取菌體內的聚羥基脂肪酸酯。
步驟(2)中細菌接種量為10-20%(移入種子液的體積和接種后培養液體積的比例),溫度25-40℃,自然ph條件,培養時間1-2天。
步驟(2)含黑液的無菌培養基為:黑液5~15g/l,(nh4)2so40.03g/l,k2hpo41g/l,kh2po41g/l,mgso4·7h2o0.2g/l,cacl20.01g/l,feso4·7h2o0.015g/l,mnso4·h2o0.01g/l。
步驟(3)將木質素降解菌接種于含堿處理干渣的無菌培養基中,培養1-2天后,過濾分離得堿-生物處理濕渣及上層清液;堿-生物處理濕渣用超純水清洗3次,烘干至恒重,得到堿-生物處理干渣。
步驟(3)中細菌接種量為10-20%(移入種子液的體積和接種后培養液體積的比例),溫度25-40℃,自然ph條件,培養時間1-2天。
步驟(3)中含堿處理干渣的無菌培養基:堿處理干渣5~15g/l,(nh4)2so40.03g/l,k2hpo41g/l,kh2po41g/l,mgso4·7h2o0.2g/l,cacl20.01g/l,feso4·7h2o0.015g/l,mnso4·h2o0.01g/l。
步驟(4)堿-生物處理干渣資源化:將堿-生物處理干渣按固液比1:40(g/ml)加入50mmph=4.8的檸檬酸緩沖液及纖維素酶12pfu/g水稻秸稈干重,在50℃條件下,酶解24h,得到糖。
本發明提供的預處理方法的優勢在于:
(1)利用木質素降解菌預處理可深度去除堿處理后中殘留的木質素和半纖維素,同時破壞廢棄生物質結構,使廢棄生物質的直桿狀結構消失,而呈現出細絲狀,結構變得松散,增加了酶解糖化時的可及表面。
(2)現有技術中的化學處理方法強度大,能耗高、藥劑使用量大;本發明實現了木質素的深度去除,同時降低了化學預處理的強度、能耗和藥耗,提高了廢棄生物質中碳源利用和資源化產率。
(3)本發明采用的原料為木質纖維素的堿處理黑液,相比于現有技術中采用的其他原料,具有成本低廉的優勢,可大大降低生物塑料工業化應用的成本,同時可減少木質纖維素預處理過程中帶來的環境污染問題。且本發明采用的培養基中多種組分均明顯減少了使用量,從而降低了成本。
(4)大幅提高酶解糖化效率,相比于未經預處理的廢棄生物質,酶解效率最多提高為原來的10倍以上,實現了纖維素及半纖維成分的高效資源化。
(5)具有操作簡單、二次污染小、處理時間短、成本低廉等優點。
(6)實現廢棄生物質中木質素成分資源化的最大化,得到的聚羥基脂肪酸酯在可生物降解的包裝材料、組織工程材料、緩釋材料、電學材料以及醫療材料方面有廣闊的應用前景,豐富了廢棄生物質應用工藝的產品線和經濟性。
本發明所使用的木質素降解菌(cupriavidusbasilensisb-8),保藏編號cgmccno.4240,是由本申請人篩選的已經做過專利保藏和專利申請的菌株。
附圖說明:
圖1:本發明廢棄生物質資源化工藝示意圖;
圖2:實施例中預處理后廢棄生物質糖產量變化;
圖3:實施例中經本發明預處理后廢棄生物質各組分變化;
圖4:實施例中預處理的廢棄生物質預處理前后掃描電鏡分析;
圖5:實施例中得到聚羥基脂肪酸酯的組分(gc-ms)分析結果。
具體實施方式
下面結合附圖和具體實施例對本發明作進一步詳細描述,但不作為對本發明的限定。
實施例1
(1)將水稻秸稈粉碎后60目過篩,超純水清洗兩遍,于60℃烘干至恒重。
(2)將廢棄生物質置于適當大小容器中,按固液比為1:10(g/ml)加入濃度為2%的naoh溶液,靜置于121℃恒溫環境中60min后,過濾分離得到濕渣a1及處理黑液b。
(3)用蒸餾水反復沖洗過濾分離得到的濕渣a1,直至沖洗液ph呈中性,置于60℃烘干至恒重得干渣a2。
(4)將保存在lb斜面的cupriavidusbasilensisb-8菌體接種于lb液體培養基中,于30℃溫度下,培養18h(600nm的光密度達到0.8-1.0),得到cupriavidusbasilensisb-8的種子液;其中所述lb液體培養基各成分配比為:蛋白胨10g,酵母粉5g,氯化鈉10g,蒸餾水1l;所述lb斜面是在上述配方的基礎上加入15g/l的瓊脂;
(5)將上一步所得到的cupriavidusbasilensisb-8種子液在12000rpm條件下離心5分鐘,棄去上層清液,收集菌體;
(6)將收集的cupriavidusbasilensisb-8菌體按20%接種量(移入種子液的體積和接種后培養液體積的比例),接種于a2培養基中,于30℃溫度下,自然ph,培養2天,過濾分離得濕渣a3及上清液,將上清液在12000rpm條件下離心5分鐘,收集沉淀的菌體c1;其中a2培養基各成分配比為:堿處理干渣a210.0g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸餾水1l;
(7)用蒸餾水反復沖洗過濾分離得到的濕渣a3,置于60℃烘干至恒重得到干渣a4。
(8)將干渣a4按固液比1:40(g/ml)加入50mm檸檬酸緩沖液(ph=4.8)及纖維素酶12pfu/g(水稻秸稈干重),在50℃條件下,酶解24h,得到高純度糖。
(9)將步驟(5)收集的cupriavidusbasilensisb-8菌體按20%接種量(移入種子液的體積和接種后培養液體積的比例),接種于處理黑液b培養基中,于30℃溫度下,自然ph,培養2天,其中所述處理黑液b培養基各成分配比為:處理黑液b5g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸餾水1l;
(10)將培養液在12000rpm條件下離心5分鐘,棄去上層清液,收集菌體c2;
(11)將收集到的菌體c1、c2分別采用甲醇-氯仿法提取菌體內積累的聚羥基脂肪酸酯。
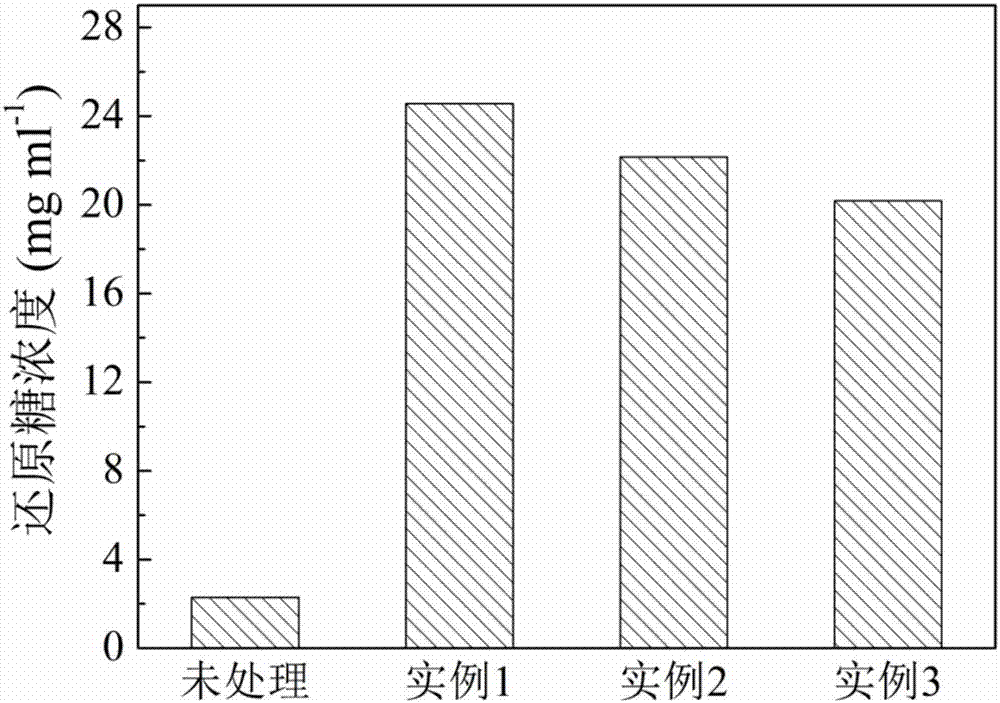
通過本實施例的實施,水稻秸稈各組分含量發生顯著變化,木質素及半纖維素含量顯著降低,而纖維素含量升高(如附圖3)。木質素和半纖維素的去除,使得水稻秸稈的結構更容易被酶解糖化;掃描電鏡圖像(如附圖4)所示,預處理使直桿狀結構消失,原料呈現出細絲狀,使廢棄生物質結構變得松散。經本實施例細菌強化預處理后的水稻秸稈酶解液中還原糖含量從2.3g/l提高到24.6g/l,細菌強化預處理后的酶解效率為未處理的10.7倍(如附圖2),效果顯著。處理廢液經生物處理后,得到聚羥基脂肪酸酯(如附圖5)270mg/l,轉化率高。
實施例2
(1)將水稻秸稈粉碎后60目過篩,超純水清洗兩遍,于60℃烘干至恒重。
(2)將廢棄生物質置于適當大小容器中,按固液比為1:10(g/ml)加入濃度為2%的naoh溶液,靜置于121℃恒溫環境中15min后,過濾分離得到濕渣a1及處理黑液b。
(3)用蒸餾水反復沖洗過濾分離得到的濕渣a1,直至沖洗液ph呈中性,置于60℃烘干至恒重得干渣a2。
(4)將保存在lb斜面的cupriavidusbasilensisb-8菌體接種于lb液體培養基中,于30℃溫度下,培養18h(即600nm處光密度達到0.8-1.0),得到cupriavidusbasilensisb-8的種子液;其中所述lb液體培養基各成分配比為:蛋白胨10g,酵母粉5g,氯化鈉10g,蒸餾水1l;所述lb斜面是在上述配方的基礎上加入15g/l的瓊脂;
(5)將上一步所得到的cupriavidusbasilensisb-8種子液在12000rpm條件下離心5分鐘,棄去上層清液,收集菌體;
(6)將收集的cupriavidusbasilensisb-8菌體按20%接種量(移入種子液的體積和接種后培養液體積的比例),接種于a2培養基中,于30℃溫度下,自然ph,培養2天,過濾分離得濕渣a3及上清液,將上清液在12000rpm條件下離心5分鐘,收集沉淀的菌體c1;其中a2培養基各成分配比為:堿處理干渣a210.0g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸餾水1l;
(7)用蒸餾水反復沖洗過濾分離得到的濕渣a3,置于60℃烘干至恒重得到干渣a4。
(8)將干渣a4按固液比1:40(g/ml)加入50mm檸檬酸緩沖液(ph=4.8)及纖維素酶12pfu/g(水稻秸稈干重),在50℃條件下,酶解24h,得到高純度糖。
(9)將步驟(5)收集的cupriavidusbasilensisb-8菌體按20%接種量(移入種子液的體積和接種后培養液體積的比例),接種于處理黑液b培養基中,于30℃溫度下,自然ph,培養2天,其中所述處理黑液b培養基各成分配比為:處理黑液b5g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸餾水1l;
(10)將培養液在12000rpm條件下離心5分鐘,棄去上層清液,收集菌體c2;
(11)將收集到的菌體c1、c2分別采用甲醇-氯仿法提取菌體內積累的聚羥基脂肪酸酯。
經本實施例細菌強化預處理后的水稻秸稈酶解液中還原糖含量從2.3g/l提高到22.2g/l,酶解效率提高為未處理的9.7倍(如附圖1);處理廢液經生物處理后,得到聚羥基脂肪酸酯270mg/l,轉化率高。
實施例3
(1)將水稻秸稈粉碎后60目過篩,超純水清洗兩遍,于60℃烘干至恒重。
(2)將廢棄生物質置于適當大小容器中,按固液比為1:10(g/ml)加入濃度為1%的naoh溶液,靜置于121℃恒溫環境中30min后,過濾分離得到濕渣a1及處理黑液b。
(3)用蒸餾水反復沖洗過濾分離得到的濕渣a1,直至沖洗液ph呈中性,置于60℃烘干至恒重得干渣a2。
(4)將保存在lb斜面的cupriavidusbasilensisb-8菌體接種于lb液體培養基中,于30℃溫度下,培養18h(即600nm處光密度達到0.8-1.0),得到cupriavidusbasilensisb-8的種子液;其中所述lb液體培養基各成分配比為:蛋白胨10g,酵母粉5g,氯化鈉10g,蒸餾水1l;所述lb斜面是在上述配方的基礎上加入15g/l的瓊脂;
(5)將上一步所得到的cupriavidusbasilensisb-8種子液在12000rpm條件下離心5分鐘,棄去上層清液,收集菌體;
(6)將收集的cupriavidusbasilensisb-8菌體按20%接種量(移入種子液的體積和接種后培養液體積的比例),接種于a2培養基中,于30℃溫度下,自然ph,培養2天,過濾分離得濕渣a3及上清液,將上清液在12000rpm條件下離心5分鐘,收集沉淀的菌體c1;其中a2培養基各成分配比為:堿處理干渣a210.0g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸餾水1l;
(7)用蒸餾水反復沖洗過濾分離得到的濕渣a3,置于60℃烘干至恒重得到干渣a4。
(8)將干渣a4按固液比1:40(g/ml)加入50mm檸檬酸緩沖液(ph=4.8)及纖維素酶12pfu/g(水稻秸稈干重),在50℃條件下,酶解24h,得到高純度糖。
(9)將步驟(5)收集的cupriavidusbasilensisb-8菌體按20%接種量(移入種子液的體積和接種后培養液體積的比例),接種于處理黑液b培養基中,于30℃溫度下,自然ph,培養2天,其中所述處理黑液b培養基各成分配比為:處理黑液b5g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸餾水1l;
(10)將培養液在12000rpm條件下離心5分鐘,棄去上層清液,收集菌體c2;
(11)將收集到的菌體c1、c2分別采用甲醇-氯仿法提取菌體內積累的聚羥基脂肪酸酯。
經本實施例細菌強化預處理后的水稻秸稈酶解液中還原糖含量從2.3g/l提高到20.2g/l,酶解效率提高為未處理的8.8倍(如附圖1);處理廢液經生物處理后,得到聚羥基脂肪酸酯270mg/l,轉化率高。
對比例1
本對比例中的木質纖維素的預處理方法,僅包括實施例3中步驟(1)-(3)的堿溶液預處理過程,其中使用原料、操作參數等均與實施例3相同。經本對比例預處理后的水稻秸稈酶解液中還原糖含量為17.8g/l,低于實施例3中20.2g/l的還原糖產量。此外,實施例3中細菌cupriavidusbasilensisb-8能在預處理過程在菌體內積累聚羥基脂肪酸酯。從而同時實現木質纖維素去除木質素的預處理目的和木質素成分資源化的目的。
對比例2
本對比例僅僅采用堿預處理水稻秸稈,所采用的條件,即按照固液比為1:10,將水稻秸稈置于2%的naoh溶液中,120℃反應4小時。相比于未經預處理水稻秸稈,該對比例處理后的玉米秸稈酶解效率提高9倍。該對比例中固液比、處理液濃度、反應溫度均與實施例1中相似,而處理時間4小時明顯長于實施例1中1小時,但相對酶解效率提高比例卻低于實施例1中的10.7倍。該對比例表明:本發明能夠大大降低化學預處理的能耗。
對比例3
本對比例中采用的木質纖維素預處理方法,僅包括實施例2中步驟(4)-(7)的細菌cupriavidusbasilensisb-8預處理過程,具體步驟如下:
(1)將水稻秸稈粉碎后60目過篩,超純水清洗兩遍,于60℃烘干至恒重,得到干渣b。
(2)將保存在lb斜面的cupriavidusbasilensisb-8菌體接種于lb液體培養基中,于30℃溫度下,培養18h(即600nm處光密度達到0.8-1.0),得到cupriavidusbasilensisb-8的種子液;其中所述lb液體培養基各成分配比為:蛋白胨10g,酵母粉5g,氯化鈉10g,蒸餾水1l;所述lb斜面是在上述配方的基礎上加入15g/l的瓊脂;
(3)將上一步所得到的cupriavidusbasilensisb-8種子液在12000rpm條件下離心5分鐘,棄去上層清液,收集菌體;
(4)將收集的cupriavidusbasilensisb-8菌體按20%接種量(移入種子液的體積和接種后培養液體積的比例),接種于水稻秸稈培養基中,于30℃溫度下,自然ph,培養2天,過濾分離得濕渣c1;其中所述水稻秸稈培養基各成分配比為:干渣b10.0g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso47h2o0.015g,mnso4h2o0.01g,蒸餾水1l;
(5)用蒸餾水反復沖洗過濾分離得到的濕渣c1,置于60℃烘干至恒重得到干渣c2;
(6)將干渣c2按固液比1:40(g/ml)加入50mm檸檬酸緩沖液(ph=4.8)及纖維素酶12pfu/g(水稻秸稈干重),在50℃條件下,酶解24h,得到糖。
經本對比例預處理后的水稻秸稈酶解液中還原糖含量為3.2g/l,略高于未處理水稻秸稈的2.3g/l,但遠遠低于實施例2中22.2g/l的還原糖產量。說明單獨采用cupriavidusbasilensisb-8預處理未能達到理想效果。
對比例4
本對比例即本發明方法處理完成后收集到的菌體c1、c2,與專利(申請號:201610569477.0)中發酵后得到的木質素降解菌cupriavidusbasilensisb-8稀釋至相同菌濃后采用相同的甲醇-氯仿法提取菌體內積累的聚羥基脂肪酸酯進行對比。
專利(申請號:201610569477.0)中細菌cupriavidusbasilensisb-8可利用堿木質素合成的聚羥基脂肪酸酯的產量為0.128g/l,該產量低于本發明實施例1中270mg/l的聚羥基脂肪酸酯的產量。可能是由于本發明采用的原料黑液和堿處理干渣成分復雜,不同于該專利中的堿木質素,而且經過培養基成分的調整,以適應本發明的原料,并得到明顯的優化效果。
此外,實施例1中采用的原料為木質纖維素的堿處理黑液,相比于本對比例中采用的堿木質素,具有成本低廉的優勢,可大大降低生物塑料工業化應用的成本,同時可減少木質纖維素預處理過程中帶來的環境污染問題。且本發明中的氮源濃度(nh4)2so40.03g/l低于該專利中(nh4)2so40.28g/l,cacl20.01g/l低于該專利中0.1g/l,feso4·7h2o0.015g/l低于該專利中0.05g/l,mnso4·h2o0.01g/l低于該專利中0.02g/l。減少了原料的使用量,從而降低成本。
實施例步驟(6)的大部分培養基成分改為與專利(申請號:201610569477.0)相同,以本發明實施例制備的堿處理干渣5~15g/l,代替堿木質素1-6g,其他組分為:(nh4)2so40.28g,k2hpo41g,mgso40.2g,cacl20.1g,feso40.05g,mnso40.02g,kh2po41g,蒸餾水1000ml。結果發現,利用專利(申請號:201610569477.0)中的培養基條件后,細菌生物量顯著減少,預處理后的水稻秸稈的酶解效果僅約為實施例中的1/2。
- 還沒有人留言評論。精彩留言會獲得點贊!