羊肚菌、黃精和雪花蓮活性多糖蛋白及其制備方法和應用與流程
本發明具體涉及羊肚菌、黃精、雪花蓮等真菌與植物活性多糖蛋白及其制備方法和應用。
背景技術:
糖結合蛋白是具有與各種糖專一結合特性的一類結合蛋白。其中大多數有血凝活力,有的還具有促細胞有絲分裂的作用。這些性質與凝集素沒有明顯的區別,因此有人稱這類蛋白質為凝集素,也有人稱它為受體(受體可以是蛋白質、糖蛋白、糖脂或其它化合物,所以應該說是多種受體中的一類)。如哺乳動物肝細胞膜上對半乳糖專一的結合蛋白,ashwell等研究者在同一篇文章中又稱它為凝集素和受體,主要根據其性質和功能從不同的角度命名,沒有嚴格區分的標準。
糖結合蛋白存在于所有生物體:病毒、細菌、真菌、高等植物、動物乃至人的許多組織和器官中。其中有許多是各種細胞膜的組成成分,包括質膜、微粒體膜、高爾基復合體膜等。目前還陸續有新的糖結合蛋白被發現。經過數億年的生物演化,這類蛋白質仍被保留下來,表明它們是生物體內不可缺少的成分,并具有重要的功能。至于它們在機體內的作用直至近幾十年才為人們所重視。目前已有許多實驗室對它們在生物體內的作用、作用機理正在進行廣泛而深人的研究。
細胞與細胞間的粘著如海綿、粘菌的團聚、細菌感染宿主細胞等;機體生長發育和代謝調節控制,如體液中的廢物和老化細胞的清除、分子或離子的傳遞、胚胎發育、粘菌生長的調節等;分子間的識別,如雌蕊受精、精子與卵的結合,共生固氮、防御病原體的侵襲等,都包含有糖結合蛋白的作用。糖結合蛋白主要的一些功能包括胞飲作用、粘著作用、結合蛋白在共生固氮中的作用。
從具有重要藥用價值的植物和真菌中開展糖結合蛋白的研究,具有重要意義。主要的研究方向有:從中選取糖結合蛋白多肽未被研究的、有重要藥用價值的植物以及多種藥食兼用的真菌,集成運用蛋白質化學、腫瘤的細胞生物學、病毒學、分子生物學、生物信息學、蛋白質組學、蛋白質工程和結構生物學相關技術,分離具有自主知識產權的抗重大常見惡性腫瘤(肝癌、乳腺癌、肺癌、胃癌等)、抗艾滋病、流感和肝炎等病毒活性的新型糖結合蛋白質和多肽類化合物(特別是凝集素、受體等生物活性大分子);進行其生物學活性和作用機制研究,揭示糖結合蛋白多肽藥物與細胞內相關蛋白質相互作用的規律,發現并確立其作用新靶點;進行功能基因克隆、結構模擬、表達和定點突變研究以及空間結構研究等。
我們已研究報道過屬于真菌糖結合蛋白的雙孢菇凝集素通過調節細胞周期蛋白介導胰島β細胞增殖。
不過,如何從一些中藥中獲得具有重要藥用活性的多糖蛋白,目前還未形成統一的認識。
技術實現要素:
針對現有技術的缺點和本領域的需求,本發明的目的之一在于提供一種活性多糖蛋白的制備方法,所述方法包括如下步驟:
(1)將原料進行超微粉碎至300目,然后加入氯化鈉溶液進行浸提,過濾離心后,獲得沉淀和上清液;
(2)向所得上清液加入硫酸銨,使飽和度至40%,靜置處理后離心,棄去沉淀;
(3)利用超濾膜對步驟(2)所得物進行超濾,濃縮至原體積的20~30%;
(4)向步驟(3)所得物加入乙醇,進行沉淀處理后離心,取沉淀;
(5)對步驟(4)所得物進行凍干,獲得所述活性多糖蛋白;
所屬原料為羊肚菌、黃精、雪花蓮中的至少一種。
在本發明中,屬于植物糖結合蛋白的黃精凝集素、雪花蓮凝集素家族,是從傳統中藥黃精根莖、雪花蓮中分離出的一種甘露糖/唾液酸結合凝集素,具有抗腫瘤作用。
本發明通過前期研究的積累,整合優化了諸如羊肚菌、黃精、雪花蓮等真菌和植物的多糖結合蛋白分離流程,形成了簡便高效的真菌和植物多糖蛋白分離制備工藝。
作為本發明的優選實施方案,所述原料為羊肚菌和黃精的混合物;優選的,羊肚菌和黃精的重量比為1:1。
作為本發明的優選實施方案,所述原料為羊肚菌、黃精和雪花蓮的混合物;優選的,羊肚菌、黃精和雪花蓮的重量比為1:1:1。
優選的,步驟(1)中,利用氯化鈉溶液進行浸提時,采取兩次浸提的方式;第一次浸提時,氯化鈉溶液的濃度為0.1~0.5m,加入量為10~20ml/g·原料,浸提時間為4~8小時;第二次浸提時,取第一次浸提后所得物,進行離心,取沉淀,加入濃度為0.1~0.5m的氯化鈉溶液,加入量為5~10ml/g·所述沉淀,浸提時間為2~4小時。
優選的,步驟(2)中,靜置處理的時間為4~6小時,和/或,步驟(3)中,超濾時,超濾膜的截留分子量為5000~6000道爾頓。
優選的,步驟(4)中,乙醇與步驟(3)所得物的體積比為6:4~9:1;沉淀處理時,時間為4~6小時。
優選的,在整個制備過程中,溫度不高于42℃,各步驟中進行離心時于4℃下進行。
本發明的另外一個目的在于提供由上述制備方法制備得到的活性多糖蛋白。
本發明的另外一個目的在于提供含有上述活性多糖蛋白的制劑,所述制劑包括口服制劑或者注射制劑。
本發明的另外一個目的在于提供所述的活性多糖蛋白在抗腫瘤、抗病毒、增強免疫力中至少一個方面的應用。
本發明的有益效果:
(1)本發明獲得的活性多糖蛋白的純度高且得率較大;
(2)與現有技術相比,本發明所得活性多糖蛋白的抑制氧自由基、清除羥自由基及抑制腫瘤細胞的活性有很大提高。
附圖說明
圖1為本發明所得活性多糖蛋白對于hela細胞的抑制情況結果圖;
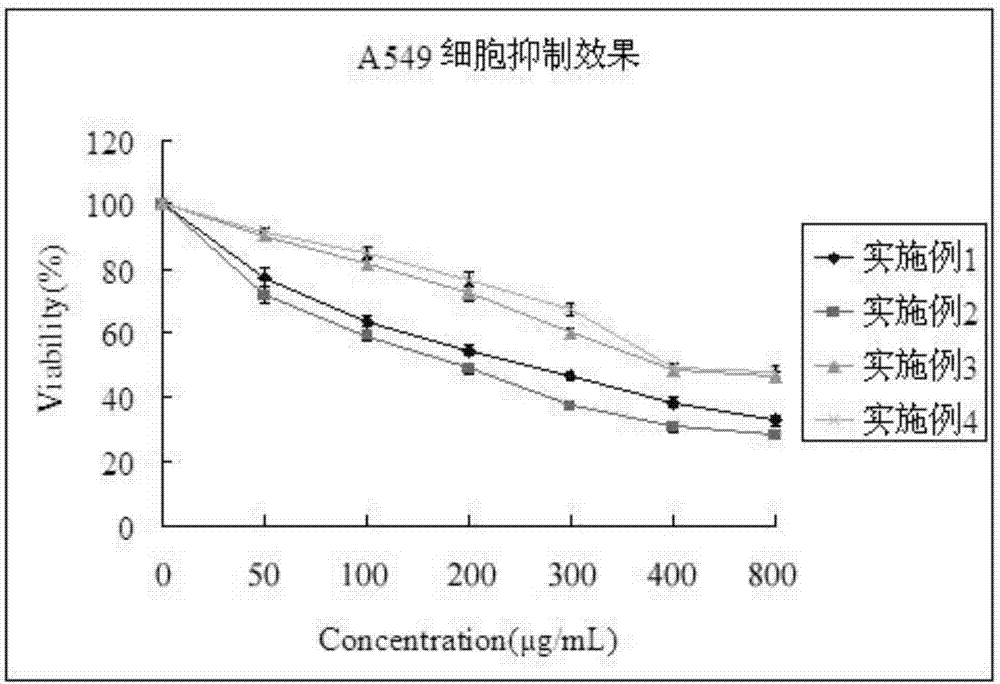
圖2為利用mtt分析法進行本發明所得活性多糖蛋白對a549細胞的抑制情況的結果圖;
圖3位利用mtt分析法進行本發明所得活性多糖蛋白對hela細胞的抑制情況的結果圖。
具體實施方式
下面通過實施例對本發明進行具體描述,有必要在此指出的是以下實施例只是用于對本發明進行進一步的說明,不能理解為對本發明保護范圍的限制,該領域的技術熟練人員根據上述發明內容所做出的一些非本質的改進和調整,仍屬于本發明的保護范圍。
下述實施例中所述的“質量體積比”值得是g/ml。如“質量體積比15倍”則意為15ml/g。
實施例1
將羊肚菌、黃精、雪花蓮干燥材料各取10g混合共30g,用超微粉碎機粉碎至300目,然后加入質量體積比15倍體積的0.1m氯化鈉溶液,攪拌均勻,浸提6小時,2層紗布過濾,離心(4℃,5,000g,30min),獲得上清和沉淀。
取上述沉淀,加入質量體積比5倍體積的0.5m氯化鈉溶液,攪拌均勻,浸提2小時,2層紗布過濾,離心(4℃,5,000g,30min),獲得上清和沉淀。
將所得全部上清合并,得到提取液。
向提取液中添加硫酸按達40%飽和度,放置5小時,離心(4℃,10,000g,20min)去沉淀;
取上清,采用超濾濃縮脫鹽,超濾膜的截留分子量為6000道爾頓;體積濃縮至原來的25%,加入無水乙醇(60%),沉淀6小時后離心(4℃,5,000g,30min),獲得沉淀;
將所述沉淀凍干,得灰白色粉末,即為活性多糖蛋白,整個提取過程在42℃以下。
實施例2
將羊肚菌、黃精干燥材料各取20g混合共40g,用超微粉碎機粉碎至300目,然后加入質量體積比10倍體積的0.3m氯化鈉溶液,攪拌均勻,浸提6小時,2層紗布過濾,離心(4℃,5,000g,30min),獲得上清和沉淀。
取上述沉淀,加入質量體積比8倍體積的0.3m氯化鈉溶液,攪拌均勻,浸提4小時,2層紗布過濾,離心(4℃,5,000g,30min),獲得上清和沉淀。
將所得全部上清合并,得到提取液。
向提取液中添加硫酸按達40%飽和度,放置6小時,離心(4℃,10,000g,20min)去沉淀;
取上清,采用超濾濃縮脫鹽,超濾膜的截留分子量為5000道爾頓;體積濃縮至原來的20%,加入無水乙醇(85%),沉淀5小時后離心(4℃,5,000g,30min),獲得沉淀;
將所述沉淀凍干,得灰白色粉末,即為活性多糖蛋白,整個提取過程在42℃以下。
實施例3
將羊肚菌干燥材料取50g,用超微粉碎機粉碎至300目,然后加入質量體積比20倍體積的0.2m氯化鈉溶液,攪拌均勻,浸提4小時,3層紗布過濾,離心(4℃,5,000g,30min),獲得上清和沉淀。
取上述沉淀,加入質量體積比10倍體積的0.2m氯化鈉溶液,攪拌均勻,浸提3小時,3層紗布過濾,離心(4℃,5,000g,30min),獲得上清和沉淀。
將所得全部上清合并,得到提取液。
向提取液中添加硫酸按達40%飽和度,放置4小時,離心(4℃,10,000g,20min)去沉淀;
取上清,采用超濾濃縮脫鹽,超濾膜的截留分子量為5000道爾頓;體積濃縮至原來的30%,加入無水乙醇(90%),沉淀4小時后離心(4℃,5,000g,30min),獲得沉淀;
將所述沉淀凍干,得灰白色粉末,即為活性多糖蛋白,整個提取過程在42℃以下。
實施例4
將羊肚菌、雪花蓮干燥材料各取25g混合共50g,用超微粉碎機粉碎至300目,然后加入質量體積比10倍體積的0.5m氯化鈉溶液,攪拌均勻,浸提6小時,2層紗布過濾,離心(4℃,5,000g,30min),獲得上清和沉淀。
取上述沉淀,加入質量體積比5倍體積的0.1m氯化鈉溶液,攪拌均勻,浸提4小時,2層紗布過濾,離心(4℃,5,000g,30min),獲得上清和沉淀。
將所得全部上清合并,得到提取液。
向提取液中添加硫酸按達40%飽和度,放置4小時,離心(4℃,10,000g,20min)去沉淀;
取上清,采用超濾濃縮脫鹽,超濾膜的截留分子量為5000道爾頓;體積濃縮至原來的20%,加入無水乙醇(75%),沉淀6小時后離心(4℃,5,000g,30min),獲得沉淀;
將所述沉淀凍干,得灰白色粉末,即為活性多糖蛋白,整個提取過程在42℃以下。
實驗例
總抗氧化能力的測定采用磷鉬酸銨比色法;還原力的測定采用普魯士藍法;清除超氧陰離子自由基能力的測定采用鄰苯三酚自氧化法;清除羥基自由基能力的測定采用水楊酸比色法。總抗氧化能力和還原力的測定中,吸光度值越大表明活性越強;對超氧陰離子自由基和羥基自由基的清除能力的測定中,清除率越大,表明活性越強。清除率按式(1)計算。
r=(d0-d)/d0×100%。(1)
式中,r表示清除率;d0表示對照管的吸光度;d表示樣品管的吸光度。
所有試驗均以vc作陽性對照,根據試驗結果計算樣品和vc的ic50(總抗氧化能力和還原力為吸光度值為0.5時對應的樣品濃度;其他為清除率50%時對應的樣品濃度),并計算樣品的vc當量(每克多糖蛋白相當于vc的毫克數,即vc的ic50除以多糖蛋白的ic50)。
表1提取活性多糖蛋白的抗氧化活性
實驗例2
活性多糖蛋白抑制腫瘤細胞試驗
細胞采用hela細胞;培養條件為:在含有10%胎牛血清(fbs),1%谷氨酰胺(200mmo1/l),青霉素(100iu/ml)和鏈霉素(100mg/l)的rpmi1640培養基中37℃培養,co2濃度為5%。hela細胞在24孔板培養,培養基500μl,培養24h后,加入藥物質量為10μg、20μg、40μg、80μg的提取物蒸餾水溶液100μl,繼續培養24h,觀察。結果見圖1。
體外抗腫瘤活性采用mtt法評價
hela細胞,人肺癌細胞(a549)培養條件為:在含有10%胎牛血清(fbs),1%谷氨酰胺(200mmo1/l),青霉素(100iu/ml)和鏈霉素(100mg/l)的rpmi1640培養基中37℃培養,co2濃度為5%。提取的活性多糖蛋白對hela和a549細胞生長的影響效果采用mtt法進行評價。hela細胞或a549細胞在96孔板的培養密度為5×104cell/ml。固定時間添加含有培養基的多糖蛋白樣品溶液。24h去除培養液。然后采用mtt法測定細胞抑制效果。
根據以下公式計算:
細胞活性(%)=實驗組吸光值/空白組吸光值×100%。
結果如圖2和圖3所示。
- 還沒有人留言評論。精彩留言會獲得點贊!