AntiMUC1CAR?T細胞及其制備方法和應用與流程
本發明涉及一種antimuc1car-t細胞及其制備方法和應用,屬于基因修飾細胞及腫瘤治療技術領域。
背景技術:
在腫瘤免疫治療方法中,淋巴細胞免疫技術包括細胞因子誘導殺傷細胞、細胞毒性t淋巴細胞和浸潤性t淋巴細胞等在國內外已經用于臨床治療惡性腫瘤,并取得一些臨床療效,但其為非特異性免疫作用,由于腫瘤細胞本身免疫逃逸和抗原隱蔽性,其對體內腫瘤細胞清除還非常有限。嵌合抗原受體基因修飾淋巴細胞技術的出現為臨床治療癌癥提供了新的方向。嵌合抗原受體t細胞(chimericantigenreceptortcell,簡稱:car-tcell)療法是通過提取患者體內t淋巴細胞,經過體外10至14天的培養改造,通過載體整合進入到正常t細胞基因序列,形成嵌合抗原受體t細胞(car-t)。被重新編碼的t細胞就能獲得特異性識別和攻擊殺傷腫瘤細胞的能力,能精確殺傷腫瘤細胞,但又不會傷及正常細胞。由于是誘導、激活自體細胞,因此該療法沒有通常放、化療的毒副反應,也沒有傳統治療中出現的耐藥性。
嵌合抗原受體(chimericantigenreceptor,簡稱:car)主要由兩部分構成,一端位于細胞外,能夠特異性識別癌細胞表面的某一抗原;另一端位于細胞內,含有信號激活元件(如t細胞受體的zeta鏈),起傳遞信號激活t細胞的作用。這樣表達car的t淋巴細胞(car-t細胞)就能避免t細胞受體識別靶細胞的限制,從而起到靶向癌細胞的的殺傷作用。目前,car-t治療的臨床試驗正在迅速增長,其中大部分是對b細胞惡性腫瘤治療的評估。不同的臨床試驗所采用的cd19car-t細胞都報道了顯著的效果,復發性或難治性淋巴細胞白血病的治療能達到60-90%的反應率,一部分患者達到持續的緩解,最長的達到2年,這種免疫治療已經給一些患者帶來了前所未有的效果。除了血液系統腫瘤外,研究者們一直在努力將car-t治療擴展到實體瘤,但是,car-t治療實體瘤還處于早期階段,還有許多問題需要解決。
mucin1是膜結合型粘蛋白家族成員,簡稱muc1。在正常情況下,muc1呈低水平表達在乳腺,胰腺,胃腸道,呼吸道及泌尿生殖道的上皮細胞的近管腔面,不能被機體免疫系統識別,其表達特點為極性表達,頂端分布,糖基化豐富。在大多數腺癌、血液系惡性腫瘤中muc1呈異常過表達,可通過調控多個信號通路調節細胞惡性轉化,是促進腫瘤發生與發展的重要癌基因。由于muc1在腫瘤細胞中的表達糖基化不全,并失去極性,遍布于整個細胞表面,容易被抗體識別,因此,muc1蛋白可作為car-t細胞抗腫瘤治療的一個理想靶點。
技術實現要素:
本發明提供一種antimuc1car-t細胞及其制備方法和應用,該細胞經過t細胞修飾和改造得到,并且能夠特異性識別和殺傷腺癌、血液系惡性腫瘤,適用于相應腫瘤疾病的預防和治療。
本發明提供一種antimuc1car-t細胞,所述antimuc1car-t細胞在t細胞內表達scfv–igd–cd28–ox40–cd3ζ融合蛋白;所述scfv–igd–cd28–ox40–cd3ζ融合蛋白中,所述scfv用于結合所述muc1蛋白,并且所述scfv的氨基酸序列為第一序列,所述第一序列為:
evqlqqsggglvqpggsmklscvaskftfsnywmnwvrqspekglewvaeirlksnnyathyaesvkgrftisrddskssvylqmnnlraedtgiyyctfgnsfaywgqgttvtvssggggsggggsggggsdivvtqesalttspgetvtltcrsstgavttsnysnwvqekpdhlftgliggtnnrapgvparfsgskigdkaaltitgaqtedeaiyfcalwesnhwvfgggtkltvlgse
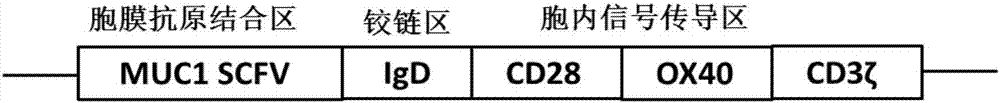
該antimuc1car-t細胞以muc1為靶點,具體地,所述antimuc1car-t細胞的嵌合抗原受體car包括胞膜外抗原結合區、鉸鏈區和胞內信號傳導區,所述胞膜外抗原結合區為scfv,所述鉸鏈區為igd,所述胞內信號傳導區為cd28–ox40–cd3ζ。圖1為本發明的antimuc1car的設計示意圖,請參考圖1。
進一步地,所述scfv–igd–cd28–ox40–cd3ζ融合蛋白中,所述igd的氨基酸序列為第二序列。
具體地,第二序列為:
tftcfvvgsdlkdahltwevagkvptggveegllerhsngsqsqhsrltlprslwnagtsvtctlahpslppqrlmalrepaaqapvklstnllassdppeaa
進一步地,所述scfv–igd–cd28–ox40–cd3ζ融合蛋白中,所述cd28的氨基酸序列為第三序列。
具體地,第三序列為:
fwvlvvvggvlacysllvtvafiifwvrskrsallhsdymnmtprrpgptrkhyqpyapprdfaayrs
進一步地,所述scfv–igd–cd28–ox40–cd3ζ融合蛋白中,所述ox40的氨基酸序列為第四序列,所述cd3ζ的氨基酸序列為第五序列。
具體地,第四序列為:
rrdqrlppdshkppgggsfrtpiqeeqadahstlaki
具體地,第五序列為:
rvkfsrsaeppayqqgqnqlynelnlgrseeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
進一步地,所述scfv–igd–cd28–ox40–cd3ζ融合蛋白中,
所述scfv–igd–cd28–ox40–cd3ζ融合蛋白的氨基酸序列為第六序列。
具體地,第六序列為:
evqlvqsgaevkkpgesltisckasgysfpnywitwvrqmsggglewmgridpgdsyttynpsfqghvtisidkstntaylhwnslkasdtamyycaryyvslvdiwgqgtlvtvssggggsggggsggggsqsvltqpasvsgspgqsitisctgtsskvggynyvswyqqhpgkapklmiydvnnrpsevsnrfsgsksgntasltisglqaedeadyykssyttgsravfgggtkltvlgtftcfvvgsdlkdahltwevagkvptggveegllerhsngsqsqhsrltlpralwnagtsvtctlnhpslppqrlmalrepaaqapvklslnllassdppeaafwvlvvvggvlacysllvtvafiifwvrskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrsrrdqrlppdahkppgggsfrtpiqeeqadahstlakirvkfsrsaeppakqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
進一步地,所述antimuc1car-t細胞通過慢病毒感染t淋巴細胞獲得,所述慢病毒通過攜帶有所述scfv–igd–cd28–ox40–cd3ζ融合蛋白的慢病毒表達載體感染293t細胞得到。
本發明還提供一種上述任一所述的antimuc1car-t細胞的制備方法,包括如下步驟:
1)構建慢病毒表達載體,所述慢病毒表達載體具有所述scfv–igd–cd28–ox40–cd3ζ融合蛋白;
2)利用慢病毒包裝質粒和所述慢病毒表達載體感染293t細胞,獲得慢病毒,所述慢病毒被所述scfv–igd–cd28–ox40–cd3ζ融合蛋白包裝;
3)分離t淋巴細胞,并用所述慢病毒感染所述t淋巴細胞,獲得所述antimuc1car-t細胞,所述antimuc1car-t細胞的t細胞內表達所述scfv–igd–cd28–ox40–cd3ζ融合蛋白。
在步驟1)中,通過基因工程手段,將scfv–igd–cd28–ox40–cd3ζ融合蛋白基因克隆到慢病毒表達載體上,從而完成對慢病毒表達載體的構建。在步驟2)中,利用步驟1)所得的慢病毒表達載體對293t細胞感染,獲得被scfv–igd–cd28–ox40–cd3ζ融合蛋白包裝的慢病毒。在步驟3)中,將步驟2)中的慢病毒表達于人外周血中分離收集的t淋巴細胞以獲得car-t細胞。
進一步地,在所述步驟1)之前,還包括合成和擴增所述scfv–igd–cd28–ox40–cd3ζ融合蛋白基因。具體合成和擴增方法可按照本領域常規技術手段獲得。
進一步地,還包括對所述慢病毒進行純化,并用所述純化后的慢病毒感染所述t淋巴細胞。一般的,該純化手段可以使用本領域常規手段進行,例如過濾、超濾等。
本發明還提供了上述任一所述的antimuc1car-t細胞在制備治療腺癌藥物中的應用,尤其能夠用于muc1分子高表達的腫瘤的治療。
本發明方案具有以下優點:
1、本發明的antimuc1car-t細胞將muc1抗體用于car-t細胞的構建,能夠對muc1蛋白進行有效結合。
2、本發明提供的antimuc1car-t細胞制備方法能簡單、有效的制備具有特異性識別和殺傷腫瘤的antimuc1car-t細胞。
3、本發明的antimuc1car-t細胞具有高效的腫瘤殺傷活性,能夠用于制備治療腫瘤藥物中,尤其能夠以muc1分子為靶抗原,用于muc1分子高表達腫瘤的治療。
附圖說明
圖1為本發明的antimuc1car的設計示意圖;
圖2為本發明實施例的antimuc1car-t細胞以及未感染的t細胞對靶細胞mcf-7(乳腺癌)的殺傷效果示意圖;
圖3為本發明實施例的antimuc1car-t細胞以及未感染的t細胞對靶細胞bxpc-3(胰腺癌)的殺傷效果示意圖;
圖4為本發明實施例的antimuc1car-t細胞、對照例以及空白例對治療乳腺癌(mcf-7)移植瘤模型小鼠后的小鼠生存期示意圖。
具體實施方式
為使本發明的目的、技術方案和優點更加清楚,下面將結合本發明的實施例,對本發明實施例中的技術方案進行清楚、完整地描述,顯然,所描述的實施例是本發明一部分實施例,而不是全部的實施例。基于本發明中的實施例,本領域普通技術人員在沒有做出創造性勞動前提下所獲得的所有其他實施例,都屬于本發明保護的范圍。
實施例1
本發明antimuc1car-t細胞的制備
1、構建慢病毒表達載體
通過常規的基因工程手段,合成scfv–igd–cd28–ox40–cd3ζ融合蛋白基因序列,將scfv–igd–cd28–ox40–cd3ζ融合蛋白基因序列克隆到慢病毒表達載體上,獲得scfv–igd–cd28–ox40–cd3ζ慢病毒表達載體pgreenpuro-car。其中,scfv–igd–cd28–ox40–cd3ζ融合蛋白的各序列如前所述。
2、慢病毒包裝
1)用質量分數為10wt%胎牛血清(fetalbovineserum,簡稱:fbs)的1640培養基培養293t細胞;
2)將293t細胞以3x105/cm2的密度傳至直徑15cm的培養皿中培養20h,保證轉染時細胞匯合度為80-90%;
用不含血清的1640培養基換液,備用;
3)取兩個ep管,分別在兩個ep管中加入1ml1640,將慢病毒載體pgreenpuro-car與pmdlgprre、prsv-rev和pmd2.g質粒按照摩爾比1:1:1:1于其中一個ep管中混勻;在另一個ep管中加入150ullipo2000,混勻放置5min;將混有lipo2000的1640加入含有質粒的ep管中,混勻得混合液,室溫放置20min,然后將混合液逐滴加入上述2)中制備的細胞培養皿中,繼續培養4h后,用含10%fbs的1640培養基更換培養液,繼續培養48h后收集細胞上清液,獲得被scfv–igd–cd28–ox40–cd3ζ融合蛋白包裝的慢病毒。
3、慢病毒純化
將2中獲得的被包裝的慢病毒用0.22μm過濾膜過濾,濾液收集在50ml超濾管中,以3000g/min的速度離心45min;將剩余的上層病毒濃縮液轉移至ep管,放-80℃保存備用。
4、cd8+t細胞的分離
1)全血倒入50ml離心管,室溫離心20分鐘,控制離心力ref為700g(普通離心);
2)取上述離心下部細胞成分,加杜氏磷酸鹽緩沖液dpbs至50ml;
3)分別取25ml上述液體加到20ml人淋巴細胞分離液,將離心管室溫離心15分鐘,控制離心力ref為800g;
5)取白膜層細胞,加入dpbs,補足至50ml;
6)離心10分鐘,控制離心力ref為600g,棄上清液,得外周血單個細胞(peripheralbloodmononuclearcell,簡稱:pbmc);
7)采用cd8+t細胞磁珠分選試劑盒分選cd8+t細胞。
5、慢病毒載體感染t淋巴細胞
用質量分數為10wt%fbs的rpmi1640完全培養基培養cd8+t細胞,第一天加入抗cd3單克隆抗體活化;第三天加入150moi的3中純化后的慢病毒(antimuc1car),16h后將培養基更換為含有50iu/ml重組人il-2的rpmi1640完全培養基,繼續培養10-20天,得到antimuc1car-t細胞。
實施例2
對實施例1制備的antimuc1car-t細胞體外抗腫瘤效果進行評價,包括以下步驟:
以穩定表達muc1的乳腺癌細胞系mcf-7和胰腺癌細胞系bxpc-3作為靶細胞,分別用慢病毒載體pgreenpuro-car感染的t細胞(即,實施例1制得antimuc1car-t細胞)和未感染的t細胞制得效應細胞,將靶細胞按照密度1x105個/ml接種96孔板,每孔100μl,按照5:1,10:1,20:1效靶比將效應細胞加入靶細胞,置于5%co2,37℃培養箱培養4h,采用wst-1檢測細胞活力,計算殺傷效率。
圖2為本發明實施例的antimuc1car-t細胞以及未感染的t細胞對靶細胞mcf-7(乳腺癌)的殺傷效果示意圖;圖3為本發明實施例的antimuc1car-t細胞以及未感染的t細胞對靶細胞bxpc-3(胰腺癌)的殺傷效果示意圖。
圖2和圖3結果表明,表達muc1car的t淋巴細胞對muc1陽性腫瘤細胞具有很強的殺傷作用。
實施例3
對實施例1制備的antimuc1car-t細胞體內抗腫瘤效果進行評價,包括以下步驟:
取6周齡雌裸鼠15只,右腋下皮下注射5x106mcf-7(乳腺癌)細胞,待腫瘤長到60mm3大小,腫瘤模型隨機分成3組:對照組、antimuc1car-t細胞組、t細胞組;對照組尾靜脈注射生理鹽水200ul/次,每周2次;antimuc1car-t細胞組尾靜脈注射antimuc1car-t細胞1×107個/次,每周2次;t細胞組尾靜脈注射t細胞1×107個/次,每周2次;統計100天內小鼠生存狀態,做生存率曲線。圖4為本發明實施例的antimuc1car-t細胞、對照例以及空白例對治療乳腺癌(mcf-7)移植瘤模型小鼠后的小鼠生存期示意圖。
圖4結果表明,antimuc1car-t細胞相對于未感染的t細胞以及空白例可延遲muc1高表達的乳腺癌移植瘤小鼠模型的生存期。
最后應說明的是:以上各實施例僅用以說明本發明的技術方案,而非對其限制;盡管參照前述各實施例對本發明進行了詳細的說明,本領域的普通技術人員應當理解:其依然可以對前述各實施例所記載的技術方案進行修改,或者對其中部分或者全部技術特征進行等同替換;而這些修改或者替換,并不使相應技術方案的本質脫離本發明各實施例技術方案的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!