藥品中銅綠假單胞菌能力驗證樣品及其制備方法與流程
本發明屬于微生物學檢測方面的質量控制領域,特別涉及一種藥品中銅綠假單胞菌能力驗證樣品及其制備方法。
背景技術:
藥品微生物學檢驗領域非常特殊。目前,雖然國內外已有認可機構組織藥品微生物學能力驗證和大規模的制備微生物能力驗證樣品的先例,但樣品均為僅含銅綠假單胞菌的純菌株,沒有背景菌存在,與實際樣品差異較大,即銅綠假單胞菌標準樣品仍屬空白領域。
銅綠假單胞菌,又稱綠膿桿菌,攝入到人體后,會引起人腹瀉、發燒等癥狀。如果制備的銅綠假單胞菌樣品中,目標菌群易發生變化(繁殖和死亡等),就會導致樣品的保存期短,樣品的均勻性和穩定性差。因此,綜合考慮細菌的生化特性,選取性質相對穩定的菌群作為目標菌群對保證樣品的均勻性和穩定性十分重要。銅綠假單胞菌樣品制備的工藝技術要求比較高,并且樣品的均勻性和穩定性與凍干的菌種、凍干的工藝條件、凍干保護劑的使用、再水化的介質等均有密切的關系。
藥品中銅綠假單胞菌指標,直接反映著藥品的衛生質量與潛在致病風險。如果藥品中污染了銅綠假單胞菌,會導致患者直接感染銅綠假單胞菌,甚至有致命的風險。因此,制備均勻性與穩定性俱佳的銅綠假單胞菌樣品,可以避免銅綠假單胞菌檢驗的隨意性和不確定性,真實地反映檢測實驗室的能力。這對提高實驗室質量控制水平,保障藥品安全,甚至于打破國際貿易壁壘、提高我國藥品國際競爭力都具有特殊重要的意義。
技術實現要素:
本發明的目的是克服銅綠假單胞菌測定樣品中總的活的細菌數目在運輸、儲存和測試等過程中菌落數都可發生變化的問題,提供一種藥品中銅綠假單胞菌能力驗證樣品,均勻性、穩定性符合能力驗證要求,本發明的另一個目的是提供該樣品的制備方法,工藝簡單,成功率高。
本發明為實現上述目的所采用的技術方案是:藥品中銅綠假單胞菌能力驗證樣品,其特征是:包括目標菌和背景菌群,所述目標菌為銅綠假單胞菌(pseudomonasaeruginosa),所述背景菌群由大腸埃希菌(e.coil)、肺炎克雷伯菌(klebsiellapnenmoniae)、金黃色葡萄球菌(staphylococcusaureus)、蠟樣芽胞桿菌(bacilluscereus)組成。
所述樣品以海藻糖、脫脂奶粉和無菌水為基質,其中海藻糖的體積分數為12%、脫脂奶粉的體積分數為0.5%。
所述樣品中目標菌的目標濃度為102cfu/ml,背景菌群的目標濃度為103cfu/ml。
一種藥品中銅綠假單胞菌能力驗證樣品的制備方法,其特征是:包括樣品添加菌株的選擇、凍干保護劑的配制、樣品凍干、樣品的均勻性和穩定性試驗四個步驟,其中樣品凍干過程為:菌株復蘇傳代—增菌—菌懸液配制—凍干和包裝—儲存,具體過程為:
(1)菌株復蘇傳代
將標準菌株接種到營養瓊脂斜面培養基中,在36±1℃下使其復蘇和生長,并對復蘇的菌株進行鑒定;
(2)增菌
目標菌培養至對數生長期末,背景菌群培養至穩定期,從斜面刮取菌落,加到10ml的凍干保護劑中制成相應單一菌種的菌液;
(3)菌懸液配制
將上一過程得到的菌液與凍干保護劑混合,按目標菌的目標濃度102cfu/ml和背景菌群的目標濃度103cfu/ml配制菌懸液,分別配制目標菌的菌懸液和4個背景菌的菌懸液,背景菌按1:1體積比混合形成背景菌群懸液,再將目標菌懸液與背景菌群懸液按1:1體積比混合,置于磁力攪拌器上不斷攪拌下分裝到樣品瓶中,加上瓶塞,但要留有空隙,不要蓋實;(4)凍干和包裝
將裝有混合菌懸液的樣品瓶開蓋放入凍干機中,冷凍干燥40~50h,當樣品冷凍干燥結束后,直接進行箱內加塞,關閉機器,樣品瓶中樣品為真空狀態;
(5)儲存
將樣品放置在-18℃條件下避光保存,從全部樣品中隨機挑選樣品進行均勻性和穩定性試驗,滿足要求后發放給參試實驗室進行實驗室間比對。
所述凍干保護劑為含有海藻糖和脫脂奶粉的無菌水,其中體積分數分別為:海藻糖12%、脫脂奶粉0.5%。
所述樣品的均勻性和穩定性試驗按照cnas—gl03《能力驗證樣品均勻性和穩定性評價指南》進行。
本發明菌種的選擇采用銅綠假單胞菌作為銅綠假單胞菌樣品的目標菌群,以大腸埃希菌、肺炎克雷伯菌、金黃色葡萄球菌、蠟樣芽胞桿菌作為背景菌群。眾所周知,銅綠假單胞菌屬于非發酵革蘭氏陰性桿菌,以銅綠假單胞菌作為目標菌群,可以最大程度保證測試樣品的穩定性,即使在運輸及儲存中大腸埃希菌的含量發生變化,在統計學意義上也不會影響銅綠假單胞菌的總量。
本發明的銅綠假單胞菌能力驗證樣品具有以下優勢特性:活的微生物、數量不發生變化、生化特征不發生變異,從滿足特殊運輸的條件著手,通過特殊工藝的研究、穩定性和均勻性的研究等形成一套完善的能力驗證的樣品制備技術,完全適合開展藥品中銅綠假單胞菌(定性)項目的考核,正確評價能力驗證結果。
附圖說明
圖1為本發明工藝流程圖。
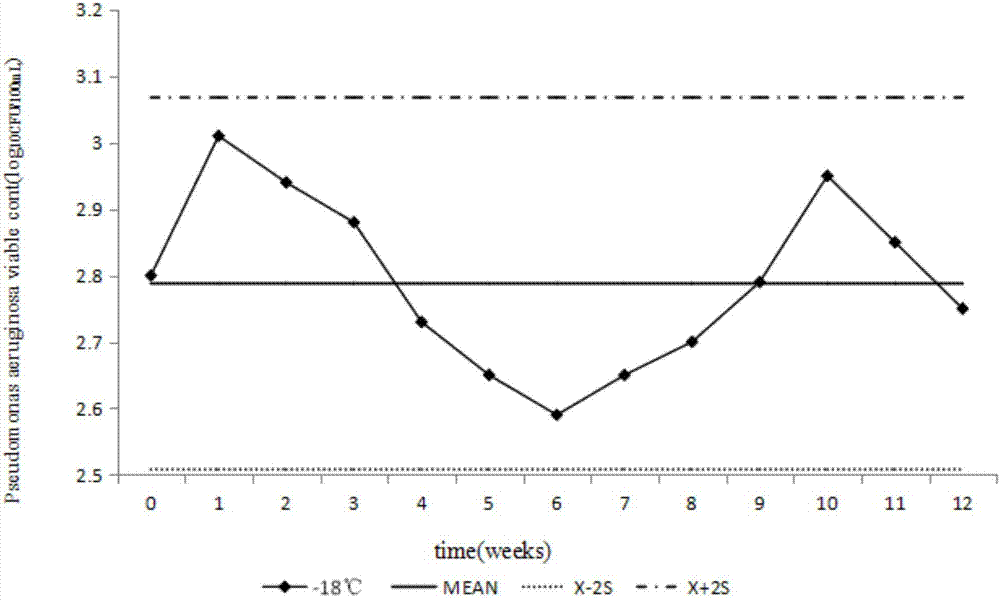
圖2為4℃條件下樣品銅綠假單胞菌的穩定性試驗結果圖。
圖3為在不同溫度下樣品的穩定性試驗結果圖。
具體實施方式
下面結合附圖及具體實施例對本發明作進一步詳細描述,但本發明并不局限于具體實施例。
實施例1
藥品中銅綠假單胞菌能力驗證樣品,包括目標菌和背景菌群,所述目標菌為銅綠假單胞菌(pseudomonasaeruginosa),所述背景菌群由大腸埃希菌(e.coil)、肺炎克雷伯菌(klebsiellapnenmoniae)、金黃色葡萄球菌(staphylococcusaureus)、蠟樣芽胞桿菌(bacilluscereus)組成。
所述樣品以海藻糖、脫脂奶粉和無菌水為基質,其中海藻糖體積分數為12%、脫脂奶粉體積分數為0.5%。
所述樣品中目標菌的目標濃度為102cfu/ml,背景菌群的目標濃度為103cfu/ml。
實施例2
如圖1所示,一種實施例1中藥品中銅綠假單胞菌能力驗證樣品的制備方法,包括樣品添加菌株的選擇、凍干保護劑的配制、樣品凍干、樣品的均勻性和穩定性試驗四個步驟,具體步驟如下:
1、樣品添加菌株的選擇
按照目標菌:銅綠假單胞菌(pseudomonasaeruginosa),背景菌群:大腸埃希菌(e.coil)、肺炎克雷伯菌(klebsiellapnenmoniae)、金黃色葡萄球菌(staphylococcusaureus)、蠟樣芽胞桿菌(bacilluscereus)選擇標準菌株,所有標準菌株均購于政府指定的機構,并附有菌株證書,保證了菌株的溯源性。
2、凍干保護劑的配制
樣品以海藻糖、脫脂奶粉和無菌水為基質(體積分數:海藻糖12%,脫脂奶粉0.5%)配制凍干保護劑。
3、樣品凍干
(1)菌株復蘇傳代
將標準菌株接種到營養瓊脂培養基中,在36±1℃下使其復蘇和生長,并對復蘇的菌株進行鑒定;
(2)增菌
目標菌培養至對數生長期末,背景菌群培養至穩定期,從斜面刮取菌落,加到10ml的凍干保護劑中制成相應單一菌種的菌液;
(3)菌懸液配制
將上一過程得到的菌液與凍干保護劑混合,按目標菌的目標濃度102cfu/ml和背景菌群的目標濃度103cfu/ml配制菌懸液。為保證得到的最終樣品中含有以上目標濃度的菌株,本實施例中按照目標菌102cfu/ml配制目標菌的菌懸液;背景菌按103cfu/ml配制4個背景菌的菌懸液,按1:1體積比混合,形成背景菌群懸液;背景菌群懸液與目標菌懸液按1:1體積比混合,得到混合菌懸液,采用比濁法檢查菌株含量;置于磁力攪拌器上不斷攪拌下取1.0ml分裝到樣品瓶(西林瓶)中,加上瓶塞,但要留有空隙,不要蓋實
(4)凍干和包裝
將裝有混合菌懸液的樣品瓶開蓋放入凍干機中,冷凍干燥機參數按如下設置:
冷凍速度(coolingrate)0.5℃/min
早期冷凍點(incipientfreezingpoint)-1℃15min
冷凍溫度(coolingtemperature)-40℃
共熔點(meltingpointeutectictemperature)-29℃
加熱溫度(heatingtemperature)20℃120min
啟動冷凍干燥機,機器直接進入程序化的冷凍干燥過程,整個凍干過程40h。
當樣品冷凍干燥結束后,直接進行箱內加塞;關閉機器。剔除塞子不緊的西林瓶,西林瓶中樣品為真空狀態;
(5)儲存
將樣品放置在-18℃條件下避光保存,并對保存的樣品進行適當管理和檢測,從全部樣品中隨機挑選樣品進行均勻性和穩定性試驗,滿足要求后發放給參試實驗室進行實驗室間比對。
4、樣品的均勻性和穩定性試驗
對樣品中目標菌的均勻性和穩定性檢查是驗證樣品制備過程有效性的主要方法。檢查樣品均勻性和穩定性按照cnas—gl03《能力驗證樣品均勻性和穩定性評價指南》進行。
所得樣品均勻性和穩定性檢測方法及結果如下:
分別隨機選取12個樣品,采用sn/t1897-2007法,在重復條件測試2×12份樣品的銅綠假單胞菌。結果數據用單因素方差分析(anov)進行統計處理,統計步驟及結果如下:
表1方差分析公式
上表中,
表2樣品均勻性檢測結果
表3樣品均勻性試驗方差分析結果
結論:在95%置信概率下,與其他因素對測試結果的影響相比,樣品的不均勻性是可接受的。
采用兩種類型的穩定性試驗:一種是在短期貯存溫度(4℃)下的穩定性試驗,另一種是在高的溫度(模擬樣品的運輸條件)下的穩定性試驗,選用三個溫度點,分別為20℃、36℃和45℃。定期檢測樣品,針對不同溫度點不同的保存時間測試3個樣本,將2×3份樣品結果的均值(對數轉化后)與均勻性測試結果比較,之間的絕對差值除以測試計劃中能力評價用穩健標準差s*,比值小于0.3為原則確定在不同溫度條件下符合能力驗證樣品要求的最長保存時間。穩定性試驗結果見圖2和圖3。
實施例3
本實施例中所述的藥品中銅綠假單胞菌能力驗證樣品的制備方法的各步驟均與實施例2中相同,不同的技術參數為:菌株培養基選用營養瓊脂斜面培養基;菌懸液配制中,目標菌懸液中目標菌的濃度按照5×102cfu/ml配制,背景菌群懸液中各背景菌的濃度按照103cfu/ml配制;凍干過程45h。
實施例4
本實施例中所述的藥品中銅綠假單胞菌能力驗證樣品的制備方法的各步驟均與實施例3中相同,不同的技術參數為:菌懸液配制中,目標菌懸液中目標菌的濃度按照4.5×102cfu/ml配制;凍干過程50h。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 檢測水中銅綠假單胞菌和toxA的引物、試劑盒和方法與流程
- 一株可裂解多重耐藥銅綠假單胞菌的噬菌體及其治療感染的應用的制作方法與工藝
- 芪類化合物在抑制銅綠假單胞菌群體感應系統中的應用的制作方法與工藝
- 利用群體感應調控銅綠假單胞菌好氧反硝化以除廢水中硝酸鹽的方法與流程
- 適用于廣泛耐藥銅綠假單胞菌的篩查培養基及制備方法與流程
- 一株用于細菌病害防治的假單胞菌及應用的制造方法與工藝
- 一種利用高產鼠李糖脂的銅綠假單胞菌降解石油的方法與流程
- D?色氨酸在抑制銅綠假單胞菌產彈性蛋白酶中的應用的制造方法與工藝
- 用于RPA快速檢測攜帶喹諾酮類耐藥基因的銅綠假單胞菌的引物及其應用的制造方法與工藝
- 銅綠假單胞菌噬菌體裂解酶及應用的制造方法與工藝