海通葉揮發油的提取方法及應用與流程
本發明涉及藥學技術領域,尤其是一種海通葉揮發油的提取方法及應用。
背景技術:
目前,揮發油的提取方法有水蒸汽蒸餾法、溶劑萃取法、油脂吸收法、超聲波輔助提取法、微波輔助萃取法、超臨界co2萃取技術等方法。這些方法中有些存在提取效率低,能耗大,原料成本高,儀器設備要求精密,對環境污染大等問題。
近些年,臨床上抗生素的不合理使用造成微生物產生了廣泛耐藥性,長期使用抗菌及抗炎藥物對人體的毒副作用也受到臨床藥物治療的高度關注,同時,在化妝品添加劑使用者對抗氧化物質的化學成分也更傾向于天然有效成分,為此,尋找更合理的抗菌途徑、抗炎、防腐劑及化妝品等物品添加劑在安全性上提出了更高的要求,用天然防腐劑代替化學合成防腐劑已成為發展趨勢。
技術實現要素:
本發明的其中一個目的是提供了一種海通葉揮發油的提取方法。
本發明的另一個目的是提供海通葉揮發油在制備抑菌藥物中的應用。
本發明是這樣實現的:海通葉揮發油的提取方法,其特征在于:向海通葉干燥粗粉中加入10-14重量倍的水,浸泡8-12小時后再蒸餾6-10小時,在蒸餾過程中施加超聲波60-100分鐘;蒸餾結束后,獲得海通葉揮發油。
海通葉揮發油在制備抑菌藥物中的應用,將海通葉揮發油作為唯一有效成分。
為了驗證本發明的技術效果,進行了如下實驗。
一、海通葉揮發油的制備方法實驗。
1.1材料與方法
1.1.1實驗材料
藥材采自貴州大學南校區,經貴州大學林學院鑒定為馬鞭草科大青屬植物clerodendrummandarinorumdiels的葉片,采摘后自然晾干,粉碎備用。
1.1.2實驗儀器與試劑
fa2004型電子分析天平(上海良平儀器有限公司),fw177型中藥粉碎機(溫嶺市百樂粉碎設備廠),bb89-2000型揮發油提取器(蘭州昱欣儀器設備有限公司),電子調溫電熱套(天津市泰斯特儀器有限公司),不銹鋼斷水自控蒸餾水器(天津市泰斯特儀器有限公司),kh-500de型數控超聲波清洗器(昆山禾創超聲儀器有限公司)。正己烷、無水硫酸鈉、氯化鈉均為分析純、水為蒸餾水。
1.2不同單因素對海通葉揮發油得油率考察
1.2.1海通葉揮發油的提取
稱取海通葉干燥粗粉100g,按《中華人民共和國藥典》2010版i部附錄xd揮發油測定甲法操作(中華人民共和國藥典,2010)。以海通葉揮發油得油率為考察指標,以加液量(a)、浸泡時間(b)、蒸餾時間(c)、超聲時間(d)為影響因素,進行正交試驗,油水先在提取器中粗分離,將蒸出的油水混合物迅速冷卻加入過量氯化鈉至溶液達到飽和(王佰靈,2014),靜置2h,然后用正己烷萃取,無水硫酸鈉脫水過夜,低于35℃自然風干,得到淡黃色油狀物,精密稱重,計算得油率:
揮發油得油率(%)=海通葉中揮發油含量/海通葉重量×100%
1.2.2不同加液量對海通葉揮發油得油率的考察
稱取海通葉粗粉約100g,共6份,分別加入6,8,10,12,14,16倍的水。浸泡2h,蒸餾5h,照2.2.1項下方法實驗,重復三次,其揮發油平均得油率分別為0.21%,0.25%,0.27%,0.28%,0.27%,0.27%。表明:加水量在12倍時海通葉揮發油的得油率最高。原因可能為加水量過多易導致溶液暴沸,原料沾壁,影響提取效果,水量過少又不能充分浸潤其原料,故選擇12倍加液量為最佳加液量。
1.2.3不同浸泡時間對海通葉揮發油得油率的考察
稱取海通葉粗粉約100g,共6份,加入12倍的水,浸泡時間分別為0,4,8,12,16,20h,蒸餾5h,按照2.2.1項方法實驗,重復三次,其揮發油平均得油率分別為0.23%,0.25%,0.28%,0.3%,0.3%,0.29%。表明:海通葉揮發油提取率隨著浸泡時間的延長而增大,但在浸泡時間大于12h以后,得油率變化不明顯。浸泡理論認為浸泡可使植物細胞間隙變大,組織細胞充分膨脹,加速細胞內、外液動態交換而有利于揮發油的提取(伍振峰等,2014)。因此,可以認為海通葉浸泡12h組織已經充分膨脹,本著工業生產節約時間原則,浸泡時間選擇為12h。
1.2.4不同超聲時間對海通葉揮發油得油率的考察
稱取海通葉粗粉約100g,共6份,加水12倍,浸泡時間12h,蒸餾時間10h,超聲時間分別為20,40,60,80,100,120min,按照2.2.1項方法實驗,重復三次,其揮發油平均得油率分別為0.22%,0.24%,0.28%,0.30%,0.30%,0.29%。表明:超聲時間小于60min,得油率增加較為顯著,60min后,揮發油得油率增加相對變慢,100min后揮發油得油率幾乎保持不變,在超聲100min時其揮發油得油率最佳。超聲提取的優勢在于由于超聲波機械作用及溫熱效應的存在,使揮發油向外滲出的效率大大增加。一方面,機械效應可以使細胞內的物質產生震蕩、旋轉、摩擦等運動,并可以改變細胞膜的通透性,刺激細胞半透膜的彌散過程,加快了細胞內物質向外的滲出。另方面,溫熱效應可以提高溶劑(水)的溫度,增加分子的運動速度,有利于細胞內成分的滲出(朱兆友等,2010)
1.2.5不同蒸餾時間對海通葉揮發油得油率的考察
稱取海通葉粗粉約100g,共6份,加水12倍,浸泡時間12h,蒸餾時間分別為2,4,6,8,10,12h,按照2.2.1項方法實驗,重復三次,其揮發油平均得油率分別為0.18%,0.22%,0.28%,0.30%,0.32%,0.32%。表明:蒸餾時間小于6h時,揮發油的量隨蒸餾時間的增加較為明顯,6h后,揮發油量增加相對緩慢,到達10h后,揮發油的量幾乎不再有變化。由于隨時間推移,料液中油類組分減少,海通葉揮發油蒸餾出的量也相應減少。在蒸餾10h達到最大值并保持相對平穩,故選擇10h為最佳蒸餾時間。
1.2.6實驗因素水平設計
參考單因素實驗結果,以揮發油得油率為指標,考察海通葉加液量、浸泡時間、超聲波處理時間、蒸餾時間四個因素,每個因素三個水平,見表1。準確稱取海通葉,加入蒸餾水,室溫下浸泡,釆用正交設計表中的設計方案進行海通葉揮發油的提取(每個處理重復3次)。蒸溜所得揮發油,釆用少量正己烷多次萃取,在用少量無水硫酸鈉干燥,揮去正己烷后,記錄出油量(g)。
表1實驗因素水平
1.2.7正交實驗
根據單因素實驗結果,選擇加液量(a)、浸泡時間(b)、蒸餾時間(c)和超聲時間(d)為考察因素,每個單因素各3個水平,以海通葉揮發油得油率為評定指標,選用l9(34)正交表。稱取海通葉粗粉約100g,共9份,照1.2.1項方法進行實驗,結果見表2。
表2海通葉提取工藝的正交實驗結果
表3方差分析表
注:f0.05(2,2)=19,f0.01(2,2)=99。
由表3方差分析結果表明:c因素的影響具有非常顯著性意義(p<0.01),a因素具有顯著性(0.1<p<0.05),b、d顯著性不明顯(p<0.1),因此,最優水平為a2b2c2d1,即加液量12倍,浸泡時間12h,超聲時間80min,蒸餾時間10h。結果與單因素實驗結果一致。
1.2.8驗證性實驗
取海通葉粗粉約100g,共5份,根據篩選a2b2c2d2得到的工藝進行驗證實驗,得到揮發油得油率分別為0.32%,0.34%,0.33%,0.33%,0.34%,平均得油率為0.332%,rsd為2.52%,表明所得到的揮發油提取工藝穩定可行,重復性好。
1.3結論
1、水蒸氣蒸餾法是提取揮發油最常用的方法,具有設備簡單、容易操作、成本低、得油率高的優點。
2、在提取過程中發現粉碎的海通葉粗粉質輕,易漂于水面上不易浸透,故在加水浸泡時應注意攪拌,使海通葉能充分浸潤。
3、提取器蒸餾的海通葉揮發油油滴散布在水中,有些密度大的成分會下沉至揮發油提取器的刻度下端,導致無法聚集,故本文采取加入少量正己烷的方法以促進其揮發油的聚集。
4、水蒸氣蒸餾法提取揮發油,由于溫度過高可能對有些對熱敏感的化合物結構造成破壞,同時,海通葉自身酶的作用加速其某些次生代謝產物分解,從而,對揮發油的提取有一定的影響。
通過gc-ms檢測出海通葉揮發油主要化合物中含量最高的1-辛烯-3-醇,又稱蘑菇醇(mashroomaloeho1),其次芳樟醇,因此構成了特殊的香味。目前使用的香料產品中,芳樟醇是使用頻率最高的一種廣譜性香料等。普遍應用于制造香精香料(陳尚钘等,2013)、醫療保健、制藥等領域(王堅,2004;bradleybf,2007)。
二、海通葉揮發油的抗菌實驗
2.1材料與儀器
2.1.1材料與試劑
海通葉采自貴州大學南區,經貴州大學林學院鑒定為馬鞭草科大青屬植物clerodendrummandarinorumdiels的葉;牛肉浸膏(上海博微生物科技有限公司)氯化鈉(ar,成都金山化學試劑有限公司);葡萄糖(ar,成都金山化學試劑有限公司);酵母粉(北京奧博星生物技術有限公司);蛋白胨(北京奧博星生物技術有限公司);青霉素鈉(哈藥集團制藥總廠);酮康唑(阿拉丁);丙酮(上海南翔試劑有限公司);正己烷(上海南翔試劑有限公司);蒸餾水(自制);
金黃色葡萄球菌(staphylococcusaureus)、表皮葡萄球(staphylococcus)、奇異變形桿菌(proteusmirabilis)、大腸桿菌(escherichiacoli)、銅綠假單胞桿菌(pseudomonasaeruginosa)、白色念珠菌(candidaalbicans)、木霉(trichodermaspp)、青霉(bgbfngnvb.nhg)均由貴州省中藥民族藥創制工程中心提供。
2.1.2實驗儀器
自動雙重純水蒸餾儀(上海亞榮生化儀器廠);電熱恒溫箱(上海博訊實業有限公司醫療設備廠);zwyr-2102c型恒溫培養振蕩器(上海智城分析儀器制造有限公司);立式壓力蒸汽滅菌鍋(上海博訊實業有限公司醫療設備廠);cj-2d潔凈工作臺(天津泰斯特儀器有限公司);千分之一電子天平(福州華志科學儀器有限公司)。
2.2實驗方法
2.2.1海通葉揮發油的提取
稱取海通葉干燥粗粉100g,按《中華人民共和國藥典》2010版i部附錄xd揮發油測定甲法操作。采用水蒸氣蒸餾法最佳提取工藝加12倍量水浸泡12h,蒸餾提取10h,超聲80min提取海通葉揮發油,油水先在提取器中粗分離,將蒸出的油水混合物迅速冷卻加入過量氯化鈉至溶液達到飽和,靜置2h,然后用正己烷萃取,無水硫酸鈉脫水過夜,低于35℃自然風干,得到淡黃色油狀物,精密稱重,計算得油率,陰涼避光保存備用。
2.2.2菌懸液的制備
測定海通葉揮發油對細菌活性的抑制作用時,應該保證接種時的細菌濃度需要達到108cu/ml左右。為盡可能的控制細菌原始數量,使其結果更加可靠,故對其生長曲線進行實驗研究。
(1)培養基的配置
1)肉湯培養基:稱取牛肉膏5.0g、蛋白胨10.0g、氯化鈉15.0g、溶解于1000ml水中,調節ph值約7.0,分裝于三角瓶中,121℃高壓蒸汽滅菌30min。
2)肉湯瓊脂培養基::稱取牛肉膏5.0g、蛋白胨10.0g、氯化鈉15.0g、20.0g瓊脂溶解于1000ml水中,調節ph值約7.0,分裝于三角瓶中,121℃高壓蒸汽滅菌30min。
3)改良馬丁培養基:稱取蛋白胨5.0g、k2ho41.0g、酵母浸出粉2.0g、mgso40.5g、葡萄糖20.0g、14.0g瓊脂,溶解于1000ml水中,調節ph值約7.0,分裝于三角瓶中,121℃高壓蒸汽滅菌30min。
4)霉菌培養基:馬鈴薯去皮切塊200.0g、蔗糖20.0g、瓊脂20.0g、蒸餾水1000ml,自然ph。
(2)細菌液體培養基及od值測定
按照“2.2.2菌懸液的制備”方法,(1)配置液體培養基,測定其原始培養基od值,在接種菌種,(第三代),將三角瓶放于振蕩器中37℃,真菌為25℃培養,每隔8h取樣一次,測定od值,同時,將樣液分別稀釋10、102、103、104、105、106、107倍。按照本章“4.2.2菌懸液的制備”方法的(1)方法配置相應的瓊脂培養基,并將培養基倒入滅菌干燥好的培養皿中,冷卻后,取稀釋106、107倍的菌液0.1ml,接種到培養皿中,37℃真菌25℃培養48h(真菌為24h),數出其中的菌落數,以此判斷原始取樣的濃度,直到濃度為108cfu/ml左右。
菌懸液的制備:細菌采用平板計數法,霉菌采用顯微鏡直接記數法測菌體或孢子個數,調至濃度為含孢子或菌體106~107個.ml-1的菌懸液,備用(沈萍,1999)。
2.2.3抑菌活性測定
采用濾紙片法(沈萍,1999):制直徑為6mm圓形濾紙片,滅菌后備用;將各種待測菌懸液各取100μl在相應的固體培養基上均勻涂抹,制成含菌平板;將濾紙片放入用丙酮稀釋80%海通葉揮發油溶液中浸泡2h,取浸泡過濾紙片貼在含菌平板上,每個培養皿貼濾紙片2片。用丙酮浸泡的濾紙片做空白對照,用濃度為1mg·ml-1(稀釋劑為蒸餾水)的青霉素鈉浸泡的濾紙片作為細菌抑菌對照,用濃度為0.4mg·ml-1(稀釋劑為丙二醇)的酮康唑浸泡的濾紙片作為真菌抑菌對照。細菌置培養箱中36℃下培養24h,霉菌置培養箱中27℃下培養72h。測量抑菌圈的直徑(mm),做3次平行實驗,結果取均值。
2.2.4最低抑菌濃度(mic)的測定
采用平板涂布法(趙淑艷,2008):將濃度為10%、5%、2.5%、1.25%、0.625%、0.3125%(溶劑為丙酮)的揮發油定量地加入到培養基中,充分混合均勻,倒入培養皿,待培養基冷卻后,用接種針于各培養基中依次涂布供試菌液0.1ml,細菌置培養箱中36℃下培養24h,真菌置培養箱中27℃下培養72h,觀察菌體的生長情況,每個濃度做3次重復,從無菌生長的培養基中找出提取物濃度最低的培養基,即為該抑菌劑的最低抑菌濃度。
2.2.5不同ph值對海通葉揮發油抑菌活性的影響
用20%的naoh和50%的檸檬酸調節ph值,分別制成ph為4、5、6、7、8、9的系列培養基,將50%濃度(溶劑為丙酮)的揮發油分別在按照2.2.3項方法測定其對金黃色葡萄球菌、奇異變形桿菌、大腸桿菌、銅綠假單胞菌、白色鏈球菌、木霉抑菌圈大小,比較不同ph值對海通葉揮發油抑菌活性的影響。
2.2.6抑菌成分熱穩定性實驗
將揮發油分別置于80、100、121℃下熱處理15min,制成50%濃度(溶劑為丙酮)的揮發油溶液,選取相應待試菌,按照2.2.3項項方法測定其對金黃色葡萄球菌、奇異變形桿菌、大腸桿菌、銅綠假單胞菌、白色鏈球菌、木霉抑菌圈大小,比較不同溫度下處理的海通葉揮發油對其抑菌活性的影響。
2.2.7抑菌活性紫外穩定性實驗
將揮發油放置在紫外燈下照射5、10、15、20、25min,制成50%濃度(溶劑為丙酮)的揮發油溶液,按照2.2.3項方法測定其金黃色葡萄球菌、奇異變形桿菌、大腸桿菌、銅綠假單胞菌、白色鏈球菌、木霉抑菌圈大小,比較紫外燈照射對海通葉揮發油抑菌活性的影響。
2.3結果與分析
2.3.1海通葉揮發油的抑菌活性
海通葉揮發油對菌金黃色葡萄球菌、表皮葡萄球菌、大腸桿菌、銅綠假單胞菌、奇異變形桿菌、白色鏈球菌、木霉、青霉抑菌效果如表4所示。
表4海通葉揮發油對供試菌的抑菌圈直徑
注:-表示沒有測定
抗菌素抑菌圈的判定標準是:抑菌圈直徑>15mm時為較敏感、10~15mm為中度敏感,7~9mm時為低度敏感,無抑菌者為不敏感(沈萍,1999)。由表4結果可見,海通葉揮發油對8種供試菌均具有抑菌效果,對表皮葡萄球菌、銅綠假單胞桿菌的抑菌圈直徑處于10~15mm之間,屬于中度敏感;對金黃色葡萄球菌、奇異變相桿菌、大腸桿菌、大腸桿菌、白色念珠菌、木霉、青霉的抑菌圈均達15mm以上,屬較敏感。結果表明海通葉揮發油對各供試的細菌、真菌均有抑制作用。
2.3.2海通葉揮發油的最低抑菌濃度(mic)
海通葉揮發油對8種供試菌的最低抑菌濃度(mic)的測定結果如表5所示。
表5海通葉揮發油對供試菌的mic
注:-表示無菌落出現;+表示有菌落出現。
海通葉揮發油對各組受試菌均有一定的抑制作用,因此,采用適當的海通葉揮發油稀釋濃度對各受試菌進行稀釋敏感實驗,由表4-2可知,海通葉揮發油對金黃色葡萄球菌、表皮葡萄球菌、奇異變形桿菌、大腸桿菌、銅綠假單胞菌、白色鏈球菌、木霉、青霉各受試菌的最小抑制濃度(mic)分別是2.5%、5%、2.5%、2.5%、5%、1.25%、0.625%、0.625%。從上表還可看出,在低于的濃度范圍內,隨揮發油濃度的降低,各受試菌生長越多。
2.3.3ph值對海通葉揮發油抑菌活性的影響
以金黃色葡萄球菌、奇異變形桿菌、大腸桿菌、銅綠假單胞菌、白色鏈球菌、木霉為對象菌,不同ph值條件下海通葉揮發油對6種菌的抑菌效果如圖1。
圖1結果顯示:當ph值為4時菌體幾乎停止生長;ph值為5、6、7時,隨ph值的增大抑菌圈有減小的趨勢。表明海通葉揮發油的抑菌效果在酸性條件下極為敏感,在中性和堿性范圍內隨ph值的增大而有所減弱。低ph抑菌力增強有兩方面的原因:一方面是h+的作用,ph降低,改變細菌所處生長環境發,降低了細菌的活性;另一方面,ph降低引起非極性酚類化合物上所帶的酚羥基的電離度變小,疏水性增加,酚類更易溶于細菌細胞膜的脂相及蛋白質的疏水區域,和細胞膜上的蛋白質結合能力更強,因而ph降低,抑菌作用增大(顧仁勇,2006)。
2.3.4海通葉揮發油熱穩定性測定結果
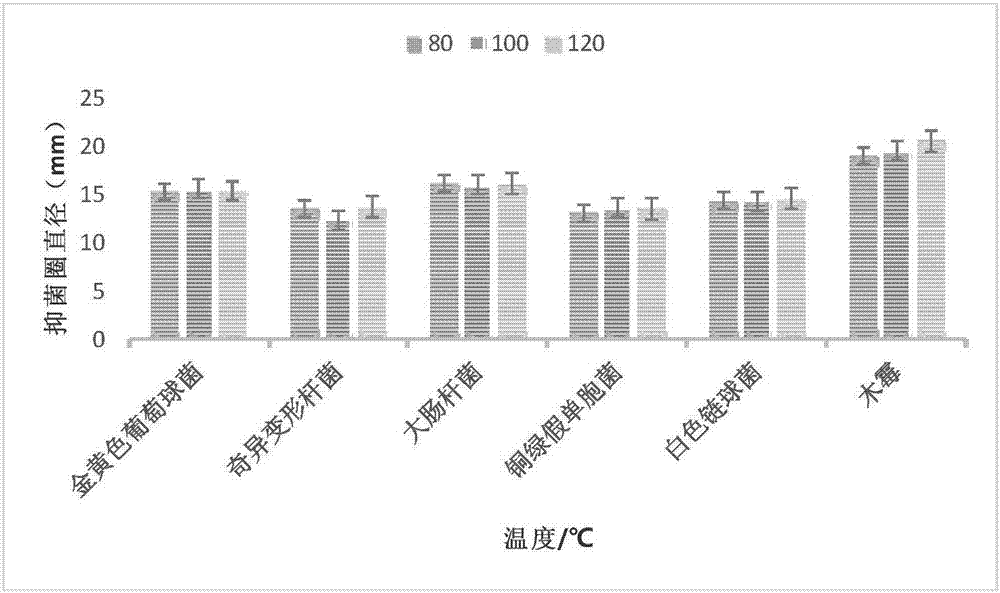
海通葉揮發油分別經過80、100、121℃熱處理15min,測定其對金黃色葡萄球菌、奇異變形桿菌、大腸桿菌、銅綠假單胞菌、白色鏈球菌、木霉的抑菌圈大小,結果見圖2。
圖2的結果可知,經過80、100、121℃的熱處理15min后,海通葉揮發油對金黃色葡萄球菌、奇異變形桿菌、大腸桿菌、銅綠假單胞菌、白色鏈球菌、木霉的抑菌圈直徑相互間沒有明顯差異。這一結果表明海通葉揮發油在加熱的條件下,對其抗菌成分影響不明顯,說明其中的抑菌菌成分具備良好的熱穩定性。
2.3.5海通葉揮發油抑菌效果的紫外穩定性
海通葉揮發油在5、10、15、20、25min紫外光下處理由,測定其對金黃色葡萄球菌、奇異變形桿菌、大腸桿菌、銅綠假單胞菌、白色鏈球菌、木霉抑菌圈的大小,結果見圖3。
如圖3可見,在紫外光處理條件下,隨著時間的變化海通葉揮發油對金黃色葡萄球菌、表皮葡萄球菌、奇異變形桿菌、大腸桿菌、銅綠假單胞菌、白色鏈球菌、木霉、青霉的抑菌活性基本保持不變,結果表明:海通葉揮發油對紫外光照射具有較好的穩定性。
2.4討論
海通葉揮發油對8種受試菌的抑菌效果有一定差異,對霉菌的抑制作用相對較強,對革蘭陽性菌和革蘭氏陰性菌的抑制作用相對較弱;揮發油對溫度和紫外照射具有良好的穩定性,在不同的ph值條件下其抑菌活性不穩定,酸性環境下其抑菌活性較弱,ph<5瓊脂培養基不易凝固成型,對菌液的均勻涂布有一定的影響;因此,ph的改變對抑菌活性影響較大。
與現有的技術相比,本發明優化了提取方案,有效降低了海通葉揮發油的提取成本,并顯著提高了提取效率;發明人還發現了海通葉揮發油對于金黃色葡萄球菌、表皮葡萄球菌、大腸桿菌、銅綠假單胞菌、奇異變形桿菌、白色鏈球菌、木霉及青霉等具有抑制效果,既能作為新的抗菌途徑和有效且安全的食品天然防腐劑,為海通資源的綜合開發利用提供一些有益的參考依據。本發明材料來源廣泛,成本低廉,使用效果好。
附圖說明
圖1ph值對海通葉揮發油抑菌效果的影響;
圖2溫度對楓香葉精油抑菌效果的影響;
圖3紫外光處理對海通葉揮發油抑菌的影響。
具體實施方式
本發明的實施例1:海通葉揮發油的提取方法,其特征在于:向海通葉干燥粗粉中加入12重量倍的水,浸泡12小時后再蒸餾10小時,在蒸餾過程中施加超聲波80分鐘;蒸餾結束后,獲得海通葉揮發油。
本發明的實施例2:將海通葉揮發油作為唯一活性成分加入藥學上可接受的輔劑,制成各種劑型的抑菌藥物。
- 還沒有人留言評論。精彩留言會獲得點贊!