一種為肺癌提供離體個體化藥物測試的方法及培養基與流程
本發明屬于細胞生物學與藥理學領域,涉及一種為肺癌提供離體個體化藥物測試系統的建立及培養基。
背景技術:
肺癌是中國和世界范圍內最常見也是死亡率最高的惡性腫瘤,是危害人類健康的頭號殺手。肺癌按病理分型可分為非小細胞肺癌(nsclc)和小細胞肺癌(sclc),約占所有肺癌的80%和20%。非小細胞肺癌中,鱗癌約占20%-35%,腺癌約占30%-45%。肺癌確診時多數患者分期較晚是影響肺癌預后的重要原因,而早期肺癌可以通過多學科綜合治療實現較好的預后,可以得到更好的臨床獲益。nsclc的腫瘤細胞生長速度及惡性程度均比sclc低,但對放化療不如sclc敏感。化療是晚期nsclc綜合治療的重要手段,在肺癌的治療中占有非常重要的地位,但有效率只有20-40%。腫瘤的多藥耐藥現象和臨床上缺乏個體化治療是導致化療失敗的重要原因。準確的化療藥物體外敏感性檢測是制定個體化治療方案的前提。因此如何針對性的選擇化療藥物,避免無效治療,降低患者痛苦,提高臨床上的療效日益受到越來越多科研人員和醫學工作者的關注與重視。
有文獻報道體外藥敏的檢測結果與臨床治療療效的總體符合率約為80%,具有較高的敏感度和特異度,表明體外藥敏試驗與臨床治療敏感性有較好的相關性,且具有操作簡易和經濟可行等優勢。然而體外藥敏評價細胞模型也存在建立成功率低、腫瘤間質細胞混雜、無法長期培養等問題。一直以來受限于原代腫瘤細胞體外培養的技術,很難建立來源于肺癌患者的原發腫瘤細胞模型,因為這樣的模型不僅需要能夠在體外穩定培養,而且能反映出患者體內腫瘤細胞的特性,代表真正原發位點的腫瘤生物學特性,才能作為理想的體外藥敏檢測模型。從腫瘤的個體化治療角度而言,只有在體外分離培養原代腫瘤細胞穩定傳代后,才能進行更多更廣泛的臨床前藥敏檢測,結合臨床經驗設計藥物劑量和藥物組合,才能確定最優化的化療使用方案安排臨床治療。
此外,抗腫瘤藥尤其是化療藥引起的肺毒性反應嚴重影響患者的生存質量,甚至危及生命的化療限制性毒性。抗腫瘤藥相關肺損傷可涉及氣道、胸膜、縱膈、肺血管,最常見的肺毒性是間質性肺疾病(ild)。可致肺毒性的代表腫瘤藥以博來霉素、甲氨蝶呤、絲裂霉素、馬利蘭、洛莫司汀為首。其他可能導致ild的腫瘤藥:阿糖胞苷、紫杉醇類、環磷酰胺、吉西他濱、伊立替康、奧沙利鉑、長春堿、拓撲替康、多柔比星、依托泊苷,靶向藥物如貝伐單抗、利妥昔單抗、曲妥珠單抗、厄洛替尼、吉非替尼。因此,增加對肺正常組織細胞的毒性評價顯得尤為重要,也是未來的肺癌藥敏試驗個體化治療需要優化之處。
綜上所述,患者來源的癌細胞和癌旁正常細胞的培養一直以來是世界性的技術難題。如果能建立個體的肺原代上皮細胞和肺原代腫瘤細胞的體外長期培養體系,并利用該體系進行藥敏檢測,體外預測患者對常用化療藥物的敏感性和評價藥物的安全性,將為肺癌精準化療敏感藥物的選擇提供參考,盡可能地減輕毒性和副作用負擔,最大限度地延長該肺癌患者的生存時間。
技術實現要素:
為了解決現有技術存在的問題,本發明提供一種用于人或哺乳動物原代正常上皮細胞和原代腫瘤細胞培養的培養基及基于該培養基為肺癌提供穩定準確可靠的離體個體化藥物測試的方法。
本發明的第一方面,提供一種用于培養人或哺乳動物的原代正常上皮細胞和原代腫瘤細胞的培養基m,所述培養基m成分包括:dmem與ham’sf-12nutrientmix按體積比3:1混合的培養基,同時添加4-6%胎牛血清、1-3nm三碘甲狀腺氨酸(triiodothyronine),0.4-0.65%胰島素-轉鐵蛋白-硒鈉(insulin-transferrin-selenium)、5-20umy-27632、9-11ng/ml表皮生長因子、0.3-0.5μg/ml氫化可的松、0.5-1.5nm霍亂毒素、0.4-0.6μg/ml兩性霉素b、35-45μg/ml慶大霉素,激活素a(activina)5-20ng/ml及3ug/ml重組人r-spondin-1。
本發明的第二方面,提供一種短期內快速增殖的肺癌病人肺上皮細胞和腫瘤細胞的原代分離培養和傳代培養的方法,包括如下具體步驟:
a、肺癌和癌旁組織樣本的取材及其樣本儲存運輸
a1、樣本標準:肺癌患者手術樣本(適宜手術患者,切除的癌組織及癌旁組織樣品至少1×1×1cm3)或活檢、穿刺小樣本(不適宜手術患者,纖支鏡或ct引導經皮穿刺可獲得的小樣本),涵蓋各臨床分期;
a2、樣本儲存運輸:潔凈室條件下,嚴格按照無菌操作標準,將手術樣本或小樣本收集保存于試管中,根據樣本量大小添加樣本收集液,一般為3-5ml,樣本收集液為含2%青/鏈霉素和100ug/ml制霉菌素的pbs,樣本可用于直接分離培養或長期液氮保存;樣本直接分離培養時可先放置于4℃冰箱,但保存不宜超過48小時;樣本儲存于液氮前,需加入覆蓋樣本體積的冰浴后的pbs緩沖液清洗兩次,每次10秒左右,用無菌鑷子將清洗干凈的樣本放入新培養皿中,用眼科剪剪碎至米粒大小,加入1ml樣本凍存液,移液器轉移保存于細胞凍存管,放入程序降溫盒中,-80℃冰箱過夜冷藏,次日可轉移至液氮中長期儲存,所述樣本凍存液為胎牛血清(10099-141,gibco)與二甲基亞砜(dmso,(ch3)2so)溶液按體積比為9:1配制;需要運輸的樣本在經過-80℃冰箱過夜冷藏后可放入體積合適的泡沫盒,加入足量的運輸干冰,密封冰凍運輸;
b、對來自于肺癌和癌旁組織樣本的肺上皮細胞和腫瘤細胞的原代分離培養:
b1、分離培養前的實驗室準備:使超凈工作臺處于開機狀態,并打開紫外燈,工作30-60分鐘后,關閉紫外燈,打開調風機調節風量大小,保證工作區內的風速始終處于理想狀態后開始實驗;準備五個60mm或100mm細胞培養皿(伽馬射線消毒滅菌,無熱源、無rna酶、無dna酶),標記為①②③④⑤,按照順序擺放,在②號培養皿加入10ml無水乙醇(分析純),③、④號培養皿分別加入冰浴的10mlpbs緩沖液;
b2、配制消化液:所述消化液為含0.2mg/ml膠原酶/透明質酸酶混合液的培養基m;
b3、樣本直接分離培養:
b3.1、將樣本放置①號培養皿,依次在②號培養皿無水乙醇和③、④號培養皿pbs緩沖液清洗,然后分別將肺癌和癌旁組織樣本放入⑤號無菌培養皿中,用無菌的眼科剪將組織盡可能剪碎,大小1-2mm3體積為宜,剪碎過程中滴加適量pbs緩沖液維持樣本組織活性;
b3.2、在⑤號無菌培養皿中加入含步驟2.2所配制消化液,分別消化剪碎后的肺癌和癌旁組織樣本;
b3.3、分別將步驟2.3.2處理后的肺癌和癌旁組織樣本低速離心去除上清,速度為1000prm,時長為8分鐘;
b3.4、分別將步驟2.3.3處理后的肺癌和癌旁組織樣本沉淀室溫條件下重懸于2-5ml,濃度為0.25%胰酶/edta中消化;
b3.5、加入于胰酶/edta2倍體積的含10%fbs的dmem培養基終止消化,分別用無菌的一次性塑料槍頭反復吹打肺癌和癌旁組織樣本,時長為1分鐘;
b3.6、分別用70μm細胞篩過濾細胞懸液,收集過濾后的細胞懸液,1000prm低速離心,時長為10分鐘去除上清;
b3.7、分別重懸步驟2.3.6中的正常細胞沉淀和腫瘤細胞沉淀于pbs緩沖液中清洗,收集清洗后的細胞懸液,1000prm低速離心,時長為5分鐘去除上清;
b3.8、分別重懸步驟b3.7中的正常細胞沉淀和腫瘤細胞沉淀于培養基m中,接種于培養瓶培養,靜置培養36-48小時后顯微鏡觀察拍照記錄細胞克隆生長情況;
或者,
b3’、當樣本為運輸樣本和液氮儲存樣本時的分離培養
b3’.1、復蘇時需要在40℃醫用恒溫水箱中快速溶解,經75%醫用消毒酒精擦拭后生物傳遞窗傳送至細胞培養室;
b3’.2、取15ml離心管加入適量pbs緩沖溶液,移液器移取溶解后的含樣本的凍存液至離心管中,1000rpm低速離心5分鐘,小心移去含凍存液的上清,并嚴格執行收到新鮮組織樣本的所有實驗操作b3.1-b3.8;
c、建立大量擴增肺癌病人肺原代上皮細胞和肺原代腫瘤細胞的傳代培養:
c1、試劑配制:配備dmem培養基、hbss緩沖溶液、0.25%胰蛋白酶/edta、0.02%edta等,用hbss緩沖溶液與0.25%胰蛋白酶/edta配制成0.05%胰蛋白酶/edta(對細胞傷害更低的細胞解離試劑),pbs緩沖溶液與胎牛血清以9:1的體積比配制成10%的消化終止液;
c2、當細胞培養瓶中培養的人肺原代上皮細胞和肺原代腫瘤細胞增殖至70-90%豐度時,用1xpbs緩沖液洗滌細胞兩次,再用0.05%胰酶/edta消化單層細胞2-5分鐘;
c3、含10%fbs的dmem培養基中和消化反應,1000prm低速離心3-4分鐘去除上清;
c4、以1:2,1:3,1:4或1:5比例分別重懸正常細胞沉淀和腫瘤細胞沉淀于培養基m中接種培養,比例的選擇只要維持細胞貼壁和正常生長即可。
進一步地,本發明提供了上述建立的肺癌病人肺原代上皮細胞和原代腫瘤細胞的體外培養體系在藥物或其聯用組敏感性篩選的方法,包括如下具體步驟:
s1、當細胞培養瓶中培養的人肺原代上皮細胞和原代腫瘤細胞處于對數生長期時,用0.05%胰蛋白酶/edta消化3-5分鐘,消化終止液終止消化,1000rpm低速離心3-5分鐘,分別用培養基m制備成單細胞懸液,通過臺盼藍與細胞懸液1:1混勻細胞計數儀檢測細胞數量與活力,每孔100μl細胞懸液接種于96孔板,細胞數為6000-8000個/孔,放入37℃二氧化碳培養箱培養;
s2、次日吸去孔內溶液加藥(根據2016年版中國臨床腫瘤學會(csco)原發性肺癌診療指南,選擇其中常用的化療藥物或小分子靶向藥物等進行處理),每孔加入200μl含不同濃度藥物的培養基;藥物濃度梯度可按照實驗需求設置,每種藥物的每個梯度設置5-6個復孔,同時設置細胞對照組(同體積細胞培養基替代)及空白對照組(同體積pbs緩沖液替代)每組設置6個復孔;
s3、根據實驗需求進行一定時間的藥物處理,移去板內溶液,每孔加入含有10μlckk-8檢測試劑的無血清dmem培養基100μl,包含各實驗組、對照組和空白組;
s4、在37℃二氧化碳細胞培養箱繼續孵育1-1.5小時,孵育時間跟細胞量的多少相關,具體時間可根據液體顏色變化確定,吸光度最大范圍控制在1.0-1.5;
s5、用酶標儀在450nm處測定的吸光度;
s6、所有數據經統計軟件graphpadprism6和calcusyn2進行統計學分析和作圖,計算單藥和其聯用組的半數抑制濃度、量效關系方程、回歸系數、不同抑制率時的劑量濃度,輸出并保存圖形和數據。
本發明的第三方面,提供了上述建立的肺癌病人肺原代上皮細胞和原代腫瘤細胞的體外培養的細胞在藥物或其聯用組敏感性篩選中的應用。
本發明的有益效果體現在:
1、本發明建立了基于培養基m的個體的肺原代上皮細胞和肺原代腫瘤細胞的體外長期培養體系,并利用該體系進行藥敏檢測,獲得了一套完整的技術流程,實現體外同時預測患者對常用化療藥物的敏感性和評價藥物的安全性,為肺癌精準化療敏感藥物的選擇提供參考,最大程度地減輕毒性和副作用負擔,最大限度地延長該肺癌患者的生存時間。
2、本發明建立了個體的肺原代上皮細胞和肺原代腫瘤細胞的體外長期培養體系,可以在細胞水平上再評價已上市藥物的藥效或探索其新的臨床獲益率;
3、作為藥物研發與測試新系統,通過該系統的開發和應用有可能提高藥物進入臨床的有效率。
附圖說明
圖1是建立肺癌個體化治療-藥敏試驗檢測系統的方法流程圖;
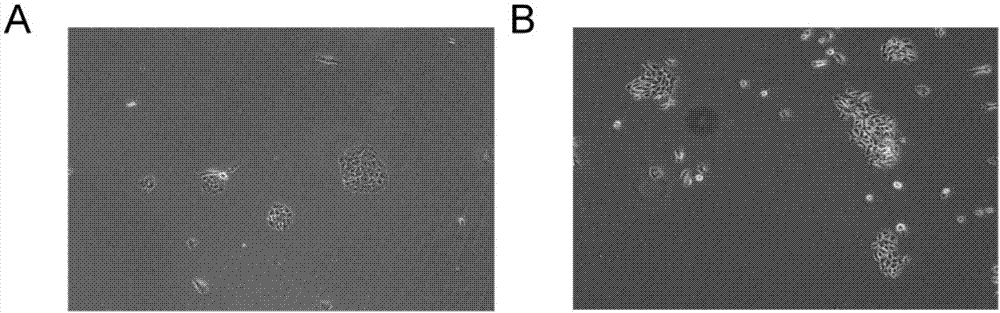
圖2是原代分離培養的肺癌病人肺上皮細胞和肺腫瘤細胞形態圖,
a為人肺原代上皮細胞生長到第3天的形態圖,b為人肺原代腫瘤細胞生長到第3天的形態圖;
圖3是兩周內快速擴增的肺癌病人肺原代上皮細胞和原代腫瘤細胞形態圖;
a為人肺原代上皮細胞生長到第9天的形態圖,b為人肺原代腫瘤細胞生長到第12天的形態圖;
圖4是肺癌病人肺原代上皮細胞和肺原代腫瘤細胞的傳代培養的周期及獲得的細胞數量統計圖;
圖5是肺癌病人肺原代上皮細胞和肺原代腫瘤細胞的培養體系的藥敏檢測結果。
具體實施方式
通過以下詳細說明結合附圖可以進一步理解本發明的特點和優點。所提供的實施例僅是對本發明方法的說明,而不以任何方式限制本發明揭示的其余內容。
【實施例1】用于分離培養、傳代培養人或哺乳動物原代上皮細胞和原代腫瘤細胞的培養基m
其組成成分包括:dmem與ham’sf-12nutrientmix按體積比3:1混合的培養基,同時添加5%胎牛血清、2nmtriiodothyronine,0.5%insulin-transferrin-selenium試劑、10umy-27632、10ng/ml表皮生長因子、0.4μg/ml氫化可的松、1.0nm霍亂毒素、0.5μg/ml兩性霉素b、40μg/ml慶大霉素,activina10ng/ml及3μg/ml重組人r-spondin-1。
【實施例2】建立肺癌和癌旁組織樣本的取材及其樣本儲存運輸的操作方法
1)在病人和病人監護人知情同意的情況下,本實驗所用的肺癌和癌旁組織樣本均約為1cm3(立方厘米),取自醫院手術切除樣本,該患者的臨床分期為低分化肺腺癌,無其它治療。
2)潔凈室條件下,嚴格按照無菌操作標準,將手術樣本收集保存于試管中,根據樣本量大小添加樣本收集液,一般為3-5ml,樣本收集液為含2%青/鏈霉素和100ug/ml制霉菌素的pbs,由于樣本量尚可,一分為二同時嘗試直接分離培養和長期液氮保存。
3)胎牛血清(10099-141,gibco)與二甲基亞砜(dmso,(ch3)2so)溶液體積比為9:1配制樣本凍存液,保證最優凍存和復蘇的效果。
4)準備5個60mm無菌細胞培養皿分別標記①②③④⑤,按照順序擺放,①培養皿放入8ml無水乙醇,②、③培養皿各自放入8mlpbs緩沖液。用無菌鑷子取出組織樣本放入①培養皿快速清洗,2秒左右。②、③培養皿快速清洗,每次10秒左右,將清洗干凈的樣本放入④培養皿中,配合眼科剪分成兩小份,一份放入⑤培養皿,另一份直接在④培養皿中,剪碎至米粒大小,加入1ml樣本凍存液,移液器轉移保存于細胞凍存管,放入程序降溫盒中,-80℃冰箱過夜冷藏,次日轉移至液氮中長期儲存(如圖1)。
【實施例3】建立短期內快速增殖的肺癌病人肺上皮細胞和腫瘤細胞的原代分離培養的方法,包括如下具體步驟:
1)進行樣本直接分離培養前,使超凈工作臺處于開機狀態,并打開紫外燈,工作30分鐘后,關閉紫外燈,打開調風機調節風量大小,保證工作區內的風速始終處于理想狀態后開始實驗;
2)準備5個100mm無菌細胞培養皿分別標記為①②③④⑤,按照順序擺放,在②號培養皿加入10ml無水乙醇(分析純,易燃,遠離火源),③、④號培養皿分別加入冰浴的10mlpbs緩沖液。
3)消化液的配制:含0.2mg/ml膠原酶/透明質酸酶(07912,stemcell)(終濃度為1x的混合液)的上述培養基m。根據組織的大小,加入10倍于樣本體積的消化液的用量。
4)用無菌鑷子將另一份新鮮肺癌組織樣本放入①號培養皿中,再將組織樣本放入②號培養皿中,用無水乙醇快速清洗組織1次,時間為1秒左右。用鑷子將樣本依次分別放入③、④號培養皿中,用pbs緩沖液清洗組織2次,每次10秒左右。
5)將組織樣本放入⑤號培養皿中,用無菌的眼科剪將組織盡可能剪碎,大小1-2mm3體積為宜(剪碎過程中加入適量pbs緩沖液維持樣本組織活性)。
6)移取10ml消化液至⑤號培養皿,輕微晃動培養皿使消化液與剪碎的組織微塊混勻,37℃恒溫二氧化碳培養箱孵育2小時(孵育過程中取出輕微混勻兩到三次使組織微塊充分得到消化。)
7)將孵育消化后的組織微塊收集至15ml離心管中,1000rpm低速離心8分鐘,小心吸去上清,加入5ml的0.25%胰酶/edta重懸細胞沉淀,置于二氧化碳培養箱再消化10分鐘。(孵育過程中取出輕微混勻兩到三次使細胞沉淀充分得到消化。)
8)取出后加入10ml10%fbs的dmem培養基,移液器吹打混勻成細胞懸液,用70μm細胞篩過濾細胞懸液,50ml離心管收集過濾后的細胞懸液,1000rpm低速離心10分鐘,小心移去上清。
9)加入5ml的pbs緩沖液,移液器吹打混勻,1000rpm低速離心5分鐘,去除上清。
10)細胞培養瓶先添加適量培養基m,將腫瘤細胞沉淀重懸于上述原代腫瘤細胞基礎培養基m中,放入37℃恒溫二氧化碳培養箱培養48小時后顯微鏡下觀察細胞生長狀況。
11)原代分離培養肺癌旁組織樣本時,重復以上(2)-(9)操作步驟,細胞培養瓶先添加適量培養基m,將正常細胞沉淀重懸于上述原代上皮細胞基礎培養基m中,放入37℃恒溫二氧化碳培養箱培養48小時后顯微鏡下觀察細胞生長狀況并拍照。
12)顯微鏡下觀察到在原代分離培養肺癌和癌旁組織樣本的第3天,可明顯觀察到肺原代上皮細胞和原代腫瘤細胞的細胞克隆(如圖2)。
【實施例4】建立大量擴增肺癌病人肺原代上皮細胞和肺原代腫瘤細胞的傳代培養的方法,包括如下具體步驟:
1)配備dmem培養基、hbss緩沖溶液、0.25%胰蛋白酶/edta等,用hbss緩沖溶液與0.25%胰蛋白酶/edta配制成0.05%胰蛋白酶/edta,pbs緩沖溶液與胎牛血清以9:1的體積比配制成10%的消化終止液。
2)顯微鏡下觀察到在肺癌和癌旁組織樣本原代分離培養的第12天和第9天,細胞培養瓶中培養的人肺原代上皮細胞和肺原代腫瘤細胞增殖至約90%豐度(如圖3)。
3)用1xpbs緩沖液洗滌細胞,再用0.05%胰酶/edta消化單層細胞,消化時長為3分鐘。倒置顯微鏡觀察發現約有90%的肺原代腫瘤細胞脫落,加入消化終止液1ml終止消化,移液器吹打混勻并收集細胞懸液轉移至15ml的離心管中,依次加入4mlpbs緩沖液清洗培養瓶2次,一并轉移至該離心管中,室溫1000rpm低速離心4分鐘。
4)以1:2比例重懸腫瘤細胞沉淀于培養基m中接種培養,維持細胞貼壁和正常生長。
5)剩余腫瘤細胞沉淀還可重懸于的細胞凍存液中儲存于液氮中備用。
6)擴增培養肺原代上皮細胞時,重復以上(3)-(5)操作步驟。
同時繪制傳代培養的周期及獲得的細胞數量統計圖:人肺原代上皮細胞和原代腫瘤細胞在第0天以相同細胞密度同時接種傳代培養,細胞密度為4×105個/ml,在第3、7、11天時消化傳代并進行細胞計數。(如圖4)
【實施例5】建立肺癌病人肺原代上皮細胞和原代腫瘤細胞的體外培養體系在藥物或其組合敏感性篩選的的方法,包括如下具體步驟:
1)當細胞培養瓶中培養的人肺原代上皮細胞和原代腫瘤細胞處于對數生長期時,用0.05%胰蛋白酶/edta消化3分鐘,消化終止液終止消化,1000rpm低速離心4分鐘,分別用培養基m制備成單細胞懸液,取出適量單細胞懸液,臺盼藍與細胞懸液1:1混勻細胞計數儀檢測細胞數量與活力,每孔100μl細胞懸液接種于96孔板,細胞數為6000-8000個/孔,放入37℃二氧化碳培養箱培養;
2)次日吸去孔內溶液加藥,設置單藥組順鉑、紫杉醇、卡鉑、吉西他濱和聯用組順鉑+紫杉醇、順鉑+吉西他濱、卡鉑+紫杉醇處理細胞,每孔加入200μl含不同濃度藥物的培養基m。設置合理藥物濃度梯度,各個藥物實驗組的各個梯度均設置6個復孔,同時設置細胞對照組(同體積細胞培養基m替代)及空白對照組(同體積pbs緩沖液替代)每組設置6個復孔。
3)藥物統一處理48小時,移去板內溶液,每孔加入含有10μlckk-8檢測試劑(ck04,東仁化學)的無血清dmem培養基100μl,包含各藥物實驗組、對照組和空白組。
4)在37℃二氧化碳細胞培養箱繼續孵育1.5小時,酶標儀在450nm處測定的吸光度。
5)所有數據經統計軟件graphpadprism6和calcusyn2進行統計學分析和作圖,輸出并保存圖形和數據。
6)結果分析:由實驗結果可知,對人肺原代腫瘤細胞藥效學為:紫杉醇>順鉑>吉西他濱>卡鉑,但同時對人肺原代上皮細胞的殺傷作用也較大。考慮《nccn指南》以鉑為主組合化療的標準方案,嘗試藥物聯用的藥敏檢測和毒性檢測,順鉑+紫杉醇和順鉑+吉西他濱的組合對對人肺原代上皮細胞的殺傷作用較大,對該個體而言卡鉑+紫杉醇的組合聯用效應較高,且對人肺原代上皮細胞傷害較小,可考慮為臨床治療備選方案。(如圖5)
- 還沒有人留言評論。精彩留言會獲得點贊!