肺表面活性蛋白B前肽的重組蛋白及其制備方法和應用與流程
本發明涉及基因工程領域,具體涉及一種肺表面活性蛋白b前肽的重組蛋白、編碼該重組蛋白的核酸、一種重組質粒、一種重組菌株、一種制備肺表面活性蛋白b前肽的重組蛋白的方法以及它們的應用。
背景技術:
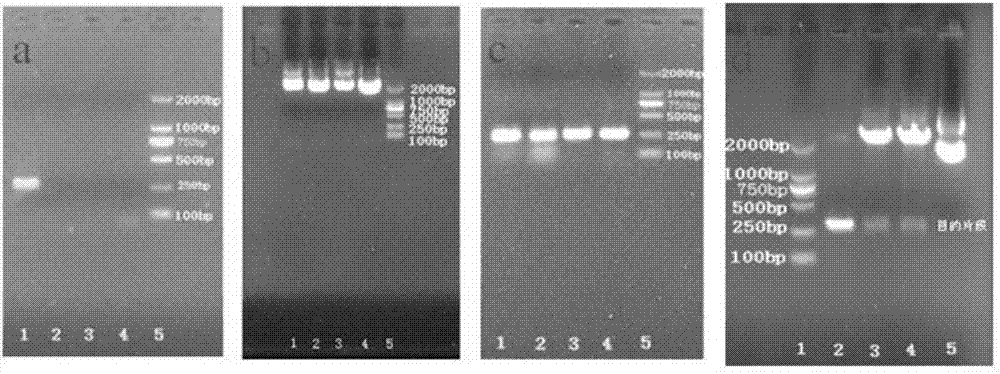
:自從抗生素被發現以來,在人類疾病治療過程中發揮了重大的作用,治愈了許多人類束手無策的感染性疾病,挽救了許多人的生命,大大的提高了人類的平均壽命。然而由于它們的大量使用、濫用及不規范使用等原因,致使大量的耐藥菌株出現、傳播,導致感染性疾病的治療復雜化,治療費用增長,發病率、死亡率增加,使得感染菌的耐藥性成為一個不可回避的問題。并且這些傳統的抗感染藥物還具有耳毒性、腎毒性、肝毒性、神經毒性、心臟毒性、變態反應及對造血系統成造成損傷等許多明顯的毒副作用,從而對患者造成一些不可預見的影響,甚至會危及患者的生命。由于傳統抗生素藥物的諸多不利因素,因此尋找抗生素的有效替代品,開發出新的毒性低且效果好的抗菌藥物具有現實的意義。而抗菌肽作為一類新型的抗菌藥物,近幾年來的發展十分迅猛。其中,肺表面活性物質由于是由人體自身細胞所表達、分泌的物質,且可能具有抗炎抗菌活性,因此,以肺表面活性物質為基礎開發出一類抗菌藥物具有重大前景。肺表面活性蛋白(surfactantprotein,sp)作為肺表面活性物質中最為重要的物質之一,特別是其中的sp-b蛋白的抗菌作用,越來越受到人們的關注。但是,marnie等研究發現成熟的sp-b蛋白的抗菌作用僅發生于體外,在機體內,成熟sp-b與磷脂質相互關聯,磷脂質與sp-b的結合較為穩定,不能使得sp-b作用于外來的細菌來發揮其抗菌功能,并且成熟的sp-b非選擇性的作用于磷脂分子層,裂解細胞膜,表現出非選擇性的溶解體細胞,特別是紅細胞,造成溶血等機體損傷。因此,人們又將目光轉移到肺表面活性蛋白b前肽(prosurfactantprotein-b,prosp-b)上,但是,prosp-b由于具有較強的疏水性,很難通過化學合成方式獲得,這增加了對該類物質的進一步開發和研究。因此,目前急需尋找一種獲得具有良好抗菌活性的prosp-b的方法,以為開發出既可以克服傳統抗生素的諸多缺陷,又具有良好抗菌效果的新型抗菌藥奠定基礎。技術實現要素:本發明的目的是為了克服現有技術存在的上述問題,提供一種prosp-b的重組蛋白,編碼該重組蛋白的核酸、重組質粒、重組菌株和制備prosp-b的重組蛋白的方法以及它們的應用。采用本發明提供的方法,成功地獲得了prosp-b重組蛋白,該prosp-b重組蛋白的細胞毒性低,且表現出良好的抗菌活性。為了實現上述目的,第一方面,本發明提供了一種肺表面活性蛋白b前肽的重組蛋白,其中,所述重組蛋白具有seqidno:1所示的氨基酸序列,或者在seqidno:1的氨基末端和/或羧基末端連接有標簽的氨基酸序列。第二方面,本發明還提供了能夠編碼上述重組蛋白的核酸。第三方面,本發明還提供了一種重組質粒,該重組質粒含有上述核酸。第四方面,本發明還提供了一種重組菌株,該重組菌株含有上述重組質粒。第五方面,本發明還提供了一種制備肺表面活性蛋白b前肽的重組蛋白的方法,其中,該方法包括以下步驟:(1)將上述的重組質粒轉化至表達宿主菌中,以得到重組菌株;(2)所述重組菌株經培養后,在誘導劑的存在下進行誘導培養,以得到培養液;(3)將由步驟(2)得到的培養液進行純化和標簽去除,以得到肺表面活性蛋白b前肽的重組蛋白。上述重組蛋白、核酸、重組質粒、重組菌株、以及上述的方法制備得到的重組蛋白在制備抗菌藥中應用;優選地,所述抗菌藥為抗金黃色葡萄球菌(staphylococcusaureus)、大腸桿菌(escherichiacoli)、石膏樣小孢子菌(microsporumgypseum)、白色念珠菌(moniliaalbican)、紅色毛癬菌(trichophytonrubrum)、銅綠假單胞菌(pseudomonasaeruginosa)和耐甲氧西林金黃色葡萄球菌(methicillin-resistantstaphylococcusaureus)中的至少一種的藥物。prosp-b由于具有較強的疏水性,很難通過化學合成方式獲得,本發明采用基因工程方法,特別是通過使用特定的表達載體(pgex4t-1)和表達宿主菌(大腸桿菌bl21(de3)plyss菌株),成功地獲得了濃度較高的prosp-b重組蛋白,并且,通過將pgex4t-1載體上的gst標簽與prosp-b融合,由于gst標簽具有親水性,可以明顯提高prosp-b重組蛋白的水溶性,擴大其應用范圍。另外,本發明提供的prosp-b重組蛋白表現出良好的廣譜抗菌活性,其對臨床上常見的細菌、真菌均具有較強的抑制作用,特別是對金黃色葡萄球菌、大腸桿菌、石膏樣小孢子菌、白色念珠菌、紅色毛癬菌、銅綠假單胞菌和耐甲氧西林金黃色葡萄球菌表現出明顯的抑制活性。進一步的研究發現,prosp-b重組蛋白發揮其抗菌作用的可能是通過影響細菌細胞膜的通透性,從而抑制細菌的正常生長。同時,本發明提供的prosp-b重組蛋白的細胞毒性較小,即使將蛋白濃度提高到1mg/ml(該濃度遠遠大于其對細菌的mic值),細胞的增殖能力依然高于59%,這說明本發明提供的prosp-b重組蛋白具有較高的安全性。附圖說明圖1顯示的是本發明的實施例1中pcr產物鑒定的結果;圖2顯示的是本發明的實施例1中重組質粒pet30-prosp-b的鑒定結果;圖3顯示的是本發明的實施例1中重組質粒pgex4t-1-prosp-b的鑒定結果;圖4顯示的是本發明的實施例1中prosp-b重組蛋白誘導表達的sds-page結果;圖5顯示的是本發明的實施例1中prosp-b重組蛋白誘導表達的western-blot結果;圖6顯示的是本發明的實施例1中誘導表達的prosp-b重組蛋白經純化后的sds-page和sds-page;圖7顯示的是本發明的實施例3中prosp-b重組蛋白的抗菌譜測定的結果。具體實施方式在本文中所披露的范圍的端點和任何值都不限于該精確的范圍或值,這些范圍或值應當理解為包含接近這些范圍或值的值。對于數值范圍來說,各個范圍的端點值之間、各個范圍的端點值和單獨的點值之間,以及單獨的點值之間可以彼此組合而得到一個或多個新的數值范圍,這些數值范圍應被視為在本文中具體公開。第一方面,本發明提供了一種肺表面活性蛋白b前肽的重組蛋白,其中,所述重組蛋白具有seqidno:1所示的氨基酸序列,或者在seqidno:1的氨基末端和/或羧基末端連接有標簽的氨基酸序列。seqidno:1所示的氨基酸序列為:agandlcqecedivhlltkmtkedafqdtirkfleqecdilplkllvprcrqvldvylplvidyfqgqikpkaicshvglc。在本發明中,所述“連接有標簽的氨基酸序列”是指使用本領域常見的標簽對seqidno:1所示的氨基酸序列進行添加和修飾。考慮到prosp-b具有較強的疏水性,在優選的情況下,所述標簽具有親水性。更優選地,所述標簽為gst標簽。在本發明中,所述gst(glutathiones-transferase,谷胱甘肽s-轉移酶)標簽可以是本領域常規使用的gst標簽,其可以通過表達載體引入。在優選的情況下,所述gst標簽的氨基酸序列的genbank號為:amq34028.1(具體請參見https://www.ncbi.nlm.nih.gov/protein/1005883217)。第二方面,本發明還提供了一種能夠編碼上述重組蛋白的核酸。根據本發明,所述核酸具有seqidno:2所示的核酸序列,或者在seqidno:2的氨基末端和/或羧基末端連接有標簽的核酸序列;優選地,所述標簽具有親水性;更優選地,所述標簽為gst標簽。seqidno:2所示的核酸序列為:gcaggagctaatgacctgtgccaagagtgtgaggatattgtccacctcctcacaaagatgaccaaggaagacgctttccaggacacgatccggaagttcctggaacaagaatgtgatatcctacccttgaagctgcttgtgccccggtgtcgccaagtgcttgatgtctacctgcccctggttatcgactacttccagggccagattaaacccaaagccatctgcagtcatgtgggcctgtgc。在本發明中,由于本發明提供的核酸具有較強的疏水性,很難通過人工合成法獲得,因此,本發明提供的核酸通常采用基因工程方法獲得,例如,可以通過聚合酶鏈式反應(pcr)擴增法獲得。具體地,本領域技術人員可以根據本發明所提供的核苷酸序列,可以很容易得到模板和相應的引物,利用pcr進行擴增獲得有關序列。一旦獲得了有關核酸序列,就可以用重組法大批量的獲得有關氨基酸序列。通常將所得核酸序列克隆入表達載體,再轉入表達宿主菌中,然后通過常規的方法從增殖后的表達宿主菌分離得到有關核酸序列。在本發明中,所述“連接有標簽的核酸序列”是指使用本領域常見的標簽對seqidno:2所示的核酸序列進行添加和修飾。考慮到prosp-b具有較強的疏水性,在優選的情況下,所述標簽具有親水性。更優選地,所述標簽為gst標簽。在本發明中,所述gst標簽可以是本領域常規使用的gst標簽,其可以通過表達載體引入,優選通過pgex4t-1質粒引入。在優選的情況下,所述gst標簽的核酸序列為genbank號:ku312308.1的第258位至第959位所示的序列。第三方面,本發明還提供了一種重組質粒,該重組質粒含有上述核酸。在本發明中,所述重組質粒使用的質粒優選為pet30a質粒和/或pgex4t-1質粒(均可以通過商購手段獲得)。所述重組質粒可以采用能夠在載體多克隆位點具有切割位點的各種核酸內切酶進行酶切獲得線性質粒,然后與采用相同核酸內切酶切割的核酸片段連接,獲得重組質粒。例如,對于pet30a質粒,可以使用xholi、noti、eagi、hindiii、ecori、bamhi、ncoi、kpni、bgiii、ndei等內切酶;對于pgex4t-1質粒,可以使用xholi、noti、ecori、bamhi、smai等內切酶。在本發明的一種優選的實施方式中,所述重組質粒為在pgex4t-1質粒的bamhi和xhoi酶切位點之間插入seqidno:2所示的核酸序列而得到的表達載體。第四方面,本發明還提供了一種重組菌株,其中,該重組菌株含有上述重組質粒;優選地,所述重組菌株為含有上述重組質粒大腸桿菌bl21(de3)plyss菌株本發明可以采用本領域常規使用的方法將重組質粒轉化進入表達宿主菌中,以獲得重組菌株。例如,可以使用熱激法、氯化鈣化學轉化法等,優選為熱激法。在本發明中,所述表達宿主菌可以為本領域常規使用的任意適于作為宿主的細菌或真菌,例如,可以為大腸桿菌。優選地,用于保存重組質粒的大腸桿菌dh5α菌株,用于表達的大腸桿菌bl21(de3)plyss菌株。本發明使用的表達宿主菌均可以通過常規的商購手段獲得。第五方面,本發明還提供了一種制備肺表面活性蛋白b前肽的重組蛋白的方法,其中,該方法包括以下步驟:(1)將上述重組質粒轉化至表達宿主菌中,以得到重組菌株;(2)所述重組菌株經培養后,在誘導劑的存在下進行誘導培養,以得到培養液;(3)將由步驟(2)得到的培養液進行純化和標簽去除,以得到肺表面活性蛋白b前肽的重組蛋白。在本發明中,在步驟(1)中,可以采用本領域常規使用的方法將重組質粒轉化進入表達宿主菌中,以獲得重組菌株。例如,可以使用熱激法、氯化鈣化學轉化法等,優選為熱激法。在本發明中,在步驟(1)中,所述表達宿主菌可以為本領域常規使用的任意適于作為宿主的細菌或真菌,例如,可以為大腸桿菌。優選地,用于保存重組質粒的表達宿主菌為大腸桿菌dh5α菌株,用于表達的表達宿主菌為大腸桿菌bl21(de3)plyss菌株。本發明使用的表達宿主菌均可以通過常規的商購手段獲得。在本發明中,在步驟(2)中,本發明對所述誘導劑的種類沒有特別的限定,可以為本領域的常規選擇,例如,所述誘導劑可以為異丙基-β-d-硫代半乳糖苷(iptg),且所述誘導劑的濃度為0.5-2mmol/l,優選為0.8-1.5mmol/l。在本發明中,在步驟(2)中,本發明對所述誘導培養的條件沒有特別的限定,只要能夠達到誘導重組蛋白表達的目的即可。在優選的情況下,所述誘導培養的條件包括:溫度為28-37℃,優選為28-35℃,更優選為28-32℃;時間為3h以上,優選為3-24h,更優選為12-24h。在本發明中,在步驟(3)中,本發明對所述純化和標簽去除的方式沒有特別的限定,只要能夠實現蛋白純化和標簽去除的目的即可,例如,可以通過吸附的方式進行蛋白純化,可以使用蛋白酶進行標簽去除。在本發明的一種具體的實施方式中,對于pgex4t-1質粒,使用gstrapff16/10預裝柱(可以通過常規的商購手段獲得)進行重組蛋白的純化和標簽去除。第六方面,本發明還提供了上述重組蛋白、上述核酸、上述重組質粒、上述重組菌株、由上述方法制備得到的重組蛋白在制備抗菌藥中的應用;優選地,所述抗菌藥為抗金黃色葡萄球菌(staphylococcusaureus)、大腸桿菌(escherichiacoli)、石膏樣小孢子菌(microsporumgypseum)、白色念珠菌(moniliaalbican)、紅色毛癬菌(trichophytonrubrum)、銅綠假單胞菌(pseudomonasaeruginosa)和耐甲氧西林金黃色葡萄球菌(methicillin-resistantstaphylococcusaureus)中的至少一種的藥物;更優選地,所述抗菌藥為抗金黃色葡萄球菌、大腸桿菌、石膏樣小孢子菌、白色念珠菌、紅色毛癬菌和耐甲氧西林金黃色葡萄球菌中的至少一種的藥物;進一步優選地,所述抗菌藥為抗金黃色葡萄球菌和/或耐甲氧西林金黃色葡萄球菌的藥物。在本發明所述的應用中,上述重組蛋白、上述核酸、上述重組質粒、上述重組菌株、由上述方法制備得到的重組蛋白在所述抗菌藥中使用的ph值為3-8,優選為5-6,更優選為5.4-6。以下將通過實施例對本發明進行詳細描述。在以下實施例中:sd大鼠購于大坪醫院野戰外科研究所實驗動物中心;大腸桿菌dh5α購自上海昂羽生物科技有限公司;大腸桿菌bl21(de3)plyss購自北京華越洋生物公司,大腸桿菌、金黃色葡萄球菌、石膏樣小孢子菌、白色念珠菌、紅色毛癬菌、銅綠假單胞菌購自北京北納創聯生物技術研究院、耐甲氧西林金黃色葡萄球菌(編號atcc43300)購自廣東省微生物菌種保藏中心;ccl-149細胞株購自上海谷研生物科技公司;pgex4t-1購自上海友科生物技術有限公司;bamhi、hindiii、xhoi均購自美國neb公司;t4連接酶、總rna提取試劑盒、逆反轉錄試劑盒均購自美國genecopoeia公司;dna膠回收試劑盒、dnaloadingbuffer、dnamarker均購自日本takara公司;碘化丙啶(pi)購自上海翔圣生物科技有限公司;ldh試劑盒購自碧云天生物科技有限公司。其余實驗試劑和耗材均可以通過常規的商購手段獲得。實施例1本實施例用于說明本發明提供的prosp-b重組蛋白的制備方法。1、大鼠肺組織總rna提取(1)使用總rna提取試劑盒(購于美國genecopoeia公司)提取大鼠肺組織總rna;(2)rna的電泳檢測使用新配置的凝膠電泳液進行電泳,凝膠成像儀檢測分析rna質量。2、prosp-b基因cdna的獲得及擴增(1)獲得cdna片段反轉錄反應體系:總rna1μgoli(dt)181μlfreernasewater至13μl于65℃下反應10min,然后于4℃下保存。反應體系:反應條件:于42℃下反應60min,再于85℃下反應5min,然后在4℃保存。最后將反轉錄的產物放在-80℃冰箱長期保存。(2)以cdna為模板進行pcr擴增(a)引物序列設計根據pet30a質粒圖譜和bamhⅰ及hindⅲ酶切位點,用primerpremier5.0軟件設計上、下游引物,其引物序列如下。prosp-b-f5'-aaaggatccgcaggagctaatgacctg-3'(seqidno:3)prosp-b-r5'-tttaagcttttagcacaggcccacatg-3'(seqidno:4)(b)反應液配制:(c)pcr反應條件:95℃反應5min;95℃變性30s,64℃退火30s,72℃延伸45s,共39個循環;72℃延伸6min,4℃保存。(d)pcr產物鑒定pcr反應結束后,進行瓊脂糖凝膠電泳檢測,凝膠成像系統上觀察條帶,分析結果。結果如圖1所示,由圖1可知在約250bp處出現條帶,大小符合目的基因大小,初步證明反轉錄成功。(e)用pcr產物純化回收試劑盒進行pcr產物的純化。(3)pet30-prosp-b表達載體的構建、鑒定利用bamhi、hindiii對pet30和prosp-b片段進行雙酶切,并切膠回收酶切產物,t4dna連接酶4℃過夜連接。(a)bamhi、hindⅲ雙酶切反應體系:反應條件:恒溫水浴鍋,37℃,8h,瓊脂糖凝膠電泳檢測。(b)載體、目的片段切膠回收產物的切膠回收及純化按dna純化回收試劑盒說明書進行。(c)t4dna連接酶反應體系:(d)重組質粒的轉化與鑒定:將10μl連接產物全部加入到100μl的大腸桿菌dh5α感受態中,運用pcr儀進行轉化的質粒導入操作,過程如下:0℃反應30min,再于42℃反應30s,然后于0℃保存。然后往產物中加入300μl液體lb培養基,37℃、150r/min培養1h。然后涂布在含50μg/ml卡那的固體lb平板上,37℃過夜培養,然后挑取菌落進行菌落pcr鑒定,鑒定為陽性的菌落進行擴培提質粒,質粒pcr和雙酶切鑒定。將鑒定為陽性的重組質粒命名為pet30-prosp-b,送生工生物工程(上海)股份有限公司測序。測序結果表明,該重組質粒序列的第187-429位與seqidno:2所示序列相一致。pcr結果如圖2所示。具體地,將連接產物轉化進入dh5α感受態細胞中,經含卡那的抗性平板篩選,其菌落pcr鑒定結果如圖2(a)所示,菌落搖瓶質粒瓊脂糖電泳結果如圖2(b)所示,菌落質粒pcr鑒定結果如圖2(c)所示,菌落質粒雙酶切結果如圖2(d)所示,由圖可知,pcr結果均為單一條帶,且其大小約250bp,與目的基因prosp-b大小吻合,雙酶切圖也顯示在250bp處有單一條帶,位置正確,與prosp-b大小符合,初步證明重組質粒pet30-prosp-b構建成功。并且,經在ncbi中blast的結果可知,陽性質粒的測序結果與prosp-b相匹配,這表明實驗過程中構建的pet30-prosp-b載體構建成功。(4)pgex4t-1-prosp-b表達載體的構建、鑒定利用bamhi、xhoi對pgex4t-1和pet30-prosp-b質粒進行雙酶切并切膠回收酶切產物,t4dna連接酶4℃過夜連接。(a)酶切反應體系:雙酶切反應條件:恒溫水浴鍋,37℃,8h,瓊脂糖凝膠電泳檢測。(b)t4dna連接酶反應體系:(c)重組質粒的轉化與鑒定:將連接產物轉化到大腸桿菌dh5α感受態中,并進行菌落pcr鑒定。對鑒定為陽性的菌落進行擴培提質粒,質粒pcr和雙酶切鑒定。將鑒定為陽性的重組質粒命名為pgex4t-1-prosp-b,送生工生物工程(上海)股份有限公司測序。測序結果表明,該重組質粒序列的第609-851位與seqidno:2所示序列相一致。pcr結果如圖3所示。具體地,將連接產物轉化進入dh5α感受態細胞中,經含氨芐的抗性平板篩選,其菌落pcr鑒定結果如圖3(a)所示,菌落搖瓶質粒瓊脂糖電泳結果如圖3(b)所示,菌落質粒pcr鑒定結果如圖3(c)所示,菌落質粒雙酶切結果如圖3(d)所示,由圖可知,pcr結果均為單一條帶,且其大小約250bp,與目的基因prosp-b大小吻合,雙酶切圖也顯示在250bp處有單一條帶,位置正確,與prosp-b大小符合,初步證明重組質粒pgex4t-1-prosp-b構建成功。并且,經在ncbi中blast的結果可知,陽性質粒的測序結果與prosp-b相匹配,這表明實驗過程中構建的pgex4t-1-prosp-b載體構建成功。(5)prosp-b重組蛋白誘導表達及sds-page檢測將測序結果顯示正確的重組質粒pgex4t-1-prosp-b轉化至大腸桿菌bl21(de3)plyss中。于37℃、250r/min過夜培養,次日以1:100的接種量轉接于含amp50μg/ml的新鮮lb液體培養基中,37℃、250r/min振蕩培養,當菌液od600約為0.8時,吸取部分菌液作為誘導前對照,12000r/min離心收集;菌液加入iptg誘導使其終濃度為1.0mmol/l,分別于30℃和37℃、250r/min振蕩培養,并在3h、6h、9h、12h、24h收集菌體,用sds-page檢測分析。sds-page配膠體系:sds-page條件:恒壓進行電泳,其中濃縮膠為80v,分離膠為120v,待蛋白marker完全分開且占據單行膠的3/4時停止電泳。染色:將電泳完的膠去除濃縮膠,將分離膠置于考馬斯亮藍r250染色液中,室溫水平搖床上染色1h;然后用脫色液進行脫色,使膠上考馬斯亮藍r250藍色部分完全脫凈,取出、拍照。結果如4所示。具體地,圖4(a)顯示的是分別于37℃和30℃誘導后的sds-page跑膠結果。其中,條帶1顯示的是未經誘導的菌體的蛋白表達結果;條帶2顯示的是37℃下誘導的菌體的蛋白表達結果;條帶3顯示的是30℃下誘導的菌體的蛋白表達結果;條帶4顯示的是30℃下菌體破碎上清的蛋白表達結果;條帶5為蛋白marker。由圖4(a)可知,在37℃條件下誘導所得的蛋白量沒有30℃條件下誘導所得的量大,且菌體上清含有的蛋白量與全菌體的量基本一致,由此說明30℃時,重組蛋白以可溶性蛋白的形式存在,且于蛋白30℃下誘導較為合適。圖4(b)顯示的是30℃下誘導不同時間后蛋白表達的情況。其中,條帶1為蛋白marker;條帶2顯示的是未經誘導的菌體的蛋白表達結果;條帶3顯示的是誘導3h后菌體上清的蛋白表達結果;條帶4顯示的是誘導6h后菌體上清的蛋白表達結果;條帶5顯示的是誘導9h后菌體上清的蛋白表達結果;條帶6顯示的是誘導12h后菌體上清的蛋白表達結果;條帶7顯示的是誘導24h后菌體上清的蛋白表達結果。由圖4(b)可知,在30℃條件下,誘導3-24h,目的蛋白的表達量隨著時間的增加而逐漸增加,到12h后增加趨勢變緩。(6)westernblot檢測prosp-b的表達當蛋白經sda-page分離后,依據蛋白marker位置剪下gst-prosp-b所在區域,轉印至pvdf膜上,恒流電轉,250ma,1h。用含5%脫脂奶粉的tbs-t封閉1h;進行兔抗大鼠prosp-b多克隆抗體(1∶10000稀釋)4℃冰箱過夜孵育;第二天用tbs-t洗滌完后,用hrp標記山羊抗兔igg二抗(1∶5000稀釋)室溫孵育1h,再經tbs-t洗滌后滴加chemiluminescenthrpsubstrate發光液,用天能發光成像工作站成像。結果如圖5所示,其中,條帶1顯示的是未經誘導的菌體的蛋白表達結果;條帶2-7分別顯示的是誘導3h、6h、9h、12h和24小時后菌體上清的蛋白表達結果。由圖5可知,本發明得到的prosp-b重組蛋白條帶為單一條帶,無非特異性條帶出現,且蛋白大小與預期一致,這說明表達的蛋白為prosp-b重組蛋白。(7)gst-prosp-b重組蛋白的純化按1:100的接種量將重組菌株pgex4t-1-prosp-b接種于含amp50ug/ml的液體lb培養基中,30℃誘導12h后離心收集菌體。pbs(含0.1mmol/lpmsf)重懸菌體沉淀,超聲處理10min,12000r/min離心20min收集上清,然后用0.45μm微孔濾膜過濾。蛋白用蛋白純化系統進行純化,其中純化柱為gstrapff16/10預裝柱。純化后進行sds-page、westernblot檢測分析,并用bca蛋白定量試劑盒測定蛋白濃度。經測定,重組蛋白的濃度約為1mg/ml。純化后的sds-page、westernblot檢測結果如圖6所示。具體地,圖6(a)顯示的是蛋白經純化后的sds-page結果,其中,條帶1為蛋白marker;條帶2顯示的是于30℃下誘導12h后的菌體上清(純化前)的結果;條帶3顯示的是于30℃下誘導12h后的菌體上清經純化后的結果。圖6(b)顯示的是蛋白經純化后的westernblot結果,其中,條帶1為蛋白marker;條帶2顯示的是未誘導菌體上清的結果;條帶3顯示的是于30℃下誘導12h后的菌體上清經純化后的結果。圖6(a)和圖6(b)的結果表明,純化后可以獲得表達量更高的重組蛋白(具有seqidno:1所示的氨基酸序列)。實施例2本實施例用于說明本發明提供的prosp-b重組蛋白的細胞毒性(1)使用含10%fbs的r/mini1640培養基培養ccl-149細胞。(2)將培養穩定的ccl-149細胞,用胰酶消化細胞,收集細胞并用培養基稀釋調節細胞濃度,使其在100μl中約有5000個細胞,在96孔板第1~10孔中接種100μlccl-149細胞,在第11孔中加入100μl培養基,37℃、5%co2細胞培養箱中培養24h。(3)依次往96孔板的第1~9孔加入10μl濃度為1000μg/ml、500μg/ml、250μg/ml、125μg/ml、62.5μg/ml、21.25μg/ml、15.63μg/ml、7.81μg/ml、3.91μg/ml的由實施例1中步驟(7)獲得的純化后的蛋白,第10、11孔加入10μl滅菌蒸餾水。(4)將96孔板置于37℃、5%co2細胞培養箱中培養12h。(5)往96孔板中每孔加入10μlcck-8溶液。(6)將96孔板在37℃、5%co2細胞培養箱中孵育4小時。(7)用酶標儀在450nm處測定吸光度值。(8)按下列公式計算細胞活力:ac:細胞被prosp-b重組蛋白溶液處理過的吸光度,即實驗組;a0:不含細胞的吸光度,即空白組;as:有細胞,但細胞沒被prosp-b重組蛋白溶液處理過的吸光度,即對照組。細胞毒性實驗的結果如表1所示。表1由表1的結果可以計算出本發明提供的prosp-b重組蛋白的ic50=1595.68μg/ml,具體地,當prosp-b重組蛋白的濃度為1mg/ml時,其細胞活力為59.62%,說明prosp-b重組蛋白的細胞毒性是較小的,根據細胞毒性評價標準—rgr毒性分級法,當細胞相對增殖率(rgr)≥75%時,可以判定藥物毒性為0級或1級,當rgr在50%~74%間時,判定藥物毒性為2級;其中2級及以下都說明藥物的毒性是可接受的,即是安全的。當prosp-b重組蛋白的濃度提高至1595μg/ml時,其細胞增殖率也高于50%,說明prosp-b重組蛋白濃度為1595μg/ml時,其是低毒的,可以用于藥物開發,而一般藥物的治療計量均低于1595μg/ml,因此本研究的對象prosp-b重組蛋白作為一類抗菌藥物開發完全是安全的。實施例3本實施例用于說明本發明提供的prosp-b重組蛋白的抗菌活性1、菌種的活化和菌懸液的制備(1)金黃色葡萄球菌培養:用劃線法將金黃色葡萄球菌活化于lb瓊脂平板上,37℃、12h恒溫培養,待長出單菌落后,挑取單菌落接種在10mllb液體培養基中,37℃、12h、150r/min,培養,移液槍吸取菌液與滅菌過的雙蒸水制成菌懸液,調整其濃度,制得106cfu的菌懸液。(2)大腸桿菌的培養:用劃線法將大腸桿菌活化于lb瓊脂平板上,37℃、12h恒溫培養,待長出單菌落后,挑取單菌落接種在10mllb液體培養基中,37℃、12h、150r/min,培養,移液槍吸取菌液與滅過菌的雙蒸水制成菌懸液,調整其濃度,制得106cfu的菌懸液。(3)紅色毛癬菌培養:配制sda培養基,倒入玻璃試管中,形成斜面,在斜面的上中下三個位置接種紅色毛癬菌,28℃恒溫培養10d,然后往每支試管中加入滅過菌的雙蒸水2ml,使管中的紅色毛癬菌分散于液體中,調整其濃度,制得106cfu的菌懸液。(4)石膏樣小孢子菌的培養:配制sda斜面培養基平板,在斜面的上中下三個位置接種石膏樣小孢子菌,28℃恒溫培養10d,然后往每支試管中加入滅過菌的雙蒸水2ml,使管中的石膏樣小孢子菌分散于液體中,調整其濃度,制得106cfu的菌懸液。(5)白色念珠菌:用劃線法將白色念珠菌活于lb瓊脂平板上,28℃、10d恒溫培養,待長出單菌落后,挑取單菌落接種在10mllb液體培養基中,37℃、12h、150r/min,培養,移液槍吸取菌液與滅過菌的雙蒸水制成菌懸液,調整其濃度,制得106cfu的菌懸液。(6)銅綠假單胞菌:用劃線法將銅綠假單胞菌活化于lb瓊脂平板上,37℃、12h恒溫培養,待長出單菌落后,挑取單菌落接種在10mllb液體培養基中,37℃、12h、150r/min,培養,移液槍吸取菌液與滅過菌的雙蒸水制成菌懸液,調整其濃度,制得106cfu的菌懸液。(7)耐甲氧西林金黃色葡萄球菌:用劃線法將保存的耐甲氧西林金黃色葡萄球菌活化于lb瓊脂平板上,37℃、12h恒溫培養,待長出單菌落后,挑取單菌落接種在10mllb液體培養基中,37℃、12h、150r/min,培養,移液槍吸取菌液與滅過菌的雙蒸水制成菌懸液,調整其濃度,制得106cfu的菌懸液。2、prosp-b重組蛋白抑菌實驗-ph值的優化(1)將配制好的蛋白緩沖液調節不同的ph值,制備成不同的蛋白緩沖液。(2)抑菌濾紙片的制備:制備好約6mm的圓形濾紙片,121℃滅菌20min,電熱鼓風干燥箱干燥2h。將濾紙片用無菌鑷子夾取放到500μg/ml由實施例1中步驟(7)得到的蛋白液中浸泡,將浸泡后的濾紙片分別放入無菌培養皿中,干燥表面多余液體,以得到浸藥的濾紙片;并以無菌生理鹽水為陰性對照,以青霉素或特比萘芬為陽性對照(細菌的陽性對照為青霉素,真菌的陽性對照為特比萘芬)。(3)菌種的涂布:移液槍吸取各稀釋制備好的菌懸液50μl,玻璃涂布棒均勻的涂抹于各個固體平板上。(4)將含藥濾紙片用無菌鑷子將浸藥的濾紙片、陰性對照濾紙片、陽性對照濾紙片貼于平板中,用記號筆在培養皿背面做好標記。(5)菌體培養:將貼了濾紙片的大腸桿菌、金黃色葡萄球菌、銅綠假單胞菌、耐甲氧西林金黃色葡萄球菌倒置于37℃細菌生化培養箱培養12h;紅色毛癬菌、石膏樣小孢子菌、白色念珠菌平板倒置于28℃細菌生化培養箱培養5d。(6)用直尺測量各平板的抑菌圈大小(單位mm),結果如表2所示。統計分析,篩選合適的ph值。表2由表2的結果可知,prosp-b重組蛋白在ph3-8時均具有一定的抗菌活性,說明抗菌肽對弱酸性和弱堿性都具有一定的耐性。其中,在弱酸環境下,prosp-b重組蛋白的抗菌活性表現得更明顯,當ph為5.6時,其抑菌效果最強,當ph>5.6時,其抑菌程度隨ph值的增大而降低,這可能與蛋白的構象變化有關系,其在堿性環境下分子構象發生變化,而影響了抗菌肽的生物學活性,導致其抗菌活性的降低。3、prosp-b重組蛋白的抗菌譜測定(1)抑菌濾紙片的制備:制備好約6mm的圓形濾紙片,121℃滅菌20min,電熱鼓風干燥箱干燥2h。將濾紙片用無菌鑷子夾取放到500μg/ml由實施例1中步驟(7)得到的蛋白液中浸泡,將浸泡后的濾紙片分別放入無菌培養皿中,干燥表面多余液體,以得到浸藥的濾紙片;并以無菌生理鹽水為陰性對照,以青霉素或特比萘芬為陽性對照(細菌的陽性對照為青霉素,真菌的陽性對照為特比萘芬)。(2)菌種的涂布:移液槍吸取各稀釋制備好的菌懸液50μl,玻璃涂布棒均勻的涂抹于各個固體平板上。(3)將含藥濾紙片用無菌鑷子將浸藥的濾紙片、陰性對照濾紙片、陽性對照濾紙片貼于平板中,用記號筆在培養皿背面做好標記。(4)菌體培養:將貼了濾紙片的大腸桿菌、金黃色葡萄球菌、銅綠假單胞菌、耐甲氧西林金黃色葡萄球菌倒置于37℃細菌生化培養箱培養12h;紅色毛癬菌、石膏樣小孢子菌、白色念珠菌平板倒置于28℃細菌生化培養箱培養5d。(5)用直尺測量各平板的抑菌圈大小,(單位mm),結果如圖7(a為空白對照,b為陽性對照)和表3所示。具體在圖7中,圖7(a)顯示的是金黃色葡萄球菌的結果;圖7(b)顯示的是大腸桿菌的結果;圖7(c)顯示的是白色念珠菌的結果;圖7(d)顯示的是紅色毛癬菌的結果;圖7(e)顯示的是石膏樣小孢子菌的結果;圖7(f)顯示的是銅綠假單胞菌的結果;圖7(g)顯示的是耐甲氧西林金黃色葡萄球菌的結果。然后進行統計分析,計算各菌的敏感程度,藥敏實驗的判定標準如表4所示。表3表4抑菌圈直徑(mm)20以上15-1010-1410以下6以下敏感度極敏高敏中敏低敏不敏感由表3和圖7可知,prosp-b重組蛋白對金黃色葡萄球菌、耐甲氧西林金黃色葡萄球菌、大腸桿菌、紅色毛癬菌、石膏樣小孢子菌、白色念珠菌均具有較強的抑制作用,其中對金黃色葡萄球菌、耐甲氧西林金黃色葡萄球菌的抑制作用最強,其抑菌圈大小分別達到20.6mm、20mm,所以金黃色葡萄球菌、耐甲氧西林金黃色葡萄球菌對于蛋白濃度為500μg/ml時都是極敏的;而對大腸桿菌的抑制作用較強,其抑菌圈大小達到15.3mm,所以大腸桿菌的對于蛋白濃度為500μg/ml時是高敏的;紅色毛癬菌、石膏樣小孢子菌、白色念珠菌的抑菌圈大小分別為12.3mm、14mm、13mm,故紅色毛癬菌、石膏樣小孢子菌、白色念珠菌對于蛋白濃度為500μg/ml時都是高敏的;而銅綠假單胞菌的抑菌圈大小只有8mm,所以銅綠假單胞菌對于蛋白濃度為500μg/ml時都是低敏的。4、prosp-b重組蛋白最小抑菌濃度(mic)的測定(1)將稀釋制備好的菌懸液加入100μl培養在96孔板中,并依次在第1~9中加入50μl各濃度的由實施例1中步驟(7)得到的蛋白液,第10孔作為空白對照,第11、12孔作為陽性對照(細菌為青霉素和頭孢克肟,真菌為特比萘芬和酮康唑,濃度均為200μg/ml)。(2)大腸桿菌、金黃色葡萄球菌、銅綠假單胞菌、耐甲氧西林金黃色葡萄球菌在生化培養箱37℃恒溫培養12h后,將96孔細胞培養板取出,用酶標儀分布在600nm波長處測定od值,計算蛋白對金黃色葡萄球菌、大腸桿菌、耐甲氧西林金黃色葡萄球菌、銅綠假單胞菌的最小抑菌濃度。(3)石膏樣小孢子菌、紅色毛癬菌、白色念珠菌在生化培養箱30℃恒溫培養4天后,將96孔細胞培養板取出,用酶標儀分布在600nm波長處測定od值,計算蛋白對紅色毛癬菌、石膏樣小孢子菌、白色念珠菌的最小抑菌濃度。結果如表5所示。表5菌名最小抑菌濃度(mic)μg/ml金黃色葡萄球菌20大腸桿菌30白色念珠菌60紅色毛癬菌30石膏樣小孢子菌30銅綠假單胞菌125耐甲氧西林金黃色葡萄球菌20由表5可知,prosp-b重組蛋白對細菌類如金黃色葡萄球菌、大腸桿菌、耐甲氧西林金黃色葡萄球菌均具有較高的抑菌效果,抑制他們生長的prosp-b重組蛋白濃度較低,各只需20μg/ml、30μg/ml、20μg/ml;并且prosp-b重組蛋白對真菌也表現出明顯的抑菌作用,如白色念珠菌、石膏樣小孢子菌、紅色毛癬菌的最小抑菌濃度各為60μg/ml、30μg/ml、30μg/ml,也相對很低,說明只需要較低濃度的prosp-b重組蛋白即可抑制各種細菌、真菌的生長,從而說明了prosp-b重組蛋白具有很高的殺菌、抑菌活性;但prosp-b重組蛋白對銅綠假單胞菌的最小抑菌濃度為125μg/ml,相對與另外六種菌是較高的。本實驗進而證明prosp-b重組蛋白對常見的g+、g-菌及酵母菌等真菌具有較強的抑制效果。5、pi測定prosp-b重組蛋白對金黃色葡萄球菌細胞膜通透性的影響(1)在96孔板1~7列中依次加入稀釋制備好的金黃色葡萄球菌懸液100μl培養,共4行。在第8列加入100μl的滅菌蒸餾水,然后依次在第1~4列中加入不同量的由實施例1中步驟(7)得到的prosp-b重組蛋白液,使其蛋白終濃度依次為20μg/ml、30μg/ml、60μg/ml、120μg/ml,第5~8列依次加入青霉素、tritonx-100、滅菌蒸餾水、prosp-b重組蛋白液,使其青霉素終濃度為50μg/ml,tritonx-100的終濃度為0.1%,prosp-b重組蛋白的終濃度為120μg/ml,最后加入一定量的lb培養基,保證每孔體積為200μl。(2)將96孔板放在生化培養箱中37℃培養12h,然后取出,加入pi,使其終濃度為50μg/ml。(3)加入pi后孵育30min,在多功能酶標儀上測定熒光od值,其激發波長為488nm,發射波長為630nm。(4)以tritonx-100的結果為100%計算分析細菌細胞膜的透過率。結果如表6所示。表6由表6可知,較陰性對照和空白對照,實驗組的熒光od值明顯較高,其細胞的通透性均較強;相對于陽性對照,20μg/ml的prosp-b重組蛋白對細菌細胞膜的通透能達到12.68%,進而破壞細胞內環境的破壞,從而影響其生長,所以prosp-b重組蛋白能通過改變細胞膜的通透性來影響細菌的生長情況。6、細胞膜外滲性實驗(1)將制備好的金黃色葡萄球菌菌懸液100μl依次加入到96孔板中,并在1~4中依次加入一定量的由實施例1中步驟(7)得到的prosp-b重組蛋白液,使其終濃度分別為20μg/ml、30μg/ml、60μg/ml、120μg/ml,在5~8中依次加入青霉素、tritonx-100、滅菌蒸餾水、prosp-b重組蛋白液,其中第8孔不加金黃色葡萄球菌,使其青霉素終濃度為50μg/ml,tritonx-100的終濃度為0.1%,prosp-b重組蛋白的終濃度為120μg/ml,最后加入一定量的lb培養基,保證每孔體積為200μl。(2)將96孔板放在生化培養箱中37℃培養12h,然后取出,按照ldh試劑盒說明書依次加入各試劑,室溫孵育5min。(3)然后取出,在多功能酶標儀上測定其在450nm處的od值。(4)以tritonx-100的結果為100%計算分析ldh的釋放率。結果如表7所示。表7由表7可知,在正常的細胞下,細胞內環境是穩定的,其胞內外物質保持相對的穩定,而在細胞膜受損傷的情況下,其細胞通過率明顯增加,胞內大分子物質會通過受損的細胞膜釋放出來,通過檢測細菌培養液可以間接說明細胞膜的通透性是否發生明顯改變。乳酸脫氫酶(ldh)是胞內的其中一種大分子物質,其檢測比較簡單,且他的外滲能直接反應出細胞內環境的改變,從而反應出細胞的生理狀態變化。由測定的結果可以看出,與陰性對照、空白對照相比,prosp-b重組蛋白處理作用后的金黃色葡萄球菌,其ldh外滲明顯增加,說明菌體的細胞膜通透性發生了增加;而與陽性對照相比,120μg/ml的prosp-b重組蛋白就能使細胞的ldh外滲率達到31%,進而影響細菌細胞的穩定,影響其生長,說明prosp-b重組蛋白能發揮改變細菌生理狀態的作用。總的來說,由以上實施例1-3的結果可以看出,本發明采用基因工程方法,特別是通過使用特定的表達載體(pgex4t-1)和表達宿主菌(大腸桿菌bl21(de3)plyss菌株),成功地獲得了濃度較高的prosp-b重組蛋白,并且,通過將pgex4t-1載體上的gst標簽與prosp-b融合,由于gst標簽具有親水性,可以明顯提高prosp-b重組蛋白的水溶性,擴大其應用范圍。另外,本發明提供的prosp-b重組蛋白表現出良好的廣譜抗菌活性,其對臨床上常見的細菌、真菌均具有較強的抑制作用,特別是對金黃色葡萄球菌、大腸桿菌、石膏樣小孢子菌、白色念珠菌、紅色毛癬菌、銅綠假單胞菌和耐甲氧西林金黃色葡萄球菌表現出明顯的抑制活性。進一步的研究發現,prosp-b重組蛋白發揮其抗菌作用的可能是通過影響細菌細胞膜的通透性,從而抑制細菌的正常生長。同時,本發明提供的prosp-b重組蛋白的細胞毒性較小,即使將蛋白濃度提高到1mg/ml(該濃度遠遠大于其對細菌的mic值),細胞的增殖能力依然高于59%,這說明本發明提供的prosp-b重組蛋白具有較高的安全性。以上詳細描述了本發明的優選實施方式,但是,本發明并不限于此。在本發明的技術構思范圍內,可以對本發明的技術方案進行多種簡單變型,包括各個技術特征以任何其它的合適方式進行組合,這些簡單變型和組合同樣應當視為本發明所公開的內容,均屬于本發明的保護范圍。sequencelisting<110>重慶理工大學<120>肺表面活性蛋白b前肽的重組蛋白及其制備方法和應用<130><160>4<170>patentinversion3.5<210>1<211>81<212>prt<213>artificialsequence<220><223>thesequenceissynthesized<400>1alaglyalaasnaspleucysglnglucysgluaspilevalhisleu151015leuthrlysmetthrlysgluaspalapheglnaspthrilearglys202530pheleugluglnglucysaspileleuproleulysleuleuvalpro354045argcysargglnvalleuaspvaltyrleuproleuvalileasptyr505560pheglnglyglnilelysprolysalailecysserhisvalglyleu65707580cys<210>2<211>243<212>dna<213>artificialsequence<220><223>thesequenceissynthesized<400>2gcaggagctaatgacctgtgccaagagtgtgaggatattgtccacctcctcacaaagatg60accaaggaagacgctttccaggacacgatccggaagttcctggaacaagaatgtgatatc120ctacccttgaagctgcttgtgccccggtgtcgccaagtgcttgatgtctacctgcccctg180gttatcgactacttccagggccagattaaacccaaagccatctgcagtcatgtgggcctg240tgc243<210>3<211>27<212>dna<213>artificialsequence<220><223>thesequenceissynthesized<400>3aaaggatccgcaggagctaatgacctg27<210>4<211>27<212>dna<213>artificialsequence<220><223>thesequenceissynthesized<400>4tttaagcttttagcacaggcccacatg27當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1