一種培養液的制作方法
本發明涉及干細胞領域,尤其涉及一種培養液。
背景技術:
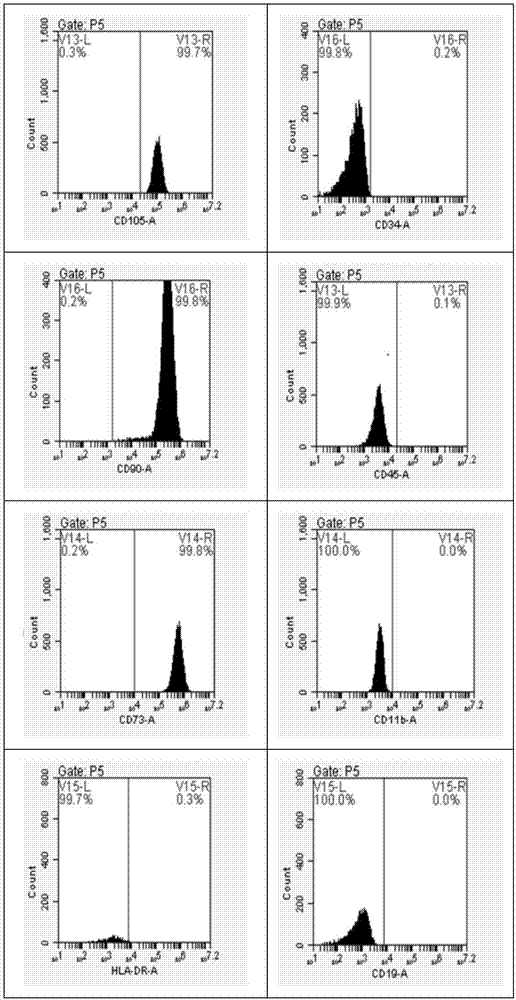
:隨著社會經濟的發展,生活水平的而提高以及人口老齡化現象,以軟骨面破壞為主要表現的骨關節炎等疾病的發病率日益增加。因此,如何微創修復損傷的軟骨,緩解病人的痛苦、提高生活質量長期以來就是骨科醫學領域研究的重點方向之一。骨關節炎是骨科臨床的常見疾病,由于退行性病變、創傷等造成的關節軟骨缺損,已成為導致殘廢、影響生活質量的重要原因。關節軟骨是一種無血管組織,軟骨細胞主要靠關節滑液及細胞周圍的基質供給營養以無氧酵解供能,其自身的修復能力很有限。關節軟骨一旦損傷,就會引起關節疼痛、不穩和僵硬,會加速關節的骨化,細胞外基質降解的速度大于新基質的合成,則遺留永久性病變,從而導致關節炎的發生。傳統的治療方法如軟骨下骨鉆孔術、軟骨移植、骨膜或軟骨膜移植、軟骨細胞移植等因修復組織以纖維軟骨為主,缺少正常透明軟骨的力學性能及耐用性,故不能取得滿意效果。應用組織工程方法修復關節軟骨缺損展示了令人鼓舞的前景。種子細胞是組織工程化軟骨形成的首要條件。間充質干細胞(mesenchymalstemcells,mscs)作為一種多潛能干細胞,因其成功避開了胚胎干細胞來源缺乏、異體排斥、倫理道德等諸多問題,近年來已成為干細胞領域的研究熱點。其不僅支持造血系統,還可向中胚層和外胚層來源的組織分化,在一定的實驗條件控制下可分化為肌細胞、成骨細胞、脂肪細胞、神經細胞、肝細胞、心肌細胞等。因此,mscs具有廣闊的臨床應用前景,是細胞替代治療和組織工程的首選種子細胞,是移植領域和自身性免疫疾病治療的研究熱點。近年來研究表明,mscs是一類來源于中胚葉的多潛能干細胞,具有自我更新和多向分化的能力,可作為種子細胞促進組織損傷的修復和再生。由于其組織來源廣泛,易于體外擴增、免疫原性低等優點,已逐漸成為組織工程和細胞移植最理想的種子細胞。目前,骨髓來源mscs是最常用的種子細胞,但其數量和分化潛能隨著年齡的增長顯著減少和降低,并且取材時易對供體造成身體傷害。因此,非常有必要尋找新的自體和異體移植的細胞來源。這種新的細胞除了必須具備比骨髓來源mscs有更強的增殖力和多向分化潛能的特點外,還必須取材便利,不易造成病毒污染,且不受倫理道德限制等。自mitchell等首次自臍帶中成功地分離出臍帶間充質干細胞(huc-mscs)并證實其多分化潛能后,對臍帶組織來源間充質干細胞的研究引起了廣泛關注,越來越多的研究集中到該領域中。從huc-mscs被發現至今,中外學者已經進行相當多的研究,其具有的低污染、來源充足、增殖旺盛等特點吸引了眾多的研究者。從臍帶中分離提取間充質干細胞的重要意義在于,臍帶作為分娩廢棄物,來源廣泛,取材方便,不受任何倫理及法理限制。mscs的分化與其生長的微環境有密切關系,因此,體外誘導mscs分化是通過采取不同的方法模擬體內相應組織細胞生長的真實環境和必要條件。傳統的治療方法如軟骨下骨鉆孔術、軟骨移植、骨膜或軟骨膜移植、軟骨細胞移植等因修復組織以纖維軟骨為主,缺少正常透明軟骨的力學性能及耐用性,故不能取得滿意效果。現有的huc-mscs成軟骨分化誘導液效果不佳,誘導分化的特異性不強。技術實現要素:有鑒于此,本發明的目的在于提供一種培養液,本發明提供的培養液能明顯提高huc-mscs向軟骨細胞的特異性分化。本發明提供了一種培養液,包含人軟骨細胞培養上清液和dmem培養液。優選的,所述人軟骨細胞培養上清液與dmem培養液的體積比為:0.5~1.5:1.5~1.5。優選的,所述人軟骨細胞培養上清液通過以下方法獲得:a)收集關節軟骨,依次經過清洗、剪碎、離心、過濾,得到細胞懸液;b)將細胞懸液接種后進行培養,細胞融合至覆蓋培養皿底80%以上時,進行消化、傳代,得到上清液粗品;c)將上清液粗品進行離心,取上清進行過濾、鏡檢,得到所述人軟骨細胞培養上清液。優選的,步驟a)所述過濾的篩網為180~220目。優選的,步驟b)所述接種的細胞密度為0.5~1.5×109/l。優選的,步驟c)所述過濾的濾器粒徑為0.2~0.24μm。優選的,所述dmem培養液包含轉化生長因子、地塞米松、l-抗壞血酸、itspremix和fbs。優選的,所述轉化生長因子為β1或者β2中的任意一種。優選的,所述dmem培養液為高糖型。優選的,上述培養液在體外誘導干細胞分化方面的應用。從以上技術方案可以看出,本發明實施例具有以下優點:本發明提供的一種培養液,本發明提供的培養液包含人軟骨細胞培養上清液和dmem培養液,其中人軟骨細胞培養上清液含有多種促huc-mscs向軟骨細胞特異性分化的細胞因子和有效成分。本發明提供的培養液能夠有效促進huc-mscs向軟骨細胞的特異性分化。附圖說明為了更清楚地說明本發明實施例或現有技術中的技術方案,下面將對實施例或現有技術描述中所需要使用的附圖作簡單地介紹,顯而易見地,下面描述中的附圖僅僅是本發明的一些實施例,對于本領域普通技術人員來講,在不付出創造性勞動性的前提下,還可以根據這些附圖獲得其它的附圖。圖1示細胞形態圖(光鏡下的huc-mscs(100×))圖2示huc-mscs表面標志物流式檢測結果示意圖圖3示番紅o-快綠染色和ii型膠原免疫組化結果示意圖圖4示ⅱ型膠原(col-2)表達水平比較示意圖圖5示葡萄糖胺聚糖(gag)表達水平比較示意圖圖6示sox-9表達水平比較示意圖具體實施方式為使得本發明的發明目的、特征、優點能夠更加的明顯和易懂,下面將結合本發明實施例中的附圖,對本發明實施例中的技術方案進行清楚、完整地描述,顯然,下面所描述的實施例僅僅是本發明一部分實施例,而非全部的實施例。基于本發明中的實施例,本領域普通技術人員在沒有做出創造性勞動前提下所獲得的所有其它實施例,都屬于本發明保護的范圍。本發明提供了一種培養液,包含人軟骨細胞培養上清液和dmem培養液。本發明提供了一種培養液,包含人軟骨細胞培養上清液和dmem培養液。其中,所述人軟骨細胞培養上清液在本發明中的主要作用是促進huc-mscs向軟骨細胞的特異性分化。優選的,所述人軟骨細胞培養上清液與dmem培養液的體積比為:0.5~1.5:1.5~1.5,更優選的體積比為1:1。本發明提供的培養液,其中人軟骨細胞培養上清液優選通過以下方法獲得:首先,收集關節軟骨組織。所述關節軟骨組織來自多指切除手術的指關節。將關節軟骨組織收集于磷酸鹽緩沖液中,反復清洗剪碎。所述剪碎的組織塊的規格優選為lmm×1mm×1mm左右。將組織塊轉移至50ml無菌離心管中進行消化。所述消化的過程為加入消化液進行消化30min,所述消化液優選為0.05%ⅱ型膠原酶。消化后反復洗滌、離心。然后加入消化液依次進行水浴和過濾。所述水浴優選條件為37℃水浴中輕微振蕩消化3–4h。所述過濾的篩網優選為200目細胞篩網。過濾后將細胞懸液收集到50ml無菌離心管內。未消化完全的軟骨組織繼續進行消化。所述消化過程為加入消化液后置于37℃水浴中輕微振蕩消化1~2h,直至軟骨組織塊基本消失、溶液變渾濁為止。所述消化液優選為0.25%胰蛋白酶溶液。其次,收集消化后的細胞,進行計數。所述計數的數量優選為1×109/l。計數后將細胞接種于10cm培養中,每2天換液1次。當原代細胞融合并覆蓋皿底80%以上時,進行消化和傳代。所述消化過程使用的的消化液優選為0.25%胰蛋白酶,所述傳代的比例優選為1:2。最后,每隔48h收集細胞培養上清至50ml離心管進行離心。所述離心的條件優選為2000rpm/min離心10min。離心后在無菌條件下取上清液進行過濾。所述過濾的濾器粒徑優選為0.2~0.24μm,更優選為0.22μm。過濾后的上清液經鏡檢不含軟骨細胞,制得所述人軟骨細胞培養上清液,在-20℃冰箱中保存備用。在本發明中,所述dmem培養液的作用為細胞提供有效營養成分。優選的,所述dmem培養液包含轉化生長因子、地塞米松、l-抗壞血酸、its+premix和fbs。更為優選的,所述轉化生長因子為β1或者β2中的任意一種。優選的,所述dmem培養液為高糖型。本發明還提供了上述培養液在體外誘導干細胞分化方面的應用。本發明提供的一種培養液,本發明提供的培養液包含人軟骨細胞培養上清液和dmem培養液,其中人軟骨細胞培養上清液含有多種促huc-mscs向軟骨細胞特異性分化的細胞因子和有效成分。本發明提供的培養液能夠有效增加ii型膠原合成量,促進huc-mscs向軟骨細胞的特異性分化。為了更清楚起見,下面通過以下實施例進行詳細說明。實施例1臍帶間充質干細胞培養(1)臍帶間充質干細胞的分離①臍帶取自健康產婦(乙肝、丙肝、hiv、支原體、梅毒等血清學檢查均為陰性),將臍帶置于含有100u/ml青霉素和100u/ml鏈霉素的pbs中漂洗2次,加入預冷的75%酒精,浸泡1-2min,期間不停翻動臍帶;②加入pbs漂洗2次洗去酒精。用組織剪將臍帶剪成2mm左右的小段,每段用眼科剪縱向開,用血管鉗去除臍帶內三根血管(兩條動脈,一條靜脈),同時去除臍帶外膜;將分離好的臍帶用眼科剪剪成約1mm3大小的組織塊,取適量放入直徑為10cm的無菌培養皿中,覆蓋70%培養皿的底面積。③加入lonza人干細胞無血清培養液(lonzaultraculturetm),5%co2、37℃、飽和濕度為95%的co2培養箱中培養。第5~7天半量換培養基,繼續培養12~14天左右全量換液去掉組織塊,同時收集細胞傳代培養。(2)細胞形態觀察在顯微鏡下觀察細胞形態,如圖1所示。從圖1中可以看出huc-mscs生長旺盛,邊界光滑,呈現巢狀生長,集落大多呈多角形或梭形,集落內細胞排列緊密,胞漿較豐富,細胞核大,核仁大。(3)細胞表面抗原檢測取第3代對數生長期細胞,細胞分離液消化,流式細胞術檢測表面抗原cd105、cd73、cd90、cd34、cd45、cd11b、cd19、hla-dr表達情況,cell-quest軟件分析結果。每個樣本分析6000~8000個細胞。表1huc-mscs細胞表面標志物表達率細胞表型cd105cd90cd73hla-drcd34cd45cd11bcd19陽性表達率(%)99.7099.8099.800.300.200.100.000.00如表1,圖2所示,經流式細胞術檢測,第3代huc-mscs高表達cd105、cd73和cd90,低表達或不表達hla-dr、cd19、cd11b、cd45和cd34等標記物。結果表明huc-mscs與其他來源的mscs基本相同。實施例2(1)取實施例1中培養得到的第3代huc-mscs,按5×105cell/管接種于15ml離心管內,1000rpm離心5min,使細胞成團聚集在離心管底部,管蓋擰松一半,放入37℃,5%co2培養箱靜置培養。(2)24h后吸棄舊液,更換1ml陰性對照組培養基:含10%fbs的高糖dmem培養液。輕彈離心管使細胞團漂浮,管蓋擰松一半,放入37℃,5%co2培養箱靜置培養。(3)培養21d后對細胞進行石蠟切片、番紅o-快綠染色及ii型膠原免疫組化等實驗。(4)番紅o-快綠染色實驗結果如圖3所示,細胞切片無著色。ii型膠原免疫組化實驗結果顯示無ii型膠原形成。實施例3(1)取實施例1中培養得到的第3代huc-mscs,按5×105cell/管接種于15ml離心管內,1000rpm離心5min,使細胞成團聚集在離心管底部,管蓋擰松一半,放入37℃,5%co2培養箱靜置培養。(2)24h后吸棄舊液,更換1ml陽性對照組成軟骨誘導液:含10μg/l轉化生長因子β1、10-7mol/l地塞米松、100μmol/ll-抗壞血酸、1%itspremix,10%fbs的高糖dmem培養液。輕彈離心管使細胞團漂浮,管蓋擰松一半,放入37℃,5%co2培養箱靜置培養。(3)誘導分化培養21d后對細胞進行石蠟切片、番紅o-快綠染色及ii型膠原免疫組化等實驗。(4)番紅o-快綠染色實驗結果如圖3所示,細胞切片有著色,但著色區域較小,ii型膠原免疫組化實驗結果顯示有ii型膠原形成。實施例4(1)取實施例1中培養得到的第3代huc-mscs,按5×105cell/管接種于15ml離心管內,1000rpm離心5min,使細胞成團聚集在離心管底部,管蓋擰松一半,放入37℃,5%co2培養箱靜置培養。(2)24h后吸棄舊液,更換1ml實驗組成軟骨誘導液:由50%含10μg/l轉化生長因子β1、10-7mol/l地塞米松、100μmol/ll-抗壞血酸、1%itspremix,10%fbs的高糖dmem培養液,50%人軟骨細胞培養上清混合而成的誘導分化培養基。輕彈離心管使細胞團漂浮,管蓋擰松一半,放入37℃,5%co2培養箱靜置培養。(3)誘導分化培養21d后對細胞進行石蠟切片、番紅o-快綠染色及ii型膠原免疫組化等實驗。(4)番紅o-快綠染色實驗結果如圖3所示,細胞切片有著色,著色區域明顯大于對比例2,ii型膠原免疫組化實驗結果顯示有ii型膠原合成,ii型膠原合成量明顯多于對比例2。實施例5培養液誘導效果評價根據ⅱ型膠原(col-2)、葡萄糖胺聚糖(gag)和sox-9基因的表達結果進行評定。實驗檢測過程按照實施例2、實施例3和實施例4的操作方法對huc-mscs進行培養或成軟骨分化誘導,連續誘導培養21d后對細胞進行ⅱ型膠原(col-2)、葡萄糖胺聚糖(gag)和sox-9基因的表達檢測。按照trizol試劑盒說明書進行細胞總rna提取;m-mlv反轉錄試劑盒獲得cdna。按照sybrgreen定量pcr試劑盒說明書對ⅱ型膠原(col-2)、葡萄糖胺聚糖(gag)和sox-9基因表達水平進行檢測。以gapdh作為內參基因。使用的引物如表2所示。以2-△△ct法進行定量分析。表2引物序列表實驗結果如圖4、5、6所示,細胞誘導培養21d后,實施例3、實施例4與實施例2(陰性對照組)比較,成軟骨分化細胞標志性基因ⅱ型膠原(col-2)、葡萄糖胺聚糖(gag)和sox-9基因表達水平均有極顯著性差異(**,p<0.01),實施例4與實施例3有顯著性差異(*,p<0.05)。根據實驗結果可以說明本發明提供的培養液能有效促進huc-mscs向軟骨細胞的特異性分化。以上所述,以上實施例僅用以說明本發明的技術方案,而非對其限制;盡管參照前述實施例對本發明進行了詳細的說明,本領域的普通技術人員應當理解:其依然可以對前述各實施例所記載的技術方案進行修改,或者對其中部分技術特征進行等同替換;而這些修改或者替換,并不使相應技術方案的本質脫離本發明各實施例技術方案的精神和范圍。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1