新型氟化的芳香類聚酰胺基因轉染試劑其制備方法及應用與流程
本發明屬于生物材料技術領域,具體地說,涉及一種新型氟化的芳香類聚酰胺基因轉染試劑其制備方法及應用。
背景技術:
基因治療成為現在臨床應用的一種方法,即將特定的基因材料轉入到特定的細胞進而治療各種慢性疾病和遺傳病。常用于基因治療的載體有兩種,病毒性載體和非病毒性載體。目前,由于病毒性載體具有低免疫原性,潛在的傳染性及致瘤性等一系列的嚴重缺陷,在應用上存在一定的局限性。因此,非病毒基因轉染載體的研究成為熱點,在這些非病毒基因轉染載體中,人工合成的聚陽離子高分子由于其較低的免疫原性,可修飾性,高負載量,易規模化生產等優點而被廣泛應用。但是陽離子高分子的轉染效率和分子量成正比,毒性和分子量成反比。也就是說高分子載體的分子量越高,電荷密度就越大,其相應的細胞毒性顯著增加,因此限制了高分子量載體的使用,以及轉染效率的進一步提高。
現有技術中急需一種新型氟化的芳香類聚酰胺基因轉染試劑其制備方法及應用。
技術實現要素:
本發明的目的在于為了克服現有技術中存在的缺陷,和降低各種新型陽離子高分子基因載體的成本,提供一種新型氟化的芳香類聚酰胺基因轉染試劑其制備方法及應用。對現有的低成本的基因載體進行改性,合成出一種新型的中性基因轉染試劑,在大幅度提高基因轉染效率的同時,細胞毒性得以顯著降低。
其具體技術方案為:
一種新型氟化的芳香類聚酰胺基因轉染試劑,其分子式為:((c2h4nco(c6r1r2r3r4)m(c6r5r6r7r8r9))n。
一種本發明所述新型氟化的芳香類聚酰胺基因轉染試劑的制備方法,包括以下步驟:
分子量為25kda的枝狀聚乙烯亞胺與芳香類含氟酸酐在摩爾比為1∶1的情況下,于甲醇溶液中反應48小時之后;分別在室溫條件下,于pbs緩沖溶液和蒸餾水中透析48小時,經過-80℃過夜,冷凍干燥后,即獲得白色絮狀的新型氟化的芳香類聚酰胺基因轉染試劑。
進一步,所述獲得白色絮狀的新型氟化的芳香類聚酰胺基因轉染試劑包括pa1(polyamide1)和pa2(polyamide2),pa1與pa2的差別在于后者芳香族基團的替代度高于前者。
本發明所述新型氟化的芳香類聚酰胺基因轉染試劑在體外的原代細胞和難轉染神經細胞也能得到比較好的效果。
與現有技術相比,本發明的有益效果為:
本發明采用中性高分子來避免陽離子聚合物的細胞毒性,這是因為中性高分子由于不帶電荷,在體內和體外實驗中,都不會和帶負電荷的大部分生物分子產生靜電結合而發生聚集,從而保持其結構和負載蛋白的穩定性。而陽離子高分子在基因傳遞過程中體積會逐漸增大,當達到微米級的時候,相對于納米尺寸的載體,更難以通過各種生理屏障到達細胞核進行基因傳遞,這是其基因轉染效率較低的一個主要原因。本發明設計的這些中性高分子在酸度較低的細胞溶酶體或者內涵體中可以自發水解,形成母體聚乙烯亞胺,同時實施海綿質子效應,幫助負載的蛋白逃逸和避免被降解,從而增加了基因轉染效率。
附圖說明
圖1為本發明新型氟化的芳香類聚酰胺基因轉染試劑的結構式;
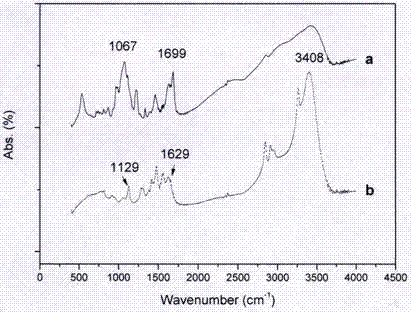
圖2為聚酰胺(a)和聚乙烯亞胺的(b)紅外光譜分析;
圖3為聚酰胺/蛋白質尺寸隨兩者摩爾比的變化關系;
圖4為在聚酰胺/pbs中逐滴加入0.1m的hcl,溶液酸度的變化;
圖5為在聚酰胺的pbs溶液中逐滴加入0.1m的hcl后電位的變化;
圖6為基因載體的轉染效率對比,其中圖6a為樹枝狀的pei,圖6b為pa1,圖6c為pa2;
圖7為基因載體的轉染效率比較;
圖8為基因載體的毒性分析。
具體實施方式
下面結合附圖和具體實施例對本發明的技術方案作進一步詳細地說明。
新型氟化的芳香類聚酰胺基因轉染試劑的結構式如圖1所示。
實施例1新型轉染試劑的理化表征
物理和化學性能分析:經過對合成的高分子納米材料進行紅外光譜分析,聚乙烯亞胺經過和芳香族酸酐的縮合反應,生成的酰胺官能團在1699和1607cm-1出現特征吸收峰(圖2)。
聚酰胺和蛋白絡合之后,尺寸從10-20納米增加到200-250納米左右,隨著聚酰胺比例的增加,復合物的大小有逐漸變小,提示了聚合物和蛋白絡合過程中構型發生了變化(圖3)。
由于在基因轉染實驗中,聚酰胺/蛋白復合物是溶解在pbs溶液中的,所以如果假設聚酰胺在低酸度的內涵體中會發生水解,生成聚乙烯亞胺,我們做了一個水解實驗來驗證。首先我們在聚酰胺的pbs溶液中逐滴加入0.1m的鹽酸,測試酸度的變化,發現由于pbs的緩沖效應,酸度變化比較小(圖4),然而電位出現了比較大的變化,從聚酰胺的接近于零的電位上升到16毫安,顯示了聚酰胺的化學結構很有可能發生了改變,從中性狀態水解變成了帶正電荷的聚乙烯亞胺(圖5)。
轉染效率和細胞毒性分析
檢測egfp的表達:實驗采用帶有綠色熒光標簽的egfp質粒,將合成的新型轉染試劑轉入hek293細胞,以樹枝狀聚乙烯亞胺作為對照,檢測其轉染效率。發現經過聚酰胺的轉染效率比樹枝狀的pei轉染效率要高(圖6)。對其進行定量分析,通過luciferase實驗,再次證實聚酰胺相比沒有修飾的pei,其轉染效率明顯增加(圖7)。
如圖8所示,通過mtt細胞毒性分析實驗,對新型轉染試劑進行毒性檢測,發現其細胞毒性相比及商業上常用的轉染試劑pei和質粒有輕微程度較低,由此說明聚酰胺的細胞毒性比較小。
實施例2合成方法
分子量為25kda的樹枝狀聚乙烯亞胺與芳香類含氟酸酐在摩爾比為1∶1的情況下,于甲醇溶液中反應48小時之后;分別在室溫條件下,于pbs緩沖溶液和蒸餾水中透析48小時,經過-80℃過夜,冷凍干燥后,即獲得白色絮狀的枝狀芳香族聚酰胺化合物pa1(polyamide1)和pa2(polyamide2)。pa1與pa2的差別在于后者芳香族基團的替代度高于前者。
實施例3激光散射實驗
檢測轉染試劑與dna結合之后的尺寸與電勢的變化情況。其方法與前面方法一致,分別在n/p值3.8、7.5、15、30的情況下,檢測新型轉染載體pa1、pa2與dna在pbs緩沖溶液中結合30分鐘之后的尺寸和電位如何變化的。
實施例4水解實驗
通過配置一定濃度的枝狀芳香族聚酰胺pa1、pa2的pbs溶液,逐滴加入0.1m的鹽酸,紀錄產物酸度和電位隨時間的變化曲線。
實施例5透射電鏡
通過配置一定濃度的枝狀芳香族聚酰胺/dna復合物溶液,滴一滴在電鏡銅網上,在室溫下真空干燥,然后在電鏡下觀察復合物大小。
實施例6基因轉染
設計不同的濃度梯度,即n/p值分別在3.8、7.5、15、30情況下,檢測轉染試劑在不同濃度下的轉染效率,從而篩選出每種轉染試劑最優化的轉染條件。本實驗是將hek293細胞平鋪6孔板中,每孔細胞數大約為7×104,于37℃和5%co2培養箱中培養24小時,枝狀芳香族聚酰胺與dna的結合體系含2μg的質粒(pegfp),在將枝狀芳香族聚酰胺/dna復合物加入到細胞之前,現將兩者在200μl的dmem中結合20分鐘,于37℃和5%co2培養箱培養48小時,在熒光顯微鏡觀測綠色熒光蛋白(gfp)的表達,轉染效率=綠色熒光的細胞數目/總的細胞數目×100%。
實施例7熒光報告實驗
通過熒光報告實驗,對基因轉染效率進行定量分析。本實驗是將hek293細胞平鋪24孔板中,每孔細胞數為4×104個,培養24小時,在200μl的dmem中加入0.5μg的pluc熒光素酶表達質粒及最適劑量的枝狀芳香族聚酰胺,室溫下結合15-20分鐘,加入細胞中,培養48小時后,檢測熒光素酶的相對活性,25kda枝狀pei/dna(pluc)作為對照。
實施例8mtt實驗
通過mtt細胞增殖實驗,分析新型轉染試劑對hek293細胞的毒性。將hek293細胞平鋪96孔板中,每孔細胞數為5000個,于37℃和5%co2培養箱培養24小時,pei/dna復合物(n/p的摩爾比為3.8、7.5、15、30)于dmem溶液中結合15-20分鐘之后加入96孔細胞培養板中,培養箱中培養48小時,將原培養基棄掉,按培養基/mtt(5mg/ml)10∶1的比例混合均勻加入新的培養基,孵育4小時之后,棄培養基,每孔加入150μl的dmso溶液,振蕩15分鐘,酶標儀檢測。細胞活性率=樣本檢測的od值/對照樣品的od值×100%。
實施例9細胞凋亡分析
分別將25kda枝狀pei與枝狀芳香族聚酰胺pa1、pa2在最優化的轉染條件下,與pegfp質粒dna結合后轉染hek293細胞,24小時后收集、裂解細胞,提取總蛋白,利用western印跡實驗檢測凋亡標志物-parp裂解產物(cleavedparp)的表達水平。parp裂解產物水平越高反映轉染試劑的毒性越高。
以上所述,僅為本發明較佳的具體實施方式,本發明的保護范圍不限于此,任何熟悉本技術領域的技術人員在本發明披露的技術范圍內,可顯而易見地得到的技術方案的簡單變化或等效替換均落入本發明的保護范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!