基于核酸適配體特異性檢測磺胺嘧啶的生物傳感探針試劑盒及其應用的制作方法
本發明屬于生物學與食品安全分析領域,具體涉及一種磺胺嘧啶殘留的生物傳感探針及其檢測試劑盒制備方法和應用。
技術背景
獸藥濫用和違禁使用的現象愈演愈烈,其殘留不僅直接影響人類的身體健康(致癌、致畸、致敏、神經毒性),誘導某些菌種產生耐藥性,給人類生態環境造成嚴重的危害。磺胺嘧啶(sulfadiazine,sdz)是人工合成的廣譜抗菌藥物,對大多數革蘭氏陽性菌和陰性菌有抑制作用。由于該類藥物對于動物疾病的預防、治療具有較好的效果,因而在畜牧業生產中被廣泛應用。sdz抗生素的不合理使用而導致其在動物源性食品中殘留,通過食物鏈進入人體,對人體產生一定的毒副作用,具有潛在的致癌性。為了保障動物用藥安全性和有效性,以及人類攝食動物性食品后的安全性,很多國家制定了抗生素的最高殘留限量(maximumresiduelimit,mrl)。加拿大、美國、歐盟規定了動物源性食品中磺胺類抗生素總量的最大殘留量為0.1mg/kg。我國規定動物性食品中sdz的mrls為0.1mg/kg。因此,為了提高動物源食品的安全性,建立高靈敏、高選擇的磺胺類抗生素檢測方法迫在眉睫。
常規檢測sdz殘留的方法有高效液相-質譜聯用、氣相色譜-質譜聯用、薄層色譜法和毛細管電泳法,這些儀器檢測方法雖然準確,但樣品前處理繁瑣、試劑消耗量大、檢測時間長、設備昂貴、需專業技術人員進行操作、不適合進行現場快速檢測和大量樣品的篩選,難以滿足高通量多殘留快速檢測的需要。基于抗原-抗體特異性反應的免疫分析方法,由于靈敏度高、操作簡便、成本低且適合現場快速檢測而越來越受到重視。但針對sdz靶標的抗體需要一系列繁瑣復雜的動物體內篩選過程,實驗周期長,成本高,同時抗體容易變性,對檢測環境的要求很高。抗體的制備過程不僅需要使用實驗動物,且制備出的抗體很難被重復生產,批間差異明顯。因此,亟需開發靈敏、特異、快速的新型靶標識別元件用于磺胺類等抗生素的檢測。
適配體(aptamer)作為一種抗體的替代物,由于其具有靶標范圍廣,親和力強,結合強度高,特異性好,制備、修飾方便快速等優點,為抗生素等靶標的特異性檢測開辟了新的途經。適配體是一類在體外通過指數級富集的配體系統進化技術(selex)篩選出的能與各種目標分子高親和、高特異結合的單鏈dna或rna片段,可以通過自身折疊形成二級或三級結構使其對特定靶標(如金屬離子、小分子、蛋白、細胞等)有很強的親和力,作為分子識別的元件,而廣泛應用于醫學臨床診斷和治療。在農產品及食品質量安全領域,已篩選到了針對真菌毒素、重金屬離子、農藥殘留、獸藥殘留等污染物的適配體,建立了基于核酸適配體的檢測方法。
經過對現有技術的檢索發現,倪娟佳在《學位論文》公開了“恩諾沙星和磺胺二甲嘧啶核酸適配體的篩選及化學發光檢測方法的研究”,篩選出能特異性識別sdz的核酸適配體,并分別建立了用于牛奶中磺胺二甲嘧啶殘留檢測的直接競爭化學發光分析方法。結果:其對磺胺二甲嘧啶檢測限為0.92ng/ml,ic50為5.61ng/ml,線性范圍為1.85-21.57ng/ml。該檢測限明顯低于目前國家限定的sdz殘留量。但該適配體特異性高,sdz沒有交叉反應。并且該基于適配體的檢測方法主要是針對比較簡單生物基質的檢測,而雞肉、雞蛋等復雜基質成分的動物源性食品中若富含鹽離子(na+或k+),將可能顯著改變反應體系的離子濃度,使得該核酸適配體無法折疊成正確構型,將直接導致核酸適配體無法與靶標結合,從而導致檢測方法的失敗。使得上述化學發光適配體分析方法應用于動物源性食品臨床樣品檢測時受到了極大限制。
本發明篩選到可以與sdz高親和力結合的單鏈dna核酸適配體(aptamer)序列,建立了基于納米生物素(biotin)化sdz適配體傳感探針(biotin-sdzaptamer)識別的熒光檢測方法(檢測方法原理見圖1),可用于動物源性食品中sdz殘留的快速、高靈敏度檢測,在臨床檢測中具有十分重要意義。
技術實現要素:
本發明目的:本發明針對現有技術存在的上述不足,提出一種基于核酸適配體特異性檢測sdz殘留的生物傳感探針及其檢測試劑盒制備方法和應用。鑒于sdz分子的結構特點,設計了改良的瓊脂糖磁珠selex技術優選sdz的方法,借助基于selex的組合化學技術,篩選得到能特異性識別sdz靶標的dna適配體,其特征在于,所述適配體的核苷酸序列如s-sdzno.1所示。將sdz核酸適配體(sdzaptamer)通過納米生物素(biotin)粒子固定于其表面,以biotin-核酸適配體為傳感識別探針(biotin-sdzaptamer),利用生物素-鏈霉親和素系統,固化適配體探針,競爭識別檢測樣品中sdz和辣根過氧化物(hrp)標記sdz(hrp-sdz)偶聯物,建立了用于sdz殘留檢測的直接競爭酶聯適體分析法(directcompetitiveenzyme-linkedaptamerassay,dc-elaa),方法的具體原理及應用見圖1。該適配體生物傳感方法,利用適配體傳感探針分別測試不同濃度靶標的標準品溶液,分析熒光增強比例與靶標物濃度之間的線性關系,優化影響探針識別性能的因子,進行探針對sdz靈敏特異間接測定。
該適配體是sdz的新型識別元件,具有穩定性良好、靈敏度高、成本低、易制備、易修飾和標記的高特異性的優勢。
本發明篩選到可以與sdz高親和力結合的單鏈dna適配體序列,首次建立一種dc-elaa傳感探針檢測雞肉、雞蛋等動物源性組織中的sdz抗生素。
一種基于核酸適配體特異性檢測sdz的生物傳感探針試劑盒,包括biotin標記sdz核苷酸適配體(biotin-sdzaptamer)稀釋液、sdz-hrp稀釋液、洗滌液和終止液;其特征在于所述biotin-sdzaptamer稀釋液包括探針;所述探針的核苷酸序列為s-sdzno.1。
5′-cgtacggtcgacgctagcttggccatcttggccgggataaggatccagccgttgtagatttgcggtagggaaacgtatcacgtggagctcggatcc-3′。
為實現上述目的,本發明的技術方案提供如下:
一種sdz的核酸適體,其探針中單鏈dna片段(如核苷酸序列表中s-sdzno.1所示),具體序列如下:5′-cgtacggtcgacgctagcttggccatcttggccgggataaggatccagccgttgtagatttgcggtagggaaacgtatcacgtggagctcggatcc-3′。
將上述單鏈dna片段進行修改或改造得到的核酸適體衍生物也屬于本發明的保護范圍。
所述biotin-sdzaptamer由單鏈dna組成,且3'末端或5'末端標標記有biotin。
所述的核酸適體衍生物為核苷酸序列上結合有biotin納米標記物。
所述探針由上述序列所示的單鏈dna組成,且5'末端標記有biotin或3'末端標記有biotin,所述biotin標記核酸適配體序如下:5′-biotin-cgtacggtcgacgctagcttggccatcttggccgggataaggatccagccgttgtagatttgcggtagggaaacgtatcacgtggagctcggatcc-3′或5′-biotin-cgtacggtcgacgctagcttggccatcttggccgggataaggatccagccgttgtagatttgcggtagggaaacgtatcacgtggagctcggatcc-biotin-3′。
本發明還提供了一種sdz的核酸適體的制備方法,包括如下步驟:
(1)將sdz、磺胺間甲氧嘧啶分別和羧基瓊脂糖磁珠偶聯
分別將sdz、磺胺間甲氧嘧啶經活化氨基后,取羧基瓊脂糖磁珠與活化的sdz、磺胺間甲氧嘧啶溶液混合,進行偶聯反應;獲得sdz、磺胺間甲氧嘧啶修飾的瓊脂糖磁珠偶聯物。
(2)單鏈dna文庫與相應引物
隨機文庫為全長96bp的單鏈dna文庫(核苷酸序列表s-sdzno.2):5′-cgtacggtcgacgctagc–n60-cacgtggagctcggatcc-3′,n60為60個堿基的隨機序列;上游引物(核苷酸序列表s-sdzno.3)為5′-cgtacggtcgacgctagc-3′,下游引物(核苷酸序列表s-sdzno.4)為5′-cacgtggagctcggatcc-3′。
(3)selex篩選sdz核酸適體的過程
①文庫的變性:將溶解的上述ssdna文庫置于95℃水浴中放置10-20min;
②反篩:取磺胺間甲氧嘧啶修飾的瓊脂糖磁珠,與變性的文庫混合,室溫孵育,反應完畢,離心,保留上層清液,得到反篩未結合文庫;并且第一輪不做反篩;
③正篩:取sdz修飾的瓊脂糖磁珠加入上一步驟得到的反篩未結合文庫,在室溫孵育,反應完畢,離心并棄去上層清液,得到正篩未結合文庫;
④洗提結合dna:將上一步驟得到的正篩未結合文庫用naoh洗提6次;
⑤純化洗提的dna:用nap-5寡核苷酸純化柱子對naoh洗提液進行回收純化,以去除naoh及其他雜質,得到的篩選產物dna溶液即為篩選一輪的適體,一輪篩選完畢;
⑥以篩選適體dna為模板,通過對稱pcr、鏈酶親和素瓊脂糖珠等技術獲得大量的dna,為下一輪篩選做準備;
⑦重復上述步驟1-6,共篩選7輪;
(4)克隆測序
利用第7輪篩選產物通過無標記的上、下游引物進行pcr擴增,然后將pcr產物進行克隆,并隨機挑選若干個克隆進行測序;最終選擇的核酸適體為上述的核酸適體。
本發明還提供了一種含有上述核酸適體或上述核酸探針的dc-elaa方法試劑盒。
本發明提供的核酸適體、核酸探針、或含有上述核酸適體、上述核酸探針dc-elaa試劑盒的應用如下:
(1)鑒定雞肉、雞蛋樣品中是否存在sdz;
(2)測定雞肉、雞蛋樣品中sdz的濃度。
本發明還提供了一種檢測雞肉、雞蛋樣品中sdz含量的dc-elaa試劑盒,包括如下應用操作程序:
(1)平衡:從冷藏環境中取出的試劑及樣品,應于室溫(20-25℃)平衡約30min。
(2)配液:將pbs濃縮洗滌液用超純水作20倍稀釋成工作濃度洗滌液。
(3)準備酶標板:取96孔包被sav酶標板,預設置空白、陰性、陽性對照各2孔。酶標板包被方法:取鏈霉親和素(sav)溶解于pbs中,37℃放置1小時。加入戊二酸溶液,混勻。4℃放置2小時,將反應液全量加至處理好的透析袋中,透析。將透析好的鏈霉親和素戊二酸復合物用包被緩沖液液稀釋1mg/ml,取稀釋好的鏈霉親和素戊二酸復合物加至酶標板,每孔200μl,混勻,37℃包被過夜。包被酶標板洗滌4次后備用。
(4)加樣:將預處理25μlbiotin-sdzaptamer探針、25μlsdz-hrp、50μl不同濃度sdz標準品混合均勻,37℃孵化60min,然后加入到洗滌后的酶標板的凹槽。37℃孵化45min。
(5)洗板:棄去反應液,洗滌3次,拍干。
(6)加底物:每孔再加入顯色劑a1和a2各100ml避光顯色30min。
(7)洗板:棄去反應液,洗滌3次,拍干。
(8)終止:每孔加50μl終止液,混勻。
(9)測定:10分鐘內以酶標儀450nm雙波長測定各孔od值,繪制濃度-吸光度標準曲。
測試待檢樣品過程,重復上述步驟(1)-(9):將預處理25μlbiotin-sdzaptamer探針、25μlsdz-hrp、50μl待測組織處理樣品混合均勻,37℃孵化60min,然后加入到洗滌后的酶標板的凹槽。37℃孵化45min后,棄去反應液,洗滌3次,拍干后每孔再加入顯色劑a1和a2各100ml避光顯色30min,反應后,用酶標儀測溶液吸光度,與標準曲線比較,得到待測試樣中sdz的含量。
其中:所述sdz檢測試劑盒由如下組分構成:鏈霉親和素sav包被96孔或48孔酶標板1塊,陰性對照1瓶,陽性對照1瓶,樣品稀釋液1瓶,biotin-sdzaptamer稀釋液1瓶,sdz-hrp稀釋液1瓶,洗滌液1瓶,顯色劑a1瓶,顯色劑a2瓶,終止液1瓶,說明書1份,不干膠封片3片。
上述酶標板為透明聚苯乙烯96或48孔酶標板,且其各孔包被有濃度為1μg/ml的包被sav,包被緩沖液為ph4.7~4.9磷酸鹽緩沖液稀釋;biotin-sdzaptamer稀釋液為標記上了biotin的sdz核苷酸序列的溶液;sdz-hrp稀釋液為做了相適稀釋的sdz-hrp;顯色體系為3,3,5,5-四甲基聯苯胺(tmb)體系。陰性對照為sdz標準品,濃度為100ng/ml;陽性對照為100ng/ml磺胺間甲氧嘧啶。
本發明的有益技術效果是:本發明提供的試劑盒及方法具有檢測快速、穩定、簡單等優點,制得的核酸適體對sdz殘留檢測快速、靈敏度高、重復性好,特異性高,在食品安全快速檢測中有廣闊應用前景。
附圖說明
圖1:檢測sdz殘留的biotin-sdzaptamer探針試劑盒及其應用原理;
圖2:sdzaptamer的特異性分析;
圖3:利用不同濃度標準品所繪制dc-elaa標準曲線圖;
其中,圖1中,aptamer的中文意思是適配體,biotin的中文意思是生物素,sulfadiazine(sdz)的中文意思是磺胺嘧啶,feed的中文意思是飼料喂養,injection的中文意思是注射治療。
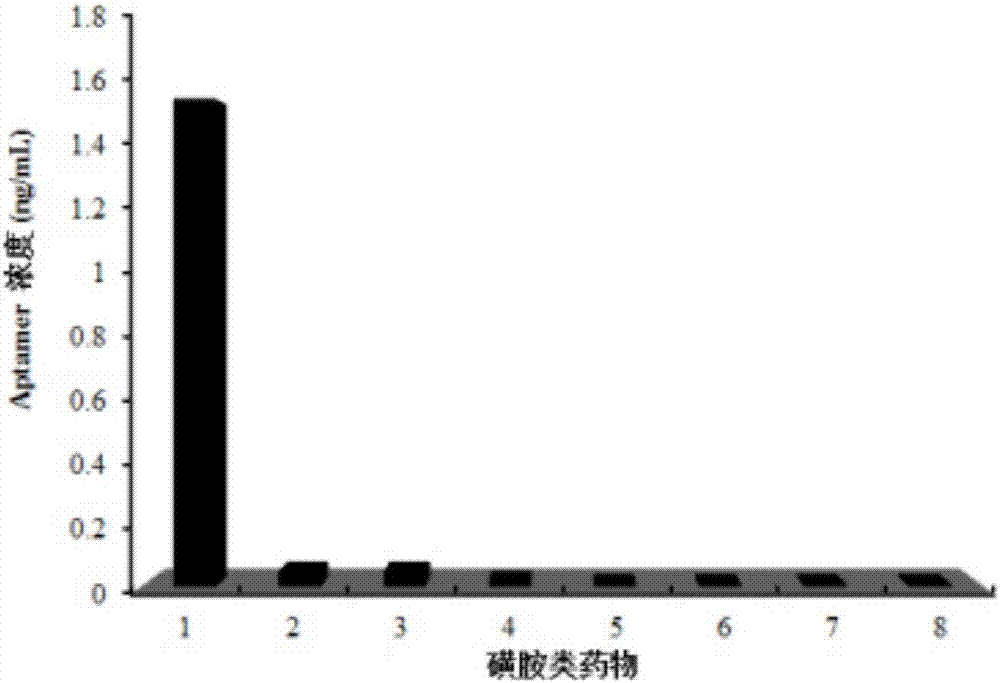
圖2中,1、sdz,2、磺胺間甲氧嘧啶,3、磺胺對甲氧嘧啶,4、磺胺二甲氧嘧啶,5、磺胺二甲嘧啶,6、磺胺喹噁啉,7、磺胺甲氧嗪,8、磺胺甲噁唑。
具體實施方式
實施例1制備sdz的核酸適體
(1)sdz和磺胺間甲氧嘧啶與瓊脂糖磁珠偶聯
取10mgsdz,首先溶于2ml的dmf中,待完全溶解后再加入2ml偶聯緩沖液,接著按順序在溶液中分別加入30mg的nhs(n-羥基硫代琥珀酰亞胺)和26mg的edc[1-乙基-(3-二甲基氨基丙基)碳酰二亞胺,再將nhs和edc完全溶解;溶液放置搖床中,4℃條件下反應15min,活化sdz中的氨基;2ml氨基瓊脂糖磁珠用偶聯緩沖液洗滌3次后和上述活化的sdz溶液混合,放置于搖床中室溫條件下反應2h;反應完畢,將反應物用酸堿交替的緩沖溶液洗滌5次,再用pbs洗5次,最后置于pbs中4℃保存;相同的方法用于磺胺間甲氧嘧啶和氨基瓊脂糖磁珠的偶聯反應;
偶聯緩沖溶液:磷酸鹽緩沖溶液(0.1mmol/lpbs,na2hpo4,8mmol/l;kh2po4,2mmo1/l;nacl,140mmol/l;kc1,10mmol/l;ph7.2);
酸性緩沖液:0.1m含0.5mnacl的乙酸-乙酸鈉緩沖液(ph=4.0);
堿性緩沖液:0.1m含0.5mnacl的硼酸-四硼酸鈉緩沖液(ph=8.0)。
(2)單鏈dna文庫與相應引物
隨機文庫為全長96bp的單鏈dna(ssdna)文庫(如核苷酸序列表s-sdzno.2):5′-cgtacggtcgacgctagc–n60-cacgtggagctcggatcc-3′,兩端各18個固定堿基序列,n60為60個堿基的隨機序列;上游引物為(核苷酸序列表s-sdzno.3)5′-cgtacggtcgacgctagc-3′,下游引物為(核苷酸序列表s-sdzno.4)5′-cacgtggagctcggatcc-3′;上游標記引物為5′-titf-cgtacggtcgacgctagc-3′,下游標記引物為5′-biotin-cacgtggagctcggatcc-3′。
(3)selex篩選sdz核酸適體的過程
①文庫的變性:將上述的ssdna文庫在離心機離心10min,然后加入0.5ml結合緩沖溶液(20mmol/ltris-hcl,100mmol/lnacl,2mmol/lmgcl2,5mmol/lkc1,0.02%tween20,lmg/ml酵母trna,ph7.6),于4℃放置2h使ssdna完全溶解;溶解的ssdna文庫置于95℃水浴中放置10min,然后拿到室溫自然冷卻;
②反篩:取一定量的磺胺間甲氧嘧啶修飾的瓊脂糖磁珠,用洗滌緩沖液(20mmol/ltris-hcl,100mmol/lnacl,2mmol/lmgcl2,5mmol/lkcl,0.02%tween20,ph7.6)洗三次;將上一步處理好的文庫和洗滌過的磺胺間甲氧嘧啶飾的瓊脂糖珠混合,室溫下在150rpm轉速的搖床中孵育50min;反應完畢,離心,保留上層清液,得到反篩未結合文庫;第一輪不做反篩;
③正篩:取一定量的sdz修飾的瓊脂糖珠,用洗滌緩沖液洗三次;然后在瓊脂糖磁珠中加入前一步驟得到的反篩未結合文庫,搖勻后在室溫下,160rpm轉速的搖床中孵50min;反應完畢,離心并棄去上層清液,得到正篩未結合文庫;
④洗提結合dna:用洗滌緩沖液洗滌正篩后的sdz修飾的瓊脂糖磁珠3次,便去除未結合的dna及結合能力弱的dna;洗滌每次加入0.5ml洗滌緩沖液,室溫搖動5min,然后離心,棄去上清;再用naoh洗提2次,每次加0.25ml的2mol/lnaoh,置于95℃水浴中l0min,然后離心保留上清;共得到洗提液0.5ml;
⑤純化洗提的dna:將洗提得到的含dna的naoh溶液加入到寡核苷酸純化柱子進行脫鹽,然后收集0.5-1.5ml之間的濾液;得到的篩選產物dna濾液即為篩選一輪的適體,一輪篩選完畢;
⑥以篩選產物dna為模板,通過對稱pcr、鏈酶親和素瓊脂糖磁珠等技術獲得大量的dna,為下一輪做準備;
⑦重復上述步驟1-6,進行反復的篩選,直至篩選完成。
通過7輪的篩選之后,文庫中能與sdz結合的dna已達到飽和。
(4)克隆測序
利用第7輪篩選產物通過無標記的上、下游引物進行pcr擴增,然后將pcr產物進行克隆,隨機挑選若干個克隆進行測序。
實施例2平衡解離常數的測定試驗
合成測序得到的核酸適配體,用熒光方法測定其平衡解離常數kd。將合成的5'-fam標記的核酸適體用結合緩沖液配置成不同濃度梯度溶液(0.05,0.1,0.2,0.4,0.8,0.16,0.32和0.64μmol/l)取10μlsdz修飾的瓊脂糖珠,將200μl不同濃度梯度的5'-fam標記的核酸適體和10μlsdz修飾的瓊脂糖珠混合,室溫孵育反應30min,離心分離棄去未結合dna;再將瓊脂糖磁珠用結合緩沖液洗滌3次,每次用200μl結合緩沖液;再在95℃用100μl的2mol/lnaoh溶液洗提和sdz結合的dna,洗提2次,共得200μl洗提液;將不同的洗提液稀釋相同的倍數,然后置于96孔黑色熒光測定板,用酶標儀測定熒光強度;熒光強度對核酸適體的濃度作圖,通過方程式y=bmaxx/(kd+x)擬合出sdz適配體的解離常數。實驗測定的kd結果發現,篩選得到的適配體與sdz的親和力較高,kd最低,為0.16μmol,擬合曲線的r2=0.9746,說明擬合良好。由sdz酸適體的kd值可知,sdz和核酸適體的結合能力較強。由于解離常數越低,親和力越高,因此,選擇該適配體進行下一步特異性研究。
實施例3適配體特異性試驗
取sdz、磺胺間甲氧嘧啶、磺胺對甲氧嘧啶、磺胺二甲氧嘧啶、磺胺二甲嘧啶、磺胺喹噁啉、磺胺甲氧嗪和磺胺甲噁唑標準儲備液,用結合緩沖液稀釋至終濃度5μmol/l。取5μg核酸適配體溶解于100μl結合緩沖液中,95℃變性再迅速置于冰上10min,然后置室溫5min。取配制好的上述sdz等標準品溶液100μl至預處理好的核酸適配體溶液中,37℃孵化30min。然后將上述混合溶液加入sdz-瓊脂糖磁珠偶聯物,37℃孵化30min。取出孵化后的上清,用nanodrop測定上清中的ssdna的濃度。參考組選用不含藥物的結合緩沖液與預處理好的核酸適配體孵育(操作同步驟上述),再將此孵化液加至dz-瓊脂糖磁珠偶聯物,37℃孵化30min。最后取出孵化后的上清,用nanodrop測定上清中的ssdna的濃度,每個實驗重復3次。
結果如圖2所示,適配體對sdz的特異性很高,對結構類似物(磺胺間甲氧嘧啶、磺胺對甲氧嘧啶、磺胺二甲氧嘧啶、磺胺二甲嘧啶、磺胺喹噁啉、磺胺甲氧嗪和磺胺甲噁唑)均無結合。將結果進行t檢驗,發現核酸適配體對于sdz的比值與其他7種藥物的比值的差異顯著(p<0.05,進一步證明了該結果的準確性。使用隨機文庫作為對照組,結果表明隨機文庫對這7種藥物均無結合。
實施例4基于sdz殘留dc-elaa檢測方法的建立
(1)取鏈霉親和素(sav)溶解于pbs中,37℃放置1小時。加入戊二酸溶液,混勻。4℃放置2小時,將反應液全量加至處理好的透析袋中,透析。將透析好的鏈霉親和素戊二酸復合物用包被緩沖液液稀釋1mg/ml,取稀釋好的鏈霉親和素戊二酸復合物加至酶標板,每孔200μl,混勻,37℃包被過夜。包被酶標板洗滌4次后備用。
(2)將預處理25μlbiotin-sdzaptamer探針、25μlsdz-hrp、50μl不同濃度的sdz溶液(用pbs將標準品稀釋成不同濃度:0,0.03,0.1,0.3,1,3,10,30和100μg/l)標準品混合均勻,37℃孵化60min,然后加入到洗滌后的酶標板的凹槽。37℃孵化45minn后,棄去反應液,洗滌3次,拍干后每孔再加入顯色劑a1和a2各100ml避光顯色30min,反應后,用酶標儀測溶液吸光度,繪制標準曲線;
(3)測試待檢樣品過程,重復上述步驟(2):將預處理25μlbiotin-sdzaptamer探針、25μlsdz-hrp、50μl待測組織處理樣品混合均勻,37℃孵化60min,然后加入到洗滌后的酶標板的凹槽。37℃孵化45min后,棄去反應液,洗滌3次,拍干后每孔再顯色劑a1和a2各100ml避光顯色30min,反應后,用酶標儀測溶液吸光度,與標準曲線比較,得到待測試樣中sdz的含量。
標準曲線如圖2所示。以不同濃度標準品與空白標準品相對光密度值的百分率(b/b0%)為縱坐標,以標準品不同濃度的常用對數值作為橫坐標,繪制檢測試紙條的標準曲線,求回歸方程,進行相關回歸分析,標準曲線結果見圖3。通過對檢測限值進行統計學分析,確定傳感探針的檢測限。通過計算得到最低檢測線為:0.12ng/ml,標準曲線靈敏度(ic50)為:3.2ng/ml。
實施例5基于sdz殘留檢測的biotin-sdzaptamer探針試劑盒的組裝
sdz檢測試劑盒的構成:鏈霉親和素sav包被96孔或48孔酶標板1塊,陰性對照1瓶,陽性對照1瓶,樣品稀釋液1瓶,biotin-sdzaptamer稀釋液1瓶,sdz-hrp稀釋液1瓶,洗滌液1瓶,顯色劑a1瓶,顯色劑a2瓶,終止液1瓶,說明書1份,不干膠封片3片。
上述酶標板為透明聚苯乙烯96或48孔酶標板,且其各孔包被有濃度為1μg/ml的包被sav,包被緩沖液為ph4.7~4.9磷酸鹽緩沖液稀釋;biotin-sdzaptamer稀釋液為標記上了biotin的sdz核苷酸序列的溶液;sdz-hrp稀釋液為做了相適稀釋的sdz-hrp;顯色體系為3,3,5,5-四甲基聯苯胺(tmb)體系。陰性對照為sdz標準品,濃度為100ng/ml;陽性對照為100ng/ml磺胺間甲氧嘧啶。
biotin-sdzaptamer的制備:biotin-sdzaptamer序列如下:5′-biotin-cgtacggtcgacgctagcttggccatcttggccgggataaggatccagccgttgtagatttgcggtagggaaacgtatcacgtggagctcggatcc-3′。以上biotin-sdzaptamer由重慶若豐生物科技有限公司合成。biotin-sdzaptamer使用濃度為20nm。
sdz-hrp稀釋液的配制:sdz-hrp由重慶師范大學食品質量與安全快速檢測協同創新中心制備,濃度為1:2000稀釋。
顯色劑a1為:檸檬酸鈉44.82克,檸檬酸3.2克,30%h2o20.6ml,超純水定容至1000ml。
顯色劑a2為:tmb0.4克,檸檬酸1.9克,乙二胺四乙酸鈉0.6g,丙三醇100ml,超純水定容至1000ml。
終止液:濃硫酸56ml,超純水定容至1000ml。
本發明的sdz檢測試劑盒的應用及操作程序:
本發明還提供了一種檢測雞肉、雞蛋樣品中sdz含量的dc-elaa試劑盒,包括如下應用操作程序:
(1)平衡:從冷藏環境中取出的試劑及樣品,應于室溫(20-25℃)平衡約30min。
(2)配液:將pbs濃縮洗滌液用超純水作20倍稀釋成工作濃度洗滌液。
(3)準備酶標板:取96孔包被sav酶標板,預設置空白、陰性、陽性對照各2孔。酶標板包被方法:取鏈霉親和素(sav)溶解于pbs中,37℃放置1小時。加入戊二酸溶液,混勻。4℃放置2小時,將反應液全量加至處理好的透析袋中,透析。將透析好的鏈霉親和素戊二酸復合物用包被緩沖液液稀釋1mg/ml,取稀釋好的鏈霉親和素戊二酸復合物加至酶標板,每孔200μl,混勻,37℃包被過夜。包被酶標板洗滌4次后備用。
(4)加樣:將預處理25μlbiotin-sdzaptamer探針、25μlsdz-hrp、50μl不同濃度sdz標準品混合均勻,37℃孵化30min,然后加入到洗滌后的酶標板的凹槽。37℃孵化45min。
(5)洗板:棄去反應液,洗滌3次,拍干。
(6)加底物:每孔再加入顯色劑a1和a2各100ml避光顯色30min。
(7)洗板:棄去反應液,洗滌3次,拍干。
(8)終止:每孔加50μl終止液,混勻。
(9)測定:10分鐘內以酶標儀450nm雙波長測定各孔od值,繪制濃度-吸光度標準曲。
實施例6試劑盒的特異性試驗
用sdz殘留檢測dc-elaa方法分別檢測系列濃度的sdz,并繪制競爭抑制標準曲線,根據標準曲線計算sdz的ic50值。同樣,計算其它磺胺類藥物(磺胺間甲氧嘧啶、磺胺對甲氧嘧啶、磺胺二甲氧嘧啶、磺胺二甲嘧啶、磺胺喹噁啉、磺胺甲氧嗪和磺胺甲噁唑)的ic50值。以sdz的交叉反應率為100%,計算與其它磺胺類藥物的交叉反應率。同時用sdz殘留檢測dc-elaa方法分別檢測濃度1000ng/ml的其它藥物,如磺胺間甲氧嘧啶、磺胺對甲氧嘧啶、磺胺二甲氧嘧啶、磺胺二甲基嘧啶、磺胺喹噁啉、磺胺甲氧嗪和磺胺甲噁唑。確定sdz殘留檢測dc-elaa方法的特異性。
根據標準曲線計算sdz的ic50值為3.2ng/ml。以磺胺間甲氧嘧啶的交叉反應率為100%,其它磺胺類藥物的交叉反應率見表1。
表1dc-elaa方法與磺胺類藥物的交叉反應率
結果表明dc-elaa方法與磺胺間甲氧嘧啶(0.8%)、磺胺對甲氧嘧啶(0.5)、磺胺二甲氧嘧啶(0.3)交叉反應率很低,與磺胺二甲基嘧啶、磺胺喹噁啉、磺胺甲氧嗪和磺胺甲噁唑的交叉反應<0.1%。說明dc-elaa方法具有好的特異性。
實施例7試劑盒添加回收試驗
向經高效液相色譜法檢測不含sdz的空白樣品(雞肉、雞肝和雞蛋)中,使其sdz含量分別為5ng/g、10ng/g、50ng/g,每個滴度設5個重復,樣品經預處理后,用dc-elaa檢測方法進行檢測,根據標準曲線計算sdz含量及其回收率。
結果見表2。結果表明,sdz在不同樣品中回收率在77.4-115.5%范圍內,變異系數均小于15%。
表2sdz在動物源性食品中的回收率
sequencelisting
<110>重慶師范大學
<120>基于核酸適配體特異性檢測磺胺嘧啶的生物傳感探針試劑盒及其應用
<130>
<160>4
<170>patentinversion3.3
<210>1
<211>96
<212>dna
<213>s-sdzno.1
<220>
<221>misc_feature
<400>1
cgtacggtcgacgctagcttggccatcttggccgggataaggatccagccgttgtagatt60
tgcggtagggaaacgtatcacgtggagctcggatcc96
<210>2
<211>96
<212>dna
<213>s-sdzno.2
<220>
<221>misc_feature
<222>(19)..(53)
<223>nisa,c,g,ort
<400>2
cgtacggtcgacgctagcnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn60
nnnnnnnnnnnnnnnnnncacgtggagctcggatcc96
<210>3
<211>18
<212>dna
<213>s-sdzno.3
<220>
<221>misc_feature
<400>3
cgtacggtcgacgctagc18
<210>4
<211>18
<212>dna
<213>s-sdzno.4
<220>
<221>misc_feature
<400>4
cacgtggagctcggatcc18
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種基于短鏈核酸探針和雙鏈特異性核酸內切酶的高特異性microRNA熒光檢測方法與流程
- IL?1?α和?β雙特異性雙重可變結構域免疫球蛋白及其用途的制造方法與工藝
- 一種特異性標記家蠶微孢子蟲的核酸探針及其原位熒光雜交檢測方法與流程
- 核酸的等位基因特異性擴增的制造方法與工藝
- 一種特異性檢測弓形蟲核酸的熒光PCR方法和試劑盒與流程
- 一種特異性檢測人類微小病毒B19核酸的熒光PCR方法和試劑盒與流程
- 一種特異性結合新城疫病毒的核酸適配體及其篩選方法和應用與流程
- 球形核酸納米顆粒綴合物的序列特異性細胞攝取的制造方法與工藝
- 一種鴨特異性CpG寡脫氧核苷酸及其應用的制造方法與工藝
- 一種IgE特異性核酸適配子、其應用及適配子藥物的制造方法與工藝
- 核酸的等位基因特異性擴增的制造方法與工藝
- 一種特異性檢測弓形蟲核酸的熒光PCR方法和試劑盒與流程
- 一種特異性檢測人類微小病毒B19核酸的熒光PCR方法和試劑盒與流程
- 一種特異性結合新城疫病毒的核酸適配體及其篩選方法和應用與流程
- 球形核酸納米顆粒綴合物的序列特異性細胞攝取的制造方法與工藝
- 一種IgE特異性核酸適配子、其應用及適配子藥物的制造方法與工藝
- 基于核酸適配體特異性檢測磺胺嘧啶的生物傳感探針試劑盒及其應用的制造方法與工藝
- 一種特異性結合CD3的核酸適配體及其篩選方法和應用與流程
- 一種特異性結合GPC3的核酸適配體及其應用的制造方法與工藝
- 基于高特異性核酸適體熒光探針INS1胰島素試劑盒及其檢測方法與制造工藝
- 一種舌癌細胞的核酸適配體及試劑盒的制造方法與工藝
- 金黃色葡萄球菌腸毒素C2的核酸適配體C203及其篩選方法和應用與制造工藝
- 胰島素核酸適體INS5及其制備方法與制造工藝
- 一種高親和力興奮劑核酸適體EPO4及其制備方法與制造工藝
- 一種鄰苯二甲酸酯類增塑劑單鏈DNA核酸適配體及其篩選與表征方法及電化學傳感器與制造工藝
- 基于高特異性核酸適體熒光探針INS1胰島素試劑盒及其檢測方法與制造工藝
- 運用核酸適配體與溶菌酶特異性識別并形成G四鏈體進行熒光顯現潛指紋的方法與制造工藝
- 基于快速識別核酸適體熒光探針INS2胰島素試劑盒及其檢測方法與制造工藝
- 一種用于檢測沙門氏菌的增敏型核酸適配體試紙條及其制備方法
- 一組特異性結合結核分枝桿菌的核酸適配體及其應用