基因HAH_1662在制備多糖中的應用的制作方法
本發明涉及生物技術領域,尤其涉及一種基因hah_1662在制備多糖中的應用。
背景技術:
微生物產生多糖來適應各種環境條件,胞外多糖可以幫助微生物生長,如粘附,存儲營養,保護層,是形成生物被膜的重要組成組分。細菌產生的多糖,在許多領域具有非常廣泛的應用價值,如作為抗氧化劑,金屬螯合劑,乳化劑,增稠劑等。而極端古菌產生的多糖被研究與報道的并不多,嗜鹽古菌的生存環境很極端,其產生的多糖,也許更具價值。目前報道的可以產生胞外多糖的幾種嗜鹽古菌有haloferax、halococcus、haloarcula、natronococcus、haloterrigena和halobacterium,只有五種來自嗜鹽古菌的多糖,其組成與結構被報道,而關于嗜鹽古菌多糖的生物合成途徑,知之甚少。對于嗜鹽古菌多糖及其生物合成途徑的研究,可以豐富人類對古菌的認識,并且開發出更具價值的多糖。
技術實現要素:
本發明的一個目的是蛋白hah_1662或其編碼基因或含有所述編碼基因的表達盒、重組載體或重組菌的用途。
本發明提供了蛋白hah_1662或其編碼基因或含有所述編碼基因的表達盒、重組載體或重組菌在如下1)-3)任一中的應用:
1)提高目的菌中多糖產量;
2)在制備促進目的菌產多糖的產品中的應用;
3)在制備與嗜鹽古菌產多糖相關的產品中的應用。
上述應用中,所述蛋白hah_1662來源于嗜鹽古菌。
上述應用中,所述蛋白hah_1662為如下1)或2):
1)由序列表中序列2所示的氨基酸序列組成的蛋白質;
2)在1)所示蛋白兩端添加標簽序列得到的蛋白。
上述應用中,所述蛋白hah_1662的編碼基因為如下1)-3)中任一種:
1)序列表中序列1所示的dna分子;
2)在嚴格條件下與1)所限定的dna分子雜交且編碼由序列表中序列2所示的氨基酸序列組成的蛋白質的dna分子;
3)與1)所限定的dna分子至少具有70%、至少具有75%、至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%同源性且編碼由序列表中序列2所示的氨基酸序列組成的蛋白質的dna分子。
上述嚴格條件可為在6×ssc,0.5%sds的溶液中,在65℃下雜交,然后用2×ssc,0.1%sds和1×ssc,0.1%sds各洗膜一次。
上述應用中,所述重組載體為將所述蛋白hah_1662的編碼基因插入表達載體中得到的載體;
或所述重組菌為所述重組載體導入目的菌中,得到的菌。
上述應用中,所述目的菌為嗜鹽古菌。
上述應用中,所述多糖為酸性多糖;
或,所述多糖包括或為如下幾種組分形成的聚合物:1)甘露糖、2)半乳糖、3)葡萄糖、4)1)-3)中至少一種的硫酸化修飾產物;
或,所述多糖包括或為如下幾種組分形成的聚合物:1)甘露糖、2)半乳糖、3)葡萄糖、4)1)-3)中至少一種的硫酸化修飾產物;
所述甘露糖、所述半乳糖和所述葡萄糖的摩爾比為55.9:43.2:0.9;
所述多糖中硫酸根的質量百分含量為26%;
所述多糖中碳水化合物的質量百分含量為51%。
本發明另一個目的是提供一種制備多糖的方法。
本發明提供的方法,包括如下步驟:發酵上述重組菌,得到多糖。
抑制或沉默所述蛋白hah_1662編碼基因表達的物質在降低目的菌中多糖產量中的應用也是本發明保護的范圍。
本發明的實驗證明了,基因hah_1662確實是負責har.hispanicatcc33960的一種酸性多糖合成的關鍵基因,敲出該基因,可以提高酸性多糖的產量,該基因為提高生物合成酸性多糖的產量研究奠定基礎。
附圖說明
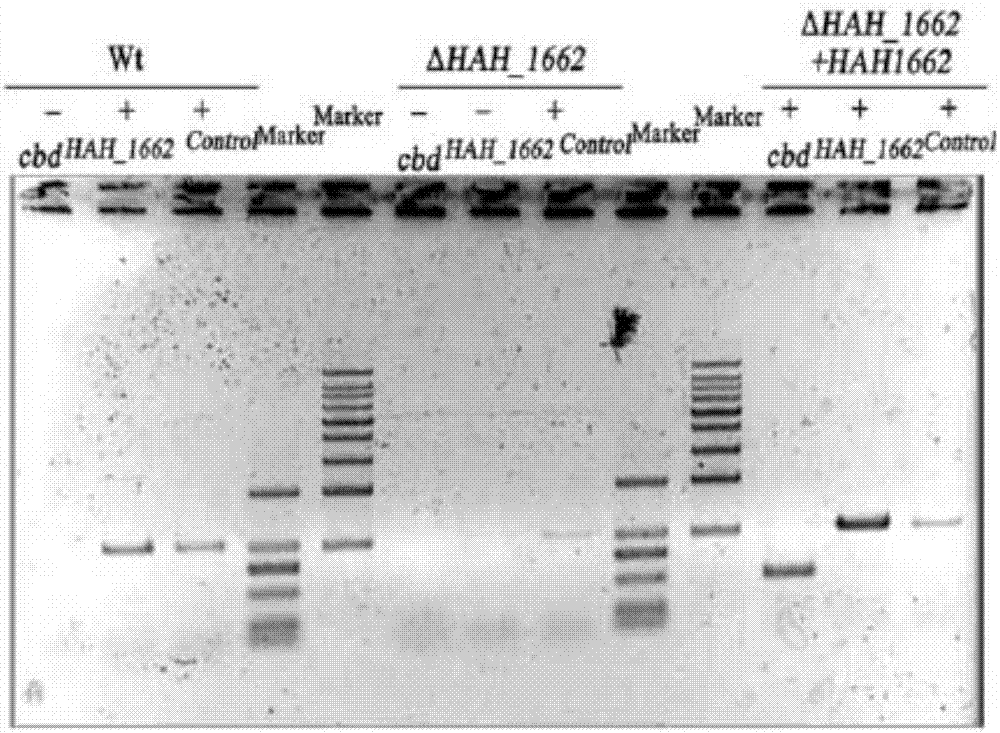
圖1為嗜鹽古菌har.hispanicatcc33960的基因敲除突變株的pcr鑒定及southern鑒定。
圖2為野生株、基因敲除突變株與表達回復菌株的rt-pcr鑒定分析。
圖3為酸性多糖的7.5%page電泳檢測。
圖4為嗜鹽古菌har.hispanicatcc33960酸性多糖的分離純化與分子量測定,a,發酵液經過deae-sepharosefastflow柱純化。蛋白含量測定,紫外檢測器檢測od280nm值;多糖含量測定,苯酚硫酸法測定od490nm值;nacl%,nacl濃度。b,洗脫組分的酸性多糖電泳。40-47管。c,多糖的均一性分析及分子量測定。
圖5為多糖的單糖組成分析,gc-ms檢測多糖的完全酸水解產物。
圖6為多糖的紅外光譜ftir檢測。
圖7為多糖的nmr檢測。
具體實施方式
下述實施例中所使用的實驗方法如無特殊說明,均為常規方法。
下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。
實施例1、基因hah_1662的獲得
提取嗜鹽古菌haloarculahispanicatcc33960(以下稱為野生株)的基因組dna,具體方法參見《分子克隆實驗指南》,所用n端引物5’ggaattccatatggatatcctccacacgccg3’和c端引物5’ccgctcgagaactaagtcttcatgtac3’,以基因組dna為模板進行pcr擴增,擴增方法為:
pcr反應體系:10×extaqbuffer5μl,n端引物和c端引物各1μl(20μmol/l),dna模板1μl(1μg/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后補水至50μl。
反應條件:98℃熱變性5min;95℃變性1min,52℃退火45s,72℃延伸1min30s,共30個循環;72℃最后延伸10min。
得到pcr擴增產物,將該產物連接到pgem-teasy載體上,構建重組質粒pgem-hah_1662,并轉化大腸桿菌dh5α,對重組質粒pgem-hah_1662進行測序,測序結果表明,該pcr產物具有序列表中序列1所示的核苷酸,該核苷酸的基因命名為hah_1662,該基因編碼的蛋白命名為hah_1662,該蛋白的氨基酸序列為序列2。
實施例2、基因hah_1662功能驗證
一、基因敲除突變株嗜鹽古菌atcc33960突變株(△hah_1662)的獲得
采用同源重組(pop-in和pop-out)的方法進行基因敲除,具體如下:
1、同源重組片段的獲得
1)、上游同源臂的擴增
首先以嗜鹽古菌haloarculahispanicatcc33960基因組dna為模板,用引物p1(5’cccaagctttatggccgagaacatcctcg3’含hindⅲ位點)和p2(5’ccgtcgattgaaacggtttgggaattagtaaattag3’)擴增,得到619bp片段,為上游同源臂,該片段的核苷酸序列為序列3第1位至第619位。
上述pcr反應體系:10×pyrobestbuffer5μl,引物p1和引物p2各1μl(20μmol/l),dna模板1μl(1μg/μl),dntps(各2.5mm)4μl,pyrobestenzyme(takara,5u/μl)1μl,最后補水至50μl。
反應條件:98℃熱變性5min;95℃變性1min,50℃退火30s,72℃延伸45s,共30個循環;72℃最后延伸10min。pcr產物(619-bp片段)用北京天根公司dna凝膠回收試劑盒回收,方法參考其說明書。
2)、下游同源臂的擴增
以嗜鹽古菌基因組dna為模板,用引物p3(5’ctaatttactaattcccaaaccgtttcaatcgacgg3’)和p4(5’cggggtacccgcatacctcttggtatag3’含kpni位點)擴增,得到607bp片段,為下游同源臂,該片段的核苷酸序列為序列3第620位至第1226位。
上述pcr反應體系:10×pyrobestbuffer5μl,引物p3和引物p4各1μl(20μmol/l),dna模板1μl(1μg/μl),dntps(各2.5mm)4μl,pyrobestenzyme(takara,5u/μl)1μl,最后補水至50μl。
上述反應條件:98℃熱變性5min;95℃變性1min,50℃退火30s,72℃延伸45s,共30個循環;72℃最后延伸10min。pcr產物(607-bp片段)用北京天根公司dna凝膠回收試劑盒回收,方法參考其說明書。
3)、同源重組片段的擴增
以上述1)得到的619bp片段和上述2)得到的607bp片段為模板,p1和p4為引物,進行overlappcr,得到1.2kb片段。
pcr反應體系:10×extaqbuffer5μl,引物p1和引物p4各1μl(20μmol/l),片段模板各1μl(1μg/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后補水至50μl。反應條件:98℃熱變性5min;95℃變性1min,52℃退火45s,72℃延伸1min30s,共18個循環;72℃最后延伸10min。將pcr產物用天根公司的pcr產物回收試劑盒回收,方法參考其說明書。
回收上述1.2kb片段,該片段5’端含有hindⅲ位點,3’端含有kpni位點,該片段的核苷酸序列為序列3,該片段即為同源重組片段。
2、重組載體的構建
將上述1得到的同源重組片段用hindⅲ和kpni酶(neb公司生產)雙酶切后,將雙酶切片段用天根公司dna凝膠回收試劑盒回收,方法參考其說明書。
將敲除載體質粒pubp(該質粒記載在如下文獻中:appl.environ.microbiol.,2007,vol73,no19,page6058-6065)同樣經過hindⅲ和kpni酶雙酶切后,將雙酶切片段用天根公司dna凝膠回收試劑盒回收,方法參考其說明書。將上述兩個酶切片段用t4ligase(promega公司生產)連接,構建成敲除質粒pubpδhah_1662。
pubpδhah_1662為將序列表中序列3所示的片段替換質粒pubp的hindⅲ和kpni酶切位點間得到的載體。
3、導入目的菌實現敲除
1)感受態的制備:從平板上用牙簽挑取少量har.hispanicatcc33960菌體,接種于as-168培養基中(bactocasaminoacids5g;bactoyeastextract5g;sodiumglutamate1g;trisodiumcitrate3g;mgso4·7h2o20g;kcl2g;nacl200g;feso4·7h2o微量;mncl2·7h2o痕量;加ddh2o至1l,用naoh調ph至7.0-7.2,固體培養基加1.2%瓊脂,8p滅菌30分鐘),37℃,200rpm培養到對數期(菌體呈淡紅色),然后以1:10轉接于新鮮培養基中,約生長20-24h至菌體呈微紅色,再以同樣比例轉接,生長20-24h,即可用于轉化。
2)轉化(所有操作均在室溫下進行):取1ml活化好的菌液于滅菌的離心管中,6000rpm離心3min;棄上清,用移液槍吸盡殘余的上清,然后加入200μlbss-ls緩沖液(nacl5.85g;kcl0.201g;sucrose15g;先溶解于95ml蒸餾水中,8p×30min滅菌后再加入5ml滅菌的1m,ph8.2tris-hcl),用移液槍輕輕吹勻,6000rpm離心3min;棄上清,用移液槍吸盡殘余的上清,然后加入100μlbss-ls/加甘油緩沖液(nacl5.85g;kcl0.201g;sucrose15g;glycerol15ml;先溶解于95ml蒸餾水中,8p×30min滅菌后再加入5ml滅菌的1m,ph8.2tris-hcl),用移液槍輕輕吹勻;加入10μl0.5mph8.0的edta緩沖液,用手輕輕拍打離心管壁,混勻后室溫下放置10min(形成原生質體);預先將待轉化的質粒pubpδhah_16625μl與5μlbss-ls/加甘油緩沖液混勻,然后加入到原生質體溶液中,放置5min(陰性對照在原生質體溶液中加入10μlbss-ls/加甘油緩沖液);加入120μl(與上面離心管中溶液等體積)60%的peg600溶液,peg600溶液使用時用ubss/ls緩沖液(nacl5.85g;kcl0.201g;sucrose15g;ddh2o加至100ml,用tris堿或naoh調至ph至7.0-7.5,8p×30min滅菌)配置,迅速上下顛倒離心管多次,直到溶液變得透亮均一,然后室溫放置20-30min。加入1ml復蘇培養基(30%seawater76.7ml;peptone0.5g;bactoyeastextract0.1g;sucrose15g;ddh2o加至100ml;用tris堿或naoh調至ph至7.0-7.5,8p×30min滅菌),上下顛倒離心管混勻溶液,10000rpm離心2min;棄上清,再加入500μl-1ml的復蘇培養基懸浮菌體,于37℃,200rpm搖床復蘇過夜。
3)涂板:將復蘇過夜的菌體10000rpm離心2min,剩余500-600μl復蘇培養基用來重懸菌體,在含mevinolin(5μg/ml)的as-168固體培養基上,讓液體在平板上流動直到均勻地吸附于平板。
4)生長:將涂好的平板放于37℃溫箱,用塑料袋裝好,以防板子干涸。7天左右可以看到淡紅色的轉化子,10天左右,可以將轉化子在含mevinolin的as-168固體培養基上劃線培養,生長3天左右即可用于dna抽提pcr檢測。
pcr檢測的引物為p1t:5’tatggccgagaacatcctcg3’;p4t:5’cgcatacctcttggtatag3’;得到1.2kb和2.4kb的片段,為目的菌株,為正確的轉化子。
5)將正確的轉化子在不含mevinolin的as-168的液體培養基中傳代培養至少三次,在傳代期間,個別菌體發生二次基因重組,選取可以在as-168/mev-平板上生長,而不能在as-168/mev+平板上生長的單菌落,經過pcr驗證篩選基因敲除突變株。
選擇p1和p4作為引物,單菌落基因組為模板,發生一次重組pop-in菌株可以擴增出1.2kb和2.4kb兩條帶,而發生兩次重組pop-out菌株,只能擴增出1.2kb條帶。pcr驗證結果見圖1a。因此,判斷兩次重組pop-out菌株為嗜鹽古菌atcc33960突變株(△hah_1662),即har.hispanicatcc33960菌體基因組敲除hah_1662基因得到的重組菌。
4、southern雜交驗證突變株。
提取野生株嗜鹽古菌atcc33960與嗜鹽古菌atcc33960突變株(△hah_1662)基因組dna,選擇ecorv(neb公司生產)進行酶切,得到的酶切產物選取hah_1662下游1550-bp片段作為探針,進行southern雜交(分子克隆實驗指南)。
1550-bp片段用引物p55’aaccgtttcaatcgacggtatatcctgattattc3’和p65’atctcacaacatctgttgattctggcattcacaag3’進行擴增,以野生型菌株嗜鹽古菌atcc33960基因組dna為模板進行pcr擴增。
pcr反應體系:10×extaqbuffer5μl,引物p5和引物p6各1μl(20μmol/l),dna模板1μl(1μg/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后補水至50μl。反應條件:98℃熱變性5min;95℃變性1min,50℃退火30s,72℃延伸1min30s,共30個循環;72℃最后延伸10min。pcr產物(1550-bp片段)用北京天根公司dna凝膠回收試劑盒回收,方法參考其說明書。
southern驗證結果見圖1b,野生菌可以雜交出3.3kb的條帶,而嗜鹽古菌atcc33960突變株(△hah_1662)可以雜出4.4kb的條帶,表明,嗜鹽古菌atcc33960突變株(△hah_1662)的確敲除hah_1662基因。
二、表達回復菌株嗜鹽古菌atcc33960δhah_1662+hah_1662的獲得
1、表達載體的構建
1)質粒骨架pwl-cbd的獲得
表達質粒pwl-cbd-secy記載在如下文獻中:irihimovitch,v.,etal.,2003,isolationoffusionproteinscontainingsecyandsece,componentsoftheproteintranslocationcomplexfromthehalophilicarchaeonhaloferaxvolcanii,extremophiles.7,71-77,該質粒含有組成型啟動子prr16和來自于clostridiumthermocellum菌的cbd(纖維素結合區)序列。
將表達質粒pwl-cbd-secy用ndei和kpni(neb公司生產)雙酶切去除secy基因,回收10kb的片段,即為質粒骨架pwl-cbd。
2)hah_1662基因的獲得
以野生型嗜鹽古菌基因組dna為模板,p7和p8為引物,擴增hah_1662基因pcr產物(序列1)。
p75’ggaattccatatggatatcctccacacgcc3’含ndei位點
p85’ggggtaccctaaactaagtcttcatgtacc3’含kpni位點
pcr反應體系:10×pyrobestbuffer5μl,引物p7和引物p8各1μl(20μmol/l),dna模板1μl(1μg/μl),dntps(各2.5mm)4μl,pyrobestenzyme(takara,5u/μl)1μl,最后補水至50μl。反應條件:98℃熱變性5min;95℃變性1min,52℃退火30s,72℃延伸1min30s,共30個循環;72℃最后延伸10min。pcr產物用北京天根公司pcr產物回收試劑盒回收,方法參考其說明書。
3)連接
將2)得到的hah_1662基因pcr產物用ndei和kpni(neb公司生產)雙酶切,然后用天根公司dna凝膠回收試劑盒回收hah_1662片段,與質粒pwl-cbd片段一起,用t4ligase(promega公司生產)連接,構建表達載體質粒pwl-cbd-hah_1662。
pwl-cbd-hah_1662為將序列1所示的hah_1662片段替換表達質粒pwl-cbd-secy中ndei和kpni位點間的secy基因得到的載體。
2、表達載體的轉化
將表達載體pwl-cbd-hah_1662轉化進入δhah_1662敲除突變株,轉化步驟見上述感受態制備與轉化,得到δhah_1662+hah_1662表達回復菌株。
3、野生株、δhah_1662突變株和δhah_1662+hah_1662表達回復菌株的鑒定
1)提取rna反轉錄得到cdna
野生株、δhah_1662突變株和δhah_1662+hah_1662表達回復菌株在as-168液體培養基中37℃,200rpm培養至od600nm達到0.6-0.8,用高壓滅菌兩次的ep管收集1.5ml菌體,12000rpm室溫離心1min,棄上清,離心甩一次,用移液槍吸盡上清。
每份菌體加入1mltrizol(invitrogen公司),用移液槍上下吹吸菌體,使其充分裂解,室溫靜置5min。加入200μl氯仿,上下顛倒離心管混勻管中液體,然后于渦輪振蕩器上振蕩15s,然后室溫靜置3min。12000rpm,4℃離心10min,轉移上面的水相至一潔凈ep管中,注意不要吸到中間的蛋白層或者下面的有機相,然后加入200μl中酚/氯仿,混勻后于12000rpm,4℃離心10min。轉移水相于一潔凈ep管中(約500μl左右),加入500μl異丙醇,室溫沉淀10min。12000rpm,4℃離心10min,立即置于冰上,棄上清,用500μl70%乙醇(用depc水配置),洗滌沉淀,輕輕棄掉乙醇。吹干,rna最后溶于100μlddh2o水中。用rnase-freednase(neb公司)去除污染的dna,參見dnase說明書。cdna的合成,按照revertaidfirststrandcdnasynthesiskit(thermoscientific)試劑盒說明書,以randomhexamers作為引物,擴增得到cdna。
2)擴增
以各菌株cdna為模板,用p9(5’atggatatcctccacacgcc3’)和p10(5’catgtacctcgttatgatcg3’)引物擴增hah_1662;
上述pcr反應體系:10×extaqbuffer5μl,引物p9和引物p10各1μl(20μmol/l),cdna模板3μl(100ng/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后補水至50μl。反應條件:98℃熱變性5min;95℃變性1min,50℃退火30s,72℃延伸1min,共30個循環;72℃最后延伸10min。
以cdna為模板,用p11(5’gtgagtaatgttctgtatcc3’)和p12(5’gccctgtatgcttccagtgc3’)引物擴增hah_1667做對照(control);
上述pcr反應體系:10×extaqbuffer5μl,引物p11和引物p12各1μl(20μmol/l),cdna模板3μl(100ng/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后補水至50μl。反應條件:98℃熱變性5min;95℃變性1min,50℃退火30s,72℃延伸1min,共30個循環;72℃最后延伸10min。
以cdna為模板,用p13(5’atggcaaatacaccggtatcag3’)和p14(5’tactacactgccaccgggttc3’)引物擴增質粒pwl-cbd-hah_1662上的cellulosebindingdomain(cbd);
上述pcr反應體系:10×extaqbuffer5μl,引物p13和引物p14各1μl(20μmol/l),cdna模板3μl(100ng/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后補水至50μl。反應條件:98℃熱變性5min;95℃變性1min,50℃退火30s,72℃延伸30s,共30個循環;72℃最后延伸10min。
上述rt-pcr產物在1%的瓊脂糖凝膠中電泳后,eb染色,結果如圖2所示,說明野生株,基因敲除株,表達回復菌株正確。
三、hah_1662基因在制備胞外酸性多糖中的應用
嗜鹽古菌har.hispanicatcc33960野生株、基因敲除突變株δhah_1662與表達回復菌株δhah_1662+hah_1662在40ml的as-168培養基中,37℃200rpm,培養至穩定期,13,000×g離心30分鐘離心去除菌體,保留上清。將40ml發酵上清用4倍體積的無水乙醇在4℃沉淀過夜,13,000×g離心30分鐘收集沉淀;將沉淀用40ml蒸餾水復溶后,在截留量為8000-12000分子量的透析袋內用蒸餾水透析除鹽,然后在透析袋內加入核酸酶2μl(購自sigma,≥250units/μl,mw30kda),37℃放置12小時;再加入20μl5mg/ml蛋白酶k(購自sigma,≥30units/mg,mw29kda),37℃放置12小時;期間換水繼續透析。將透析液再經過13,000×g離心30分鐘,收集上清,將上清溶液經過100kda截留分子量的超濾濃縮管(millipore公司生產,50ml,操作見產品說明書),濃縮到5ml,冷凍干燥成粉末,得到多糖。將凍干粉末溶于2mlddh2o中,即為粗多糖溶液。
配制7.5%的page膠,參見《分子克隆實驗指南》,取20μl粗多糖溶液加入5μl的5×loadingbuffer(終濃度為312.5mmol/l的tris-hcl,甘油終濃度為50%,溴酚藍終濃度為0.05%,ph6.8的水溶液)120v電泳,待溴酚藍跑出,收膠。用0.5%的亞甲基藍溶液(用3%的醋酸溶液配制)染色30min分鐘后,3%的醋酸溶液脫色。
結果見圖3,可以看出,敲除突變株δhah_1662中無多糖存在,而野生株atcc33960與表達回復株δhah_1662+hah_1662中可以提取到多糖。因此,表明hah_1662基因為與多糖合成相關的基因。
四、多糖性質檢測
1)、發酵制備多糖
嗜鹽古菌har.hispanic表達回復株δhah_1662+hah_1662在1l的as-168培養基中,37℃200rpm,培養至穩定期,13,000×g離心30分鐘離心去除菌體,保留上清。
將發酵上清用4倍體積的無水乙醇在4℃沉淀過夜,13,000×g離心30分鐘收集沉淀;將沉淀用500ml蒸餾水復溶后,在截留量為8000-12000分子量的透析袋內用蒸餾水透析除鹽,然后在透析袋內加入核酸酶10μl(購自sigma,≥250units/μl,mw30kda),37℃放置12小時;再加入3mg蛋白酶k(購自sigma,≥30units/mg,mw29kda),37℃放置12小時;期間換水繼續透析。將透析液再經過13,000×g離心30分鐘,收集上清,將上清溶液經過100kda截留量的超濾濃縮裝置,濃縮到250ml,冷凍干燥成粉末,得到粗多糖,將凍干粉末溶于緩沖液a(20mmnaac溶液)中,得到粗多糖溶液,粗多糖濃度為10mg/ml。
2)純化
(1)離子交換柱純化
上述粗多糖溶液經deae-sepharosefastflow(購自sigma)離子交換柱吸附后,用緩沖液b(含2.5mnacl的20mmnaac溶液)梯度洗脫5個柱體積,流速為0.5ml/min。將洗脫下來的組分收集,用紫外檢測器(280nm)、苯酚硫酸法和酸性多糖電泳法鑒定每管洗脫組分。當nacl濃度在1.25m-1.55m時,洗脫下來的組分即為純化的酸性多糖。結果見圖4中a和b,其中41-47管(nacl濃度在1.25m-1.55m)即為洗脫下來的酸性多糖。將酸性多糖各管組分合并(41-47管),裝進透析袋(截留量14000da)用蒸餾水透析除鹽后,凍成干粉。
(2)sephacryls-400/hr柱純化
將上述(1)的干粉用ddh2o溶解成多糖含量為2mg/ml的溶液,經過sephacryls-400/hr柱(購自gehealthcare),用ddh2o洗脫,流速為0.5ml/min。每管用苯酚硫酸法檢測多糖含量,并收集主峰,凍成干粉,稱重,1las-168培養基可以獲得純多糖30mg。
3)多糖的均一性分析及分子量的測定
將上述2)得到的純多糖干粉溶于ddh2o中,配制成3mg/ml的溶液,取40μl溶液經過tskg4000分子篩柱分析樣品的均一性,流動相為0.1mnano3,流速為0.5ml/min,柱溫為30℃,利用示差折光檢測器來檢測。利用不同分子量的dextran(50kda,80kda,150kda,270kda,410kda,670kda,1100kda)來做標準曲線,確定該酸性多糖的分子量。經測定,該酸性多糖分子量為1100kda,見圖4c。
4)、多糖的單糖組成測定
將200μg上述2)得到純多糖,利用2m三氟乙酸(tfa)在121℃下水解2個小時,真空旋轉干燥,利用硼氫化鈉(nabd4)還原單糖,利用乙酸酐來乙酰化單糖。選擇20μg的肌醇(inositol)作為內參。乙酰化的糖醇利用gc-ms分析確定其種類(agilent7890agcinterfacedtoa5975cmsd,electronimpactionizationmode)。分離柱為30msupelcosp-2331bondedphasefusedsilicacapillarycolumn。
gc-ms結果見圖5,該多糖中的單糖由甘露糖,半乳糖和葡萄糖組成,其組成的摩爾比為甘露糖:半乳糖:葡萄糖=55.9:43.2:0.9,碳水化合物(所有單糖)占該多糖總量的51%(質量百分含量)。
該多糖的組成不同于其他在嗜鹽古菌中發現的多糖,見表1。
表1為已知嗜鹽古菌多糖的單糖組成比較
5)、多糖的硫酸根含量測定
將上述2)得到純多糖干粉與kbr粉末一起研磨后,取少量進行紅外光譜檢測(thermonicoletis5),所選波長為500-4000cm-1,結果見圖6。多糖在3520cm-1處有一大的吸收峰值,這是-oh基團的吸收特征;2937cm-1處的吸收峰是由于c-h鍵的伸縮振動;1645cm-1處的吸收峰來自于c=o鍵的伸縮振動;900-1150cm-1處的吸收峰來自c-o-c鍵的伸縮振動;而1258cm-1和855cm-1處的吸收峰則是來自s=o鍵的伸縮振動。ftir的結果提示,該多糖是硫酸化的。利用離子色譜對該多糖的硫酸根含量進行了測定,取2mg純多糖,用2mtfa,在121℃下密閉管中水解2小時后,真空旋轉干燥,將水解后樣品溶于ddh2o中,利用高效液相離子色譜儀(ics-2100,thermoscientific)檢測so42-含量,選擇ionpacas11-hc分析柱,柱溫維持在30℃,流動相為30mmnaoh溶液,流速為1ml/min。利用na2so4做標準曲線,測定該多糖so42-含量為26%(w/w)。
7)、多糖的一維氫譜,碳譜測定
將40mg上述2)得到多糖溶于0.5ml重水中(99.96%純度的d2o),冷凍干燥交換3次,進行一維質譜檢測(brukeravanceⅲ500mhzspectrometer)。1h譜時用d2o(4.70ppm)作為內參,13c譜時用dmso(39.39ppm)作為內參。一維氫譜、碳譜結果見圖7a,13cnmr結果(圖7b)顯示了四個異頭碳原子,分別為δ104.12,103.85,102.52和96.07ppm,60-85ppm為糖環上的碳原子信號,意味著多糖的重復單位由4種類型的單糖(甘露糖,半乳糖,葡萄糖及一種硫酸化修飾的上述單糖)構成。
序列表
<110>中國科學院微生物研究所
<120>基因hah_1662在制備多糖中的應用
<160>3
<170>patentinversion3.5
<210>1
<211>1194
<212>dna
<213>嗜鹽古菌haloarculahispanic
<400>1
atggatatcctccacacgccggtccgattctatccttatatcggcggtgtagagacgtac60
gtacacgacctttcgaagaaattggttaagttcaatcacaacgtaacagtggtctgtgcc120
aaagtcgacgaagagacagagcgttgtgaaactatcgacggtatcgatgtacggcgattg180
accagcgtaggtcagatggcgaacactaatataactcctgcgcttcctgcagtgctaatt240
gaggaagcgcaatccgcagacgtaattcacacacatctacctacaccttggttcgcggat300
ctcagtgtccttgctggggtggtaacgggaacaccggtcgttatcacctatcacaatgat360
atcgtgggtgatggaatagctaatcacattgcctatttctataaccagacttggctccga420
ctgacacttcgatattcagatcgaatcatcgtcacacagccagattacgtggagaactcc480
aagtatctcagtccggaaatggataaaattgagattatctcaaacggtgttgacgtcaac540
tattttgaaccgaagacagtctcagccgaggatttggctcgtcttgggttcgacgaatcg600
cgtcccacactattctttttgagtgttctcgacggacaccacgattacaaaggattgaca660
gacctgctagaagcgttggccctgctagtcaaagaagaagatacgactccacaacttctc720
gtcggtggagggggagagtccaagtcaacttatgaacatcgagctgcaaaactcggtgtc780
gatcagttcgttgatttcctcggtcgagttccagaagacgatctggtcaattattattcg840
gcagccgatctttttgtgctaccctcaacaagtagcgaccaagaggggttcggcttagtg900
ttactggaggcgctggcaagtgggactcccgtagtaactacgaatgtcgttggtatcgct960
gaagaggtcaaacaaaatcctgtcggaacgatcgctccaaaggaaaatcccgaggcactg1020
gcgtcttcgattcgaactacgttatcgaatgacgaatttgatttagaggtcgcacgcaac1080
ctctgtgtacagaactattcgtggcgagctagtgctgaagatctggaagccatctatgag1140
agagtttgcgaaacgtcaatcgatcataacgaggtacatgaagacttagtttag1194
<210>2
<211>403
<212>prt
<213>嗜鹽古菌haloarculahispanic
<400>2
metgluthraspileleuhisthrprovalargphetyrprotyrile
151015
glyglyvalgluthrtyrvalhisaspleuserlyslysleuvallys
202530
pheasnhisasnvalthrvalvalcysalalysvalaspglugluthr
354045
gluargcysgluthrileaspglyileaspvalargargleuthrser
505560
valglyglnmetgluthralaasnthrasnilethrproalaleupro
65707580
alavalleuilegluglualaglnseralaaspvalilehisthrhis
859095
leuprothrprotrpphealaaspleuservalleualaglyvalval
100105110
thrglythrprovalvalilethrtyrhisasnaspilevalglyasp
115120125
glyilealaasnhisilealatyrphetyrasnglnthrtrpleuarg
130135140
leuthrleuargtyrseraspargileilevalthrglnproasptyr
145150155160
valgluasnserlystyrleuserproglumetgluthrasplysile
165170175
gluileileserasnglyvalaspvalasntyrphegluprolysthr
180185190
valseralagluaspleualaargleuglypheaspgluserargpro
195200205
thrleuphepheleuservalleuaspglyhishisasptyrlysgly
210215220
leuthraspleuleuglualaleualaleuleuvallysglugluasp
225230235240
thrthrproglnleuleuvalglyglyglyglygluserlysserthr
245250255
tyrgluhisargalaalalysleuglyvalaspglnphevalaspphe
260265270
leuglyargvalprogluaspaspleuvalasntyrtyrseralaala
275280285
aspleuphevalleuproserthrserseraspglngluglyphegly
290295300
leuvalleuleuglualaleualaserglythrprovalvalthrthr
305310315320
asnvalvalglyilealaglugluvallysglnasnprovalglythr
325330335
ilealaprolysgluasnproglualaleualaserserileargthr
340345350
thrleuserasnaspglupheaspleugluvalalaargasnleucys
355360365
valglnasntyrsertrpargalaseralagluaspleuglualaile
370375380
tyrgluargvalcysgluthrserileasphisasngluvalhisglu
385390395400
aspleuval
<210>3
<211>1226
<212>人工序列
<220>
<223>
<400>3
tatggccgagaacatcctcgtactcttcgagaaagcctaacatcgaaacgcggtcggcgt60
gttccagtgattcgcgtttggtatccagccggtcacgctccgggccgtcaccgatgatac120
ctagcgtgacgtcatgcctgtcggcgactacatcgaatgcctctagcagaatgtcgacgt180
tcttgtgctcgatcagtcgacctgcgaagacgatgtcgtagccggtgtcggggcgggggg240
ccgtctggacctgctcggtatcgagcccgtttggcacgacctcgatatgctcgcgattcg300
ggccgatgtcagcgaggttgtccgctgtgatgcccgaaaccgcgatcggatgctggggtg360
tcttggccgtgagttgttcgacgagtttgccacccggaacgagcgatctgaagtccatct420
tcaagtgcagaaacagtttgtcatcgccggttctaatcttgagcgacacggcgatcgtag480
cgcacttgggacactcttagacaccagggatttctcctcctcaggtgagtcagttgcaaa540
ggaactcaaaatatttataacacaaccaactgattggagaccgaatctttgataccctta600
tctaatttactaattcccaaaccgtttcaatcgacggtatatcctgattattctttcagt660
gattcatacacttcaacgagtcgatctatatgggtctcaaggctcacatcaacgtcagtc720
agatttgttgcaagccgagttgagtcacctttatgagactcaattacattggcgagaata780
ttcgcttgttctggcttgaaacaataccctgtctcgtcttcttcaatcaattcaggaata840
ccaccaatatctgccccgatgactggtgtttggcgtgcatagctctcataaatgaccatc900
ggggaattatcgtaccagcgagatgggacgacagtgtaatccgcgatagtgtattggcgc960
gctagctcttcttctgatacgaacccgtgaaatttgactctcttgtcgtttctagctcgt1020
ttttcgagcatctcccgatctggtcccttacctaaaatgtgaagttcaagatcaggatca1080
tcaagttgcttcatggcatcaatgagaatatcaattcctttgctgtaggtgagttgaccc1140
gcatataggagacgagtattacactgatcgtagtttttagctttatattgttttaattct1200
gttgtatctataccaagaggtatgcg1226
- 還沒有人留言評論。精彩留言會獲得點贊!
- 化藥/基因共轉運功能化碳納米管的制備方法及應用與流程
- 抗體基因的表達?分泌系統的制作方法與工藝
- 抗體捕獲蛋白及報告基因融合重組蛋白檢測抗體的方法與流程
- 治療性重組抗體、其編碼基因及應用的制作方法與工藝
- 一種制備高效合成泛酸基因工程菌的方法及其應用與流程
- MACF1基因及其表達產物在制備診斷和治療骨質疏松癥藥物中的應用的制作方法與工藝
- 野生型IDH2基因作為靶標在制備非小細胞肺癌治療藥物中的應用的制作方法與工藝
- FBN1基因在制備檢測先天性單純性晶狀體異位制品中的應用的制作方法與工藝
- TMEM104基因在制備治療椎間盤退行性疾病藥物中的應用的制作方法與工藝
- PSMG4基因在制備男性骨質疏松癥診斷產品中的用途的制造方法與工藝