一種高催化效率且耐高溫木聚糖酶突變體及其制備方法和應用與流程
本發明涉及基因工程領域,具體地涉及一種高催化效率且耐高溫木聚糖酶突變體及其制備方法和應用。
背景技術:
纖維素、半纖維素和木質素是構成植物細胞壁的主要成分,約占了世界上50%生物量。半纖維素主要存在于細胞壁的表面,纖維素包裹在半纖維素中,而半纖維素又與木質素共價連接形成網狀結構。木聚糖是半纖維素的主要成分,是自然界中含量僅次于纖維素的可再生資源,幾乎占地球有機碳含量的三分之一。木聚糖的結構復雜,其主鏈是由吡喃木糖以β-d-1,4-木糖苷鍵連接起來,并帶有多種取代基。
由于木聚糖的多樣性和結構的復雜性,它的完全水解需要多種酶的協同作用才能完成。包括木聚糖酶、木糖苷酶以及水解側鏈取代基團的α-d-葡萄糖醛酸苷酶、乙酰木聚糖酯酶、阿魏酸酯酶、香豆酸酯酶等。通過這些酶的協同作用,木聚糖能夠有效地被水解。其中,木聚糖酶能夠降解木聚糖主鏈的β-1,4-糖苷鍵,是木聚糖降解過程中發揮最重要作用的酶。木聚糖酶在飼料工業、食品工業、造紙工業以及能源、紡織、醫藥等行業均具有廣泛的應用價值。
木聚糖酶的分子改良方面主要集中在熱穩定性機理研究及改良。ding等(2013)通過分子動力學模擬的方法研究來源于streptomyceslividans的木聚糖酶sl-xlna的熱不穩定性區段,確定影響sl-xlna熱穩定性的因素。gallardo等通過強制進化的方法使來源于paenibaciiusbarcinonensis的木聚糖酶xyn10b的熱穩定性提高20倍。kamondi等通過familyshuffling的方法,將兩個10家族的木聚糖酶進行隨機片段的替換,發現有4個雜合體的最適溫度得到了提高。但在第10家族木聚糖酶其它性質的機制及改良方面的研究還很少,尤其在第10家族木聚糖酶高效催化機制及改良方面的研究還未見報道。
技術實現要素:
本發明的一個目的是對材料xyl10c截掉n端序列后獲得的高催化效率木聚糖酶以及材料xyl10c中e175位點突變后獲得的高催化效率木聚糖酶突變體的氨基酸序列進行保護,并詳細研究n端序列以及e175位點在xyl10c的高催化效率中所扮演的角色。
本發明的再一目的是提供包含e175飽和突變體基因的重組載體。
本發明的另一目的是提供包含e175飽和突變體基因的重組菌株。
突變體的野生型氨基酸序列全長如seqidno.1所示。
msfhsllisgllasvavavpkeawgitvtetktvsttiiatvtelgtcsstitsptsdatttttssatntnptttllatpqpsnwglnnaaradgklwfgtaadipgleqddryymkeynnthdfggttpanimkfmftepeqnvfnftgaqefldiafashklvrchnliwqselptwvtnpttnwtnetlskvlqnhvytlvshfgdqcyswdvvnealsddpagsyqnniwfdtigpeyvamafeyaekavkdhklnvklyyndynieypgpkstaaqnivkelkarniqidgvgleshfiagetpsqatqitnmadftsldidvavteldvrlylppnatseaqqvadyyatvaacaatercigitvwdfddtyswvpstfagqgyadlffqpdgpntplvkkaaydgclqalqhkaesp
突變體的野生型成熟氨基酸序列如seqidno.2所示。
vpkeawgitvtetktvsttiiatvtelgtcsstitsptsdatttttssatntnptttllatpqpsnwglnnaaradgklwfgtaadipgleqddryymkeynnthdfggttpanimkfmftepeqnvfnftgaqefldiafashklvrchnliwqselptwvtnpttnwtnetlskvlqnhvytlvshfgdqcyswdvvnealsddpagsyqnniwfdtigpeyvamafeyaekavkdhklnvklyyndynieypgpkstaaqnivkelkarniqidgvgleshfiagetpsqatqitnmadftsldidvavteldvrlylppnatseaqqvadyyatvaacaatercigitvwdfddtyswvpstfagqgyadlffqpdgpntplvkkaaydgclqalqhkaesp
權利要求1突變體的野生型氨基酸去掉n端序列如seqidno.3所示。
wglnnaaradgklwfgtaadipgleqddryymkeynnthdfggttpanimkfmftepeqnvfnftgaqefldiafashklvrchnliwqselptwvtnpttnwtnetlskvlqnhvytlvshfgdqcyswdvvnealsddpagsyqnniwfdtigpeyvamafeyaekavkdhklnvklyyndynieypgpkstaaqnivkelkarniqidgvgleshfiagetpsqatqitnmadftsldidvavteldvrlylppnatseaqqvadyyatvaacaatercigitvwdfddtyswvpstfagqgyadlffqpdgpntplvkkaaydgclqalqhkaesp
權利要求2突變體e175h氨基酸序列如seqidno.4所示。
vpkeawgitvtetktvsttiiatvtelgtcsstitsptsdatttttssatntnptttllatpqpsnwglnnaaradgklwfgtaadipgleqddryymkeynnthdfggttpanimkfmftepeqnvfnftgaqefldiafashklvrchnliwqshlptwvtnpttnwtnetlskvlqnhvytlvshfgdqcyswdvvnealsddpagsyqnniwfdtigpeyvamafeyaekavkdhklnvklyyndynieypgpkstaaqnivkelkarniqidgvgleshfiagetpsqatqitnmadftsldidvavteldvrlylppnatseaqqvadyyatvaacaatercigitvwdfddtyswvpstfagqgyadlffqpdgpntplvkkaaydgclqalqhkaesp
權利要求2突變體e175n氨基酸序列如seqidno.5所示。
vpkeawgitvtetktvsttiiatvtelgtcsstitsptsdatttttssatntnptttllatpqpsnwglnnaaradgklwfgtaadipgleqddryymkeynnthdfggttpanimkfmftepeqnvfnftgaqefldiafashklvrchnliwqsnlptwvtnpttnwtnetlskvlqnhvytlvshfgdqcyswdvvnealsddpagsyqnniwfdtigpeyvamafeyaekavkdhklnvklyyndynieypgpkstaaqnivkelkarniqidgvgleshfiagetpsqatqitnmadftsldidvavteldvrlylppnatseaqqvadyyatvaacaatercigitvwdfddtyswvpstfagqgyadlffqpdgpntplvkkaaydgclqalqhkaesp
權利要求2突變體e175d氨基酸序列如seqidno.6所示。
vpkeawgitvtetktvsttiiatvtelgtcsstitsptsdatttttssatntnptttllatpqpsnwglnnaaradgklwfgtaadipgleqddryymkeynnthdfggttpanimkfmftepeqnvfnftgaqefldiafashklvrchnliwqsdlptwvtnpttnwtnetlskvlqnhvytlvshfgdqcyswdvvnealsddpagsyqnniwfdtigpeyvamafeyaekavkdhklnvklyyndynieypgpkstaaqnivkelkarniqidgvgleshfiagetpsqatqitnmadftsldidvavteldvrlylppnatseaqqvadyyatvaacaatercigitvwdfddtyswvpstfagqgyadlffqpdgpntplvkkaaydgclqalqhkaesp
權利要求2突變體e175v氨基酸序列如seqidno.7所示。
vpkeawgitvtetktvsttiiatvtelgtcsstitsptsdatttttssatntnptttllatpqpsnwglnnaaradgklwfgtaadipgleqddryymkeynnthdfggttpanimkfmftepeqnvfnftgaqefldiafashklvrchnliwqsvlptwvtnpttnwtnetlskvlqnhvytlvshfgdqcyswdvvnealsddpagsyqnniwfdtigpeyvamafeyaekavkdhklnvklyyndynieypgpkstaaqnivkelkarniqidgvgleshfiagetpsqatqitnmadftsldidvavteldvrlylppnatseaqqvadyyatvaacaatercigitvwdfddtyswvpstfagqgyadlffqpdgpntplvkkaaydgclqalqhkaesp
權利要求2突變體e175l氨基酸序列如seqidno.8所示。
vpkeawgitvtetktvsttiiatvtelgtcsstitsptsdatttttssatntnptttllatpqpsnwglnnaaradgklwfgtaadipgleqddryymkeynnthdfggttpanimkfmftepeqnvfnftgaqefldiafashklvrchnliwqsllptwvtnpttnwtnetlskvlqnhvytlvshfgdqcyswdvvnealsddpagsyqnniwfdtigpeyvamafeyaekavkdhklnvklyyndynieypgpkstaaqnivkelkarniqidgvgleshfiagetpsqatqitnmadftsldidvavteldvrlylppnatseaqqvadyyatvaacaatercigitvwdfddtyswvpstfagqgyadlffqpdgpntplvkkaaydgclqalqhkaesp
權利要求2突變體e175q氨基酸序列如seqidno.9所示。
vpkeawgitvtetktvsttiiatvtelgtcsstitsptsdatttttssatntnptttllatpqpsnwglnnaaradgklwfgtaadipgleqddryymkeynnthdfggttpanimkfmftepeqnvfnftgaqefldiafashklvrchnliwqsqlptwvtnpttnwtnetlskvlqnhvytlvshfgdqcyswdvvnealsddpagsyqnniwfdtigpeyvamafeyaekavkdhklnvklyyndynieypgpkstaaqnivkelkarniqidgvgleshfiagetpsqatqitnmadftsldidvavteldvrlylppnatseaqqvadyyatvaacaatercigitvwdfddtyswvpstfagqgyadlffqpdgpntplvkkaaydgclqalqhkaesp
權利要求2突變體e175m氨基酸序列如seqidno.10所示。
vpkeawgitvtetktvsttiiatvtelgtcsstitsptsdatttttssatntnptttllatpqpsnwglnnaaradgklwfgtaadipgleqddryymkeynnthdfggttpanimkfmftepeqnvfnftgaqefldiafashklvrchnliwqsmlptwvtnpttnwtnetlskvlqnhvytlvshfgdqcyswdvvnealsddpagsyqnniwfdtigpeyvamafeyaekavkdhklnvklyyndynieypgpkstaaqnivkelkarniqidgvgleshfiagetpsqatqitnmadftsldidvavteldvrlylppnatseaqqvadyyatvaacaatercigitvwdfddtyswvpstfagqgyadlffqpdgpntplvkkaaydgclqalqhkaesp
本發明還是提供一種制備所述木聚糖酶突變體的方法,其技術方案如下:
1、設計突變引物如表1所示,獲得突變體的完整基因片段;
2、將獲得突變基因片段克隆到表達載體ppic9上,獲得突變體重組質粒;
3、將突變體重組質粒轉化畢赤酵母gs115,誘導表達,獲得高催化效率
聚糖酶。
本發明還提供了一種制備木聚糖酶的方法,包括以下步驟:
1、用上述的重組載體轉化酵母宿主細胞,得重組菌株;
2、培養重組菌株,誘導重組木聚糖酶表達;
3、回收并純化所表達的木聚糖酶。
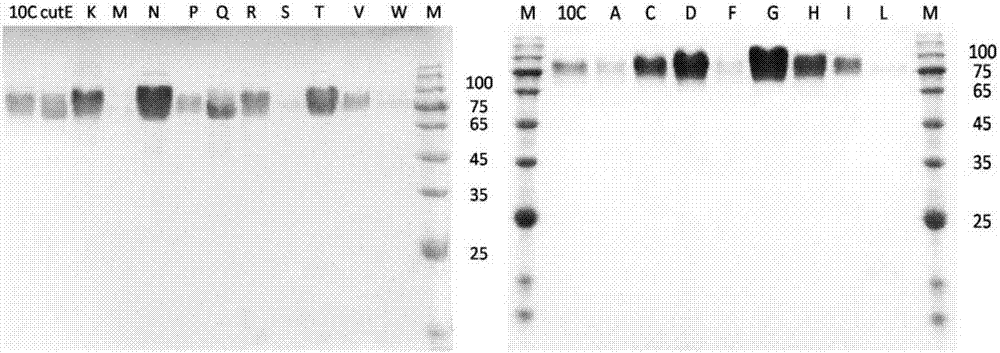
本發明通過對成熟的木聚糖酶xyl10c截掉n端以及e175位點實施飽和突變構建了包括去掉e175位點在內的21個突變體,將突變體重組載體轉化畢赤酵母gs115,小管誘導表達發現,除了xyl10c-cute,xyl10c-e175w三個突變體的小管上清沒有檢測到活性之外,其余19個突變體都有活性。
對19個有活性的突變體和野生酶xyl10c進行大瓶誘導,蛋白濃縮純化后進行了基本酶學性質的測定,如表2所示,以櫸木木聚糖測定發現,e175位點飽和突變中的18個突變體以及突變體xyl10c-cutn最適溫度在85度左右,,最適ph在4.0-4.5左右,彼此之間的ph作用范圍相類似。
突變體xyl10c-cutn、e175h、e175n、e175d、e175v、e175l、e175q、e175m的比活較野生酶xyl10c分別提高了2.1倍、2.4倍、1.7倍、1.9倍、2.0倍、1.4倍2.5倍和4.3倍。突變體xyl10c-cutn、e175h、e175n、e175d、e175v、e175l、e175q、e175m的催化效率較野生酶xyl10c分別提高了1.7倍、2.3倍、2.1倍、1.4倍、1.9倍、1.7倍、2.3倍和4.9倍。
本發明證明確認了材料xyl10c中的關鍵催化相關的位點e175位點,并證明了該位點對于該酶高催化效率高比活的重要性,即e175位點在該酶的高比活高催化效率中扮演著重要的角色。對于研究材料xyl10c的高效催化機制提供了重要的線索,同時對于提高該家族的其他木聚糖酶的催化效率提供了可靠的參考位點,證明了該位點在本家族木聚糖酶催化效率中的決定性作用。
附圖說明
圖1:gh10家族木聚糖酶xyl10c-cutn的晶體結構以及e175位點在三維結構中所處的位置。
圖2:野生酶xyl10c,突變體xyl10c-cutn以及18個有活性的突變體的蛋白純化電泳圖片。
圖3:(圖3-1和圖3-2)野生酶xyl10c,突變體xyl10c-cutn以及18個有活性的突變體的最適ph。
圖4:(圖4-1和圖4-2)野生酶xyl10c,突變體xyl10c-cutn以及18個有活性的突變體的最適溫度。
具體實施方式
以下結合附圖對本發明作進一步的描述。
表1.以xyl10c為母本的xyl10c-cutn以及e175飽和突變體構建引物
試驗材料和試劑
1、菌株及載體:表達宿主pichiapastorisgs115,表達質粒載體ppic9r為本實驗室保存。
2、酶類及其它生化試劑:內切酶購自fermentas公司,重組酶購自全式金公司,櫸木木聚糖購自sigma公司。其它都為國產分析純試劑(均可從普通生化試劑公司購買得到)。
3、培養基:
(1)lb培養基:0.5%酵母提取物,1%蛋白胨,1%nacl,ph7.0。
(2)ypd培養基:1%酵母提取物,2%蛋白胨,2%葡萄糖。
(3)md固體培養基:2%葡萄糖,1.5%瓊脂糖,1.34%ynb,0.00004%biotin。
(4)bmgy培養基:1%酵母提取物,2%蛋白胨,1%甘油(v/v),1.34%ynb,0.00004%biotin。
(5)bmmy培養基:1%酵母提取物,2%蛋白胨,1.34%ynb,0.00004%biotin,0.5%甲醇
(v/v)。
實施例1突變體xyl10c–cutn重組載體的制備
以bisporasp.mey-1來源的gh10家族木聚糖酶xyl10c-ppic9r為模板,在氨基酸序列wglnn所對應的核酸序列處設計引物xyl10c-cutn—f以及整個氨基酸序列結尾處所對應的核酸序列設計引物xyl10c-cutn—r,擴增產物經過ecorⅰ和notⅰ雙酶切后直接與切開的ppic9r質粒進行連接,轉化transi-t1感受態。
實施例2以xyl10c為母本的e175飽和突變體重組載體的構建
在基因xyl10c的e175位點處設計飽和突變引物e175x—f和e175x—r,以xyl10c--ppic9r為模板以xyl10c-f和e175x—r以及e175x—f和xyl10c-r為引物pcr,擴增出上下游片段后,再以xyl10c-f和xyl10c-r為引物進行overlap,產物經過ecorⅰ和notⅰ雙酶切后直接與切開的ppic9r質粒進行連接,轉化transi-t1感受態。挑取單克隆測序發現,只有突變體e175fe175me175te175w以及cute沒有出現,因此針對剩余的幾個突變體重新和成引物,方法同上。
實施例3木聚糖酶突變體重組菌株的制備
將與表達載體ppic9r連接測序正確的重組載體用內切酶bglii線性化并轉化畢赤酵母gs115,獲得重組酵母菌株gs115/xyl10c-cutn,gs115/xyl10c-e175x。
挑取取含有重組質粒的gs115菌株,接種于2mlbmgy培養基的10ml小管中,置于30℃,220rpm搖床培養48h;后將培養液3000g離心5min,棄上清,沉淀用1.5ml含有0.5%甲醇的bmmy培養基重懸,并再次置于30℃,220rpm條件下誘導培養48h。最后取上清用于酶活性檢測。
挑取上清酶活最高的gs115菌株,接種于30mlypd培養基中培養48h進行種子放大培養,后按1%接種體積接種于300mlbmgy培養基的1l三角瓶中,置于30℃,220rpm搖床培養48h;后將培養液3000g離心5min,棄上清,沉淀用200ml含有0.5%甲醇的bmmy培養基重懸,并再次置于30℃,220rpm條件下誘導培養。每隔12h補加1ml甲醇,使菌液中的甲醇濃度保持在0.5%,同時取上清用于酶活性檢測。
實施例4重組木聚糖酶突變體和野生型的活性分析
dns法:具體方法如下:在給定的ph、溫度條件下,1ml的反應體系包括100μl適當的稀釋酶液,900μl底物,反應10min,加入1.5mldns終止反應,沸水煮5min。冷卻后540nm測定od值。1個酶活單位(u)定義為在給定的條件下,每分鐘木聚糖生成1μmol還原端所需的酶量。
實施例5重組木聚糖酶突變體和野生型的性質測定
1、重組木聚糖酶突變體和野生型的最適ph測定方法如下:
將實施例3純化的重組木聚糖酶突變體和野生型在不同的ph下進行酶促反應以測定其最適ph。底物櫸木木聚糖用不同ph的0.2mol/l檸檬酸-磷酸氫二鈉緩沖液中80℃下進行木聚糖酶活力測定。結果(圖3)表明,重組木聚糖酶突變體和野生型的最適反應ph大致在4.0-4.5左右,且在ph3.0-6.0范圍內有相近的相對酶活力。
2、重組木聚糖酶突變體和野生型的最適溫度測定方法如下:
重組木聚糖酶突變體和野生型的最適溫度的測定為在0.2mol/l檸檬酸-磷酸氫二鈉緩沖液各自最適ph緩沖液體系及不同溫度下進行酶促反應。酶反應最適溫度測定結果(圖4)表明,重組木聚糖酶突變體和野生型的最適溫度在80-95℃左右。
3、重組木聚糖酶突變體和野生型的動力學參數測定方法如下:
參照本實驗室王坤的方法(王坤,2013),測定反應的一級反應時間。確定測定km及vmax的反應時間為5min。用不同濃度的木聚糖(10,8,5,2.5,2,1,0.75,0.5mg/ml)為底物,在同一條件(80℃、ph4.0)下測定酶活性,計算出相應的反應速度,利用grafit7軟件計算km值及vmax。
計算結果如表2所示。
表2,xyl10c與所有突變體基本酶學性質匯總
- 還沒有人留言評論。精彩留言會獲得點贊!