擬南芥At‐UGE2基因及其過表達突變株和缺失突變株在調節植物性狀中的應用的制作方法
本發明屬于植物基因工程領域,涉及一種擬南芥UDP‐葡萄糖4‐異構酶基因At‐UGE2及其過表達突變株35S::UGE2和缺失突變株uge2在調節植物產量相關性狀及抗逆性狀方面的轉基因植物中的應用。
背景技術:
:
在植物生長發育過程中,經常會遭受諸如:低溫、高溫、干旱、鹽堿等逆境環境因素的影響,這些因素往往會對植物的生長過程構成嚴重的非生物脅迫。由于植物自身的移動受限制,它們只能通過適應環境改變來維持生存,因此在漫長的適應進化過程中,植物不斷形成了一套抵御逆境脅迫的生理機制。研究植物在逆境下的生理變化規律和分子機理,有利于深入解析植物的抗逆機制,在農業生產指導中培育具有優良性狀的抗逆品種,從而提高農作物的產量和經濟效益。
植物在逆境脅迫下易發生細胞失水,植物可通過快速調節細胞內可溶性糖、脯氨酸等滲透物質的含量來應對。糖類是植物細胞中重要的有機化合物,它與植物的生長發育和抵御逆境脅迫息息相關。核苷糖是植物體內一類重要的單糖物質,可由核苷二磷酸或核苷一磷酸與不同單糖異構體的羥基連接形成。核苷糖可由核苷糖互變轉化酶催化反應,改變糖基團從而生成不同的糖類及其他代謝中間產物。研究發現,調控核苷糖生物合成、轉化過程的這類酶是也植物響應逆境脅迫的重要功能基因,其中,UDP‐D‐葡萄糖4‐異構酶(亦稱UDP‐半乳糖4‐異構酶,UGE;EC 5.1.3.2)是目前研究比較清楚的一類核苷糖互變轉化酶,它催化了UDP‐D‐葡萄糖(UDP‐glucose,UDP‐glc)與UDP‐D‐半乳糖(UDP‐galactose,UDP‐gal)之間的互變反應。該反應過程具體為:(1)UGE催化UDP‐D‐葡萄糖C4位上羥基的氫轉移到NAD+上,形成中間產物4‐呋喃糖和NADH;(2)NADH煙酰胺環上的H再轉移到糖C4位的對應面上,形成UDP‐D‐半乳糖。UDP‐D‐半乳糖是半乳糖參與生物合成過程的活性形式,它是植物合成細胞壁多糖的重要物質,在植物細胞壁果膠、半纖維素、纖維素以及胞質的多糖中都含有大量半乳糖殘基;UDP‐D‐半乳糖還與多種植物糖蛋白的核心寡糖連接,參與細胞信號轉導過程;它還是貯存代謝物棉子糖和水蘇糖的合成底物;此外,它還參與了單半乳糖二酰甘油脂(monogalactosyl diacylglycerol,MGDG)和雙半乳糖二酰甘油脂(digalactosyl diacylglycerol,DGDG)的合成,這兩類半乳 糖脂占植物葉綠體膜脂組成的75%左右,對于葉綠體功能的穩定至關重要。因此,UGE作為UDP‐D‐半乳糖合成途徑中的關鍵酶,對于維持細胞內UDP‐D‐半乳糖與UDP‐D‐葡萄糖的動態平衡起到關鍵調節作用。研究表明,UGE基因的功能缺陷會引起酵母菌和植物發生嚴重的半乳糖不耐受,產生半乳糖毒性;在人類中,UGE基因的功能缺陷會導致血糖中的半乳糖含量升高造成半乳糖血癥。目前,已從細菌、釀酒酵母、人類、水稻、大麥、馬鈴薯、瓜豆、白菜以及模式植物擬南芥中克隆到UGE基因,UGE基因的氨基酸編碼序列在各種物種中都高度保守,同源性約為50%。在擬南芥基因組中共發現5個UGE編碼基因,但它們介導的催化反應傾向不同,UGE1和UGE3傾向于催化糖類降解過程中釋放的UDP‐D‐半乳糖生成UDP‐D‐葡萄糖,為新的生物合成反應提供原料,而UGE2、4、5傾向于催化UDP‐D‐葡萄糖向UDP‐D‐半乳糖轉化,為細胞壁多糖和葉綠體膜半乳糖脂的合成提供底物。此外,這5個UGE基因在擬南芥組織器官中的表達模式也不同,UGE1主要在種子和根下胚軸中表達,UGE3在種子、花序及花中表達,UGE2和UGE5在衰老的葉片中表達,UGE4在根尖伸長區表達。在擬南芥中這五個UGE基因經常是協同發揮作用的,例如UGE2和UGE4在植物營養生長階段共同作用于細胞壁多糖的生物合成,UGE2和UGE3在植物生殖生長階段共同促進花粉的發育,而UGE1和UGE5在非生物脅迫下可非特異性地促進UGE酶活進而維持脅迫下植物的生長。UGE1基因在擬南芥中目前研究的最為系統清楚,與野生型植株相比UGE1基因缺失或過表達分別造成了UGE總酶活性降低10%或提升250%;在含有1%半乳糖的培養基上生長時,野生型擬南芥生長受到抑制,UGE1缺失突變株的抑制程度更強,UGE1過表達突變株則生長正常;在含有半乳糖的培養基上生長一段時間,野生型植株的UDP‐半乳糖含量升高,UDP‐葡萄糖含量下降,而在UGE1過表達突變體中UDP‐半乳糖和UDP‐葡萄糖的含量沒有變化。造成以上的差異的原因可能是由于野生型和UGE1缺失突變株中UGE酶活達到上限,不能及時清理細胞內積累的UDP‐半乳糖,造成細胞毒性,進而抑制植株生長,而過表達UGE1突變株中UGE表達量及酶活較高,能更大限度地耐受半乳糖毒性,使植株得以正常生長。其它相關研究也發現,UGE基因不僅參與調控植物生長發育的某些過程,還部分地參與了植物對逆境脅迫的響應。例如,在已報道的擬南芥響應逆境脅迫的基因芯片數據中,低溫、干旱、高鹽等都可誘導UGE基因的表達升高;水稻UGE1基因的表達量受干旱、高鹽及紫外線脅迫誘導,并在缺氮條件下負責糖類的分配;將水稻的UGE1基因轉入擬南芥中表達,雖未改變擬南芥的形態特征,但卻改變了其中棉子糖含量和對非生物脅迫的抗性。因此,UGE基因不僅為植物生長代謝提供了原料核苷糖,還參與了植物對逆境脅迫的響應,系統深入的研究其功能具有重要的理論價值和現實意義。
技術實現要素:
:
本發明的目的在于提供一種擬南芥UDP‐葡萄糖4‐異構酶基因At‐UGE2及其過表達突變株35S::UGE2和缺失突變株uge2在調控植物產量相關性狀及抗逆性狀中的應用。
為實現本發明的上述目的,本發明采用了如下的技術方案:
擬南芥At‐UGE2基因在調控植物營養生長和生殖生長階段中的應用。
擬南芥At‐UGE2基因在培育延緩激素脫落酸或乙烯和黑暗誘導的離體葉片衰老中的應用。
擬南芥At‐UGE2基因在培育具有高、低溫脅迫抗性的轉基因植物中的應用。
擬南芥At‐UGE2基因的過表達突變株35S::UGE2在培育具有增強產量相關性狀的轉基因植物中的應用。
如所述的擬南芥At‐UGE2基因的過表達突變株35S::UGE2在培育具有增強產量相關性狀的轉基因植物中的應用,其中所述的增強產量相關性狀是指葉面積大、葉片數多、開花時間提前、單株莢果數多、種子體積增大、種子產量提高。
擬南芥At‐UGE2基因的過表達突變株35S::UGE2在培育延緩激素脫落酸或乙烯和黑暗誘導的離體葉片衰老的轉基因植物中的應用。
擬南芥At‐UGE2基因的過表達突變株35S::UGE2在培育具有高、低溫脅迫抗性的轉基因植物中的應用。
擬南芥At‐UGE2基因的缺失突變株uge2在培育降低植物產量相關性狀的轉基因植物中的應用。
如所述的擬南芥At‐UGE2基因的缺失突變株uge2在培育降低植物產量相關性狀的轉基因植物中的應用,其中所述的降低植物產量相關性狀是指葉面積小、葉片數少、開花時間延遲、單株莢果數減少、種子體積減小、種子產量降低。
擬南芥At‐UGE2基因的缺失突變株uge2在培育具有加速激素脫落酸或乙烯和黑暗誘導的離體葉片衰老的轉基因植物中的應用。
擬南芥At‐UGE2基因的缺失突變株uge2在培育對高、低溫脅迫抗性降低的轉基因植物中的應用。
根據所述的應用,其中所述的轉基因植物是將擬南芥的At‐UGE2基因以及來源于其 他植物的同源基因,完整克隆或其中部分片斷化連接到具有使表達量升高的不同種類的表達載體上,通過對不同表達載體的遺傳轉化獲得At‐UGE2基因表達量升高的轉基因植物。
根據所述的應用,其中所述的轉基因植物是將擬南芥中的At‐UGE2基因以及來源于其他植物的同源基因,利用植物基因敲除技術同源重組、隨機插入突變、RNA干擾、CRISPR/Cas9,獲得的At‐UGE2基因表達完全缺失或部分缺失的轉基因植物。
上述應用中,所述的轉基因植物包括兩類,一是將擬南芥的At‐UGE2基因以及來源于其他植物的同源基因,完整克隆或其中部分片斷化連接到具有使其表達量升高的不同種類的表達載體上,通過對不同表達載體的遺傳轉化獲得At‐UGE2基因表達量升高的轉基因植物;二是將擬南芥中的At‐UGE2基因以及來源于其他植物的同源基因,利用同源重組、隨機插入突變、RNA干擾、CRISPR/Cas9等植物基因敲除技術,獲得的At‐UGE2基因表達完全缺失或部分缺失的轉基因植物。
本發明的技術方案是基于以下原理得出的:At‐UGE2基因在植物生長發育過程中有重要作用,過表達突變株35S::UGE2在擬南芥營養生長和生殖生長階段都表現出顯著增強產量相關性狀的優勢,與野生型相比其葉面積較大、葉片數多、開花時間提前、單株莢果數多、種子體積增大、種子產量提高等優勢,缺失突變株uge2則相反,各項產量性狀都比野生型弱;At‐UGE2基因參與了脫落酸、乙烯和黑暗誘導的植物離體葉片衰老過程,過表達突變株35S::UGE2對于這三種因素誘導的離體葉片衰老有延緩效果,葉綠素降解較慢,而缺失突變株uge2的離體葉片衰老加速,葉綠素降解較快;At‐UGE2基因還參與了植物對溫度脅迫的響應,過表達突變株35S::UGE2對高溫脅迫和低溫脅迫的抗性較強,細胞膜離子滲漏較弱,而缺失突變株uge2對高、低溫脅迫都較敏感,抗性較弱。
本發明所述的擬南芥At‐UGE2基因在GeneBank中的編號是AT4G23920,編碼區序列全長1053bp,編碼350個氨基酸,主要在細胞質表達,催化UDP‐D‐半乳糖與UDP‐D‐葡萄糖的轉換,為細胞壁多糖的合成提供原料。
本發明所述的At‐UGE2基因的過表達突變株35S::UGE2,由下述方法構建而得:用正常條件(22℃)土培生長四周的擬南芥葉片提取總RNA,以oligo(dT)為引物逆轉錄的cDNA為模版克隆At‐UGE2基因的編碼區,然后將測序后確認序列完全正確的基因片段構建到連有CaMv 35S組成型表達啟動子的過表達載體pBI121上,利用液氮凍融法將該表達載體轉入農桿菌中,進而以農桿菌侵染花序的方法進行擬南芥遺傳轉化。通過表達載體上 攜帶的卡那霉素抗性及PCR擴增目標基因雙重手段驗證,最終獲得35S::UGE2過表達轉基因植株。
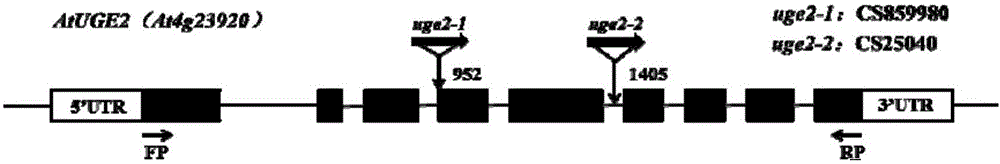
本發明所述的At‐UGE2缺失突變株uge2,是從擬南芥生物資源中心ABRC(Arabidopsis Biological Resource Center)購買的兩個T‐DNA插入純合子突變株,種子編號分別為CS25040和CS859980,突變體株的產生是由于載體pROK2上一段T‐DNA的插入。CS25040的插入位點在At‐UGE2基因的第五和第六外顯子間,CS859980插入位點在At‐UGE2基因的第三和第四外顯子間,T‐DNA的插入導致了At‐UGE2基因表達量缺失。
在本發明中,擬南芥UGE基因家族成員At‐UGE2基因的功能與植物生長發育過程、激素和黑暗誘導離體葉片衰老及溫度脅迫響應有關,組成型高表達At‐UGE2可增強植物產量相關性狀、延緩激素和黑暗誘導的衰老,增強高、低溫脅迫抗性。因此研究該基因的功能不僅對探索植物生長發育規律及闡明植物抗逆機制有重要的理論意義,操作At‐UGE2基因的表達水平對培育優良性狀的農作物及農業生產中的運用也有現實價值。
附圖說明:
圖1 At‐UGE2基因結構及缺失突變株的T‐DNA插入位置。
圖2A‐C:At‐UGE2基因T‐DNA插入突變株的鑒定;圖2A、T‐DNA插入突變株uge2‐1(CS25040)的純合子鑒定;圖2B、T‐DNA插入突變株uge2‐2(CS859980)的純合子鑒定;圖2C、半定量RT‐PCR分析22℃正常生長和4℃處理7d的野生型與過表達突變株35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2葉片中At‐UGE基因轉錄水平。
圖3A‐D:At‐UGE2基因過表達突變株35S::UGE2的構建及鑒定;圖3A、重組質粒pBI121/UGE2的酶切鑒定;圖3B、農桿菌中重組質粒載體pBI121/UGE2的PCR鑒定;圖3C、第三代過表達突變株35S::UGE2的抗生素(卡那霉素)篩選;圖3D、半定量RT‐PCR分析22℃正常生長和4℃處理7d的野生型與過表達突變株35S::UGE2‐2葉片中At‐UGE基因轉錄水平。
圖4A‐C:在不同半乳糖濃度MS培養基上生長2周的擬南芥野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2無菌苗表型;圖4A、在不同半乳糖濃度MS培養基上生長2周的野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2無菌苗的表型及光系統Ⅱ最大光化學量子產量Fv/Fm值;圖4B、在不同半乳糖濃度MS培養基上生長2周的野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2無菌苗的葉綠素含量;圖4C、在不同半乳糖MS培養基上生長2周的野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2無菌苗的類胡蘿卜素含量。
圖5A‐C:過表達突變株35S::UGE2在植物營養生長階段具有增強產量相關性狀的表現;圖5A、22℃正常培養4周的擬南芥野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2土培苗表型;圖5B、剛抽薹的野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2土培苗的葉片表型;圖5C、野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2土培苗單株莢果排列表型。
圖6A‐B:野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2土培苗的干種子大小及單株種子產量;圖6A、收獲后干燥1個月的野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2土培苗種子表型;圖6B、收獲后干燥1個月的野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2土培苗種子單株產量。
圖7A‐D:外源施加激素和黑暗誘導野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2離體葉片衰老表型;圖7A、外源施加脫落酸誘導野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2離體葉片衰老表型及光系統Ⅱ最大光化學量子產量Fv/Fm值;圖7B、外源施加脫落酸誘導野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2離體葉片衰老葉綠素和類胡蘿卜素含量;圖7C、外源施加乙烯誘導野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2離體葉片衰老表型及光系統Ⅱ最大光化學量子產量Fv/Fm值;圖7D、黑暗誘導野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2離體葉片衰老表型及光系統Ⅱ最大光化學量子產量Fv/Fm值。
圖8A‐C:野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2的高溫脅迫抗性分析;圖8A、熱馴后熱激的高溫脅迫處理(條件:先38℃熱馴2h,22℃恢復1h,之后48℃熱激3h)4周土培苗恢復3天的表型及光系統Ⅱ最大光化學量子產量Fv/Fm值;圖8B、直接熱激的高溫脅迫處理(條件:48℃直接熱激3h)4周土培苗恢復3天的表型及光系統Ⅱ最大光化學量子產量Fv/Fm值;圖8C、高溫脅迫處理(熱馴熱激和直接熱激)4周土培苗恢復5天的細胞膜離子滲漏分析。
圖9A‐C:野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2的低溫脅迫抗性分析;圖9A、低溫脅迫處理(條件:‐6℃凍1h和‐8℃凍1h)4周土培苗恢復3天的表型及光系統Ⅱ最大光化學量子產量Fv/Fm值;圖9B、低溫脅迫處理(條件:‐6℃凍1h和‐8℃凍1h)4周土培苗恢復3天的葉片細胞膜離子滲漏分析;圖9C、低溫脅迫處理(條件:‐4℃、‐6℃、‐8℃、‐10℃及‐12℃凍1h)2周無菌苗恢復3天的表型及光系統Ⅱ最大光化學量子產量Fv/Fm值。
具體實施方式:
下面結合附圖,用本發明的實施例來進一步說明本發明的實質性內容,但并不以此來限定本發明
實施例1:
At‐UGE2基因缺失突變株uge2‐1和uge2‐2的獲得和表達量檢測。
(一)At‐UGE2基因缺失突變株uge2‐1和uge2‐2純合子的PCR鑒定:
本發明所述的擬南芥At‐UGE2基因在GeneBank中的編號是AT4G23920,編碼區序列全長1053bp,編碼350個氨基酸,其核苷酸序列和氨基酸序列如序列表1和2(SEQ ID No 1:At‐UGE2基因編碼區核苷酸序列和SEQ ID No 2:At‐UGE2基因編碼氨基酸序列)所示,主要在細胞質表達,催化UDP‐D‐半乳糖與UDP‐D‐葡萄糖的轉換,參與細胞壁碳水化合物的生物合成。
本發明從擬南芥生物資源中心(Arabidopsis Biological Resource Center,ABRC)購買了At‐UGE2基因的兩個T‐DNA插入突變體株(種子編號為:CS25040和CS859980)(圖1),其側翼序列如序列表3(SEQ ID No 3:At‐UGE2基因T‐DNA插入突變株CS25040側翼序列)和序列表4(SEQ ID No 4:At‐UGE2基因T‐DNA插入突變株CS859980側翼序列)所示,通過PCR鑒定T‐DNA插入情況,所用引物如下:
CS25040FP 5’端引物:5’‐CTATCCCATTCTTAGCCCTGC‐3’
CS25040RP3’端引物:5’‐ACATCGTTCTGACTCGGAATG‐3’
LBpROK2引物:5’‐ATTTTGCCGATTTCGGAAC‐3’
CS859980FP5’端引物:5’‐TTTGGTTTAGGAAACGTGTGC‐3’
CS859980RP3’端引物:5’‐ACTAGGATGTGCACCAACAGG‐3’
LBpROK2引物:5’‐ATTTTGCCGATTTCGGAAC‐3’
結果如圖2A和圖2B所示,經鑒定T‐DNA插入突變株CS25040和CS859980皆為純合子,并將其分別命名為uge2‐1和uge2‐2用于后續實驗。
(二)半定量RT‐PCR分析過表達突變株35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2中At‐UGE2基因轉錄水平:
提取22℃正常培養下生長4周的擬南芥土培苗葉片總RNA,進行半定量RT‐PCR分析,所用引物如下:
At‐UGEF:5’‐ATGGCGAAGAGTGTTTTG‐3’
At‐UGER:5’‐TTATGAAGAGGAGCCATTG‐3’
Actin2F:5’‐TGTGCCAATCTACGAGGGTTT‐3’
Actin2R:5’‐TTTCCCGCTCTGCTGTTGT‐3’
結果如圖2C所示,T‐DNA插入已導致突變株uge2‐1和uge2‐2中At‐UGE2基因的轉錄表達缺失。
實施例2:
At‐UGE2基因過表達突變株35S::UGE2的構建及鑒定:
構建At‐UGE2過表達突變株35S::UGE2的具體方法為:用22℃正常條件土培生長四周的擬南芥葉片提取總RNA,以oligo(dT)為引物逆轉錄的cDNA為模版克隆At‐UGE2基因的編碼區,然后將測序后確認序列完全正確的基因片段構建到連有CaMv 35S組成型表達啟動子的過表達載體pBI121上(圖3A),利用液氮凍融法將該表達載體轉入農桿菌中(圖3B),進而以農桿菌侵染花序的方法進行擬南芥遺傳轉化。收獲的第一代種子以50mg/L使用終濃度的卡那霉素進行抗性篩選并通過PCR擴增目的片段驗證,對篩選得到的第一代陽性植株進行單株繁種,收獲的第二、三代種子同樣進行抗生素篩選及PCR驗證,最終獲得了四個具有抗性的株系,命名為#1、#2、#3、#4(圖3C),并選取了#1、#2用于后續實驗,命名為35S::UGE2‐1和35S::UGE2‐2。半定量RT‐PCR的結果也證實,在過表達突變株35S::UGE2‐1和35S::UGE2‐2中(圖2C和3D),At‐UGE2基因的轉錄表達水平比野生型顯著提高了。
實施例3:
利用半乳糖毒性實驗驗證At‐UGE2基因缺失突變株和過表達突變株表型。
細胞內過量的半乳糖會對植物產生嚴重的半乳糖毒性,主要表現在抑制植株生長,葉綠素含量降低,出現黃化苗。At‐UGE2基因在擬南芥中主要催化了UDP‐葡萄向UDP‐半乳糖的轉化,在外源施加一定濃度的半乳糖后,At‐UGE2基因的功能缺陷可能會導致植株產生半乳糖毒性。因此,本發明將擬南芥野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐2和缺失突變株uge2‐1、uge2‐2的種子經表面消毒后分區點種于半乳糖濃度依次增加的0mM、50mM、100mM、150mM、200mM的MS培養基上,經過4℃春化1天后放置于正常條件下培養(溫度22℃,濕度50%‐60%,光周期12h白天/12h黑暗),2周后觀察記錄無菌苗的表型及光系統Ⅱ最大光化學量子產量(Fv/Fm)值。結果如圖4所示,與野生型相比缺失突變株uge2‐1和uge2‐2隨著培養基中半乳糖濃度的升高,生長受到顯著抑制,葉片出現黃化現象,葉綠素和類胡蘿卜素含量降低,而野生型和過表達株突變株能耐受的半乳糖濃度更高,且過表達突變株35S::UGE2‐1、35S::UGE2‐2在高濃度半乳糖下的生長略優于野生型。
實施例4:
過表達突變株35S::UGE2在植物營養生長和生殖生長階段具有增強產量相關性狀表現。
將擬南芥野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐2和缺失突變株uge2‐1、uge2‐2的種子播種于泥炭土中,正常條件下(溫度22℃,濕度50%‐60%,光周期12h白天/12h黑暗)培養生長,4周時拍照記錄所有基因型植株的表型,在植株剛抽薹時統計葉片數、蓮座葉直徑、總葉面積、生物量等指標,在第一朵花開時統計株高和莖分枝數,在種子成熟后期統計莢果數目和形態,收獲種子后統計單株種子產量和種子大小。結果如圖5A所示,相同的生長周期下(4周),過表達突變株土培苗的長勢較好,其次為野生型,缺失突變株的苗體型最小;而在植株由營養生長向生殖生長轉變的剛抽薹時,過表達突變株的土培苗有較多的葉片數、較大的蓮座葉直徑和總葉面積、生物量積累最高,其次為野生型,缺失突變株最弱(圖5B和表1);在第一朵花開時,過表達突變株的株高最高,莖分枝數最多,其次為野生型和缺失突變株(表1);在單株莢果數和莢果長度上,過表達突變株也比野生型和缺失突變株有略微優勢(表1和圖5C);統計單株種子產量,過表達突變株明顯高于野生型和缺失突變株,并且過表達突變株干種子的體積明顯增大了,看起來更飽滿(圖6A和6B)。
表1、野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐1和缺失突變株uge2‐1、uge2‐2土培苗剛抽薹時的葉片數、蓮座直徑(cm)、總葉面積(cm2)、生物量(g),以及第一朵花開時的株高(cm)和莖分枝數,單株莢果數統計(n=5)
實施例5:
激素(脫落酸和乙烯)和黑暗誘導At‐UGE2各基因型植株離體葉片的衰老。
植物激素脫落酸和乙烯參與了葉片的衰老過程,外源施加脫落酸和乙烯可以加速葉片的衰老,誘導衰老相關基因表達,導致生理失調及葉綠素降解,最終葉片發黃衰老脫落。光是調控植物衰老的重要環境因子,植株或其它離體器官在黑暗條件下不能進行光合作用,因此黑暗會加速衰老的進程。本發明通過外源施加激素脫落酸和乙烯、以及避光黑暗處理,誘導野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐2和缺失突變株uge2‐1、uge2‐2離體葉片的衰老。結果如圖7所示,激素和黑暗處理能加速離體葉片的衰老發生,但在相同處理時間下,過表達突變株離體葉片的葉綠素降解程度較輕,光系統Ⅱ最大光化學量子產量Fv/Fm值減弱較慢,對誘導衰老的耐受性最強,其次為野生型,缺失突變株對誘導衰老較為敏感。
實施例6:
過表達突變株35S::UGE2對高、低溫脅迫有較強的抗性。
(一)At‐UGE2各基因型植株的高溫脅迫抗性分析:
將擬南芥野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐2和缺失突變株uge2‐1、uge2‐2的種子播種于泥炭土中,正常條件下培養(溫度22℃,濕度50%‐60%,光周期12h白天/12h黑暗)4周左右進行高溫脅迫處理,處理條件為:一是熱馴熱激,38℃熱馴2小時,22℃恢復培養1小時,然后迅速升溫至48℃熱激處理3小時;二是直 接熱激,將22℃正常培養的植株直接迅速升溫至48℃熱激處理3小時,最后將所有處理后的植株放置于22℃正常條件下恢復培養3天后觀察記錄植株表型及光系統Ⅱ最大光化學量子產量(Fv/Fm)值,檢驗高溫脅迫后植株的損傷程度。結果如圖8所示,兩種不同條件的高溫脅迫處理后,過表達突變株的抗性最好,Fv/Fm熒光值較高,說明葉片光系統Ⅱ的狀態好,細胞膜離子滲漏最低,其次是野生型,缺失突變株的高溫抗性最弱。
(二)At‐UGE2各基因型植株的低溫脅迫抗性分析:
將擬南芥野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐2和缺失突變株uge2‐1、uge2‐2的種子播種于泥炭土中,正常條件下培養(溫度22℃,濕度50%‐60%,光周期12h白天/12h黑暗)4周左右進行低溫脅迫處理,處理條件為:4℃冷馴24小時,然后以2℃/小時的速率降溫到‐2℃誘導結冰2小時,防止產生過冷,之后同樣以2℃/小時的速率降溫到‐6℃處理1小時或‐8℃處理1小時。低溫處理完成后以2℃/小時的速率升溫到4℃黑暗放置過夜(12‐16小時),最終放置于22℃,光照10%左右的條件下恢復培養3天后觀察記錄植株表型及光系統Ⅱ最大光化學量子產量(Fv/Fm)值,檢驗低溫脅迫后植株的損傷程度。結果如圖9A和9B所示,相同的冷凍處理條件,過表達突變株的抗性最好,細胞膜滲漏最低,其次是野生型,缺失突變株的低溫抗性最弱,膜滲漏最強。
將擬南芥野生型(Col‐0)、過表達突變株35S::UGE2‐1、35S::UGE2‐2和缺失突變株uge2‐1、uge2‐2的種子經表面消毒后分區點種于MS培養基上,經過4℃春化1天后放置于正常條件下培養(溫度22℃,濕度50%‐60%,光周期12小時白天/12小時黑暗),2周后進行低溫脅迫處理,處理條件為:4℃冷馴24小時,然后以2℃/小時的速率降溫到‐2℃誘導結冰2小時,防止產生過冷,之后同樣以2℃/小時的速率降溫到指定的零下溫度處理1小時。低溫處理完成后以2℃/小時的速率升溫到4℃黑暗放置過夜(12‐16小時),最終放置于22℃,光照10%左右的條件下恢復培養3天后觀察記錄植株表型及光系統Ⅱ最大光化學量子產量(Fv/Fm)值,檢驗低溫脅迫后植株的損傷程度。結果如圖9C所示,冷凍處理后,過表達突變株能忍耐更低的零下低溫處理,其次為野生型,缺失突變株對低溫的抗性最弱。
擬南芥At‐UGE2基因的以上實驗數據證明,該基因參與了植物生長發育調節和脅迫應答等過程,本發明對深入理解不同發育階段和脅迫處理后UGE酶介導的UDP‐葡萄糖和UDP‐半乳糖在細胞內的代謝轉換有實質性的意義和價值;鑒于過表達突變株35S::UGE2具有增強產量相關性狀及抗逆性的優勢,并且以往的大量研究證明以擬南芥為材料鑒定 的大多數功能基因都能應用到其它植物中,因此本發明還為植物品種改良提供了一個優質基因,闡明了一種新的提高植物產量相關性狀及抗逆性的方法和機制,具有重要的經濟意義和運用前景。
最后,還需注意的是,以上列舉的僅是本發明的其中幾個具體實施例。顯然,本發明不限于以上實施例,還可以有許多改進。本領域的普通技術人員能從本發明公開的內容直接導出或聯想到的改進,均應認為是本發明的保護范圍。
<110> 中國科學院昆明植物研究所
<120> 擬南芥At-UGE2基因及其過表達突變株和缺失突變株在調節植物性狀中的應用
<160> 4
<210> 1
<211> 1053
<212> DNA
<213> 擬南芥(Arabidopsis thaliana)
<400> 1
atggcgaaga gtgttttggt taccggcggc gctggctata tcggaagtca tactgttctt 60
caactgcttg aaggtggtta ctccgccgtc gttgttgaca attacgacaa ttcctctgct 120
gcttcgcttc agcgcgtgaa gaaactcgcc ggcgaaaacg gaaaccgcct ctccttccac 180
caggtggatc tccgagacag gcctgcgctt gagaagatat tctcagaaac aaagtttgat 240
gcagtgatac actttgctgg acttaaagca gtaggtgaga gtgtggagaa gcctttgctc 300
tattataata ataacattgt tggcactgtt actcttttgg aggttatggc tcaatacggc 360
tgcaaaaatc ttgtattttc atcatcagct actgtctatg gctggcctaa ggaggttcct 420
tgcactgagg agtcaccaat ttctgccact aacccatatg gccgtacaaa gctttttatc 480
gaagagattt gccgggatgt acatcgttct gactcggaat ggaagatcat attgcttaga 540
tacttcaacc ctgttggtgc acatcctagt ggttacattg gtgaagatcc tcttggagtt 600
cccaacaatc tcatgcctta tgtccaacaa gttgcagttg gccggagacc tcaccttact 660
gtctttggaa ccgactacaa gacaaaggat ggtacagggg ttagagatta cattcatgtc 720
atggatttag cagatggaca catagctgct ctgcgtaagc tagatgatct caaaatcagt 840
tgtgaggtat acaatcttgg aacgggtaat ggaacatcgg tcctagaaat ggtcgctgcc 900
tttgaaaaag catccggaaa gaaaatccct ttggtgatgg ctggacgacg tcctggagac 960
gctgaagttg tttacgcctc aacggaaaaa gcagagcgcg aactaaattg gaaggctaag 1020
aatgggatag aggagatgtg tagggatcta tggaattggg caagcaataa cccctacggc 1080
tacaattcct cctccaatgg ctcctcttca taa 1053
<210> 2
<211> 350
<212> PRT
<213> 擬南芥(Arabidopsis thaliana)
<400> 2
Met Ala Lys Ser Val Leu Val Thr Gly Gly Ala Gly Tyr Ile Gly Ser
1 5 10 15
His Thr Val Leu Gln Leu Leu Glu Gly Gly Tyr Ser Ala Val Val Val
20 25 30
Asp Asn Tyr Asp Asn Ser Ser Ala Ala Ser Leu Gln Arg Val Lys Lys
35 40 45
Leu Ala Gly Glu Asn Gly Asn Arg Leu Ser Phe His Gln Val Asp Leu
50 55 60
Arg Asp Arg Pro Ala Leu Glu Lys Ile Phe Ser Glu Thr Lys Phe Asp
65 70 75 80
Ala Val Ile His Phe Ala Gly Leu Lys Ala Val Gly Glu Ser Val Glu
85 90 95
Lys Pro Leu Leu Tyr Tyr Asn Asn Asn Ile Val Gly Thr Val Thr Leu
100 105 110
Leu Glu Val Met Ala Gln Tyr Gly Cys Lys Asn Leu Val Phe Ser Ser
115 120 125
Ser Ala Thr Val Tyr Gly Trp Pro Lys Glu Val Pro Cys Thr Glu Glu
130 135 140
Ser Pro Ile Ser Ala Thr Asn Pro Tyr Gly Arg Thr Lys Leu Phe Ile
145 150 155 160
Glu Glu Ile Cys Arg Asp Val His Arg Ser Asp Ser Glu Trp Lys Ile
165 170 175
Ile Leu Leu Arg Tyr Phe Asn Pro Val Gly Ala His Pro Ser Gly Tyr
180 185 190
Ile Gly Glu Asp Pro Leu Gly Val Pro Asn Asn Leu Met Pro Tyr Val
195 200 205
Gln Gln Val Ala Val Gly Arg Arg Pro His Leu Thr Val Phe Gly Thr
210 215 220
Asp Tyr Lys Thr Lys Asp Gly Thr Gly Val Arg Asp Tyr Ile His Val
225 230 235 240
Met Asp Leu Ala Asp Gly His Ile Ala Ala Leu Arg Lys Leu Asp Asp
245 250 255
Leu Lys Ile Ser Cys Glu Val Tyr Asn Leu Gly Thr Gly Asn Gly Thr
260 265 270
Ser Val Leu Glu Met Val Ala Ala Phe Glu Lys Ala Ser Gly Lys Lys
275 280 285
Ile Pro Leu Val Met Ala Gly Arg Arg Pro Gly Asp Ala Glu Val Val
290 295 300
Tyr Ala Ser Thr Glu Lys Ala Glu Arg Glu Leu Asn Trp Lys Ala Lys
305 310 315 320
Asn Gly Ile Glu Glu Met Cys Arg Asp Leu Trp Asn Trp Ala Ser Asn
325 330 335
Asn Pro Tyr Gly Tyr Asn Ser Ser Ser Asn Gly Ser Ser Ser
340 345 350
<210> 3
<211> 365
<212> DNA
<213> 擬南芥(Arabidopsis thaliana)
<400> 3
agatgaataa tatctgttaa tataattcac aattcgttgt attatctccc atactccata 60
atatatcaca atttatgatt gtaatgtaaa tctgtcaaat ggtttgttgt ctataagaca 120
tcataagtca catacccctg taccatcctt tgtcttgtag tcggttccaa agacagtaag 180
gtgaggtctc cggccaactg caacttgttg gacataaggc atgagattgt tgggaactcc 240
aagaggatct tcaccaatgt aaccactatg atgtgcacca acagggttga agtatctaag 300
caatatgatc ttccattccg agtcagaacg atgtacatcc cggcaaatct cttcgataaa 360
aagct 365
<210> 4
<211> 445
<212> DNA
<213> 擬南芥(Arabidopsis thaliana)
<400> 4
tctgttttcc atcttgtatt ttcatcatca gctactgtct atggctggcc taaggaggtt 60
ccttgcactg aggagtcacc aatttctgcc actaacccat atggcacgta caaaggtatc 120
acctttagcc tgagtattga cccaagccca ccttgtgata gtggtgatga atgataataa 180
tcaggaaatg aatctgactg acattatttg cttgtgctgt gtaagctgca gcccgggccg 240
tccaccacgc gtgccctaag ntgagtcgta agggccttcg accacgcgtg ccctatagtg 300
agtcgtaaca cacacctgcc ccatagtgat tcgtaatgac gcttttacac cgactgccac 360
atggtccccc ccctcacata ttcttgtatc atcccctgct ctccgctcaa gcctcgccct 420
acattatttt tgggacccca gtccc 445
- 還沒有人留言評論。精彩留言會獲得點贊!