一種在體篩選促胰島β細胞功能藥物的斑馬魚模型的制作方法
本發明涉及基因工程技術領域,涉及治療糖尿病藥物篩選的技術領域,尤其涉及一種在體篩選促胰島β細胞功能藥物的斑馬魚模型。
背景技術:
糖尿病是一種以高血糖為特征的慢性代謝性疾病。其發病原因主要是機體不能分泌足夠的胰島素或者胰島素的下游靶器官組織發生了胰島素抵抗,不能有效地降低血糖,從而引起血糖升高,糖尿病發病和進一步的各種嚴重的并發癥。來自全球的研究數據顯示,2013年全世界糖尿病患病人數估計達到3.82億,我國糖尿病患病人數約達1.139億,已成為糖尿病第一大國。糖尿病已經發展成為危害人類健康、社會和經濟發展的全球性問題,大力發展糖尿病基礎研究和促進其研究成果向臨床應用轉化,已成為世界各國的迫切需要。
作為機體內唯一產生和分泌胰島素的細胞,胰島β細胞的功能和數量在糖尿病的發病過程中起著決定性的作用。目前,利用高通量篩選(High-Throughput Screening,HTS)促進胰島β細胞數目和功能的藥物,是一種治療糖尿病非常有前景的方案。現在的研究主要集中于促進胰島β細胞增生的藥物篩選,然而,應用β細胞系或原代細胞體外篩選除了會造成與體外環境相關的假象外,也不能篩得間接促進(通過影響其它胰腺細胞或其它器官)β細胞增生的化合物。而斑馬魚因為其透明、占地小、較低廉的飼養費用成為理想的高通量篩選的動物模型。Didier Y.R.Stainier研究組利用基于熒光的泛素化細胞周期指標(fucci)技術,創建了可以標記分裂期的β細胞的轉基因斑馬魚,并利用該體系進行了高內涵篩選(High Content Screening,HCS),得到20種可以在體促進β細胞增殖的小分子。這些分子雖然結構迥異,但主要調節三個特異的信號途徑:血清素,視黃酸和糖皮質激素。
然而,關于促胰島β細胞功能的新藥篩選方面的研究目前仍處于空白狀態,最主要的原因是缺乏一個可以在體便捷可行地甚至自動化地評價胰島β細胞功能的動物模型。
技術實現要素:
為了克服現有技術的上述不足,本發明的目的是提供一種在體篩選促胰島β細胞功能藥物的斑馬魚模型,從而可以在體觀測胰島β細胞的功能。
本發明的另一個目的是提供一種在體篩選促胰島β細胞功能藥物的斑馬魚模型的構建方法。
為了實現上述目的,本發明是通過以下技術方案予以實現的。
一種在體篩選促胰島β細胞功能藥物的斑馬魚模型,斑馬魚BAC_CH211_69I14(BACPAC Resources Center)包含基因preproinsulin(ins)的全部序列,斑馬魚BAC_CH211_69I14上ins基因的編碼序列替換為熒光蛋白序列,熒光信號均特異性地表達在胰島β細胞中,可以指示活體內胰島β細胞鈣離子信號變化。
優選地,所述熒光蛋白序列為紅色熒光蛋白Rcamp1.07;所述紅色熒光蛋白Rcamp1.07是一種特異性指示鈣離子濃度的紅色熒光蛋白。
優選地,利用RecE/RecT同源重組技術把BAC_CH211_69I14上ins基因的編碼序列替換為Rcamp1.07的序列。
一種上述的在體篩選促胰島β細胞功能藥物的斑馬魚模型的構建方法,包括以下步驟:
S1.獲取斑馬魚胰島素ins完整基因序列和構建PNPC2-ins-Rcamp1.07質粒;
S2.轉基因斑馬魚的創建;
S3.轉基因斑馬魚的鑒定。
優選地,利用RecE/RecT同源重組技術把BAC_CH211_69I14上ins基因的編碼序列替換為紅色熒光蛋白Rcamp1.07的序列,將Rcamp1.07及其前后的ins調節序列進一步通過同源重組亞克隆到含有兩個I-SceI大范圍核酸酶酶切位點的質粒中,最終將上述得到的質粒與大范圍核酸酶I-SceI共同注射到斑馬魚胚胎處于單細胞階段的受精卵中,篩選出在胰島β細胞表達Rcamp1.07熒光蛋白并且具有種系傳遞的F0代陽性斑馬魚,根據Rcamp1.07的熒光信號的強度,選擇表達量較強的Tg(ins:Rcamp1.07)魚系進行大量繁殖。
優選地,上述的在體篩選促胰島β細胞功能藥物的斑馬魚模型的構建方法,所述的獲取斑馬魚胰島素ins完整基因序列和構建PNPC2-ins-Rcamp1.07質粒,包括以下步驟:
S1.獲取斑馬魚胰島素ins完整基因序列;
S2.把紅色熒光蛋白Rcamp1.07蛋白編碼序列克隆到R6K中間載體上;
S3.設計分別包含ins蛋白編碼序列起始ATG上游同源序列和下游同源序列的引物對,PCR擴增Rcam1.07-frt-kana-frt序列,然后轉染到含有RecE/RecT同源重組系統和BAC_ins的大腸桿菌中,利用卡那霉素篩選Rcamp1.07-frt-kana-frt基因成功插入到BAC_ins載體ins啟動子下游的克隆BAC-ins-Rcamp1.07-frt-kana-frt;
S4.設計分別包含ins基因最上游同源序列和最下游同源序列的引物對,擴增兩端攜帶I-SceI酶切位點的PNPC2載體片段,該PNPC2載體片段包含諾爾絲菌素抗性基因cloNAT,轉染到含有RecE/RecT同源重組系統和BAC-ins-Rcamp1.07-frt-kana-frt的大腸桿菌中,利用諾爾絲菌素篩選出生成PNPC2-ins-Rcamp1.07-frt-kana-frt重組質粒的大腸桿菌克隆;
S5.轉染表達flpe的質粒到含有PNPC2-ins-Rcamp1.07-frt-kana-frt的克隆中,催化兩個frt序列的同源重組,去掉卡那霉素抗性基因,最終得到含有質粒PNPC2-ins-Rcamp1.07的大腸桿菌克隆。
更優選地,上述的在體篩選促胰島β細胞功能藥物的斑馬魚模型的構建方法,所述步驟S3的引物對為:
L:5’-ATGTTTTTGATTGACAGAGATTGTATGTGTGTGTTTGTGTCAGTGTGACCCGCCACCATGGGTTCTCATC-3’;
R:5’-CCTGTGTGCAAACAGGTGTTTCTGGCATCGGCGGTGGTCAAATCTCTTCAGGCAGATCGTCAGTCAG-3’。
更優選地,上述的在體篩選促胰島β細胞功能藥物的斑馬魚模型的構建方法,所述步驟S4的引物對為:
L:5’-AGTCCATTAAATAATATCTTGTAGAATTATGTTTTTAAAAAGTACCAATGCCGTAGGGATAACAGGGTAATTTAAGC-3’;
R:5’-CAACTTTTTCACAAACACTGACCAAAACAAGCTACATGTTTTAGAGGCATTAGGGATAACAGGGTAATTGCACTG-3’。
優選地,上述的在體篩選促胰島β細胞功能藥物的斑馬魚模型的構建方法,所述轉基因斑馬魚的創建,包括以下步驟:
S1.將核酸內切酶I-SceI與上述PNPC2-ins-Rcamp1.07質粒共同注射到斑馬魚胚胎處于單細胞階段的受精卵中,隨機將ins-Rcamp1.07序列整合到斑馬魚的基因組中;
S2.將上述注射了PNPC2-ins-Rcamp1.07質粒的F0代胚胎養到2天魚齡的時候,運用配備汞燈的體式鏡或者寬場熒光顯微鏡進行篩選,將Rcamp1.07熒光信號正確定位于胰島部位的幼魚挑選出來,培養待其性成熟用于繁殖下一代;
S3.將成年的F0代轉基因魚與AB野生型斑馬魚雜交,產生的F1代在2天魚齡時用上述同樣方法篩選出在胰島中表達Rcamp1.07的陽性胚胎,選擇陽性胚胎轉基因斑馬魚F1代繼續養殖。
以上所述的在體篩選促胰島β細胞功能藥物的斑馬魚模型在篩選促胰島β細胞功能藥物中的應用。
更優選地,該轉基因斑馬魚模型可以指示活體內胰島β細胞鈣離子信號變化,在寬場熒光顯微鏡下,可以在體實時觀測和指示胰島β細胞群體的功能狀態;在雙光子三軸光片層熒光顯微鏡2P3A-DSLM的高分辨率下,可以觀察活體狀態下轉基因斑馬魚模型的單個胰島β細胞的功能狀態;通過直接觀測胰島β細胞內鈣信號變化從而直觀地評價活體中胰島β細胞的功能。
免疫熒光實驗結果表明本發明創建的Tg(ins:Rcamp1.07)轉基因斑馬魚系中Rcamp1.07的熒光信號均特異性地表達在胰島β細胞中。在寬場顯微鏡下觀測受精后3天的Tg(ins:Rcamp1.07)幼魚,當用20mM葡萄糖刺激時,其胰島β細胞的熒光強度明顯升高,反映了葡萄糖刺激下細胞膜去極化引起的鈣離子內流。綜上所述,本發明成功創建了可以在體實時觀測和指示胰島β細胞功能的轉基因斑馬魚模型,通過直接觀測胰島β細胞內鈣信號變化從而直觀地評價活體中胰島β細胞的功能。
與現有技術相比,本發明具有如下有益效果:
1、相比于Didier Y.R.Stainier研究組創建的可以指示β細胞增殖的轉基因斑馬魚,本發明的轉基因斑馬魚模型是第一個可以指示活體內胰島β細胞功能的動物模型。
2、本發明的轉基因斑馬魚可以在其活體中可以實時觀測胰島β細胞內鈣信號的變化,直觀并準確地報告胰島β細胞功能狀態;運用該轉基因斑馬魚系,可以在活體水平進行便捷、自動化和高通量地分析胰島β細胞的功能特點,從而實現對于促進胰島β細胞功能藥物的高通量篩選。
3、使用普通的寬場熒光顯微鏡,可以觀察活體狀態下轉基因斑馬魚模型的胰島β細胞群體的功能狀態,即胰島β細胞群體響應葡萄糖刺激而產生鈣離子信號增強及周期性波動;使用雙光子三軸光片層熒光顯微鏡2P3A-DSLM在高分辨率,可以觀察活體狀態下轉基因斑馬魚模型的單個胰島β細胞的功能狀態,可以得到單個胰島β細胞的高時空分辨率的Ca2+信號隨時間變化的熒光曲線。
4、本發明的轉基因斑馬魚模型可以應用于篩選促進胰島β細胞功能藥物中,也可以為篩選藥物動物模型的構建提供了方法,具有重要的現實意義和廣泛的應用前景。
附圖說明
利用附圖對本發明作進一步說明,但附圖中的實施例不構成對本發明的任何限制,對于本領域的普通技術人員,在不付出創造性勞動的前提下,還可以根據以下附圖獲得其它的附圖。
圖1為包含斑馬魚preproinsulin序列的細菌人工染色體(BAC_ins)。
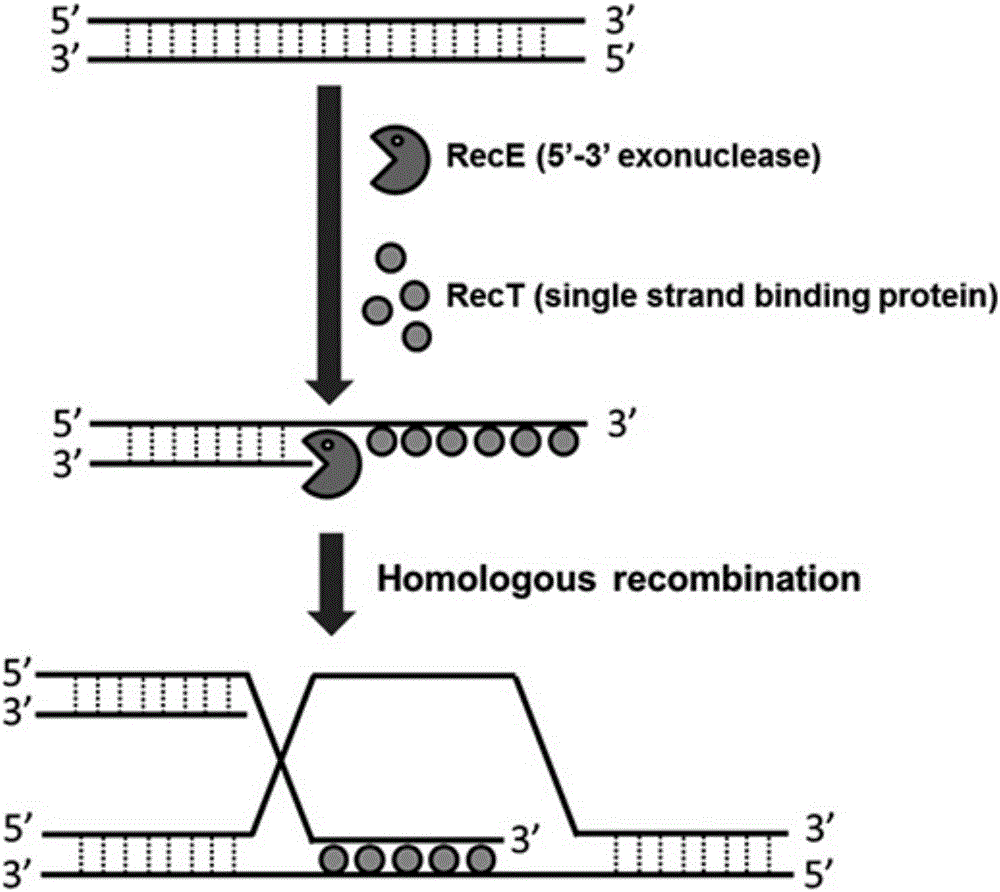
圖2為RecE/RecT系統介導同源重組的發生機制。
圖3為PNPC2-ins-Rcamp1.07質粒的構建圖譜。
圖4為斑馬魚胚胎顯微注射以及轉基因斑馬魚F0代篩選的示意圖以及結果。
其中,圖a:將大范圍核酸內切酶I-SceI與PNPC2-ins-Rcamp1.07質粒共同注射到斑馬魚胚胎處于單細胞階段的受精卵中,每枚受精卵注射大約1nL的混合液;培養至2天魚齡時,在寬場熒光顯微鏡下篩選在胰島位置表達Rcamp1.07的F0代斑馬魚并培養;
圖b:在寬場熒光顯微鏡下Rcamp1.07正確表達在胰島部位的轉基因斑馬魚F0代胚胎;
圖c:在子代F1代中遺傳了ins-Rcamp1.07轉基因的F0代斑馬魚的生殖系轉基因效率的評估。
圖5為對3天魚齡Tg(ins:Rcamp1.07)轉基因斑馬魚進行整胚胰島素抗體免疫熒光染色后胰島部位的共聚焦顯微鏡成像。
其中,圖a:Rcamp1.07蛋白的紅色熒光信號;
圖b:綠色熒光信號指示用胰島素抗體標記的胰島素的表達;
圖c:對a,b兩個通道的熒光信號進行合并;標尺,10μm。
圖6為寬場顯微鏡下Tg(ins:Rcamp1.07)轉基因斑馬魚響應葡萄糖刺激的鈣離子信號的實時成像。
其中,圖a:蒙太奇圖為2天魚齡的Tg(ins:Rcamp1.07)轉基因斑馬魚胚胎于3mM葡萄糖下孵育20min、再加入20mM葡萄糖刺激60min,在此期間每隔一段時間所拍攝的胰島熒光圖像,箭頭標注了發生鈣離子內流的胰島區域;
圖b:對a中標注的胰島區域進行熒光曲線分析;標尺,50μm。
圖7為雙光子三軸光片層熒光顯微鏡下Tg(ins:Rcamp1.07)轉基因斑馬魚響應葡萄糖刺激的鈣離子信號的實時成像。
其中,圖a:雙光子三軸光片層熒光顯微鏡下在體觀測Tg(ins:Rcamp1.07)斑馬魚胰島β細胞功能的示意圖;
圖b:對3天魚齡的Tg(ins:Rcamp1.07)斑馬魚胚胎進行活體成像和三維重構;
圖c:蒙太奇圖為對b中3天魚齡的Tg(ins:Rcamp1.07)斑馬魚胚胎加入20mM葡萄糖刺激后,在15μm和30μm兩個層面每隔20s時間間隔所拍攝的代表性圖像,箭頭標注了3個發生鈣離子內流的胰島β細胞;
圖d:對圖c中標注的胰島β細胞進行熒光曲線分析;標尺,10μm。
具體實施方式
下面結合說明書附圖和具體實施例對本發明作進一步地詳細闡述,所述實施例只用于解釋本發明,并非用于限定本發明的范圍。下述實施例中所使用的試驗方法如無特殊說明,均為常規分子生物學方法;所使用的材料、試劑等,如無特殊說明,為可從商業途徑得到的試劑和材料。
實施例1:斑馬魚模型的構建
1、PNPC2-ins-Rcamp1.07質粒的構建
1.1 斑馬魚胰島素BAC_ins完整基因序列的獲取
斑馬魚BAC_CH211_69I14(BACPAC Resources Center),包含斑馬魚preproinsulin(ins)基因的全部序列以及與其緊鄰的上下游基因(如圖1)。
1.2 斑馬魚胰島素BAC_ins基因修飾
使用RecE/RecT同源重組系統對斑馬魚胰島素BAC_ins基因進行修飾,選用來自λ噬菌體的RecE/RecT同源重組系統,RecE是一種5’-3’核酸外切酶,暴露出單鏈DNA的3’粘性末端;RecT是一種單鏈結合蛋白,它可以結合在單鏈DNA的3’粘性末端上,并介導其與另一條雙鏈DNA上或基因組上的同源序列發生同源重組,從而將目的基因插入和替換(如圖2)。
1.3 PNPC2-ins-Rcamp1.07質粒的構建
利用RecE/RecT同源重組技術把BAC_CH211_69I14上ins基因蛋白編碼序列替換為Rcamp1.07的序列,進一步通過同源重組把修飾后的ins基因全序列亞克隆到含有兩個I-SceI大范圍核酸酶酶切位點的載體上,生成PNPC2-ins-Rcamp1.07質粒(如圖3)。因為Rcamp1.07是一種指示Ca2+濃度的紅色熒光蛋白,與Ca2+結合后,Rcamp1.07的構象發生變化,可以在561nm激光激發下,產生584nm左右的激發光譜,從而指示Ca2+濃度變化。
1.4 PNPC2-ins-Rcamp1.07質粒的具體構建過程,包括如下步驟:
S1.把Rcam1.07蛋白編碼序列克隆到R6K中間載體上,使其下游是frt-kana-frt序列,kana是編碼卡那霉素抗性蛋白。
S2.設計分別包含ins蛋白編碼序列起始ATG上游或下游同源序列的引物,PCR擴增Rcam1.07-frt-kana-frt序列,然后轉染到含有RecE/RecT同源重組系統和BAC_ins的大腸桿菌中,利用卡那霉素篩選Rcamp1.07-frt-kana-frt基因成功插入到BAC_ins載體ins啟動子下游的克隆BAC-ins-Rcamp1.07-frt-kana-frt,所述引物為:
L:5’-ATGTTTTTGATTGACAGAGATTGTATGTGTGTGTTTGTGTCAGTGTGACCCGCCACCATGGGTTCTCATC-3’,
R:5’-CCTGTGTGCAAACAGGTGTTTCTGGCATCGGCGGTGGTCAAATCTCTTCAGGCAGATCGTCAGTCAG-3’;
S3.設計分別包含了ins基因最上游和最下游同源序列的引物,擴增兩端攜帶I-SceI酶切位點的PNPC2載體片段,包含諾爾絲菌素抗性基因cloNAT,轉染到含有RecE/RecT同源重組系統和BAC-ins-Rcamp1.07-frt-kana-frt的大腸桿菌中,利用諾爾絲菌素篩選出生成PNPC2-ins-Rcamp1.07-frt-kana-frt重組質粒的大腸桿菌克隆,在該克隆中PNPC2載體片段成功替換掉BAC上除了修飾后的ins基因之外的全部序列,所述引物為:
L:5’-AGTCCATTAAATAATATCTTGTAGAATTATGTTTTTAAAAAGTACCAATGCCGTAGGGATAACAGGGTAATTTAAGC-3’,
R:5’-CAACTTTTTCACAAACACTGACCAAAACAAGCTACATGTTTTAGAGGCATTAGGGATAACAGGGTAATTGCACTG-3’;
S4.轉染表達flpe的質粒到含有PNPC2-ins-Rcamp1.07-frt-kana-frt的克隆中,催化兩個frt序列的同源重組,去掉卡那霉素抗性基因,最終得到含有質粒PNPC2-ins-Rcamp1.07的大腸桿菌克隆。
2、轉基因斑馬魚Tg(ins:Rcamp1.07)的創建
2.1 斑馬魚胚胎顯微注射
在受精卵中或其卵裂形成的胚胎細胞過程中,I-SceI可以識別質粒PNPC2-ins-Rcamp1.07上的兩個I-SceI識別位點,切割并結合在酶切產物的兩個末端上,隨機將ins-Rcamp1.07序列整合到斑馬魚的基因組中。將大范圍核酸內切酶I-SceI和PNPC2-ins-Rcamp1.07質粒共同注射到斑馬魚的受精卵中(如圖4),受精卵處于單細胞階段;內切酶的最終總效價為20U,質粒的終濃度為100ng/ul。
2.2 轉基因斑馬魚F0代的篩選
將注射了PNPC2-ins-Rcamp1.07質粒的斑馬魚F0代胚胎養到2天魚齡,運用配備汞燈的體式鏡或者寬場熒光顯微鏡對其進行篩選,將Rcamp1.07熒光信號正確定位于胰島部位的幼魚挑選出來,培養至其性成熟;將成年的F0代轉基因魚與AB野生型斑馬魚雜交,對2天魚齡的F1代篩選出在胰島中表達Rcamp1.07的陽性胚胎,使用的方法與F0代相同;選擇熒光信號最強的Tg(ins:Rcamp1.07)轉基因斑馬魚F1代繼續養殖,并將其后代進行大量擴增。
實施例2:轉基因斑馬魚模型的鑒定
為了進一步驗證實施例1所構建的Tg(ins:Rcamp1.07)轉基因斑馬魚中胰腺β細胞被特異性地標記了Rcamp1.07,運用斑馬魚整胚免疫熒光染色技術,用胰島素抗體熒光標記3天魚齡的Tg(ins:Rcamp1.07)轉基因魚中的胰腺β細胞,觀察Rcamp1.07的信號是否準確定位在胰腺β細胞當中,結果顯示,Rcamp1.07的紅色熒光信號定位在由胰島素insulin抗體標記出來的胰島β細胞當中(如圖5),本發明構建的Tg(ins:Rcamp1.07)轉基因斑馬魚是準確報告胰腺β細胞特性的轉基因斑馬魚系β-cell-specific reporter fish。
實施例3:轉基因斑馬魚模型的應用
1.轉基因斑馬魚胰島β細胞群體的應用
試驗方法:使用普通的寬場熒光顯微鏡;
S1.將Tg(ins:Rcamp1.07)轉基因魚孵育在外液E3中,使用普通的寬場熒光顯微鏡,選用561nm波長的激光照射斑馬魚整胚;找到紅色熒光信號所在的斑馬魚胰島部位,精細調節焦面,使得胰島位于顯微鏡的焦平面位置,拍攝20min的基礎鈣信號。
S2.往外液加入20mM葡萄糖刺激,繼續拍攝鈣信號60min;記錄活體斑馬魚內胰島β細胞群體的鈣離子信號隨時間的變化。
E3外液的成分為:5.0mMNaCl,0.17mMKCl,0.33mM CaCl2,0.33mM MgSO4。
結果顯示:在普通的寬場熒光顯微鏡的低倍鏡(10X)視野,當外液加入高濃度的葡萄糖刺激后,轉基因斑馬魚胰島內Rcamp1.07的熒光信號快速增強,并且伴隨著信號強度的周期性波動(如圖6),表明轉基因斑馬魚可以用來指示胰島β細胞群體的功能狀態,即其可以響應葡萄糖刺激而發生鈣離子內流和周期性的鈣離子震蕩。
2.轉基因斑馬魚單個胰島β細胞的應用
因為寬場熒光顯微鏡的低分辨率不能觀測單個胰島β細胞的功能狀態,如果需要對單個胰島β細胞進行觀測其功能狀態,就要使用分辨率更高的熒光顯微鏡,本實驗采用了雙光子三軸光片層熒光顯微鏡(2P3A-DSLM),具體步驟如下:
S1.將Tg(ins:Rcamp1.07)轉基因魚包埋在1%瓊脂糖凝膠中,并孵育在外液E3中;
S2.使用雙光子三軸光片層熒光顯微鏡,用1030nm波長的激光照射斑馬魚整胚,找到紅色熒光信號所在的斑馬魚胰島部位之后,精細調節焦面,使得胰島位于顯微鏡的焦平面位置,調節斑馬魚的成像體位,獲得能夠分辨出單個胰腺β細胞的清晰圖像,拍攝基礎鈣信號30s;
S3.往外液加入20mM葡萄糖刺激,繼續拍攝鈣信號90s,觀察記錄活體斑馬魚內每個胰島β細胞的鈣離子信號的變化。
E3外液的成分為:5.0mMNaCl,0.17mMKCl,0.33mM CaCl2,0.33mM MgSO4。
結果顯示:在高倍鏡(40X)視野下,成功地得到了清晰的高空間分辨率的二維和三維的胰島圖像,得到了高時空分辨率的Ca2+信號隨時間變化的熒光曲線(如圖7)。
相比于單光子激發的寬場熒光顯微鏡系統,2P3A-DSLM成像系統結合了雙光子技術,故穿透深,可以實現對深埋在活體樣本中的胰島進行高分辨率成像;同時因為結合了光片層照明技術,可以實現對活體樣本進行長時間的成像而不發生明顯的熒光漂白。因此,Tg(ins:Rcamp1.07)轉基因斑馬魚可以在2P3A-DSLM高倍鏡下指示每一個胰島β細胞的功能狀態,在高糖刺激下,葡萄糖在胰島β細胞內代謝,產生ATP,提高ATP/ADP比例,關閉ATP依賴型的鉀離子通道,引起細胞膜去極化,從而打開電壓門控的鈣離子通道,發生鈣離子內流和周期性的鈣離子震蕩,升高的鈣離子刺激胰島素囊泡釋放;即高糖刺激下的胞漿內鈣離子水平的實時變化,因此鈣離子內流和鈣離子震蕩是評價胰島β細胞功能的重要指標。
最后應當說明的是,以上實施例僅用以說明本發明的技術方案,而非對本發明保護范圍的限制,盡管參照較佳實施例對本發明作了詳細地說明,本領域的普通技術人員應當理解,可以對本發明的技術方案進行修改或者等同替換,而不脫離本發明技術方案的實質和范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!