一種食用菌液體菌種細菌污染檢測方法與流程
本發明涉及一種液體菌種質量檢測的方法,尤其涉及一種食用菌工廠化栽培過程中液體菌種的質量檢測方法,屬于微生物領域。
背景技術:
我國食用菌工廠化產業經歷了20多年的發展歷程,栽培設施硬件和技術水平均有了巨大的進步與創新。菌種制備作為食用菌工廠化栽培過程的重要環節,逐漸由傳統的基于固體培養基料的二級、三級種生產工藝發展為具有純度高、活力強、周期短、成本低等優點的液體菌種生產工藝。液體菌種的應用大大縮短食用菌栽培周期,為食用菌工廠化高效標準化生產奠定了重要基礎,但液體菌種生產過程極易產生細菌污染,并且傳統固體菌種質量檢查方法很難用來對液體菌種進行質控。
目前文獻報道的有關食用菌液體菌種細菌污染的檢測方法,主要包括感觀判斷、顯微鏡觀察、酸堿度測定以及培養檢測等。通過顏色、氣味以及形態等指標的感觀判斷,雖然對于菌種發酵早期污染有較高準確度,但對始于發酵后期的污染易造成失誤,同時并非所有細菌污染均會形成明顯的感官特征,并且主觀性的感官判斷缺乏統一標準;顯微鏡觀察以及基于酸堿度變化的測定對液體菌種中的少量細菌污染檢測精度不夠,因此這些方法均可能形成誤判,從而可能造成生產上的嚴重損失。與上述檢測方法相比,培養方法可較為準確地判斷液體菌種污染狀況,但由于培養時間一般需要24小時至48小時,檢測時效性較差,可能延誤液體菌種最佳接種時間,降低液體菌種發酵設備的利用效率。因此建立快速、精確的細菌污染檢測技術,是液體菌種技術安全、高效應用的關鍵。
有關食用菌液體菌種質量檢測的專利技術申請只有1件(CN 105087750A,“食用菌液體菌種檢測器”),是一種用于液體菌種濃度檢測的裝置。針對液體菌種細菌污染檢測的專利申請信息幾乎未見。
技術實現要素:
本發明的目的在于提供一種快速、精確測定食用菌液體菌種污染細菌數量的檢測方法。其基本理念是:運用BAClight染色法對經過了特異性分離的食用菌液體菌種中的污染細菌進行熒光染色,通過建立細菌濃度與熒光定量指標的數學關系模型,快速、精確測定食用菌液體菌種污染細菌數量。
為了實現以上目的,本發明的技術方案如下:
本發明提供了一種食用菌液體菌種細菌污染檢測方法,包括如下步驟:
1)標準曲線制備:
分別對獲得的各稀釋度的代表污染細菌稀釋菌懸液進行NB平板培養計數和熒光染色測定,所述的代表污染細菌為食用菌液體菌種常見污染細菌污染細菌G-和G+類污染細菌中分別至少一種,如:假單胞菌(G-)和枯草芽孢桿菌(G+);隨后根據各稀釋度菌懸液平板計數結果(Bq)及相應熒光染色測定結果(Fg)建立標準曲線,以明確每種代表污染細菌數量與熒光值之間線性關系范圍。
進一步地,所述的代表污染細菌可以是兩種或者多種代表污染細菌株;優選地,所述的標準曲線可以是所使用的代表污染細菌株標準曲線的擬合標準曲線。
2)根據食用菌菌絲與細菌細胞個體大小及形態的差異性,采用孔徑適宜的濾膜,即:適合過濾食用菌菌絲的濾膜,如:孔徑5μm尼龍網,對液體菌種進行過濾,將食用菌絲球從液體菌種培養液濾除,避免其對污染細菌定量檢測產生干擾,優選地,重復過濾3次;隨后,對濾液進行離心,棄去培養液,并利用無菌生理鹽水對菌體沉淀物進行洗滌,再沉淀,取無菌水對沉淀細菌細胞進行再懸浮處理,并進行梯度稀釋形成系列梯度菌懸液。
3)對步驟2)中獲得的污染細菌系列梯度菌懸液進行染色并測定熒光值,方法同步驟1)中的標準曲線制備,并依據標準曲線計算食用菌液體菌種中污染細菌濃度。
4)校正系數和校正公式的計算:通過待測菌種定量加入典型污染菌,形成模擬細菌污染液體菌種,并采用步驟2)及3)檢測計算其污染細菌濃度(測量值),并與液體菌種中實際摻入污染細菌濃度比對,獲得校正系數;其校正公式為:實際值=測量值×校正系數。其中,校正系數是考慮抽濾過程污染細菌菌體有一部分仍粘附于食用菌菌絲球中,從而使得通過上述方法獲得的污染細菌濃度低于實際濃度,因此建立了一個校正公式。
通過上述技術方案,本發明達到了如下的有益效果:
本發明提供的液體菌種細菌污染檢測方法可以把檢測時間控制在90分鐘內,測定結果與基于培養的檢測結果誤差小;相對于現有技術中的感官判斷及鏡檢檢測方法具有明顯的準確度優勢,并且相對于傳統培養檢測法具有便捷快速優勢,因此是一種快捷、準確的食用菌液體菌種細菌污染檢測方法;本發明方法針對液體菌種中污染細菌活細胞進行精確的定量測定,從而為食用菌液體菌種工廠化應用提供了快速、準確、便捷的檢測手段,具有較廣泛的應用推廣價值。
附圖說明
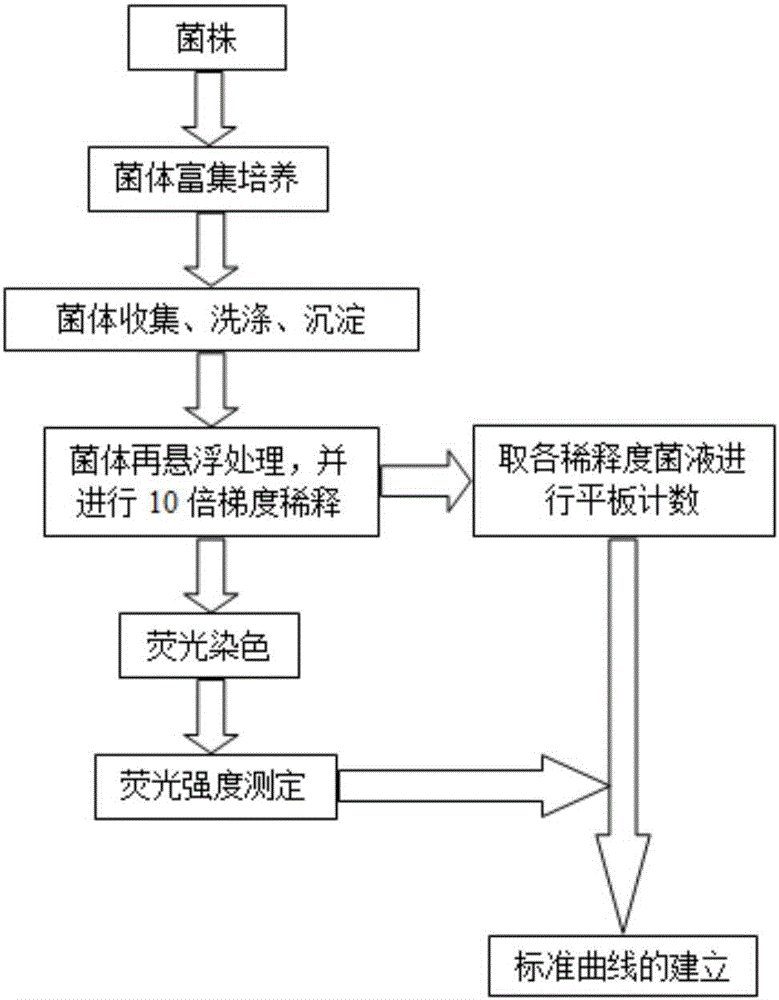
圖1是本發明食用菌液體菌種污染細菌數量熒光染色定量測定標準曲線建立流程圖。
圖2是本發明一種食用菌液體菌種中污染細菌分離與檢測流程圖。
圖3是本發明模擬細菌污染的食用菌液體菌種中細菌數量測定及校正系數確定流程圖。
圖4是本發明中兩種典型污染細菌的熒光染色強度與平板計數結果的關系曲線(標準曲線)。圖中分別列出了熒光假單胞菌和枯草芽孢桿菌活菌濃度與BAClight染色綠熒光強度之間的數學關系以及兩者擬合后的活菌數量與綠熒光強度之間的數學關系。
圖5是抽濾裝置示意圖。其中,無菌環境指超凈工作臺環境,確保空氣中雜菌對抽濾過程產生污染。圖中,1.濾杯,2.夾子,3.濾頭,4.錐形瓶,5.真空泵。
具體實施方式
為了闡明本發明的技術方案及技術目的,下面結合附圖及具體實施方式對本發明做進一步的介紹。
實施例1:
實施例1是本發明所提供的食用菌液體菌種細菌污染檢測方法的一種具體實施方式,包括以下步驟:
1.標準曲線制備
圖1是本發明食用菌液體菌種污染細菌數量熒光染色定量測定標準曲線建立流程,分別采用平板計數與熒光染色兩種方法獲得細菌濃度數值,并構建兩者數學關系,形成標準曲線。本發明是以兩種典型污染細菌假單胞菌及枯草芽孢桿菌純菌株作為樣本的,本流程同樣適用于具體食用菌液體菌種生產過程中其它常見污染細菌熒光定量測定標準曲線的構建。
其具體操作步驟如下:
1.1以常見食用菌液體菌種污染細菌假單胞菌(G-)及枯草芽孢桿菌(G+)作為污染細菌代表菌株,分別接種于滅菌NB液體培養基中搖瓶培養,培養條件:28℃恒溫,搖床轉速:180r/min,培養24小時后培養液細菌濃度(OD600)范圍約為1.8-2.0;
1.2分別取假單胞菌、芽孢桿菌培養液10ml至50ml無菌離心管中,10000r/min離心5min,棄上清;
1.3用滅菌生理鹽水30ml充分洗滌菌體沉淀3次,每次均10000r/min離心5min,棄上清;
1.4取10ml無菌水對沉淀細菌細胞進行再懸浮處理,利用渦旋儀使細菌沉淀在液體中分散均勻,并進行10倍梯度稀釋形成系列梯度菌懸液;分別取200μl各梯度稀釋菌液涂布于滅菌NB平板培養基,28℃恒溫培養24小時后計數,計算各梯度稀釋液中活菌濃度(Bq);
1.5分別對上述制備的假單胞菌、枯草芽孢桿菌梯度稀釋菌懸液(稀釋倍數為100~10-10)進行熒光染色,染色劑分別用2.5mL滅菌去離子水溶解,實驗時等比例混合,具體方法:于1ml系列稀釋菌懸液分別加入25μl SYTO 9+PI(1:1混合),均勻混合,室溫避光染色15min;
1.6利用上海棱光F97Xp熒光分光光度計測定上述各稀釋度細菌染液熒光強度,儀器測定條件:激發波長470nm,發射波長510nm,激發、發射光譜帶寬均為5nm,測定綠光吸收波長(510nm)峰值計為Fg;
1.7依據各稀釋度菌懸液平板計數結果(Bq)及相應熒光染色測定結果(Fg)建立標準曲線,假單胞菌標準曲線為:Fg1=250.7lg(Bq1)+249.2,R2=0.997,檢測范圍5.2×100~5.2×107cfu/ml;芽孢桿菌標準曲線:Fg2=248.5lg(Bq2)+216.7,R2=0.995,檢測范圍8.5×100~8.5×107cfu/ml;擬合標準曲線:Fg=249.6lg(Bq)+232.9,R2=0.996。如圖4所示。考慮到食用菌液體菌種發酵過程細菌污染種類的復雜性可能,本發明以擬合標準曲線數學公式作為以下污染細菌數量的計算公式。
2.食用菌液體菌種中污染細菌的分離與檢測:
食用菌液體菌種中污染細菌分離與檢測流程可見圖2。
具體包括如下步驟:
2.1利用津騰GM-0.33II隔膜真空泵對250ml食用菌液體菌種進行抽濾,收集菌種中污染細菌體。濾膜采用孔徑5μm尼龍網,壓強1500Pa,抽濾過程均在超凈工作臺進行;
2.2取無菌生理鹽水30ml充分洗滌濾膜上的菌絲,并抽濾入細菌收集瓶(見圖5),重復3次,以洗出吸附在菌絲及濾膜表面的細菌細胞;
2.3將上述細菌收集瓶中濾液(約330ml)分批裝入2只50ml無菌離心管(離心管1、離心管2)中,10000r/min離心5min,最終獲得上述濾液菌體沉淀;
2.4取滅菌生理鹽水30ml充分洗滌菌體沉淀2次,每次均10000r/min離心5min,棄上清;取滅菌生理鹽水10ml加入離心管1中,懸浮處理后將懸浮液合并入離心管2,并再取滅菌生理鹽水10ml洗滌離心管1后并入離心管2,重復洗滌1次并將洗滌液并入離心管2。對離心管2離心處理,方法同上,最終獲得食用菌液體菌種中污染細菌細胞沉淀。
2.5取10ml無菌水對沉淀細菌細胞進行再懸浮處理,利用渦旋儀使菌體均勻懸浮,并進行10倍梯度稀釋形成系列稀釋度菌懸液;
2.6取稀釋度為10-1、10-3、10-5、10-7菌懸液1ml,分別加入25μl SYTO 9+PI(1:1混合),均勻混合,室溫避光染色15min;
2.7利用上海棱光F97Xp熒光分光光度計測定染液熒光強度(方法同實施例1中步驟1.6),選擇熒光強度值位于標準曲線線性范圍的樣本,依據擬合的標準曲線(見實施例1中步驟1.7)進行活菌數(Bq)計算,并計算樣本活菌數平均測定值。
實施例2:
本實施例2中,使用實施例1中的方法對模擬細菌污染的金針菇菌液體菌種進行了細菌數量的測定,其流程圖見圖3。
具體包括如下步驟:
1)培養基的制備:平板培養基:PDA培養基;液體培養基:玉米粉5%,麥麩3%,酵母膏1%,蔗糖4%,KH2PO4 0.1%,MgSO4 0.15%,VB1 10mg/L,pH=5.5。
2)金針菇平板菌種制備:將配制好的PDA培養基于高壓蒸汽滅菌鍋中滅菌(121℃,30min)處理后分裝于滅菌培養皿中,冷卻凝固后倒置于恒溫培養箱28℃培養過夜,剔除污染平板;將金針菇菌種接于PDA平板培養基上,于28℃恒溫恒濕培養7d;
3)金針菇液體菌種制備:將200ml液體培養基裝于500ml的錐形瓶,并通過高壓蒸汽滅菌鍋滅菌(121℃,30min),冷卻后每瓶接入3塊1cm2金針菇菌種,28℃恒溫,180r/min搖培8d;搖床中放置無菌濕毛巾,以保證菌種搖培處于恒濕環境。
4)模擬細菌污染金針菇液體菌種制備:分別吸取假單胞菌菌懸液(稀釋平板計數濃度為2.9×107cfu/ml)、芽孢桿菌菌懸液(稀釋平板計數濃度為8.7×107cfu/ml)各10ml分別加入上述培養8d的金針菇液體菌種中并搖勻;
5)金針菇液體菌種污染細菌分離:利用津騰GM-0.33II隔膜真空泵分別對上述混合液進行抽濾(見圖5),濾膜選用孔徑5μm尼龍網,利用滅菌生理鹽水充分洗滌濾膜上的菌絲3次并分別抽濾,對收集的菌體離心沉淀,再懸浮,并進行梯度稀釋獲得一系列稀釋度的菌懸液(具體操作同實施例1中步驟2.1—2.4);
6)分別取系列稀釋度菌懸液中稀釋度為10-1、10-3、10-5、10-7菌懸液1ml,分別加入25μl SYTO 9+PI(1:1混合),并混合均勻,室溫避光染色15min;
7)利用上海棱光F97Xp熒光分光光度計測定染液熒光強度,激發波長470nm,發射波長510nm,激發、發射光譜帶寬均為5nm,測定綠光吸收波長(510nm)的峰值Fg;并根據擬合計算公式計算活菌濃度,假單胞菌計算值分別為1.37×106cfu/ml、1.48×106cfu/ml、1.54×106cfu/ml、1.33×106cfu/ml,與理論值相比,誤差范圍為-8.28%~+6.21%;芽孢桿菌數量分別為4.01×106cfu/ml、4.78×106cfu/ml、3.86×106cfu/ml、4.41×106cfu/ml,與理論值相比,誤差范圍為-11.26%~+9.89%。
實施例3:
本實施例3中,使用實施例1中的方法對模擬細菌污染的杏孢菇菌液體菌種進行了細菌數量的測定,其流程圖見圖3。
1)培養基的制備:平板培養基:PDA培養基;液體培養基:葡萄糖3%,蛋白胨0.2%,酵母膏0.5%,KH2PO4 0.05%,MgSO4 0.05%,VB1 10mg/L,pH=7.5。
2)杏鮑菇平板菌種制備:將PDA培養基于高壓蒸汽滅菌鍋中滅菌(121℃,30min),滅菌后,將培養基分裝入滅菌平板中,冷卻凝固后倒置于恒溫培養箱28℃培養過夜,剔除污染平板;將杏鮑菇菌種接于PDA培養基上,于28℃恒溫恒濕培養7d;
3)杏鮑菇液體菌種制備:將液體培養基分裝于500ml的錐形瓶中,每瓶200ml,并置于高壓蒸汽滅菌鍋中進行滅菌,冷卻后,每瓶培養基接入3塊1cm2杏鮑菇菌種,28℃恒溫,180r/min搖培8d;搖床中放置無菌濕毛巾,以保證菌種搖培處于恒濕環境。
4)模擬細菌污染杏鮑菇液體菌種制備分別吸取假單胞菌菌懸液(稀釋平板計數濃度為2.9×107cfu/ml)、芽孢桿菌菌懸液(稀釋平板計數濃度為8.7×107cfu/ml)各10ml分別加入上述培養8d的杏鮑菇液體菌種中,混合均勻;
5)杏鮑菇液體菌種污染細菌分離:利用津騰GM-0.33II隔膜真空泵分別對上述混合液進行抽濾(見圖5),并利用滅菌生理鹽水充分洗滌濾膜上的菌絲3次并分別抽濾;濾膜選用5μm尼龍網,壓強1500Pa;利用滅菌生理鹽水充分洗滌濾膜上的菌絲3次并分別抽濾,對收集的菌體離心沉淀,再懸浮,并進行梯度稀釋獲得一系列稀釋度的菌懸液(具體操作同實施例1中步驟2.1—2.4);
6)分別取系列梯度菌懸液中稀釋度為10-1、10-3、10-5、10-7菌懸液1ml,分別加入25μl SYTO 9+PI(1:1混合),并混合均勻,室溫避光染色15min;
7)利用上海棱光F97Xp熒光分光光度計測定染液熒光強度,激發波長470nm,發射波長510nm,激發、發射光譜帶寬均為5nm,測定綠光吸收波長(510nm)的峰值Fg;并根據擬合計算公式計算活菌濃度,假單胞菌數量分別為1.34×106cfu/ml、1.42×106cfu/ml、1.58×106cfu/ml、1.30×106cfu/ml,與理論值相比,誤差范圍為-10.34%~+8.97%;芽孢桿菌數量分別為3.93×106cfu/ml、4.16×106cfu/ml、4.56×106cfu/ml、4.81×106cfu/ml,與理論值相比,誤差范圍為-9.66%~+6.89%。
實施例4:
本實施例4中,對某食用菌工廠化生產企業金針菇不同批次液體菌種進行了細菌數量測定。具體包括如下步驟:
1)對某食用菌工廠金針菇液體菌種樣本進行梯度稀釋,分別取200μl各梯度(10-1、10-3、10-5、10-7)稀釋菌液涂布于無菌NB平板28℃恒溫培養24小時計數,每個梯度3個重復,平板菌落數在30-300之間的樣本用于計算活菌數平均值。
2)取250ml金針菇液體菌種按前述(實施例1中步驟2.1—2.4)方法進行抽濾、離心并制作液體菌種中污染細菌梯度稀釋菌懸液。
3)分別取1mL梯度菌懸液(10-1、10-3、10-5、10-7),分別加入25μl SYTO 9+PI(1:1混合),并混合均勻,室溫避光染色15min;利用上海棱光F97Xp熒光分光光度計測定染液熒光強度,激發波長470nm,發射波長510nm,激發、發射光譜帶寬均為5nm,測定綠光吸收波長(510nm)的峰值Fg。
4)依據實施例2和3中模擬細菌污染金針菇及杏鮑菇液體菌種中細菌數量實際值與擬合公式計算值,計算出實際值與測量值間校正系數為1.869,即實際值=測量值×1.896;并根據擬合曲線以及校正系數計算活菌數。金針菇液體菌種不同批次樣本污染細菌數量檢測結果見表1。
表1金針菇液體菌種不同批次樣本污染細菌數量檢測結果
實施例5:
本實施例5中,對某食用菌工廠化生產企業杏鮑菇不同批次液體菌種中細菌數量測定。
具體包括如下步驟:
1)對某食用菌工廠杏鮑菇液體菌種樣本進行梯度稀釋,分別取200μl各梯度稀釋菌液(10-1、10-3、10-5、10-7)接種于滅菌NB平板培養基28℃,恒溫培養24小時后計數,每個稀釋度設3重復,計算方法同5.3.1;
2)取250ml杏鮑菇液體菌種按上述(實施例1中步驟2.1—2.4)方法進行抽濾、離心、洗滌、沉淀后,制作液體菌種中污染細菌梯度稀釋菌懸液;
3)分別取系列梯度菌懸液中稀釋度為10-1、10-3、10-5、10-7的菌懸液1ml,分別加入25μl SYTO 9+PI(1:1混合),并混合均勻,室溫避光染色15min;利用上海棱光F97Xp熒光分光光度計測定染液熒光強度,激發波長470nm,發射波長510nm,激發、發射光譜帶寬均為5nm,測定綠光吸收波長(510nm)的峰值Fg;并根據擬合曲線及實施例4步驟4)中所述的校正系數計算活菌數。杏鮑菇液體菌種不同批次樣本污染細菌數量檢測結果見表2。
表2杏鮑菇液體菌種不同批次樣本污染細菌數量檢測結果
以上顯示和描述了本發明的基本原理、主要特征和本發明的優點。本行業的技術人員應該了解,本發明不受上述實施例的限制,上述實施例和說明書中描述的只是說明本發明的原理,在不脫離本發明精神和范圍的前提下,本發明還會有各種變化和改進,本發明要求保護范圍由所附的權利要求書、說明書及其等效物界定。
- 還沒有人留言評論。精彩留言會獲得點贊!