蛋白質ZmVps29在調控植物籽粒性狀和產量中的應用的制作方法
本發明屬于生物
技術領域:
,具體涉及蛋白質ZmVps29在調控植物籽粒性狀和產量中的應用。
背景技術:
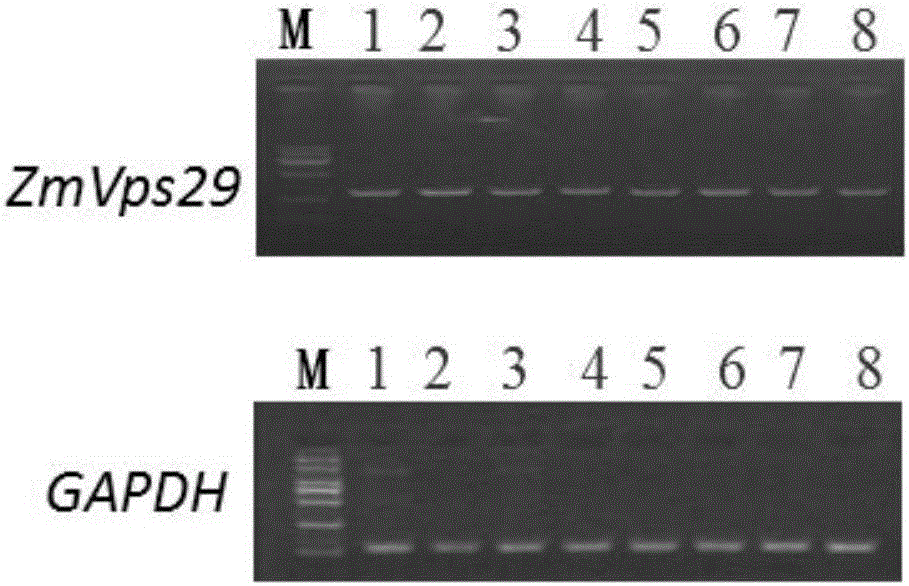
:玉米(ZeamaysL.)是世界上重要的糧食、飼料和工業原料三元作物。隨著世界人口的增加,對于糧食的需求與日俱增,進而對一系列主要糧食作物的產量提出了更高的要求。在可耕地面積的持續減少的情況下,選育單產突出的玉米新品種是穩定和提高玉米總產量最經濟有效的途徑。玉米總產量受單位面積有效穗數、穗粒數和粒重三個因素的影響,三者關系的協調是取得玉米高產的關鍵。作為產量構成因子之一的粒重相對最穩定且受環境條件的影響相對較小,歷來被育種者所重視,因此提高玉米粒重是玉米高產育種的重要途徑之一。玉米籽粒性狀(如粒長,粒寬)是決定粒重的重要因子。因此,尋找與玉米籽粒性狀相關的蛋白質對培育玉米新品種具有重要的意義。技術實現要素:本發明所要解決的技術問題是如何使植物籽粒性狀更優和如何提高植物產量。為解決上述技術問題,本發明首先提供了蛋白質ZmVps29在調控植物籽粒性狀和/或調控植物產量中的應用;所述籽粒性狀可為d1)和/或d2)和/或d3):d1)粒長/粒寬;d2)粒長;d3)粒寬。上述應用中,所述蛋白質ZmVps29可為a1)或a2)或a3):a1)氨基酸序列是序列表中序列2所示的蛋白質;a2)在序列表中序列2所示的蛋白質的N端或/和C端連接標簽得到的融合蛋白質;a3)將序列表中序列2所示的氨基酸序列經過一個或幾個氨基酸殘基的取代和/或缺失和/或添加得到的與植物籽粒性狀和/或植物產量相關的蛋白質。其中,序列表中序列2由188個氨基酸殘基組成。為了使a1)中的蛋白質便于純化,可在序列表中序列2所示的蛋白質的氨基末端或羧基末端連接上如表1所示的標簽。表1標簽的序列上述a3)中的蛋白質,所述一個或幾個氨基酸殘基的取代和/或缺失和/或添加為不超過10個氨基酸殘基的取代和/或缺失和/或添加。上述a3)中的蛋白質可人工合成,也可先合成其編碼基因,再進行生物表達得到。上述a3)中的蛋白質的編碼基因可通過將序列表中序列1所示的DNA序列中缺失一個或幾個氨基酸殘基的密碼子,和/或進行一個或幾個堿基對的錯義突變,和/或在其5′端和/或3′端連上表1所示的標簽的編碼序列得到。編碼所述蛋白質ZmVps29的核酸分子在調控植物籽粒性狀和/或調控植物產量中的應用也屬于本發明的保護范圍;所述籽粒性狀可為d1)和/或d2)和/或d3):d1)粒長/粒寬;d2)粒長;d3)粒寬。上述應用中,編碼所述蛋白質ZmVps29的核酸分子可為如下b1)或b2)或b3)或b4)所示的DNA分子:b1)編碼區如序列表中序列1所示的DNA分子;b2)核苷酸序列是序列表中序列1所示的DNA分子;b3)與b1)或(b2)限定的核苷酸序列具有75%或75%以上同一性,且編碼所述蛋白質ZmVps29的DNA分子;b4)在嚴格條件下與(b1)或(b2)限定的核苷酸序列雜交,且編碼所述蛋白質ZmVps29的DNA分子。其中,所述核酸分子可以是DNA,如cDNA、基因組DNA或重組DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。其中,序列表中序列1由567個核苷酸組成,序列表中序列1的核苷酸編碼序列表中序列2所示的氨基酸序列。本領域普通技術人員可以很容易地采用已知的方法,例如定向進化和點突變的方法,對本發明的編碼所述蛋白質ZmVps29的核苷酸序列進行突變。那些經過人工修飾的,具有與本發明分離得到的所述蛋白質ZmVps29的核苷酸序列75%或者更高同一性的核苷酸,只要編碼所述蛋白質ZmVps29,均是衍生于本發明的核苷酸序列并且等同于本發明的序列。這里使用的術語“同一性”指與天然核酸序列的序列相似性。“同一性”包括與本發明的編碼序列表的序列2所示的氨基酸序列組成的蛋白質ZmVps29的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或計算機軟件進行評價。使用計算機軟件,兩個或多個序列之間的同一性可以用百分比(%)表示,其可以用來評價相關序列之間的同一性。上述應用中,所述調控植物籽粒性狀可為植物籽粒性狀優;所述籽粒性狀優可體現為e1)和/或e2)和/或e3):e1)粒長/粒寬大;e2)粒長長;e3)粒寬小。上述應用中,所述調控植物產量可為增加植物產量。為解決上述技術問題,本發明還提供了培育轉基因植物的方法。本發明所提供的培育轉基因植物的方法,可包括將編碼所述蛋白質ZmVps29的核酸分子導入受體植物中,得到轉基因植物的步驟;與所述受體植物相比,所述轉基因植物的產量增加和/或籽粒性狀改變。上述培育轉基因植物的方法中,所述籽粒性狀改變可為粒長/粒寬增加。上述培育轉基因植物的方法中,所述籽粒性狀改變可為粒長增加。上述培育轉基因植物的方法中,所述籽粒性狀改變可為粒寬減少。上述方法中,編碼所述蛋白質ZmVps29的核酸分子可為如下b1)或b2)或b3)或b4)所示的DNA分子:b1)編碼區如序列表中序列1所示的DNA分子;b2)核苷酸序列是序列表中序列1所示的DNA分子;b3)與b1)或(b2)限定的核苷酸序列具有75%或75%以上同一性,且編碼所述蛋白質ZmVps29的DNA分子;b4)在嚴格條件下與(b1)或(b2)限定的核苷酸序列雜交,且編碼所述蛋白質ZmVps29的DNA分子。其中,所述核酸分子可以是DNA,如cDNA、基因組DNA或重組DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。其中,序列表中序列1由567個核苷酸組成,序列表中序列1的核苷酸編碼序列表中序列2所示的氨基酸序列。上述方法中,所述“將編碼所述蛋白質ZmVps29的核酸分子導入受體植物中”可通過向受體植物中導入重組載體實現;所述重組載體可為向表達載體插入編碼所述蛋白質ZmVps29的核酸分子得到的重組質粒。所述重組載體具體可為重組質粒pCAMBIA3301-ZmVps29。所述重組質粒pCAMBIA3301-ZmVps29具體可為向載體pCAMBIA3301的限制性內切酶BglⅡ和PmlI酶切位點之間插入核苷酸序列是序列表中的序列1所示的DNA分子得到的重組質粒。為解決上述技術問題,本發明還提供了植物育種方法。本發明所提供的植物育種方法,可包括如下步驟:增加植物中所述蛋白質ZmVps29的含量或活性,從而產量增加和/或籽粒性狀改變。上述植物育種方法中,所述籽粒性狀改變可為粒長/粒寬增加。上述植物育種方法中,所述籽粒性狀改變可為粒長增加。上述植物育種方法中,所述籽粒性狀改變可為粒寬減少。上述任一所述粒長/粒寬即粒長與粒寬的比值。上述任一所述粒長/粒寬可為10粒長/10粒寬。上述任一所述產量可為籽粒產量。所述籽粒產量可為單穗產量。上述任一所述植物可為如下c1)至c10)中的任一種:c1)雙子葉植物;c2)單子葉植物;c3)禾本科植物;c4)十字花科植物;c5)擬南芥;c6)野生型擬南芥;c7)玉米自交系黃早四;c8)玉米自交系旅28;c9)玉米自交系鄭58;c10)玉米品種Hi-Ⅱ。本發明還保護如序列表的序列3所示的分子標記甲或如序列表的序列4所示的分子標記乙。本發明還保護一種鑒別或輔助鑒別玉米籽粒性狀的方法,該方法可包括如下步驟:檢測待測玉米的基因組DNA中基于ZmVps29基因的啟動子的基因型為P1純合型還是P2純合型;P1純合型玉米的籽粒性狀優于P2純合型;所述籽粒性狀優體現為e1)和/或e2)和/或e3):e1)粒長/粒寬大;e2)粒長長;e3)粒寬小;P1純合型指的是基因組DNA具有序列表中序列4所示的DNA分子且為純合型;P2純合型指的是基因組DNA具有序列表中序列3所示的DNA分子且為純合型。本發明還保護一種鑒別或輔助鑒別玉米產量的方法,該方法可包括如下步驟:檢測待測玉米的基因組DNA中基于ZmVps29基因的啟動子的基因型為P1純合型還是P2純合型;P1純合型玉米的產量高于P2純合型;P1純合型指的是基因組DNA具有序列表中序列4所示的DNA分子且為純合型;P2純合型指的是基因組DNA具有序列表中序列3所示的DNA分子且為純合型。上述方法中,所述產量可為籽粒產量。所述籽粒產量可為單穗產量。實驗證明,在野生型擬南芥中過表達ZmVPS29基因,得到轉ZmVps29基因擬南芥;與野生型擬南芥相比,轉ZmVps29基因擬南芥的粒長增加和粒長/粒寬增加。實驗還證明,在黃早四或鄭58中過表達ZmVPS29基因,可以顯著的減少10粒寬、增加10粒長/10粒寬和增加單穗產量,籽粒變為細長籽粒。因此,蛋白質ZmVps29在培育籽粒性狀優良和/或植物產量高的植物中具有重要的理論意義和實用價值。附圖說明圖1為實施例3步驟一的實驗結果。圖2為實施例3步驟二的實驗結果。圖3為實施例4的實驗結果。圖4為實施例5步驟二的實驗結果。圖5為實施例5步驟三的實驗結果。圖6為實施例5步驟四的實驗結果。圖7為實施例5步驟五的實驗結果。圖8為實施例6步驟二的實驗結果。圖9為實施例6步驟三中1的實驗結果。圖10為實施例6步驟四的實驗結果。圖11為實施例6步驟四的實驗結果。圖12為實施例6步驟五中1的實驗結果。圖13為實施例6步驟五中1的實驗結果。圖14為實施例6步驟五中2的實驗結果。圖15為實施例6步驟五中2的實驗結果。具體實施方式下面結合具體實施方式對本發明進行進一步的詳細描述,給出的實施例僅為了闡明本發明,而不是為了限制本發明的范圍。下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。玉米自交系黃早四、玉米自交系旅28、玉米自交系鄭58、玉米品種Hi-Ⅱ和玉米自交系B73均來源于國家種質資源庫(網址為:http://www.cgris.net/)。公眾可從中國農業科學院作物科學研究所(即申請人處)獲得,以重復本實驗。在下文中,玉米自交系黃早四簡稱黃早四或HZS或HZ4,玉米自交系旅28簡稱旅28或LV28,玉米自交系鄭58簡稱鄭58或Z58,玉米品種Hi-Ⅱ簡稱Hi-Ⅱ,玉米自交系B73簡稱B73。TRIzol試劑和M-MLV均為Invitrogen公司的產品。pLB零背景快速克隆試劑盒為天根生化科技(北京)有限公司的產品,產品目錄號為VT205-01。克隆載體pLBVector為pLB零背景快速克隆試劑盒中的組件。SYBRPremixExTaqTM試劑盒為北京六合通經貿有限公司的產品,產品目錄號為RR420A。2×SYBRPremixExTaq和50×ROXReferenceDyeII均為SYBRPremixExTaqII試劑盒中的組件。載體pGreen-GFP和載體pCAMBIA3301均記載于如下文獻中:LuM,YingS,ZhangDF,etal.Amaizestress-responsiveNACtranscriptionfactor,ZmSNAC1,confersenhancedtolerancetodehydrationintransgenicArabidopsis[J].PlantCellReports,2012,31(9):1701-1711.,公眾可從中國農業科學院作物科學研究所(即申請人處)獲得,以重復本實驗。酶解液:先將Cellase0.3g、離析酶0.08g、甘露醇1.456g、KCl0.03g和MES0.078g溶于20mL超純水,調節pH值至5.7;然后55℃水浴10min;最后冷卻至室溫后,加入CaCl20.0294g、BSA0.02g和β-巰基乙醇5μL。W5溶液:將NaCl9.0g、CaCl213.875g、2.5mL濃度為2MKCl水溶液和4mLpH5.7、0.5MMES緩沖液溶于適量超純水,然后用超純水定容至1L。MMg溶液:將1.5mL濃度為1M的MgCl2水溶液、0.8mLpH5.7、0.5MMES緩沖液和7.3g甘露醇溶于適量超純水,然后用超純水定容至100mL。40%PEG溶液:將PEG400040g、甘露醇3.64g、10mL濃度為1M的CaCl2水溶液溶于適量超純水,然后用超純水定容至100mL。實施例1、ZmVps29基因的克隆黃早四和旅28具有不同的籽粒性狀:黃早四粒長較短,粒寬較大,表現為圓形籽粒;旅28粒長較長,粒寬較小,表現為細長籽粒;黃早四的粒長/粒寬遠小于旅28的粒長/粒寬,二者的籽粒性狀存在顯著差異。本申請的發明人根據前期玉米籽粒性狀主效QTL的挖掘與圖位克隆等實驗結果,推測玉米基因組中ZmVps29基因與玉米籽粒性狀相關。克隆ZmVps29基因的步驟如下:1、采用TRIzol試劑提取黃早四的幼嫩葉片組織的總RNA,將該總RNA用M-MLV反轉錄出第一鏈cDNA,得到葉片組織的cDNA。2、以步驟1得到的葉片組織的cDNA為模板,以F1:5’-ACTCggATCATggTgTgCAg-3’和R1:5’-CgCATgAACAggTAgAAAgCg-3’為引物進行PCR擴增,得到約721bp的PCR擴增產物。3、按照pLB零背景快速克隆試劑盒說明書的步驟,將步驟2得到的PCR擴增產物和克隆載體pLBVector連接,得到重組質粒pLB-ZmVps29-HZS。對重組質粒pLB-ZmVps29-HZS進行測序。測序結果表明,重組質粒pLB-ZmVps29-HZS中含有序列表中序列1所示的DNA分子(以下命名為ZmVps29基因),表達序列表中序列2所示的蛋白質(以下命名為ZmVps29蛋白或蛋白質ZmVps29)。按照上述方法,將步驟1中的黃早四的幼嫩葉片組織替換為旅28的幼嫩葉片組織,其它步驟均不變,得到重組質粒pLB-ZmVps29-LV28。對重組質粒pLB-ZmVps29-LV28進行測序。測序結果表明,重組質粒pLB-ZmVps29-LV28中也含有序列表中序列1所示的ZmVps29基因,表達序列表中序列2所示的蛋白質ZmVps29。上述結果表明,黃早四和旅28的基因組DNA中,均含有ZmVps29基因。實施例2、ZmVps29基因的啟動子的克隆1、采用CTAB法提取處于三葉一心時期黃早四幼苗的葉片組織的基因組DNA,得到葉片組織的基因組DNA。2、以步驟1得到的葉片組織的基因組DNA為模板,以F2:5’-CTCACCCCCACAAGTCAAGA-3’和R2:5’-CCGACCGAACCAAACAAACA-3’為引物進行PCR擴增,得到約2351bp的PCR擴增產物。3、按照pLB零背景快速克隆試劑盒說明書的步驟,將步驟2得到的PCR擴增產物和克隆載體pLBVector連接,得到重組質粒丙。對重組質粒丙進行測序。結果表明,重組質粒丙中含有序列表中序列3所示的DNA分子。按照上述方法,將步驟1中處于三葉一心時期的黃早四幼苗的葉片組織替換為處于三葉一心時期旅28幼苗的葉片組織,其它步驟均不變,得到重組質粒丁。對重組質粒丁進行測序。結果表明,重組質粒丁中含有序列表中序列4所示的DNA分子。將序列表中序列3所示的DNA分子和序列表中序列4所示的DNA分子進行比對,結果表明,黃早四和旅28的基因組DNA中ZmVps29基因的啟動子的核苷酸序列不同。推測ZmVps29基因的啟動子的核苷酸序列不同造成蛋白質ZmVps29的表達量不同,進而形成不同的籽粒性狀。實施例3、表達模式分析一、不同組織的表達模式1、采用TRIzol試劑提取黃早四材料(黃早四處于三葉一心時期的根、黃早四處于三葉一心時期的莖、黃早四處于三葉一心時期的葉片、黃早四的雌穗、黃早四的雄穗、黃早四的穗位葉、黃早四的花絲或黃早四的籽粒)的總RNA,將該總RNA用M-MLV反轉錄出第一鏈cDNA,得到黃早四材料的cDNA。黃早四材料的cDNA中,DNA濃度為500ng/μL。2、以步驟1得到的黃早四材料的cDNA為模板,采用RT-PCR檢測ZmVps29基因的表達量(以GAPDH基因作為內參基因)。檢測ZmVps29基因的引物為正向引物1:5’-CTTTGCCCTGATCTCCATATTACC-3’和反向引物1:5’-CACGCCTCCCTCGTGCTTAT-3’。檢測GAPDH基因的引物為正向引物2:5’-CCCTTCATCACCACGGACTAC-3’和反向引物2:5’-TCCCACCACGGTTCTTCCAA-3’。實驗結果見圖1(M為DNAmarker,1為黃早四處于三葉一心時期的根,2為黃早四處于三葉一心時期的莖,3為黃早四處于三葉一心時期的葉片,4為黃早四的雌穗,5為黃早四的雄穗,6為黃早四的穗位葉,7為黃早四的花絲,8為黃早四的籽粒)。結果表明,黃早四的基因組DNA中ZmVps29基因為組成型表達基因,在上述黃早四各個組織中均表達。按照上述方法,將黃早四替換為旅28,其它步驟均不變。結果表明,旅28的基因組DNA中ZmVps29基因為組成型表達基因,在旅28各個組織中均表達。二、不同時期的玉米籽粒組織的表達模式1、采用TRIzol試劑提取籽粒(黃早四自交授粉第6天的籽粒、黃早四自交授粉第12天的籽粒、黃早四自交授粉第18天的籽粒、黃早四自交授粉第24天的籽粒、旅28自交授粉第6天的籽粒、旅28自交授粉第12天的籽粒、旅28自交授粉第18天的籽粒或旅28自交授粉第24天的籽粒)的總RNA,將該總RNA用M-MLV反轉錄出第一鏈cDNA,得到籽粒的cDNA。籽粒的cDNA中,DNA濃度為500ng/μL。2、以步驟1得到的籽粒的cDNA為模板,使用SYBRPremixExTaqTM試劑盒檢測ZmVps29基因的相對表達量(以GAPDH基因作為內參基因)。檢測ZmVps29基因的引物為正向引物1:5’-CTTTGCCCTGATCTCCATATTACC-3’和反向引物1:5’-CACGCCTCCCTCGTGCTTAT-3’。檢測GAPDH基因的引物為正向引物2:5’-CCCTTCATCACCACGGACTAC-3’和反向引物2:5’-TCCCACCACGGTTCTTCCAA-3’。反應體系為20μL,由10μL2×SYBRPremixExTaq、0.4μL濃度為10μM的正向引物、0.4μL濃度為10μM的反向引物、0.4μL50×ROXReferenceDyeII、0.8μL黃早四籽粒的cDNA和8.0μL無核酸酶水組成。熒光定量PCR檢測的反應程序為:95℃預變性1min;95℃變性15sec,60℃退火15sec,72℃延伸31sec,40個循環;在95℃變性15sec,60℃退火30sec,72℃延伸15sec時收集溶解曲線,通過采用2-ΔΔCt法(LivakandSchmittgen,2001)分析籽粒的cDNA中ZmVps29基因的相對表達量。以黃早四自交授粉第6天的籽粒的ZmVps29基因的相對表達量作為1,其它籽粒的ZmVps29基因的相對表達量見圖2(注:NS表示差異不顯著,**表示差異極顯著)。結果表明,旅28自交授粉第6天的籽粒的ZmVps29基因的相對表達量顯著高于黃早四自交授粉第6天的籽粒,旅28自交授粉第12天的籽粒的ZmVps29基因的相對表達量顯著高于黃早四自交授粉第12天的籽粒,旅28自交授粉第18天的籽粒的ZmVps29基因的相對表達量顯著高于黃早四自交授粉第18天的籽粒。可見,與黃早四相比,旅28表達的蛋白質ZmVps29較多。因此,蛋白質ZmVps29的表達量越高,則粒長越長,粒寬越小,粒長/粒寬越大。實施例4、亞細胞定位分析一、重組質粒ZmVps29-pGreen-GFP的構建1、以實施例1步驟3得到的重組質粒pLB-ZmVps29-HZS為模板,以F3:5’-TTTTCTAGACATGGTGCTTGTGCT-3’(下劃線為限制性內切酶XbaI的識別位點)和R3:5’-TTTGATATCGCCGTGCATCGTC-3’(下劃線為限制性內切酶EcoRⅤ的識別位點)為引物進行PCR擴增,得到約590bp的PCR擴增產物。2、按照pLB零背景快速克隆試劑盒說明書的步驟,將步驟2得到的PCR擴增產物和克隆載體pLBVector連接,得到重組質粒pLB-ZmVps29。3、用限制性內切酶XbaI和EcoRⅤ雙酶切重組質粒pLB-ZmVps29,回收約590bp的片段甲。4、用限制性內切酶XbaI和EcoRⅤ雙酶切載體pGreen-GFP,回收約5300bp的載體骨架甲。6、將片段甲和載體骨架甲連接,得到重組質粒ZmVps29-pGreen-GFP。根據測序結果,對重組質粒ZmVps29-pGreen-GFP進行結構描述如下:向載體pGreen-GFP的限制性內切酶XbaI和EcoRⅤ酶切位點之間插入核苷酸序列是序列表中的序列1自5’末端起第1位至第564位所示的DNA分子。二、亞細胞定位分析1、制備玉米原生質體(1)取B73的種子,置于培養箱,25℃黑暗培養7-10天,得到玉米幼苗。(2)先切下步驟(1)得到的玉米幼苗第二片葉子的中間部分,然后切割成0.5mm×0.5mm小塊,將這些小塊命名為玉米組織。(3)將步驟(2)得到的玉米組織置于錐形瓶,加入20mL酶解液;然后用錫箔紙包裹錐形瓶,抽真空30min(15個大氣壓);最后置于搖床上,先25℃、40rpm振蕩培養3-4h,再25℃、80rpm振蕩培養5min,得到消化液。(4)取步驟(3)得到的消化液,用尼龍網過濾,得到濾液。(5)取步驟(4)得到的濾液,1000rpm離心2min(離心機設置為緩慢升降速模式),棄上清,將沉淀用W5溶液洗滌1-2次,即為制備的玉米原生質體。2、轉化(1)取步驟1中(5)制備的玉米原生質體,加入適量的W5溶液,然后置于冰上放置30min;離心棄上清,向沉淀中加入適量MMg溶液進行重懸,得到原生質體濃度為5×105個/mL的原生質體溶液。(2)將190μL原生質體溶液、10μL的重組質粒ZmVps29-pGreen-GFP(約15-20μg重組質粒ZmVps29-pGreen-GFP)和200μL濃度為40%PEG溶液輕輕混勻,25℃靜置18min;然后加入1.6mLW5溶液,輕輕混勻,1000rpm離心1min,棄上清,將沉淀用W5溶液洗滌1-2次。(3)完成步驟(2)后,取所述原生質體,加入1.6mLW5溶液,置于細胞培養板中暗培養12-24h;然后置于載玻片上,在激光共聚焦顯微鏡下觀察按照上述方法,將重組質粒ZmVps29-pGreen-GFP替換為載體pGreen-GFP,其它步驟均不變,在共聚焦顯微鏡下觀察,作為對照。實驗結果見圖3(A為載體pGreen-GFP,其中左上為紅光下視野,左下為紅光和綠光疊加下視野,右上為綠光下視野,右下為白光下視野;B為重組質粒ZmVps29-pGreen-GFP,其中左上為紅光下視野,左下為紅光和綠光疊加下視野,右上為綠光下視野,右下為白光下視野):載體pGreen-GFP轉化玉米原生質體后,在細胞核、細胞質和細胞膜上均可觀察到綠色熒光;重組質粒ZmVps29-pGreen-GFP轉化玉米原生質體后,僅在細胞膜上觀察到綠色熒光。因此,蛋白質ZmVps29定位在細胞膜。實施例5、轉基因擬南芥的獲得及鑒定一、重組質粒pCAMBIA3301-ZmVps29、GV3101/pCAMBIA3301-ZmVps29和GV3101/pCAMBIA3301的獲得1、重組質粒pCAMBIA3301-ZmVps29的獲得(1)以實施例1步驟3得到的重組質粒pLB-ZmVps29-HZS為模板,以F4:5’-ccccAGATCTAATGGTGCTTGTGCTTGCGCT-3’(下劃線為限制性內切酶BglⅡ的識別位點)和R4:5’-ttttCACGTGCTAGCCGTGCATCGTCGCAG-3’(下劃線為限制性內切酶PmlI的識別位點)為引物進行PCR擴增,得到約590bp的PCR擴增產物。(2)按照pLB零背景快速克隆試劑盒說明書的步驟,將步驟(1)得到的PCR擴增產物和克隆載體pLBVector連接,得到中間質粒。(3)用限制性內切酶BglⅡ和PmlI雙酶切中間質粒,回收約590bp的片段乙。(4)用限制性內切酶BglⅡ和PmlI雙酶切載體pCAMBIA3301,回收約9000bp的載體骨架乙。(5)將片段乙和載體骨架乙連接,得到重組質粒pCAMBIA3301-ZmVps29。根據測序結果,對重組質粒pCAMBIA3301-ZmVps29進行結構描述如下:向載體pCAMBIA3301的限制性內切酶BglⅡ和PmlI酶切位點之間插入核苷酸序列是序列表中的序列1所示的DNA分子。2、GV3101/pCAMBIA3301-ZmVps29的獲得將重組質粒pCAMBIA3301-ZmVps29導入根癌農桿菌GV3101,得到重組農桿菌,命名為GV3101/pCAMBIA3301-ZmVps29。3、GV3101/pCAMBIA3301的獲得將載體pCAMBIA3301導入根癌農桿菌GV3101,得到重組農桿菌,命名為GV3101/pCAMBIA3301。二、轉基因擬南芥的獲得哥倫比亞生態型擬南芥為ArabidopsisBiologicalResourceCenter的產品,詳見網址http://abrc.osu.edu/。在下文中,哥倫比亞生態型擬南芥簡稱為野生型擬南芥或WT。1、采用擬南芥花序浸花轉化法(Clough,S.J.,andBent,A.F..Floraldip:asimplifiedmethodforAgrobacterium-mediatedtransformationofArabidopsisthaliana.PlantJ.(1998)16,735-743.),將步驟一中2制備的GV3101/pCAMBIA3301-ZmVps29轉至野生型擬南芥中,獲得T1代轉ZmVps29基因擬南芥的種子。2、將T1代轉ZmVps29基因擬南芥的種子種植于營養土中,25℃培養4周,然后噴施Basta篩選,能夠正常生長的擬南芥(抗性苗)即為T1代轉ZmVps29基因陽性苗。T1代轉ZmVps29基因陽性苗收到的種子即為T2代轉ZmVps29基因擬南芥的種子。3、將步驟2篩選出的不同株系的T2代轉ZmVps29基因擬南芥的種子播種于含7mg/L草銨膦(phosphinothricin,PPT)的MS培養基上進行篩選,如果某株系中能夠正常生長的擬南芥(抗性苗)的數目與不能夠正常生長的擬南芥(非抗性苗)的數目比例為3:1,則該株系為ZmVps29基因插入一個拷貝的株系,該株系中的抗性苗收到的種子即為T3代轉ZmVps29基因擬南芥的種子。4、將步驟3篩選出的T3代轉ZmVps29基因擬南芥的種子再次播種于含7mg/LPPT的MS培養基上進行篩選,均為抗性苗的即為T3代純合轉ZmVps29基因擬南芥。將其中13個T3代純合轉ZmVps29基因擬南芥的株系依次命名為OE12-1至OE12-13,并進行后續實驗。T1代轉ZmVps29基因擬南芥的Basta篩選具體見圖4(A和B均為噴施Basta前,C為噴施Basta后)。按照上述方法,將GV3101/pCAMBIA3301-ZmVps29替換為GV3101/pCAMBIA3301,其它步驟均相同,得到T3代純合轉空載體擬南芥的植株,簡稱轉空載體擬南芥。三、分子鑒定1、分別取OE12-1至OE12-13的T3代種子,種植于營養土中,25℃培養4周,得到OE12-1至OE12-13的幼苗。2、分別提取OE12-1至OE12-13的幼苗的葉片的基因組DNA并以其作為模板,采用F4:5’-ccccAGATCTAATGGTGCTTGTGCTTGCGCT-3’和R4:5’-ttttCACGTGCTAGCCGTGCATCGTCGCAG-3’組成的引物對1進行PCR擴增,然后進行電泳。3、分別提取OE12-1至OE12-13幼苗的葉片的基因組DNA并以其作為模板,采用F6:5’-GAAGTCCAGCTGCCAGAAAC-3’和R6:5’-GTCTGCACCATCGTCAACC-3’組成的引物對2進行PCR擴增,然后進行電泳。按照上述方法,將OE12-1的幼苗的葉片的基因組DNA替換為水,其它步驟均相同,作為陰性對照。按照上述方法,將OE12-1的幼苗的葉片的基因組DNA替換為轉空載體擬南芥的幼苗的葉片的基因組DNA,其它步驟均相同,作為對照。按照上述方法,將OE12-1的幼苗的葉片的基因組DNA替換為重組質粒pCAMBIA3301-ZmVps29,其它步驟均相同,作為陽性對照。部分實驗結果見圖5(A為采用引物對1的PCR擴增結果,B為采用引物對2的PCR擴增結果;其中M為DNAMarker,泳道1-10為OE12-1至OE12-10)。結果表明,以OE12-1至OE12-13的幼苗的葉片的基因組DNA或重組質粒pCAMBIA3301-ZmVps29為模板,采用引物對1均能擴增得到587bp的條帶,采用引物對2均能擴增得到444bp的條帶;以水或轉空載體擬南芥的幼苗的葉片的基因組DNA為模板,采用引物對1均不能擴增得到587bp的條帶,采用引物對2均不能擴增得到444bp的條帶。經過分子鑒定,OE12-1至OE12-13均為轉ZmVps29基因擬南芥。四、檢測轉ZmVps29基因擬南芥的cDNA中ZmVps29基因的相對表達量1、采用TRIzol試劑提取擬南芥幼苗(野生型擬南芥幼苗、轉空載體擬南芥幼苗、OE12-1的幼苗、OE12-2的幼苗、OE12-3的幼苗、OE12-4的幼苗、OE12-6的幼苗、OE12-7的幼苗、OE12-8的幼苗、OE12-9的幼苗、OE12-11的幼苗或OE12-13的幼苗)的總RNA,將該總RNA用M-MLV反轉錄出第一鏈cDNA,得到擬南芥幼苗的cDNA。擬南芥幼苗的cDNA中,DNA濃度為500ng/μL。2、以步驟1得到的擬南芥幼苗的cDNA為模板,使用SYBRPremixExTaqTM試劑盒檢測擬南芥幼苗的ZmVps29基因的相對表達量(以Actin基因作為內參基因)。檢測ZmVps29基因的引物為F4:5’-CTTTGCCCTGATCTCCATATTACC-3’和R4:5’-CACGCCTCCCTCGTGCTTAT-3’。檢測Actin基因的引物為正向引物6:5’-AGGTATCGCTGACCGTATGAG-3’和反向引物6:5’-GCTGAGGGAAGCAAGAATG-3’。反應體系為20μL,由10μL2×SYBRPremixExTaq、0.4μL濃度為10μM的正向引物、0.4μL濃度為10μM的反向引物、0.4μL50×ROXReferenceDyeII、0.8μL擬南芥幼苗的cDNA和8.0μL無核酸酶水組成。熒光定量PCR檢測的反應程序為:95℃預變性1min;95℃變性15sec,60℃退火15sec,72℃延伸31sec,40個循環;在95℃變性15sec,60℃退火30sec,72℃延伸15sec時收集溶解曲線,通過采用2-ΔΔCt法(LivakandSchmittgen,2001)分析擬南芥幼苗的cDNA中ZmVps29基因的相對表達量。各個擬南芥幼苗的cDNA中ZmVps29基因的相對表達量見圖6(WT為野生型擬南芥幼苗)。結果表明,OE12-1的幼苗、OE12-2的幼苗、OE12-3的幼苗、OE12-4的幼苗、OE12-6的幼苗、OE12-7的幼苗、OE12-8的幼苗、OE12-9的幼苗、OE12-11的幼苗和OE12-13的幼苗的cDNA中ZmVps29基因均有一定程度的表達,野生型擬南芥幼苗和轉空載體擬南芥幼苗的cDNA中均沒有ZmVps29基因的表達。五、轉ZmVps29基因擬南芥的籽粒性狀的鑒定實驗重復三次取平均值,每次重復的步驟如下:分別將野生型擬南芥種子、轉空載體擬南芥種子、OE12-1的T3代種子、OE12-2的T3代種子、OE12-3的T3代種子、OE12-4的T3代種子、OE12-6的T3代種子、OE12-7的T3代種子、OE12-8的T3代種子、OE12-9的T3代種子、OE12-11的T3代種子和OE12-13的T3代種子種植于營養土中,25℃培養至成熟,收獲種子。將收獲的種子置于40倍體視鏡下拍照,利用ImageJ軟件測量種子的粒長和粒寬,并計算粒長/粒寬。部分實驗結果見圖7(WT為野生型擬南芥)和表2:轉ZmVps29基因擬南芥的種子為細長籽粒,均表現為粒長增加、粒長/粒寬增加,大部分籽粒的粒寬增加;野生型擬南芥種子和轉空載體擬南芥種子的粒長、粒寬和粒長/粒寬無顯著差異;與野生型擬南芥種子相比,OE12-8的T3代種子、OE12-6的T3代種子、OE12-9的T3代種子和OE12-11的T3代種子的粒長和粒寬均有顯著差異、粒長/粒寬無顯著差異,E12-1的T3代種子、OE12-2的T3代種子和OE12-7的T3代種子的粒長、粒寬和粒長/粒寬均有顯著差異,OE12-3的T3代種子、OE12-4的T3代種子和OE12-13的T3代種子的粒長和粒長/粒寬均有顯著差異。表2擬南芥粒長/粒寬P值粒長P值粒寬P值WT1.732無93.885無54.412無OE12-81.733NS108.940**63.071**OE12-61.746NS107.880**61.925**OE12-91.778NS111.630**63.078**OE12-111.783NS101.470**57.178**OE12-21.784*104.110**58.596**OE12-11.798*105.020**58.639**OE12-71.804**105.490**58.691**OE12-41.843**101.960**55.560NSOE12-131.875**103.940**55.729NSOE12-31.913**101.680**53.434NS注:NS表示P>0.05,即差異不顯著;*表示0.01<P≤0.05,即差異顯著;**表示P≤0.01,差異極顯著。上述結果表明,蛋白質ZmVps29可調控擬南芥籽粒的性狀。實施例6、轉基因玉米的獲得及鑒定一、重組質粒pCAMBIA3301-ZmVps29和EHA105/pCAMBIA3301-ZmVps29的獲得1、重組質粒pCAMBIA3301-ZmVps29的獲得同實施例4步驟一中1。2、EHA105/pCAMBIA3301-ZmVps29的獲得將重組質粒pCAMBIA3301-ZmVps29導入根癌農桿菌EHA105,得到重組農桿菌,命名為EHA105/pCAMBIA3301-ZmVps29。二、T0代轉ZmVps29基因玉米的獲得采用農桿菌侵染玉米幼胚的轉化方法,將步驟一中2制備的EHA105/pCAMBIA3301-ZmVps29轉至Hi-Ⅱ中,獲得T0代擬轉ZmVps29基因玉米。在T0代擬轉ZmVps29基因玉米的葉片上涂抹Basta,葉片能夠正常生長的植株(抗性苗)即為T0代轉ZmVps29基因玉米。T0代擬轉ZmVps29基因玉米的Basta篩選具體見圖8(左圖為玉米葉片能夠正常生長,右圖為玉米葉片不能夠正常生長)。將得到三個T0代轉ZmVps29基因玉米分別命名為ZmVPS12-1、ZmVPS12-2和ZmVPS12-3。三、T1代轉ZmVps29基因玉米的獲得1、T1代轉ZmVps29基因的黃早四*ZmVPS12-1的獲得(1)采集ZmVPS12-1的花粉,與黃早四進行雜交,得到T1代擬轉ZmVps29基因的黃早四*ZmVPS12-1。(2)分別提取T1代擬轉ZmVps29基因的黃早四*ZmVPS12-1的葉片的基因組DNA并以其作為模板,以F7:5’-CCTTCGCAAGACCCTTCCTC-3’和R7:5’-TCGCCGTCAATCAGCTCGTA-3’為引物進行PCR擴增,得到PCR擴增產物。將PCR擴增產物進行瓊脂糖凝膠電泳,然后進行如下判斷:如果能夠獲得584bp的PCR擴增產物,則相應的T1代擬轉ZmVps29基因的黃早四*ZmVPS12-1為T1代轉ZmVps29基因的黃早四*ZmVPS12-1;如果不能獲得584bp的PCR擴增產物,則相應的T1代擬轉ZmVps29基因的黃早四*ZmVPS12-1為T1代未轉ZmVps29基因的黃早四*ZmVPS12-1。部分實驗結果見圖9(M為DNAMarker,泳道1-75為75個T1代擬轉ZmVps29基因的黃早四*ZmVPS12-1。采用上述方法可以得到T1代轉ZmVps29基因的黃早四*ZmVPS12-1和T1代未轉ZmVps29基因的黃早四*ZmVPS12-1。2、T1代轉ZmVps29基因的黃早四*ZmVPS12-2的獲得按照步驟1的方法,將“ZmVPS12-1的花粉”替換為“ZmVPS12-2的花粉”,其它步驟均不變,得到T1代轉ZmVps29基因的黃早四*ZmVPS12-2和T1代未轉ZmVps29基因的黃早四*ZmVPS12-2。3、T1代轉ZmVps29基因的黃早四*ZmVPS12-3的獲得按照步驟1的方法,將“ZmVPS12-1的花粉”替換為“ZmVPS12-3的花粉”,其它步驟均不變,得到T1代轉ZmVps29基因的黃早四*ZmVPS12-3和T1代未轉ZmVps29基因的黃早四*ZmVPS12-3。4、T1代未轉ZmVps29基因的黃早四*Hi-Ⅱ的獲得采集Hi-Ⅱ的花粉,與黃早四進行雜交,得到T1代未轉ZmVps29基因的黃早四*Hi-Ⅱ。5、T1代轉ZmVps29基因的鄭58*ZmVPS12-1的獲得按照步驟1的方法,將“黃早四”替換為“鄭58”,其它步驟均不變,得到T1代轉ZmVps29基因的鄭58*ZmVPS12-1和T1代未轉ZmVps29基因的鄭58*ZmVPS12-1。6、T1代轉ZmVps29基因的鄭58*ZmVPS12-2的獲得按照步驟1的方法,將“黃早四”替換為“鄭58”且將“ZmVPS12-1的花粉”替換為“ZmVPS12-2的花粉”,其它步驟均不變,得到T1代轉ZmVps29基因的鄭58*ZmVPS12-2和T1代未轉ZmVps29基因的鄭58*ZmVPS12-2。7、T1代轉ZmVps29基因的鄭58*ZmVPS12-3的獲得按照步驟1的方法,將“黃早四”替換為“鄭58”且將“ZmVPS12-1的花粉”替換為“ZmVPS12-3的花粉”,其它步驟均不變,得到T1代轉ZmVps29基因的鄭58*ZmVPS12-3和T1代未轉ZmVps29基因的鄭58*ZmVPS12-3。8、T1代未轉ZmVps29基因的鄭58*Hi-Ⅱ的獲得采集Hi-Ⅱ的花粉,與鄭58進行雜交,得到T1代未轉ZmVps29基因的鄭58*Hi-Ⅱ。四、檢測T1代轉ZmVps29基因玉米中的ZmVps29基因的相對表達量1、玉米材料的獲得(1)隨機取5株T1代轉ZmVps29基因的黃早四*ZmVPS12-1,進行如下操作:分別取旗葉,混合,得到黃早四*ZmVPS12-1的葉片材料;分別取自交授粉第6天的籽粒,混合,得到黃早四*ZmVPS12-1的籽粒材料。(2)按照步驟(1)的方法,將T1代轉ZmVps29基因的黃早四*ZmVPS12-1替換為T1代轉ZmVps29基因的黃早四*ZmVPS12-2,其它步驟均不變,得到黃早四*ZmVPS12-2的葉片材料和黃早四*ZmVPS12-2的籽粒材料。(3)按照步驟(1)的方法,將T1代轉ZmVps29基因的黃早四*ZmVPS12-1替換為T1代轉ZmVps29基因的黃早四*ZmVPS12-3,其它步驟均不變,得到黃早四*ZmVPS12-3的葉片材料和黃早四*ZmVPS12-3的籽粒材料。(4)按照步驟(1)的方法,將T1代轉ZmVps29基因的黃早四*ZmVPS12-1替換為T1代未轉ZmVps29基因的黃早四*Hi-Ⅱ,其它步驟均不變,得到黃早四*Hi-Ⅱ的葉片材料和黃早四*Hi-Ⅱ的籽粒材料。2、采用TRIzol試劑提取玉米材料(黃早四*ZmVPS12-1的葉片材料、黃早四*ZmVPS12-1的籽粒材料、黃早四*ZmVPS12-2的葉片材料、黃早四*ZmVPS12-2的籽粒材料、黃早四*ZmVPS12-3的葉片材料、黃早四*ZmVPS12-3的籽粒材料、黃早四*Hi-Ⅱ的葉片材料或黃早四*Hi-Ⅱ的籽粒材料)的總RNA,將該總RNA用M-MLV反轉錄出第一鏈cDNA,得到玉米材料的cDNA。玉米材料的cDNA中,DNA濃度為500ng/μL。3、以步驟2得到的玉米材料的cDNA為模板,使用SYBRPremixExTaqTM試劑盒檢測玉米材料的ZmVps29基因的相對表達量(以GAPDH基因作為內參基因)。檢測ZmVps29基因的引物為正向引物1:5’-CTTTGCCCTGATCTCCATATTACC-3’和反向引物1:5’-CACGCCTCCCTCGTGCTTAT-3’。檢測GAPDH基因的引物為正向引物2:5’-CCCTTCATCACCACGGACTAC-3’和反向引物2:5’-TCCCACCACGGTTCTTCCAA-3’。反應體系為20μL,由10μL2×SYBRPremixExTaq、0.4μL濃度為10μM的正向引物、0.4μL濃度為10μM的反向引物、0.4μL50×ROXReferenceDyeII、0.8μL擬南芥幼苗的cDNA和8.0μL無核酸酶水組成。熒光定量PCR檢測的反應程序為:95℃預變性1min;95℃變性15sec,60℃退火15sec,72℃延伸31sec,40個循環;在95℃變性15sec,60℃退火30sec,72℃延伸15sec時收集溶解曲線,通過采用2-ΔΔCt法(LivakandSchmittgen,2001)分析玉米材料的ZmVps29基因的相對表達量。以黃早四*Hi-Ⅱ的葉片材料的ZmVps29基因的相對表達量作為1,其它葉片材料的相對表達量見圖10(WT為黃早四*Hi-Ⅱ的葉片材料,ZmVPS12-1為黃早四*ZmVPS12-1的葉片材料,ZmVPS12-2為黃早四*ZmVPS12-2的葉片材料,ZmVPS12-3為黃早四*ZmVPS12-3的葉片材料)。以黃早四*Hi-Ⅱ的籽粒材料的ZmVps29基因的相對表達量作為1,其它籽粒材料的相對表達量見圖11(WT為黃早四*Hi-Ⅱ的籽粒材料,ZmVPS12-1為黃早四*ZmVPS12-1的籽粒材料,ZmVPS12-2為黃早四*ZmVPS12-2的籽粒材料,ZmVPS12-3為黃早四*ZmVPS12-3的籽粒材料)。結果表明,T1代轉ZmVps29基因的黃早四*ZmVPS12-1、T1代轉ZmVps29基因的黃早四*ZmVPS12-2或T1代轉ZmVps29基因的黃早四*ZmVPS12-3的葉片或自交授粉第6天的籽粒的ZmVps29基因的相對表達量均顯著高于T1代未轉ZmVps29基因的黃早四*Hi-Ⅱ。按照上述方法,將“T1代轉ZmVps29基因的黃早四*ZmVPS12-1”替換為“T1代轉ZmVps29基因的鄭58*ZmVPS12-1”,將“T1代轉ZmVps29基因的黃早四*ZmVPS12-2”替換為“T1代轉ZmVps29基因的鄭58*ZmVPS12-2”,將“T1代轉ZmVps29基因的黃早四*ZmVPS12-3”替換為“T1代轉ZmVps29基因的鄭58*ZmVPS12-3”,將“T1代未轉ZmVps29基因的黃早四*Hi-Ⅱ”替換為“T1代未轉ZmVps29基因的鄭58*Hi-Ⅱ”,其它步驟均不變,得到各個玉米材料的相對表達量。結果表明,T1代轉ZmVps29基因的鄭58*ZmVPS12-1、T1代轉ZmVps29基因的鄭58*ZmVPS12-2或T1代轉ZmVps29基因的鄭58*ZmVPS12-3的葉片或自交授粉第6天的籽粒的ZmVps29基因的相對表達量均顯著高于T1代未轉ZmVps29基因的鄭58*Hi-Ⅱ。五、籽粒性狀的鑒定1、測量待測果穗上種子的10粒長(cm)和10粒寬(cm)。待測果穗為步驟三中1得到的T1代轉ZmVps29基因的黃早四*ZmVPS12-1的果穗、步驟三中1得到的T1代未轉ZmVps29基因的黃早四*ZmVPS12-1的果穗、步驟三中2得到的T1代轉ZmVps29基因的黃早四*ZmVPS12-2的果穗、步驟三中2得到的T1代未轉ZmVps29基因的黃早四*ZmVPS12-2的果穗、步驟三中3得到的T1代轉ZmVps29基因的黃早四*ZmVPS12-3的果穗、步驟三中3得到的T1代未轉ZmVps29基因的黃早四*ZmVPS12-3的果穗、步驟三中5得到的T1代轉ZmVps29基因的鄭58*ZmVPS12-1的果穗、步驟三中5得到的T1代未轉ZmVps29基因的鄭58*ZmVPS12-1的果穗、步驟三中6得到的T1代轉ZmVps29基因的鄭58*ZmVPS12-2的果穗、步驟三中6得到的T1代未轉ZmVps29基因的鄭58*ZmVPS12-2的果穗、步驟三中7得到的T1代轉ZmVps29基因的鄭58*ZmVPS12-3的果穗或步驟三中7得到的T1代未轉ZmVps29基因的鄭58*ZmVPS12-3的果穗。部分實驗結果圖12和圖13。2、測量待測果穗上種子的10粒長(cm)、10粒寬(cm)、10粒長/10粒寬和單穗產量(g)。待測果穗為步驟三中1得到的T1代轉ZmVps29基因的黃早四*ZmVPS12-1的果穗、步驟三中2得到的T1代轉ZmVps29基因的黃早四*ZmVPS12-2的果穗、步驟三中3得到的T1代轉ZmVps29基因的黃早四*ZmVPS12-3的果穗、步驟三中4得到的T1代未轉ZmVps29基因的黃早四*Hi-Ⅱ的果穗、步驟三中5得到的T1代轉ZmVps29基因的鄭58*ZmVPS12-1的果穗、步驟三中6得到的T1代轉ZmVps29基因的鄭58*ZmVPS12-2的果穗、步驟三中7得到的T1代轉ZmVps29基因的鄭58*ZmVPS12-3的果穗或步驟三中8得到的T1代未轉ZmVps29基因的鄭58*Hi-Ⅱ的果穗。實驗結果見圖14(左上為10粒長,右上為10粒寬,左下為10粒長/10粒寬,右下為單穗產量;WT為T1代未轉ZmVps29基因的黃早四*Hi-Ⅱ,ZmVPS12-1為T1代轉ZmVps29基因的黃早四*ZmVPS12-1,ZmVPS12-2為T1代轉ZmVps29基因的黃早四*ZmVPS12-2,ZmVPS12-3為T1代轉ZmVps29基因的黃早四*ZmVPS12-3)和圖15(左上為10粒長,右上為10粒寬,左下為10粒長/10粒寬,右下為單穗產量;WT為T1代未轉ZmVps29基因的鄭58*Hi-Ⅱ,ZmVPS12-1為T1代轉ZmVps29基因的鄭58*ZmVPS12-1,ZmVPS12-2為T1代轉ZmVps29基因的鄭58*ZmVPS12-2,ZmVPS12-3為T1代轉ZmVps29基因的鄭58*ZmVPS12-3)。上述結果表明,在黃早四或鄭58中過表達ZmVPS29基因,可以顯著的減少10粒寬、增加10粒長/10粒寬和增加單穗產量,籽粒變為細長籽粒。因此,蛋白質ZmVps29可調控玉米籽粒的性狀和單穗產量。<110>中國農業科學院作物科學研究所<120>蛋白質ZmVps29在調控植物籽粒性狀和產量中的應用<160>4<170>PatentInversion3.5<210>1<211>567<212>DNA<213>玉米ZeamaysL.<400>1atggtgcttgtgcttgcgctgggggatctgcacatcccgcaccgggcgcccgacctcccc60gccaaattcaagtccatgctcgtgcccggcaagatccaacacatcatctgcactggcaat120ctctgcatcaaggaagtccatgactacctgaaaagcctttgccctgatctccatattacc180agaggtgaacatgatgaggatgctcgatacccagagactaagacacttacaattggtcag240tttaagcttgggctgtgccatggccatcaggttgttccatggggcgacctggactccctg300gcgatgctccagcggcagctggacgtggacatcctggtgaccgggcacacgcaccagttc360aaggcatataagcacgagggaggcgtggtgatcaaccctggctctgccacgggcgcctac420agcagcatcacttacgacgtgaacccaagctttgtgctgatggacatcgacgggctccgt480gtggtggtgtacgtctacgagctgattgacggcgaggtgaaggtggacaaaatcgacttc540aagaagactgcgacgatgcacggctag567<210>2<211>188<212>PRT<213>玉米ZeamaysL.<400>2MetValLeuValLeuAlaLeuGlyAspLeuHisIleProHisArgAla151015ProAspLeuProAlaLysPheLysSerMetLeuValProGlyLysIle202530GlnHisIleIleCysThrGlyAsnLeuCysIleLysGluValHisAsp354045TyrLeuLysSerLeuCysProAspLeuHisIleThrArgGlyGluHis505560AspGluAspAlaArgTyrProGluThrLysThrLeuThrIleGlyGln65707580PheLysLeuGlyLeuCysHisGlyHisGlnValValProTrpGlyAsp859095LeuAspSerLeuAlaMetLeuGlnArgGlnLeuAspValAspIleLeu100105110ValThrGlyHisThrHisGlnPheLysAlaTyrLysHisGluGlyGly115120125ValValIleAsnProGlySerAlaThrGlyAlaTyrSerSerIleThr130135140TyrAspValAsnProSerPheValLeuMetAspIleAspGlyLeuArg145150155160ValValValTyrValTyrGluLeuIleAspGlyGluValLysValAsp165170175LysIleAspPheLysLysThrAlaThrMetHisGly180185<210>3<211>2351<212>DNA<213>人工序列<220><223><400>3ctcacccccacaagtcaagaacaggtaccacaggatgaggcgcatggaggatgctgcgat60gtgttcgtgagaggtctaggccgtcgtctcctagtcaactttgggttgctggatcgttgt120ctccttaccatgtaattatttatttattttgtacagaactcctattatatagtaaagtta180ttacattcatttctgtaccatgatttatcatatgtgtgagacttggtcccagcacacctg240gtgattatgttcgcgcctgggtccctaaaactcgagtgtgacagagggcgtgcggagatg300gccggaaaacgcgtgaacgtggacgcatccacgatgggggcgtgggtgggaggttaggga360cgaggtctgacgggtgggtccgcaggacagagagagaggatgagcgcgtgcgaggggatc420agcaccgacaggccgaccccacagagcacagagagagagagaaggggtgcgtgggctggc480gccgataggccgggtccgtctgtccgacttgggctgaaatggttttttctatttttcagg540gaatttctagtgtttttctatttatgttctctagggttttgaattcaaattcaaactaaa600tcaaacatgtgcaacaatttaaaaaatatttggagctcagcacgatgcaacatttcatga660ctcatattattttgacaaaataaaataatcaacccctcactaattaagctaattctacta720aaaagaaaaagagagagaaactagagagagaggagtaacacctgaatttggtaggtaatt780agaaagaaattttatacccccaaatttagggtgttacaacctctgcggacaaggcaaaat840gcgcagttatttgaaaggaatattcgaaccaaggttcgatctaccacggccacggcccgc900cggcggcggcggcacgcgcgtgtgtggtcgtctttcattcttttcccaacttcttaatag960atgcaccaattggtgcacctatttaagttgattgattgatctcttaaacttacaatatgg1020tactaaattattagtacaccatatcattaaagtggaccactagcattgactattattgaa1080tattaattgggccaagccaacattaatccaatataaacaatgataattaggtaatatttt1140gaataatatggatgacataaatcttgaaaatataggatacatggagattatgtattgaac1200ttgagaaatctatagacagagtttctgaattgaactaggtaaatctgtaaacgggaatac1260tgaattatactccctctctttagaaaattaacaaattcttacaatacttgatgtatgtat1320tatatatatgtgtatagatttattatcattcatttgaatatagacataaaaccaagatct1380aaaacgaatactattttagacggagagagtatagatttgtaagaatctatttagctgatg1440tatcctttcagttaggattcaatttttttttaataggaggattcaaattttttgatagta1500catctagattctagaccgtcgatctttcaaacgttgaaaagaggaagaagagcttgacgt1560tttgcttagcttaacgctagcccaacgaacttggcgaaaccgatggagcctcaaacgggc1620cgtatccgtcgtgcacagcatgctaaagcccagtgctgacgacgacgaacaacactcatc1680cggcccggtcatgagcccaatgcggggccacttcgtcgtttttgacaagtagacccacag1740tggccccacgtgcttgcccctccctttctcttctccccttgtgtcgcgctcgcgcatctg1800aagcaagggggggaagggccaagggggatcggtcttgttctcggagagggttgagctgct1860tgacggttttgactcggatcatggtgtgcagctctatcagatagagagctgacgtgaggt1920gtgagacgcggatcgtggagtactactcagtaggagaggtggggagggggaagaaggcga1980tagccggggaggatggtgcttgtgcttgcgctgggggatctgcacatcccgcaccgggcg2040cccgacctccccgccaaattcaagtccatgctcgtgcccggcaagatccaacacatcatc2100tgcactggcaatctctgcatcaaggtaaccttaccttccgcgcctggccggccggccggg2160taaccggcgtccctcggcgatcgattttacaatcctttcctctcgcctcatgtgtccaat2220ttttgcgctggctaggtcgtactgccgcggatagttgcatcacgtgagaaatcgttatgg2280ttcttaggtcgtgctgggatcagccgcatcgctgtattagtctactgcagttgtttgttt2340ggttcggtcgg2351<210>4<211>2367<212>DNA<213>人工序列<220><223><400>4ctcacccccacaagtcaagaacaggtaccacaggatgaggcgcatggaggatgctgcgat60gtgttcgtgagaggtctaggccgtcgtctcctagtcaactttgggttgatggatcgttgt120ctccttaccatgtatttatttatttattttgtacagaactcctattatatagtaaagtta180ttacattcgtttctgtaccatgatttatcatatgtgtgagacttggtcccagcgcacctg240gtgattatgttcgcgcccgggtccctaaaacccgagtgtgacagagggcgtgcggagatg300gccggaaaacgcgtgaacgtggacgcatccacgatgggggcgtgggtgggaggttaggga360cgaggtctgacgggtgggtccgcagggcagagagagaggatgagcgcgtgcgaggggatc420agcaccgacaggccgaccccacagagcagagagagagagagagaaggggtgcgtgggctg480gcgccgataggccgggtccgtctgtccgacttgggctgaaatggttttttctatttttca540gggaatttctaatgtttttctatttatgttctctagggttttgaattcaaattcaaacta600aatcaaacatgtgcaacaatttaaaaaatatttggagctcaccacgatgcaacatttcat660gactcatattgttttgacaaaataaaataatcaacccctcactaattaagctaattctac720taaaaagaaaaagagagagaaactagagagagaggagtaacacctgaatttggtaggtaa780ttagaaagaaattttatacccccaaatttagggtgttacaacctctgcggacaaggcaaa840atgcgcagttatttgaaaggaatattcgaaccaaggttcgatctaccacggccacggccc900gccggcggcggcggcacgcgcgcgtgtggtcgtttttcattcttttcccaacttcttaat960agatgcaccaattggtgcacctatttaagttgattgattgatctcttgaacttacaatat1020gatactaaattattagtataccatatcattaaagtggaccactagcattgactattattg1080aatattaattgggccaagccaacattaatccaatataaacaatgataattaggtaatatt1140ttgaataatatggatggcataaatcttgaaaatataggatacatggagattatgtattga1200acttgagaaatctatagacagagtttctgaattgaactaggtaaatctgtaaacgggaat1260actgaattatactccctctctttagaaaattaacaaattcttacaatacttgatgtatgt1320attatatatatgtgtatagatttattatcattcatttgaatatagacataaaaaccaaga1380tctaaaacgaatactattttagacggagagagtatagatttgtaagaatctatttagctg1440atgtatcctttcagttaggattcaatttttttttaataggaggattcaaattttttgata1500gtacatctagattctagaccgtcgatctttcaaacgttgaaaagaggaagaagagcttga1560cgttttgcttagcttaacgctagcccaacgaacttggcgaaaccgatggagcctcaaacg1620ggccgtatccgtcgtgcacagcatgctaaagcccagtgctgacgacgacgaacaacactc1680atccggcccggtcatgagcccaatgcggggccacttcgtcgtttttgacaagtagaccca1740cagtggccccacgtgcttgcccctccctttctcttctccccttgtgtcgcgctcgcgcat1800ctgaagcaagggggggaagggccaagggggatcggtcttgttctcggagagggttgagct1860gcttgacggttttgactcggatcatggtgtgcagctctatcagatagagagctgacgtga1920ggtgtgagacgcggatcgtggagtactactcagtaggagatcaagaggaaggaggtgggg1980agggggaagaaggcgatagccggggaggatggtgcttgtgcttgcgctgggggatctgca2040catcccgcaccgggcgcccgacctccccgccaaattcaagtccatgctcgtgcccggcaa2100gatccaacacatcatctgcactggcaatctctgcatcaaggtaaccttaccttccgcgcc2160tggccggccggccgggtaaccggcgtccctcggcgatcgattttacaatcctttcctctc2220gcctcatgtgtccaatttttgcgctggctaggtcgtactgccgcggatagttgcatcacg2280tgagaaatcgttatggttcttaggtcgtgctgggatcagccgcatcgctgtattagtcta2340ctgcagttgtttgtttggttcggtcgg2367當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1