一種水溶性的生物硫醇雙光子熒光探針及其制備方法和應用與流程
本發明涉及一種水溶性的生物硫醇雙光子熒光探針及其制備方法和應用,屬于有機小分子熒光探針領域。
背景技術:
半胱氨酸(Cys)、同型半胱氨酸(Hcy)、谷胱甘肽(GSH)是細胞內非常重要的三種小分子生物硫醇,維持著生命體的各項生理平衡。當人體內生物硫醇的含量異常時,會導致人體出現各種疾病,例如升至緩慢、神經性中毒、心血管疾病、器官衰竭等。所以,快速、定量的檢測出人體內生物硫醇的含量具有重要意義。
相比于傳統的檢測方法,光譜法檢測具有操作方便、成本低、空間分辨率高等優點,而且隨著光學成像技術的發展,熒光檢測法已做到在細胞、組織以及活體中的實時監控,在生物領域發揮著重要的作用。而且雙光子技術相比于單光子技術,可以減弱光漂白和光毒性,減小樣品的檢測背景,提高信噪比,能夠更好的得到樣品的立體成像。但是,目前報道了許多生物硫醇探針,基于不同的熒光團,利用不同的反應機理識別三種生物硫醇。但是,硫化氫具有相似巰基結構,而且具有更強的親核性,一直存在著干擾生物硫醇檢測的問題。因此,研發出在復雜生物環境中特異性檢測生物硫醇的生物熒光傳感器是必不可少的。
技術實現要素:
針對目前有機小分子熒光探針在生物硫醇的檢測中所面臨的問題,本發明通過分子設計,合成出一種水溶性的生物硫醇雙光子熒光探針,該探針可以用于水環境和生物環境中生物硫醇的傳感檢測。
本發明還提供了上述熒光探針的制備方法和應用。
本發明采用以下技術方案:
一種水溶性的生物硫醇雙光子熒光探針,其結構式如式(I)所示:
上述的水溶性生物硫醇雙光子熒光探針的制備方法,它包括如下步驟:
(1)將1mmol化合物1與1.2mmol 6-羥基萘醛(化合物2)在氮氣氛圍下加至反應瓶中,然后將0.5mL冰醋酸和30mL乙醇一次加至上述反應器中,于氮氣氛圍下在加熱回流6h后,點板檢測反應完全,反應液冷至室溫,析出沉淀,抽濾,得到粗產品,用無水乙醇重結晶,得到紅色產物NBI;
(2)將1mol化合物NBI和0.5mL三乙胺溶解在干燥的20mL二氯甲烷中,冰浴條件下,逐滴滴入3mmol丙烯酰氯的二氯甲烷溶液,冰浴下反應1h后,室溫反應2h停止反應,有機相用二次水洗三次,干燥,抽濾,減壓濃縮,粗產品通過柱色譜分離即得到目標探針化合物。
所述步驟(2)中柱色譜分離提純所用洗脫劑配比為CH2Cl2:MeOH=25:1。
本發明探針分子的合成路線如下所示:
本發明所述的雙光子熒光探針的應用,該熒光探針可用于水環境和生物體系中生物硫醇的傳感檢測;所述傳感檢測包含熒光檢測、細胞成像和組織成像檢測。
本發明的優點:(1)該探針的合成方法簡單,識別硫醇迅速;(2)本發明通過熒光光譜檢測實現了生物硫醇的定量檢測,且不受性質相似的硫化氫分子的干擾;(3)該探針具有雙光子熒光性質,能夠實現生物細胞內的雙光子成像以及肝臟和腫瘤組織成像。因此,本發明是一種簡單,快速,靈敏的生物硫醇特異性檢測試劑,在生物分子檢測領域具有廣闊的應用前景。其性能將在實施例中結合附圖給予詳細說明。
附圖說明
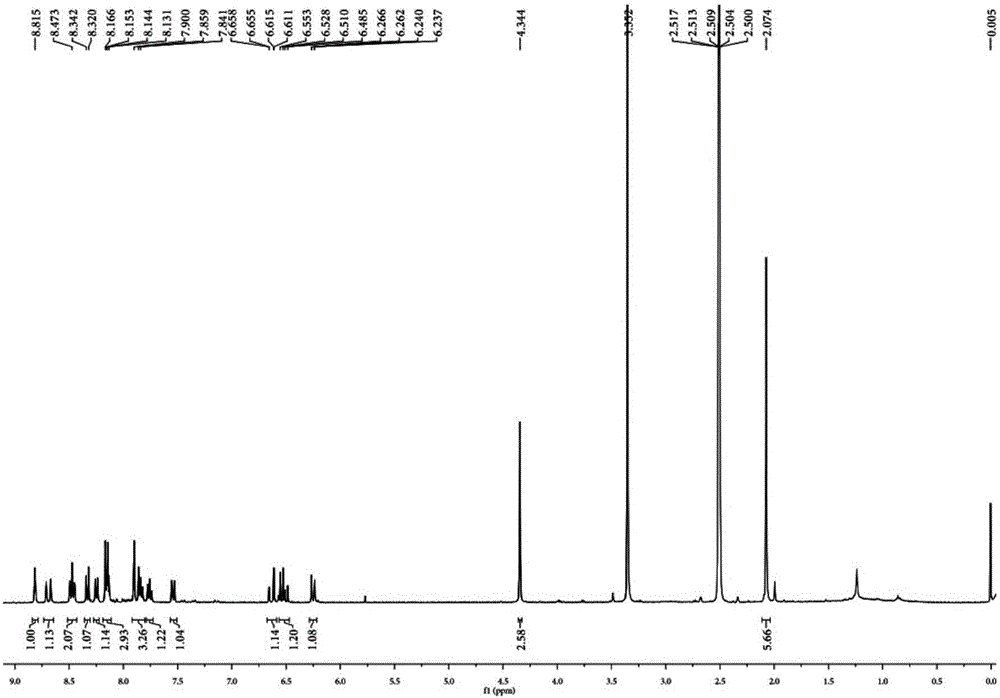
圖1為探針ANBI的核磁氫譜圖。
圖2為探針ANBI的PBS緩沖液的溶液加入多種硫醇的熒光發射圖譜。
圖3為探針ANBI的PBS緩沖液的溶液加入多種分析物的熒光發射柱狀圖譜。
圖4為探針ANBI的PBS緩沖液的溶液隨半胱氨酸的加入量逐漸增大的熒光變化圖。
圖5為探針ANBI在HeLa細胞內的單光子熒光成像圖和雙光子熒光成像圖。a-d為HeLa細胞用5.0μM探針ANBI孵育后的成像圖,e-h為HeLa細胞先用500μM N-乙基馬來酰亞胺(NEM)孵育,再用5.0μM探針ANBI孵育后的成像圖。其中,a,e為明場下細胞圖,b,f為單光子激發波長(λex=488nm)下細胞成像圖,c為a-b的疊加圖,g為e-f的疊加圖,d,h為雙光子激發波長(λex=780nm)下的細胞成像圖。
圖6為探針ANBI在小鼠肝臟中的單光子熒光成像圖和雙光子熒光成像圖,其中(a)單光子熒光成像圖;(b)單光子熒光成像三維圖;(c)雙光子熒光成像圖;(d)雙光子熒光成像三維圖。
圖7為探針ANBI在腫瘤中的單光子熒光成像圖和雙光子熒光成像圖,其中(a)單光子熒光成像圖;(b)單光子熒光成像三維圖;(c)雙光子熒光成像圖;(d)雙光子熒光成像三維圖。
具體實施方式
下面結合實施例和附圖對本發明做進一步說明,但本發明不受下述實施例的限制,實施例中化合物的號碼對于上述方案中化合物的號碼。
實施例1
探針化合物ABNI的合成:
將化合物1(1mmol,0.172g)與化合物2(1.2mmol,0.421g)在氮氣氛圍下加至反應瓶中,然后將冰醋酸(0.5mL)和乙醇(30mL)一次加至上述反應器中,于氮氣氛圍下在加熱回流6h后,點板檢測反應完全。反應液冷至室溫,析出沉淀,抽濾,得到粗產品,用無水乙醇重結晶,得到紅色產物NBI,產率為75%。1H NMR(400MHz,DMSO-d6):δ=10.45(s,1H,-OH),8.63(d,J=13.7Hz,2H),8.46(d,J=8.4Hz,1H),8.31(d,J=8.9Hz,2H),8.23(d,J=8.1Hz,1H),8.12(d,J=9.0Hz,1H),7.94(d,J=8.8Hz,1H),7.89(d,J=8.8Hz,1H),7.83(t,J=7.2Hz,1H),7.74(dd,J=15.6and 7.8Hz,2H),7.28-7.19(m,2H),4.30(s,3H),2.06(s,6H).13C NMR(100MHz,DMSO-d6):δ=182.72,159.09,153.06,139.97,138.32,137.79,135.12,133.59,131.94,131.30,130.51,129.83,128.88,127.72,127.68,12.53,127.16,124.96,123.64,120.37,113.75,111.51,109.99,54.09,35.39,25.75.HRMS:m/z[M+H]+calcd for[C27H24NO]+378.1858,found 378.1858.
將化合物NBI(1mol)和0.5mL三乙胺溶解在干燥的二氯甲烷(20mL)中。冰浴條件下,逐滴滴入丙烯酰氯(3mmol)的二氯甲烷溶液。冰浴下反應1h后,室溫反應2h停止反應。有機相用二次水洗三次,干燥,抽濾,減壓濃縮。粗產品通過柱色譜層析提純,洗脫劑為CH2Cl2:MeOH=25:1,得到暗紅色固體即為目標探針產物ANBI,產率41%。1H NMR(400MHz,DMSO-d6):δ=8.81(s,1H),8.69(d,J=16.5Hz,1H),8.47(t,J=8.3Hz,2H),8.33(d,J=8.9Hz,1H),8.25(d,J=8.2Hz,1H),8.15(dd,J=8.9,5.1Hz,3H),7.82-7.90(m,3H),7.76(t,J=7.6Hz,1H),7.54(dd,J=8.8and 2.3Hz,1H),6.63(dd,J=17.3and 1.4Hz,1H),6.52(dd,J=17.3and 10.2Hz,1H),6.25(dd,J=10.2and 1.4Hz,1H),4.34(s,3H),2.07(s,6H).13C NMR(100MHz,DMSO-d6):δ182.93,164.66,151.98,150.62,139.94,138.77,135.95,134.65,134.04,133.76,132.76,131.40,131.26,130.53,129.10,129.95,127.99,127.77,127.11,125.40,123.76,123.38,119.52,113.87,113.59,54.37,35.67,25.50.HRMS:m/z[M+H]+calcd for[C30H26NO]+432.1964,found 432.1957.
實施例2
探針ANBI在PBS緩沖溶液中的光譜測試:
取實施例1制備的探針ANBI溶于DMSO中,制成1mM的儲備液。從儲備液中取出30μL加入到5mL的離心管當中,用PBS緩沖溶液(0.1mol/L,pH=7.2)稀釋至3mL,加入不同分析物Cys、GSH、H2S,在激發波長470nm下測量其熒光性質,結果如圖2所示。圖2可以看出,對于Cys、GSH生物硫醇能夠引起熒光的增強,而H2S只能使熒光淬滅完全。這表明該探針的選擇性較好,能夠抵抗硫化氫對生物硫醇檢測的干擾。
為進一步說明本發明探針的選擇性和抗干擾能力,本發明還研究了該探針在加入多種不同分析物(Cys,GSH,Alanine,Arginine,Aspartic acid,Glutamic acid,Histidine,Phenylalanine,Serine,Threonine,Tryptophan and Valine,K+,Ca2+,Na+,Fe3+,Zn2+,H2O2)和不同當量的半胱氨酸標準溶液時的熒光性質,結果如圖3和圖4所示。圖3表示探針與多種被檢測物在最大發射波長590nm處強度,由結果可以看出,該探針在多種被檢測物中的選擇性和抗干擾能力均較好。圖4顯示,隨著半胱氨酸加入量的增加,熒光逐漸增強,因而該探針可以實現半胱氨酸的定量檢測,最低檢測限可達到0.38μM。
實施例3
細胞內熒光成像測試:
在37℃條件下,將HeLa細胞在加入5.0μM的探針ANBI的細胞培養液中培養20min,PBS緩沖溶液洗滌三次后,置于共聚焦熒光顯微鏡下分別進行單光子(λex=488nm)熒光成像和雙光子(λex=780nm)熒光成像,結果如圖5a-d所示。其中,對比實驗是將HeLa細胞先用500μM N-乙基馬來酰亞胺(NEM)孵育20min,再加入5.0μM的探針ANBI的細胞培養液培養20min,PBS緩沖溶液洗滌三次后,置于共聚焦熒光顯微鏡下進行單光子(λex=488nm)熒光成像和雙光子(λex=780nm)熒光成像。
圖5中,a-d為HeLa細胞用5.0μM探針ANBI孵育后的成像圖,e-h為HeLa細胞先用500μM N-乙基馬來酰亞胺(NEM)孵育,再用5.0μM探針ANBI孵育后的成像圖。其中,a,e為明場下細胞圖,b,f為單光子激發波長(λex=488nm)下細胞成像圖,c為a-b的疊加圖,g為e-f的疊加圖,d,h為雙光子激發波長(λex=780nm)下的細胞成像圖。圖5的紅色熒光顯示,探針ANBI滲透進細胞內,在單雙光子激發下都呈現紅色熒光。對照實驗中,利用NEM處理生物細胞HeLa即是將細胞內生物硫醇進行清除的過程,然后再加入探針ANBI之后,通過圖5中的結果可以看出無法實現細胞發光,這充分說明生物硫醇是引起細胞發光的唯一原因,因而可以利用該探針對細胞內的生物硫醇進行定性或定量檢測。
實施例4
組織成像實驗:
用20μM的探針ANBI孵育小鼠肝臟和腫瘤組織20min,PBS緩沖溶液洗滌三次后,置于共聚焦熒光顯微鏡下進行單光子(λex=488nm)熒光成像和雙光子(λex=780nm)熒光成像。圖6為小鼠肝臟成像,圖7為腫瘤組織成像,其中(a)單光子熒光成像圖;(b)單光子熒光成像三維圖;(c)雙光子熒光成像圖;(d)雙光子熒光成像三維圖。圖5-6的熒光成像圖顯示,探針可以達到肝臟的85μm深度,即使對于難于滲透的腫瘤細胞,依然能達到50μm的深度。
- 還沒有人留言評論。精彩留言會獲得點贊!