一株干巴菌菌株及其發酵得到的干巴菌菌絲體鋅多糖及應用的制作方法
本發明涉及菌絲體多糖
技術領域:
,特別涉及一株干巴菌菌株,還涉及此菌株液體發酵得到的干巴菌菌絲體鋅多糖,及干巴菌菌絲體鋅多糖的應用。
背景技術:
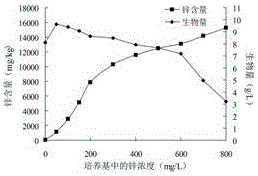
:鋅是人體內執行生理功能最多的必須微量元素,廣泛參與酶活性調控、物質代謝、基因表達調控、免疫系統調控、激素調節等一系列生物學過程。但是鋅元素不能在體內合成和儲存,只能通過每天補充獲得,而每天在膳食中獲得的鋅元素往往不能滿足人們的生理需要。據報道,世界上50%的人口面臨鋅攝入量不足的風險。缺鋅引起的營養失衡問題是目前世界上面臨的主要營養健康問題之一。由于鋅元素的重要生理作用,多年來人們一直致力于研發更好的補鋅產品,補鋅產品不斷的更新換代。第一代補鋅產品為硫酸鋅等無機鋅鹽。無機鋅鹽生物利用率低,服用后副作用較多,已經被逐漸淘汰。第二代補鋅產品為葡萄糖酸鋅等有機酸鋅。有機酸鋅會產生腸胃刺激,對其他微量元素的吸收容易產生拮抗作用,更不適于糖尿病人補鋅。第三代補鋅產品為氨基酸螯合鋅。氨基酸螯合鋅的生產工藝并不完善,存在蛋白原料成本高、蛋白分解要求高、有機溶劑消耗量大和對環境污染嚴重等問題。目前,生物態有機鋅是補鋅產品研制與開發的主流。微生物可以將環境中的無機鋅吸收轉化為微生物細胞內的生物態有機鋅,這種生物態有機鋅沒有任何毒副作用、更加易于吸收、生物利用率高。食用真菌有很強的吸收轉化微量元素的特性,以食用真菌為載體進行微量元素的生物富集已經逐漸引起人們的重視。食用真菌富集鋅元素可以通過固體栽培獲得富鋅子實體或液體發酵培養獲得富鋅菌絲體這兩條途徑實現。其中,液體發酵培養有明顯的優越性。液體發酵不僅具有生產周期短,菌絲體產量高,多糖等活性成分含量高,對鋅等金屬元素的有效富集率高的優點。而且可以進行大規模生產和連續化生產,沒有實現人工栽培的食用真菌品種也可以通過液體發酵技術獲得有價值的代謝產物。因此,液體發酵技術有利于食用真菌產業從勞動密集型產業向技術密集型產業轉變,并有利于提高食用真菌產品的附加值。近年來的研究表明,食用真菌吸收富集鋅元素后會形成鋅蛋白和鋅多糖等富鋅有機物,從而將環境中的無機鋅吸收轉化形成鋅多糖。食用真菌多糖本身具有降血糖、降血脂、抗衰老、抗氧化、提高免疫力、提高記憶力、抗腫瘤、保護肝臟等廣泛的生物學功效。而鋅多糖是食用真菌將無機鋅轉化成有機鋅的有效形式之一,并且它是一種有機鋅-多糖配合物,兼有多糖與有機鋅兩者的活性,表現出高于單一多糖或單一鋅的生物活性。本課題組研究發現干巴菌在液體發酵培養時菌絲體生長旺盛,對鋅元素的耐受和吸收能力強。干巴菌(ThelephoraganbajunZang)為革菌屬(Thelephora)真菌,異香濃郁,珍貴稀少,僅僅分布在我國滇中800~2300m高海拔地區的弱酸性紅壤地面上,與松樹有外生菌根關系,目前人工栽培尚未成功。干巴菌不僅口感好而且營養價值極高,可以增強人體的免疫功能,每年7~10月份干巴菌上市時總是供不應求,優質干巴菌市場價格如今已經上漲到了2000元/kg。由于其分布的局限性,國內外對干巴菌的研究極為有限,主要集中在干巴菌的分類、菌種分離、菌種鑒定和生態環境等方面。因此,干巴菌是一種具有極高經濟價值及營養價值的亟待研究開發的菌種資源。CN103719833A公開了一種富硒干巴菌粉,以干巴菌菌絲為原料,經過干燥、研磨步驟制備得到。但其說明書中沒有記載硒的存在形式,也就無法判斷此種形式的硒是否易被人體吸收。目前未見干巴菌液體發酵制備干巴菌菌絲體鋅多糖及活性研究的報道。技術實現要素:為了解決以上現有技術中補鋅產品效果差、不易吸收、腸胃刺激、生物利用度不高的問題,本申請提供了一株菌絲體鋅多糖產量高并且鋅多糖中鋅元素含量高的干巴菌(ThelephoraganbajunZang)菌株TG-1。本發明還提供了干巴菌菌株TG-1發酵得到的干巴菌菌絲體鋅多糖及制備方法。本發明還提供了干巴菌菌絲體鋅多糖的應用。本發明是通過以下步驟得到的:一株干巴菌菌株TG-1,其保藏編號為CGMCCNo.12977。干巴菌菌株TG-1發酵得到的干巴菌菌絲體鋅多糖,干巴菌菌株TG-1CGMCCNo.12977在添加有鋅鹽的液體培養基中發酵,菌絲體經過分離,提取干巴菌菌絲體鋅多糖。干巴菌菌絲體鋅多糖的鋅含量為1000~15000mg/kg。所述的干巴菌菌絲體鋅多糖,液體培養基中優選鋅鹽為硫酸鋅、醋酸鋅、氯化鋅或氧化鋅。所述的干巴菌菌絲體鋅多糖,優選添加有鋅鹽的液體培養基中含有馬鈴薯150~250g/L,葡萄糖15~25g/L,硫酸鎂0.5~2.5g/L,磷酸二氫鉀0.5~2.5g/L,鋅濃度50~600mg/L,在15~35℃發酵培養。所述的干巴菌菌絲體鋅多糖,菌絲體經過分離,提取干巴菌菌絲體鋅多糖的優選操作如下:(1)將菌絲體分離后凍干或烘干,并粉碎得到干巴菌富鋅菌絲體粉末;(2)干巴菌富鋅菌絲體粉末與去離子水以1﹕10~1﹕30的比例混合,調節pH值為7~9,超聲波破碎,超聲功率為100~800w,超聲時間為5~20min,然后置于40~100℃水浴中,提取1~3h,離心取上清液;(3)離心后的富鋅菌絲體殘渣按步驟(2)再提取2~4次,合并上清液;(4)采用下述方法中的一種:①將上清液濃縮至原體積的3/4~1/2,上清液中加入1~3倍體積乙醇,靜置至沉淀完全析出,3000~15000r/min離心5~15min,棄上清并于40~60℃條件下烘干,獲得干巴菌鋅多糖。②將上清液濃縮至原體積的3/4~1/2,上清液中加入1~3倍體積乙醇,靜置至沉淀完全析出,3000~15000r/min離心5~15min,棄上清并于40~60℃條件下烘干,烘干后再次溶解,離心(3000~15000r/min,5~15min),上清液除蛋白,凍干,獲得干巴菌鋅多糖。所述的干巴菌菌絲體鋅多糖在制備補鋅抗衰老保健品中的用途。所述的用途,優選所述的保健品是具有清除自由基、抗氧化作用的保健品。本發明的有益效果:1)在液體發酵時干巴菌菌株TG-1具有很好的鋅元素吸收轉化能力,鋅元素耐受能力(鋅耐受濃度可以達到50~600mg/L),以及旺盛的菌絲體生長能力。干巴菌TG-1可以很好的富集鋅元素,制備鋅多糖,鋅多糖中鋅含量可以達到1000~15000mg/kg。因此,干巴菌菌株TG-1對干巴菌菌絲體鋅多糖的生產以及提高鋅多糖中鋅的含量具有非常重要的意義;2)利用液體發酵途徑,制備干巴菌菌絲體鋅多糖,為干巴菌的資源化利用提供了一條有效途徑;3)干巴菌菌絲體鋅多糖具有顯著的還原力和清除超氧陰離子自由基、羥基自由基和DPPH自由基的能力,可以顯著提高衰老小鼠體內的抗氧化酶活性,同時降低小鼠體內的脂質過氧化水平。菌種保藏信息保藏時間:2016年9月23日,保藏單位:中國微生物菌種保藏管理委員會普通微生物中心,保藏編號:CGMCCNo.12977,保藏單位地址:北京市朝陽區北辰西路1號院3號中國科學院微生物研究所,郵政編碼:100101分類命名:干巴菌Thelephoraganbajun。附圖說明圖1干巴菌菌株TG-1鋅元素的富集能力,圖2干巴菌菌株TG-2鋅元素的富集能力,圖3干巴菌菌株TG-3鋅元素的富集能力,圖4干巴菌菌株TG-4鋅元素的富集能力,圖5鋅多糖MZPS和多糖MPS的抗氧化能力(A:還原力;B:羥基自由基清除能力),圖6鋅多糖MZPS和多糖MPS對衰老小鼠SOD水平的影響(NC為空白對照組,MC為衰老模型組,I,II,III為MPS低、中、高劑量組,IV,V,VI為MZPS低、中、高劑量組),圖7鋅多糖MZPS和多糖MPS對衰老小鼠T-AOC水平的影響(NC為空白對照組,MC為衰老模型組,I,II,III為MPS低、中、高劑量組,IV,V,VI為MZPS低、中、高劑量組),圖8鋅多糖MZPS和多糖MPS對衰老小鼠LPO含量的影響(NC為空白對照組,MC為衰老模型組,I,II,III為MPS低、中、高劑量組,IV,V,VI為MZPS低、中、高劑量組),圖9鋅多糖MZPS和多糖MPS對衰老小鼠MDA含量的影響(NC為空白對照組,MC為衰老模型組,I,II,III為MPS低、中、高劑量組,IV,V,VI為MZPS低、中、高劑量組)。具體實施方式下面通過具體的實施例對本發明進行詳細說明,但這些例舉性實施方式的用途和目的僅用來例舉本發明,并非對本發明的實際保護范圍構成任何形式的任何限定,更非將本發明的保護范圍局限于此。實施例1干巴菌菌株的獲得分別于云南省不同地區采集4個新鮮干巴菌子實體,用75%酒精進行表面消毒,再用無菌水沖洗數次后,用滅菌鑷子撕取干巴菌內部組織小塊接種到含氯霉素的馬鈴薯葡萄糖(PDA)培養基平板上,移入24℃培養箱中培養,待長出菌絲后,反復純化,直至獲得干巴菌純培養物。于4個干巴菌子實體中分別篩選獲得4株干巴菌菌種,并分別命名為TG-1、TG-2、TG-3、TG-4。實施例2干巴菌菌株TG-1、TG-2、TG-3、TG-4富鋅能力分析分別取0.5cm2干巴菌菌種TG-1、TG-2、TG-3、TG-4接入PDA液體培養基中于搖床24℃震蕩培養7d,然后分別將其轉接入含有不同濃度鋅的PDA液體培養基中(鋅濃度為0、50、100、150、200、300、400、500、600、700、800mg/L,以ZnSO4·7H2O的形式添加),每個梯度5個重復,500mL三角瓶裝液量為250mL,于搖床24℃震蕩培養10d。發酵結束后,離心(10000r/min,10min)分離干巴菌菌絲體,并用去離子水洗滌菌絲體3遍。將菌絲體于55℃烘箱中烘干,測定菌絲體生物量及菌絲體中鋅元素的含量。圖1~4分別為TG-1、TG-2、TG-3、TG-4發酵時培養基中鋅濃度與菌絲體生物量及鋅含量的關系圖。培養基中適當濃度的鋅元素促進干巴菌菌絲體的生長,而鋅濃度過高時產生抑制作用。干巴菌TG-1菌絲體生長旺盛,鋅元素耐受能力強,菌絲體中鋅元素含量高,具有良好的鋅元素富集能力。干巴菌TG-2與TG-1相比菌絲的生長能力較差,菌絲體生物量較低。干巴菌TG-3與TG-1相比鋅元素的耐受能力較差。而干巴菌TG-4菌絲體中鋅元素的含量較TG-1低。因此,干巴菌菌株TG-1是富集鋅元素的理想菌株,當鋅濃度為50mg/L時,干巴菌菌絲體生物量最高,為9.63g/L。當鋅濃度小于等于300mg/L時,鋅元素起到促進干巴菌菌絲體生長的作用。當鋅濃度大于等于400mg/L時,鋅元素逐漸產生毒性作用,抑制干巴菌菌絲體的生長。實施例3干巴菌的富鋅液體發酵進行發酵罐培養實驗。①菌種的活化。分別將干巴菌TG-1、TG-2、TG-3、TG-4接種于活化PDA培養基平板上,24℃培養7d。②種子培養。分別取0.5cm2干巴菌活化菌種接入富鋅PDA液體培養基中(馬鈴薯200g/L,葡萄糖20g/L,硫酸鎂1g/L,磷酸二氫鉀1.5g/L,鋅濃度為150mg/L,以ZnSO4·7H2O的形式添加),500mL三角瓶裝液量為300mL,然后于搖床24℃振蕩培養10d。③發酵罐培養。裝量:7.5L;接種量:10%;發酵溫度:24℃;攪拌速度:350r/min;泡沫控制:接種后加兩滴消泡劑。③發酵過程中pH值及DO值的測定。利用pH電極及溶氧電極自動在線測定并記錄數據。④富鋅菌絲體的分離。將干巴菌富鋅培養物離心(10000r/min,10min),獲得富鋅菌絲體,反復離心洗滌菌絲體3遍后,將其置于烘箱中,55℃烘干。在干巴菌的發酵過程中,pH值逐步降低,由發酵初期的4.77逐步降低至3.86。發酵過程中菌體大量繁殖并且胞外多糖大量產生,從30h開始,培養物逐漸變得粘稠,溶氧率降低較快,發酵結束時溶氧率降至20%左右。經計算干巴菌TG-1、TG-2、TG-3、TG-4富鋅菌絲體的產量分別為9.25g/L、5.96g/L、6.35g/L和7.08g/L。因此,發酵罐培養時干巴菌TG-1富鋅菌絲體的產量最高。實施例4干巴菌菌絲體鋅多糖的提取培養基中鋅濃度為150mg/L時,分別獲得菌株TG-1、TG-2、TG-3、TG-4的菌絲體,將菌絲體分別粉碎,按1:20的固液比加入去離子水,并調溶液pH=8,于超聲波細胞破碎儀中(400w,15min)超聲破碎,然后置于90℃水浴中2h(每隔15min攪動一次),離心(10000r/min,10min),以上步驟共重復4次,合并上清液并過140目篩,加入2倍體積的乙醇,靜置24h后,離心(10000r/min,10min),收集沉淀,于55℃烘箱中烘干,再次溶于適量去離子水中,離心取上清液,加入Sevag試劑,充分振搖15min,除去變性蛋白質層及下層有機相,如此反復去蛋白3次后,凍干并稱重。計算干巴菌菌絲體鋅多糖的產量及鋅多糖的鋅含量,見表1。表1干巴菌TG-1、TG-2、TG-3、TG-4的鋅多糖產量及其鋅含量鋅多糖產量(g/L)鋅含量(mg/kg)TG-10.734300TG-20.513980TG-30.494040TG-40.583230由表1可見,干巴菌菌株TG-1的鋅多糖產量及鋅多糖中的鋅含量顯著高于菌株TG-2、TG-3、TG-4。實施例5還原力及羥基自由基清除能力的測定(1)還原力的測定采用普魯士蘭法進行還原力的測定。將TG-1菌株發酵得到的干巴菌菌絲體多糖(Myceliapolysaccharide,MPS)和干巴菌菌絲體鋅多糖(Myceliazincpolysaccharide,MZPS)分別用去離子水進行梯度稀釋,配置一系列不同濃度的多糖水溶液。取1mL多糖樣品于試管中,加入2.5mL磷酸鹽緩沖液(pH6.6,0.2mol/L)和1mL鐵氰化鉀溶液(10g/L),混勻后置于50℃恒溫水浴鍋中20min。水浴結束后,再加入2mL三氯乙酸(100g/L)和1.2mL三氯化鐵溶液(1g/L)。混勻后測定700nm處吸光度,并用2,6-二叔丁-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT)作為陽性對照。(2)羥基自由基清除能力的測定采用Fenton法進行羥基自由基清除能力的測定。配置一系列不同濃度的多糖水溶液。將1mL硫酸亞鐵溶液(9mmol/L),1mL水楊酸乙醇溶液(9mmol/L),1mL多糖樣品溶液和1mL過氧化氫溶液(8.8mmol/L)于試管中混合均勻,37℃水浴30min。離心(5000r/min,10min)后取上清液于510nm處測定吸光度,并用BHT作為陽性對照。按照以下公式計算羥基自由基清除率(Scavengingrate,SR),SR(%)=(A0–A)/A0×100。其中,A0為空白對照的吸光度,A為多糖樣品的吸光度。羥基自由基的清除能力以EC50值表示,EC50值代表羥基自由基清除50%時所需要的樣品濃度。由圖5(A)可見,隨著多糖濃度的增加,還原力逐漸增強。在濃度為5000mg/L時,MPS、MZPS和BHT的還原力分別為1.91,2.08和1.27,三者還原力的強弱順序為:MZPS>MPS>BHT。因此,MZPS和MPS都具有一定的還原力,且MZPS的還原力高于MPS。由圖5(B)可見,MZPS,MPS和BHT的EC50值分別為875.44,1501.32和320.91mg/L。當濃度高于1000mg/L時MZPS的超氧陰離子自由基清除能力超過了BHT,三者清除能力大小為:MZPS>BHT>MPS。當濃度達到4000mg/L時,MPS的超氧陰離子自由基清除能力超過了BHT,三者清除能力大小為:MZPS>MPS>BHT。因此,MZPS和MPS都具有清除超氧陰離子自由基的能力,且MZPS的清除能力高于MPS。實施例6干巴菌鋅多糖的體內抗氧化實驗(1)動物模型構建與藥物干預將小鼠隨機分為8組(每組10只),即空白對照組(NC)、衰老模型組(MC)、MPS高、中、低干預組(I,II,III)和MZPS高、中、低干預組(IV,V,VI),適應性飼養一周后按照以下方法開始實驗。(NC)空白對照組:灌胃去離子水(10mL/kg),同時腹腔注射生理鹽水(5mL/kg)。(MC)衰老模型組:灌胃去離子水(10mL/kg),同時腹腔注射D-半乳糖(150mg/kg/d)。(I,II,III)高、中、低劑量MPS干預組:分別灌胃MPS(60、120和240mg/kg/d),同時腹腔注射D-半乳糖(150mg/kg/d)。(IV,V,VI)高、中、低劑量MZPS干預組:分別灌胃MZPS(60、120和240mg/kg/d),同時腹腔注射D-半乳糖(150mg/kg/d)。實驗一直持續30d。(2)樣品制備小鼠禁食12h后,摘眼球取血,然后頸椎脫臼處死小鼠。將血液離心(12000r/min,10min,4℃)分離血清。(3)指標檢測SOD活性測定:用SOD測定試劑盒進行測定,試劑盒采用黃嘌呤氧化酶法(羥胺法)測定SOD活力。T-AOC測定:用T-AOC測定試劑盒進行測定。測定原理為抗氧化物質,能使Fe3+還原成Fe2+,后者可與菲啉類物質形成穩固的絡和物,通過比色可測出其抗氧化能力的高低。LPO含量測定:取0.5mL樣品于離心管中,并加入2.5mL硫代巴比妥酸乙酸溶液(2.68g/L),混勻后置于沸水浴中30min。冷卻后加入7mL正丁醇,離心(10000r/min,10min),取上清液于520nm處測定吸光度。同時用40nmol/mL1,1,3,3-四乙氧基丙烷(1,1,3,3-tetraethoxy-propane,TEP)作為對照,按照以下公式計算LPO濃度(C):C(nmol/mL)=A/A0×40。A為樣品的吸光度,A0為TEP的吸光度。MDA含量測定:將0.5mL樣品、1.5mL去離子水和2mL硫代巴比妥酸溶液(6g/L)混合均勻,置于沸水浴中15min,迅速冷卻后,離心(10000r/min,10min),上清液于450、532和600nm處測定吸光度,按照以下公式計算MDA濃度(C):C(μmol/L)=6.45×(A532nm–A600nm)–0.56×A450nm。MPS和MZPS對衰老小鼠SOD活性的影響見圖6。機體抵抗自由基傷害的防御體系有酶促與非酶促兩個體系組成,SOD是酶促防御體系的關鍵酶,它可以有效的清除自由基反應的啟動因子超氧陰離子自由基,從而抑制自由基反應,降低自由基反應的毒害作用。因此,SOD活性反映了機體清除自由基的能力,是機體抗氧化能力的重要指標。由圖6可知,與空白對照組(NC)小鼠相比,衰老模型組(MC)小鼠體內的SOD活性顯著降低(P<0.01)。而在MPS(I,II,III)和MZPS(IV,V,VI)干預下,小鼠體內的SOD活性顯著上升,并呈現出一定的量效關系。在低、中、高劑量MPS(I,II,III)干預下,小鼠血清中SOD活性較D-半乳糖致衰老組小鼠分別提高了40.12%,86.89%和109.81%。在低、中、高劑量MZPS(IV,V,VI)干預下,小鼠血清中SOD活性分別提高了36.56%,100.97%和122.92%。MPS和MZPS對衰老小鼠T-AOC水平的影響見圖7。非酶促防御體系主要包含維生素E、胡蘿卜素、維生素C、半胱氨酸、蛋氨酸、色氨酸、轉鐵蛋白和乳鐵蛋白等維生素、氨基酸和金屬蛋白質,它們主要通過以下途徑發揮抗氧化作用:清除體內的自由基;阻斷過氧化鏈;分解過氧化物;除去起催化作用的金屬離子。T-AOC水平反映了機體抵抗自由基傷害的非酶促防御能力,研究表明衰老時各組織中的T-AOC水平明顯降低。由圖7可以看出,腹腔注射D-半乳糖30d后,衰老模型組(MC)小鼠血清中的T-AOC水平顯著低于空白對照組(P<0.01)。與衰老模型組(MC)小鼠相比較,MPS(I,II,III)和MZPS(IV,V,VI)干預組T-AOC水平隨著多糖劑量的增加而升高。當MPS灌胃劑量為80,160,240mg/kg/d時(III),小鼠血清中T-AOC水平分別升高了21.10%,29.22%和98.26%。當MZPS灌胃劑量為80,160,240mg/kg/d時(VI),T-AOC水平分別升高了14.65%,21.75%和107.76%。MPS和MZPS對衰老小鼠LPO含量的影響見圖8。脂質過氧化反應的產物LPO具有一定的毒性,可以影響細胞膜的流動性和細胞的代謝,進而導致細胞損傷和凋亡。LPO的積累與機體衰老和某些疾病的發生、發展過程有著密切的聯系。因此,LPO的含量作為組織損傷的一項指標,被廣泛應用于抗氧化的研究。如圖8所示,衰老模型組(MC)小鼠各組織中LPO含量顯著升高(P<0.01)。而MPS(I,II,III)和MZPS(IV,V,VI)顯著降低了D-半乳糖致衰老小鼠血清中的LPO含量,并且表現出了明顯的量效關系。在低、中、高劑量MPS干預組(III)中,小鼠血清LPO抑制率分別為12.34%,40.73%和56.67%。在低、中、高劑量MZPS干預組(VI)中,小鼠血清LPO抑制率分別為20.33%,57.08%和61.64%。MPS和MZPS對衰老小鼠MDA含量的影響見圖9。脂質過氧化反應的產物LPO是不穩定的,它會進一步分解成為一系列復雜的化合物,其中,MDA是最主要的分解終產物,它可以導致DNA的損傷。因此,MDA的含量可以間接反映機體脂質過氧化的程度,是評價氧化損傷和衰老的重要指標之一。如圖9所示,MDA含量在衰老模型組(MC)小鼠各組織中顯著升高,與空白對照組(NC)小鼠相比存在顯著差異性(P<0.01)。而在MPS(I,II,III)和MZPS(IV,V,VI)干預下,D-半乳糖致衰老小鼠血清中的MDA含量顯著降低,并且呈現出了一定的量效關系。在低、中、高劑量MPS干預組(I,II,III)中,小鼠血清的MDA抑制率分別為14.84%,35.10%和48.29%。在低、中、高劑量MZPS干預組(VI,V,VI)中,小鼠血清的MDA抑制率分別為24.26%,65.96%和72.20%。上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受實施例的限制,其它任何未背離本發明的精神實質與原理下所做的改變、修飾、組合、替代、簡化均應為等效替換方式,都包含在本發明的保護范圍之內。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1