一種優化的pIFN?γ肽鏈及在提高畢赤酵母分泌表達豬IFN?γ產量和活性中的應用的制作方法
本發明涉及基因工程
技術領域:
,具體地,涉及一種優化的pIFN-γ肽鏈及在提高畢赤酵母分泌表達豬IFN-γ產量和活性中的應用。
背景技術:
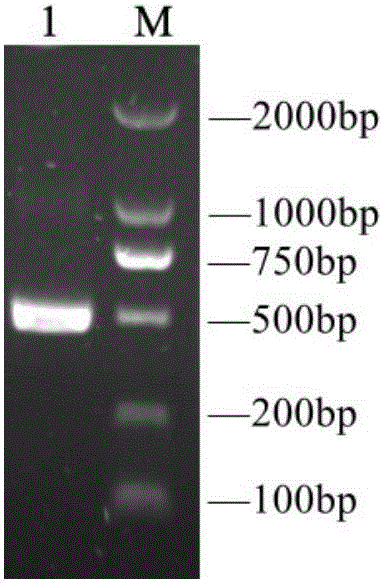
:豬伽馬干擾素(porcineInterferonGamma,pIFN-γ)是一種具有廣譜抗病毒、抗腫瘤活性和免疫調節功能的細胞因子。豬伽馬干擾素屬于Ⅱ型干擾素中的唯一成員,主要是由活化的T細胞和NK細胞產生的一種具有廣譜抗病毒活性和免疫調節功能的細胞因子。豬伽馬干擾素在生豬養殖中具有廣闊的運用前景,在生豬養殖中可作為抗生素類替代藥品、豬腫瘤性疾病的治療及流行性疾病的防治等用途。目前國內研究者構建的各類pIFN-γ表達菌株存在目的蛋白表達效率低下,采用分泌表達方式表達量一般為100~300mg/L,采用胞內表達方式目的蛋白純化成本高昂,產量一般占細胞總蛋白1/5~1/3;此外,表達的pIFN-γ還存在活性較低的問題,阻礙了pIFN-γ在生豬養殖中的進一步運用。為此,構建一種能夠高效分泌表達具有高活性的pIFN-γ工程菌對于推動pIFN-γ在生豬養殖業中的應用是十分必要的。目前,未見有關能夠提高pIFN-γ分泌表達水平及其活性的改良氨基酸序列的報道。技術實現要素:本發明為了克服現有技術的上述不足,提供了一種優化的pIFN-γ肽鏈,優化的pIFN-γ肽鏈能提高畢赤酵母分泌表達豬IFN-γ產量和活性。本發明的另一個目的是提供一種優化的pIFN-γ肽鏈提高畢赤酵母分泌表達豬IFN-γ產量和活性中的應用。本發明的另一個目的是提供一種提高畢赤酵母分泌表達豬IFN-γ產量和活性的方法。為了實現上述目的,本發明是通過以下方案予以實現的:一種提高畢赤酵母分泌表達豬IFN-γ產量和活性的pIFN-γ肽鏈,pIFN-γ肽鏈的氨基酸序列如SEQIDNO:1所示。優化的pIFN-γ肽鏈命名為pIFN-γ-C。天然未經過改造的pIFN-γ肽鏈序列如SEQIDNO:2所示。本發明提供的優化的pIFN-γ肽鏈是在天然pIFN-γ肽鏈序列第129和131位氨基酸殘基由精氨酸(R)定向突變為組氨酸(H)得到的。SEQIDNO:1所示氨基酸序列的pIFN-γ肽鏈在提高畢赤酵母分泌表達豬IFN-γ產量和活性中的應用。一種提高畢赤酵母分泌表達豬IFN-γ產量和活性的方法,具體為將SEQIDNO:1所示序列的pIFN-γ肽鏈整合到畢赤酵母中,得到的重組畢赤酵母分泌表達的豬IFN-γ的產量和活性大大提高。一種提高畢赤酵母分泌表達豬IFN-γ產量和活性的方法,包括如下步驟:將SEQIDNO:1所示序列的pIFN-γ肽鏈對應的核苷酸片段插入質粒pPICZαA中,重組質粒轉入畢赤酵母X33野生型感受態細胞,利用質粒上的抗性基因,通過高抗篩選得到具有目的基因高拷貝的畢赤酵母重組子,獲得能高效分泌表達具有高活性pIFN-γ的畢赤酵母工程菌。與現有技術相比,本發明具有如下有益效果:將本發明提供的優化后的pIFN-γ肽鏈整合到畢赤酵母中,可以大大提高畢赤酵母分泌表達豬IFN-γ產量和活性,因此,本發明提供的優化后的pIFN-γ肽鏈對于推動pIFN-γ在生豬養殖業中的應用是十分必要的。附圖說明圖1為引入酶切位點的pIFN-γ-C基因高保真PCR擴增結果,圖中M為DL2000標準分子量Marker,泳道1為引入酶切位點的pIFN-γ(484bp)。圖2為菌落PCR篩選DH5α陽性轉化子(陽性克隆約1000bp),圖中M為DL2000標準分子量Marker,陽性克隆長度約1000bp。圖3為質粒pPICZαA-pIFN-γ-C反向測序結果。圖4畢赤酵母轉化子的高抗篩選結果,圖中1為0.5mg/mLZeocin平板篩選結果,2為1mg/mLZeocin平板篩選結果,1和2中菌落為原位一一對應關系。圖5為誘導發酵上清SDS-PAGE電泳結果;1-4號泳道為抗1.0mg/mLZeocin的酵母轉化菌株誘導表達發酵上清,第5號泳道為X33野生型誘導表達發酵上清,表達的pIFN-γ-C理論分子量為17.5Kda。圖6為pIFN-γ-C蛋白的Western-blot鑒定結果;泳道1-8為抗1.0mg/mLZeocin的酵母轉化菌株誘導表達發酵上清,M為Bio-RadDualColor標準分子量預染Marker,表達的pIFN-γ-C理論分子量為17.5Kda。圖7為Ni-親和層析純化pIFN-γ-C結果;泳道1-8為Eltionbuffer洗脫樣品,表達的pIFN-γ理論分子量為17.5Kda。具體實施方式下面結合具體實施例對本發明作出進一步地詳細闡述,所述實施例只用于解釋本發明,并非用于限定本發明的范圍。下述實施例中所使用的試驗方法如無特殊說明,均為常規方法;所使用的材料、試劑等,如無特殊說明,為可從商業途徑得到的試劑和材料。實施例1天然未經過改造的pIFN-γ肽鏈序列如SEQIDNO:2所示,本發明利用本領域常用的基因突變方法將天然pIFN-γ肽鏈序列第129和131位氨基酸殘基由精氨酸(R)定向突變為組氨酸(H),得到SEQIDNO:1所示的優化的pIFN-γ肽鏈。(1)根據本發明提供的優化的pIFN-γ基因的核苷酸序列SEQIDNO:1為表達基因,分泌表達pIFN-γ突變體。優化的pIFN-γ-C基因通過體外全基因合成得到。全基因合成得到的pIFN-γ序列高保真PCR結果如圖1所示(目的產物上下游分別引入XhoⅠ與XbaⅠ酶切位點)。(2)構建pIFN-γ畢赤酵母重組分泌表達載體:將畢赤酵母分泌表達載體pPICZαA與上述步驟(1)中得到的pIFN-γ基因高保真PCR產物用XhoⅠ與XbaⅠ進行雙酶切,用PCR純化回收試劑盒和DNA瓊脂糖凝膠回收試劑盒分別對基因和質粒雙酶切產物進行回收,將回收的基因與質粒用T4連接酶連接,轉化大腸桿菌DH5α感受態細胞,構建得到pIFN-γ重組畢赤酵母分泌表達載體pPICZαA-pIFN-γ-C,保存載體的菌株命名為DH5α-pPICZαA-pIFN-γ-C。用質粒通用引物5’AOXⅠ、3’AOXⅠ通過菌落PCR篩選DH5α陽性轉化子結果如圖2所示,將所有陽性克隆菌落送樣測序,將測序結果完全一致的菌落保種,測序結果如圖3所示。(3)pIFN-γ-C畢赤酵母分泌表達菌株的構建與高拷貝菌株的篩選:將上述步驟(3)中構建的重組表達載體用SacⅠ單酶切線性化后,電擊轉化畢赤酵母野生型X33感受態細胞,涂布YPDSZ篩選平板,置于30℃培養箱中培養至長出單菌落,隨機挑取約100個單菌落分別溶于10uL無菌水中,用無菌牙簽沾取菌液分別一一對應接種于含0.5mg/mL和1.0mg/mLZeocin的兩塊YPDZ平板,將平板置于30℃培養箱中培養,通過高濃度的Zeocin(博來霉素)YPDZ平板篩選具有目的基因高拷貝的畢赤酵母轉化子。畢赤酵母轉化子的高抗篩選結果如圖4所示。(4)pIFN-γ-C畢赤酵母分泌表達菌株的誘導發酵:將上述步驟(3)中得到的抗1.0mg/mLZeocin的酵母表達菌株接種于BMGY液體培養基,30℃、230rpm震蕩培養至OD595nm值5-6時,按照無菌操作要求,離心收集菌體沉淀,按4:1或5:1的比例(如40或50mLBMGY液體培養基培養物轉入10mLBMMY液體培養基中),將菌體沉淀轉接于含1%甲醇的BMMY液體培養基,28℃、230rpm誘導發酵48小時,每隔24小時向BMMY液體培養基補加甲醇至1%,48小時后離心收集誘導發酵上清。誘導發酵上清SDS-PAGE電泳結果如圖5所示;誘導發酵上清Western-blot結果如圖6所示,Western-blot所用一抗為抗His標簽鼠單克隆抗體,二抗為羊抗鼠IgG-HRP抗體。(5)誘導發酵上清中pIFN-γ-C的Ni親和層析:按照氨酸親和層析樹脂填料Ni-NTAHis-Bind要求,對上述誘導發酵上清中的pIFN-γ-C進行純化,Ni親和層析結果如圖7所示。(6)優化后的pIFN-γ的發酵產量和活性對比,以未優化的SEQIDNO:2序列通過質粒轉入畢赤酵母并表達為對照,在5升發酵罐內發酵后,pIFN-γ和pIFN-γ-C的表達水平和活性分別如表1和2所示。表1為pIFN-γ和pIFN-γ-C5升發酵罐發酵水平實驗組表達量(mg/L)pIFN-γ303pIFN-γ-C1921表2為pIFN-γ和pIFN-γ-C5升發酵罐發酵產品活性實驗組活性單位(U/ml)pIFN-γ3.47×106pIFN-γ-C9.28×108由表1、2的結果可知,經優化的pIFN-γ-C的表達量和活性遠高于未優化的pIFN-γ。上述結果說明調整pIFN-γ的氨基酸序列有得于畢赤酵母的表達及提高其活性。實施例2天然未經過改造的pIFN-γ肽鏈序列如SEQIDNO:2所示,本發明利用本領域常用的基因突變方法將天然pIFN-γ肽鏈序列第129和131位氨基酸殘基由精氨酸(R)定向突變為組氨酸(H),得到SEQIDNO:1所示的優化的pIFN-γ肽鏈。(1)將SEQIDNO:1所示氨基酸序列的pIFN-γ肽鏈插入質粒pPICZαA,轉入與畢赤酵母GS115野生型感受態細胞,利用質粒上的抗性基因,通過高抗篩選得到具有目的基因高拷貝的畢赤酵母重組子,可以獲得能高效分泌表達具有高活性pIFN-γ的畢赤酵母工程菌。(2)優化后的pIFN-γ的發酵產量和活性對比,以未優化的SEQIDNO:2序列通過質粒轉入畢赤酵母并表達為對照,在5升發酵罐內發酵后,pIFN-γ和pIFN-γ-C的表達水平和活性分別如表3和4所示。表3為pIFN-γ和pIFN-γ-C5升發酵罐發酵水平實驗組表達量(mg/L)pIFN-γ248pIFN-γ-C1681表4為pIFN-γ和pIFN-γ-C5升發酵罐發酵產品活性實驗組活性單位(U/ml)pIFN-γ1.77×106pIFN-γ-C6.94×108由表3、4的結果可知,經優化的pIFN-γ-C的表達量和活性遠高于未優化的pIFN-γ。上述結果說明調整pIFN-γ的氨基酸序列有得于畢赤酵母的表達及提高其活性。實施例3天然未經過改造的pIFN-γ肽鏈序列如SEQIDNO:2所示,本發明利用本領域常用的基因突變方法將天然pIFN-γ肽鏈序列第129和131位氨基酸殘基由精氨酸(R)定向突變為組氨酸(H),得到SEQIDNO:1所示的優化的pIFN-γ肽鏈。(1)將SEQIDNO:1所示氨基酸序列的pIFN-γ肽鏈插入質粒pPICZαA,轉入與畢赤酵母KM71野生型感受態細胞,利用質粒上的抗性基因,通過高抗篩選得到具有目的基因高拷貝的畢赤酵母重組子,可以獲得能高效分泌表達具有高活性pIFN-γ的畢赤酵母工程菌。(2)優化后的pIFN-γ的發酵產量和活性對比,以未優化的SEQIDNO:2序列通過質粒轉入畢赤酵母并表達為對照,在5L發酵罐內發酵后,pIFN-γ和pIFN-γ-C的表達水平和活性分別如表5和6所示。表5為pIFN-γ和pIFN-γ-C5升發酵罐發酵水平實驗組表達量(mg/L)pIFN-γ189pIFN-γ-C843表6為pIFN-γ和pIFN-γ-C5升發酵罐發酵產品活性實驗組活性單位(U/ml)pIFN-γ3.59×106pIFN-γ-C8.42×108由表5、6的結果可知,經優化的pIFN-γ-C的表達量和活性遠高于未優化的pIFN-γ。上述結果說明調整pIFN-γ的氨基酸序列有得于畢赤酵母的表達及提高其活性。SEQUENCELISTING<110>華南農業大學<120>一種優化的pIFN-γ肽鏈及在提高畢赤酵母分泌表達豬IFN-γ產量和活性中的應用<130><160>2<170>PatentInversion3.3<210>1<211>143<212>PRT<213>改造后的pIFN-γ肽鏈序列<400>1GlnAlaProPhePheLysGluIleThrIleLeuLysAspTyrPheAsn151015AlaSerThrSerAspValProAsnGlyGlyProLeuPheLeuGluIle202530LeuLysAsnTrpLysGluGluSerAspLysLysIleIleGlnSerGln354045IleValSerPheTyrPheLysPhePheGluIlePheLysAspAsnGln505560AlaIleGlnArgSerMetAspValIleLysGlnAspMetPheGlnArg65707580PheLeuAsnGlySerSerGlyLysLeuAsnAspPheGluLysLeuIle859095LysIleProValAspAsnLeuGlnIleGlnArgLysAlaIleSerGlu100105110LeuIleLysValMetAsnAspLeuSerProArgSerAsnLeuArgLys115120125HisLysHisSerGlnThrMetPheGlnGlyGlnArgAlaSerLys130135140<210>2<211>143<212>PRT<213>未改造pIFN-γ肽鏈序列<400>2GlnAlaProPhePheLysGluIleThrIleLeuLysAspTyrPheAsn151015AlaSerThrSerAspValProAsnGlyGlyProLeuPheLeuGluIle202530LeuLysAsnTrpLysGluGluSerAspLysLysIleIleGlnSerGln354045IleValSerPheTyrPheLysPhePheGluIlePheLysAspAsnGln505560AlaIleGlnArgSerMetAspValIleLysGlnAspMetPheGlnArg65707580PheLeuAsnGlySerSerGlyLysLeuAsnAspPheGluLysLeuIle859095LysIleProValAspAsnLeuGlnIleGlnArgLysAlaIleSerGlu100105110LeuIleLysValMetAsnAspLeuSerProArgSerAsnLeuArgLys115120125ArgLysArgSerGlnThrMetPheGlnGlyGlnArgAlaSerLys130135140當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1