一種基于I型膠原質凍膠的軟骨誘導方法與流程
本發明涉及I型膠原質凍膠的用途,具體地說是以I型膠原質凍膠制備組織工程化軟骨的應用。
背景技術:
軟骨缺損是臨床上常見的疾病。目前,臨床對軟骨缺損的治療仍沒有較好的質量方案。近些年來,組織工程學和再生醫學的發展給軟骨缺損的治療帶來了契機。I型膠原因其良好的組織相容性和降解性被廣泛應用到臨床中。雖然軟骨組織的主要成分是II型膠原,但是理化性能沒有I型膠原好。而I型膠原與II型膠原有相似的組成結構,同時能夠提供細胞生長的微環境,而開發成為凍膠,包含結合水成分,與軟骨組織更為接近,是軟骨組織修復的理想材料。因此采用組織工程技術從小牛皮中提取開發軟骨誘導型I型膠原質凍膠具有重要意義。
技術實現要素:
本發明的目的是研究開發軟骨誘導型I型膠原質凍膠做為誘導軟骨和軟骨修復的材料,開發I型膠原質凍膠的新用途,以I型膠原質凍膠制備組織工程化軟骨的應用。
本發明是基于發明人的實驗研究而完成的。研究分兩大部分:
一、I型膠原質凍膠的制備
提取方法:將去毛的小牛皮洗凈,瀝干,剪碎,粉碎后,Tris-HCl 4℃浸泡過夜,0.1%的醋酸溶液溶解2小時后,用2%的胃蛋白酶4℃消化24小時至48小時。
純化方法: 將胃蛋白酶消化的產物加入0.1%的醋酸中,反復洗滌離心3次;加入0.5M的NaOH調節PH至7.2左右,放置于-20℃,即獲得高純度的I型膠原質凍膠;即時使用時放置于4℃。
鑒定方法:I型膠原質凍膠溶液均勻地涂覆在石英片上,在180~420nm處進行檢測其紫外光譜。
二、I型膠原體外誘導骨髓間充質干細胞(BMSCs)成軟骨實驗
提取新西蘭大白兔骨髓間充質干細胞,然后用I型膠原質凍膠誘導骨髓間充質干細胞成軟骨。細胞活力檢測表明骨髓間充質干細胞在I型膠原質凍膠中能夠較好的生長,且在不斷地增殖。
番紅O染色檢測結果顯示,I型膠原質凍膠的誘導下可以形成類似軟骨陷窩的結構,且骨髓間充質干細胞在I型膠原質凍膠得誘導下可以促使軟骨相關多糖蛋白的表達增高。
定量PCR檢測軟骨相關基因:II型膠原(COL2A1), 蛋白聚糖(ACAN)和SOX9均有所上調,而纖維軟骨相關基因——I型膠原(COL1A1)和軟骨肥大化相關基因(COL10)表達量均較低。以上結果說明I型膠原水凝膠有誘導骨髓間充質干細胞成軟骨的作用。
I型膠原質凍膠作為誘導軟骨和軟骨修復材料開辟了新用途。
I型膠原質凍膠在軟骨誘導性能上的應用,是按照以下方法實現的:
將海綿狀的I型膠原質凍膠以15mg/mL的濃度溶解于0.1%得醋酸溶液中,并在4攝氏度下用0.5M的NaOH調節PH至7.2左右,用于后續實驗;實驗分為:1)對照組,BMSCs小球(107個細胞/團);2)誘導組,BMSCs + I型膠原質凍膠(107個細胞/團)。實驗組采用渦流的方法,將15mg/mL I型膠原質凍膠與骨髓間充質干細胞混合,放在培養箱中15分鐘后成凝膠,加入正常的完全培養基,分別培養7天,14天和21天。
總之,本發明首次對I型膠原質凍膠的軟骨誘導性能進行了研究,實驗表明I型膠原質凍膠可以促進骨髓間充質干細胞的增殖和生長。與此同時,I型膠原質凍膠還有誘導骨髓間充質干細胞向軟骨細胞分化的作用。因此,軟骨誘導型I型膠原質凍膠可以作為誘導軟骨和軟骨修復的材料,開發了I型膠原質凍膠的新用途,應用I型膠原質凍膠構建軟骨誘導性膠原水凝膠在軟骨缺損的治療上有重要意義。
附圖說明
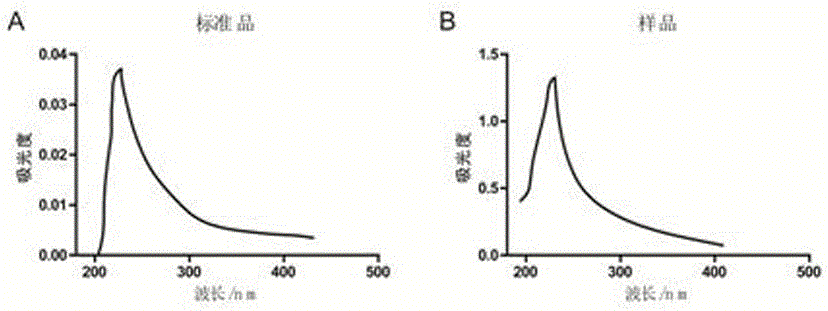
圖1A是標準 Sigma I型膠原紫外光譜圖;
圖1B是所提取的I型膠原質凍膠紫外光譜圖;
圖2是I型膠原質凍膠誘導BMSCs成軟骨細胞的番紅O染色圖。
具體實施方式
一、I型膠原質凍膠的制備和鑒定
提取方法:將去毛的小牛皮洗凈,瀝干,剪碎,粉碎后,用0.05M的Tris-HCl 在4℃浸泡過夜,棄緩沖液后,用超純水洗滌3次。室溫下將沉淀物溶于0.1%的醋酸溶液中,2小時后用勻漿機將沉淀物打勻,用2%的胃蛋白酶在4℃消化24至48小時。此時即可獲得粗提的I型膠原質凍膠。
純化方法:將粗提的產物以每克50ml 0.1% 醋酸的比例洗滌,4攝氏度下10000rpm離心30分鐘,重復3次后即可獲得高純度的I型膠原質凍膠。并將I型膠原質凍膠用凍干機凍干48小時后形成海綿狀備用。
鑒定方法:將I型膠原質凍膠溶液均勻地涂覆在石英片上, 在180~420nm處進行檢測其紫外光譜。膠原的肽鏈中含有CO、COOH和CONH2等生色基團, 可在近紫外區檢測其吸收峰值。圖1A是標準 Sigma I型膠原紫外光譜圖,圖1B是所提取的I型膠原質凍膠紫外光譜圖。所提取的I型膠原質凍最大吸收在230nm附近,而Sigma I型膠原也是在230nm處。證明所提取的樣品含有I型膠原蛋白的結構特征。
二、I型膠原體外誘導骨髓間充質干細胞成軟骨實驗
實驗方案:
(1)實驗分組及處理
選取2月新西蘭大白兔,用骨髓穿刺針于股骨處抽取骨髓10毫升,利用梯度密度離心法分離出骨髓間充質干細胞,用alpha-Minimum Essential Medium (α-MEM) 培養基在37攝氏度,5%CO2培養箱中培養。并用第三代骨髓間充質干細胞(BMSCs)進行誘導實驗。將海綿狀的I型膠原質凍膠以15mg/mL的濃度溶解于0.1%得醋酸溶液中,并在4攝氏度下用0.5M的NaOH調節PH至7.2左右,用于后續實驗。實驗分為:1)對照組,BMSCs小球(107個細胞/團);2)誘導組,BMSCs + 15mg/mL I型膠原質凍膠(107個細胞/團)。實驗組采用渦流的方法I型膠原質凍膠成凝膠之前與細胞混合,放在培養箱中15分鐘后成凝膠。兩組加入正常完全培養基后分別培養7天,14天和21天。
(2)檢測指標
①細胞增殖;
②軟骨相關蛋白GAG檢測;
③番紅O染色;
④RT-PCR檢測COL2A1,COL1A1,SOX9,COL10,ACAN mRNA的表達。
(3)實驗結果:
①細胞增殖情況
運用DNA法檢測細胞的增殖情況,細胞增殖情況約佳,OD值約高。隨著時間的增長兩組細胞均有所增長,其中,誘導組細胞增殖比對照組更高(P<0.05)。
結果見表1。
*代表P<0.05
②軟骨相關蛋白GAG檢測
與對照組比較,經過I型膠原質凍膠誘導后,骨髓間充質干細胞有像軟骨細胞分化的傾向,且軟骨相關蛋白明顯提高(P < 0. 05)。
結果見表2。
*代表P<0.05
③番紅O染色
番紅O染色可以間接反應軟骨相關多糖蛋白的表達量。骨髓間充質干細胞在經過I型膠原質凍膠誘導后,出現深染的陽性表達區,見圖2,表明I型膠原質凍膠有誘導軟骨形成的能力。
④RT-PCR檢測COL2A1,COL1A1,SOX9,COL10,ACAN mRNA的表達
誘導組中COL2A1,SOX9和ACAN表達量隨著時間的增加而增高,且均高于對照組(p<0.05),而COL1A1和COL10并無較高的表達且結果與對照組無明顯的差異。
結果見表3。
*代表P<0.05
結論:
I型膠原質凍膠可以在不加任何生長因子和誘導液的情況下,有誘導間充質干細胞向軟骨分化的能力,可做為誘導軟骨和軟骨修復的材料。
- 還沒有人留言評論。精彩留言會獲得點贊!