一種純化耦合固定化腺苷酸環化酶的制備方法與流程
本發明屬于生物工程技術領域,具體設計一種純化耦合固定化腺苷酸環化酶的制備方法。
背景技術:
酶是一類具有催化功能的生物分子,它與人類的生產和生活密切相關,世上的所有生物離開酶都不能生存。酶的特點包括高效性、專一性、反應條件溫和等。但游離酶穩定性差、易失活且不能重復使用,致使其難以應用到大規模的工業化生產中。為了解決這一難題,固定化酶技術應運而生。固定化酶較游離酶有很多優點,如穩定性高、可進行工藝加工、可重復使用。常用的酶的固定化方法包括吸附法、交聯法、共價法和包埋法。其中吸附法和包埋法屬于物理方法,交聯法和共價法屬于化學方法。
酶活是酶活力的度量單位,國際生化學會酶學委員會規定在最適反應條件(最適底物、最適pH、最適緩沖液的離子強度及25℃)下,每分鐘催化一微摩爾底物轉化為產物所需的酶量即為一個國際酶活力單位。酶活力是衡量固定化酶的一個重要指標。影響固定化酶酶活力的因素有很多,除了常見的溫度、pH、抑制劑、激活劑等外,還有一些特殊的影響因素例如:
(1)載體的選擇:載體選擇直接關系到固定化能否成功以及固定化酶的活性。絕大多數的酶都是蛋白質,蛋白質的結構決定其功能,同理酶的結構決定其功能。在酶分子中并不是所有的部位都發揮作用,酶分子中只有一小部分區域的氨基酸殘基能夠與底物結合并催化底物產生產物,這一特殊區域即酶的活性中心,酶的活性中心是與酶活力直接相關的區域,酶活性部位的結構與酶的活力密切相關。在固定化的過程中,如果選擇的載體不合適,可能會直接影響到酶的活性中心以及酶蛋白的高級結構,從而造成固定化酶酶活性低甚至失活。固定化酶載體的選擇一般遵循以下幾種原則:①載體中含有能與酶發生反應的官能團可以增強其與酶的結合能力,提高固定化酶的穩定性。②載體具有較大的比表面積和多孔結構易于與酶交聯,提高固定化率。③載體應不溶于水,可防止酶失活。④載體應具有較好的機械剛性和穩定性,提高固定化酶的重復使用率⑤載體應盡量選擇可重復使用的,可大大降低固定化成本⑥載體應無毒、可降解,對環境無影響。常用的載體包括有機和無機材料兩大類。有機材料主要是離子交換樹脂,用離子交換樹脂作載體吸附酶的主要優點是操作方便、條件溫和、能夠獲得較高的固定化酶活力以及載體經洗脫后可重復使用。
(2)固定的方向:酶的固定化有隨意和定向之分。隨意固定化是指酶通過酶分子上的賴氨酸殘基隨意固定在載體上,這種固定化會阻礙底物進入到酶的活性位點從而降低酶的活性,并且酶隨意固定化在載體上時一般是多位點結合,會降低其固定量。酶的定向固定化則是將酶與載體在酶的特定部位連接起來,使酶在載體表面按一定的方向排列,這種固定化可使酶的活性位點暴露在外側,方便底物進入活性部位,可提高固定化酶的活性。酶的定向固定化方法很多,包括酶和抗體的親和連接、酶通過糖基部分固定化、酶和金屬離子的連接以及分子生物學的方法。其中酶和金屬離子的連接屬于常用的一種定向固定化方法。金屬Ni2+可將組氨酸標記的蛋白質定向的固定在載體上,實現目標蛋白的分離與純化。
(3)固定化酶的通透性:研究表明酶固定后,由于酶與底物處于不同的相中,底物需經過水不溶網塊和周圍的擴散層才能和酶接觸,所以固定化酶的反應動力學在很大程度上由固定化酶的通透性決定的。提高固定化酶通透性可以提高其酶活。大孔材料孔道寬,傳質阻力小,能夠明顯的提高固定化酶的通透性。由于這些優點使其在有關固定化酶方面的研究越來越受到重視。
cAMP即環腺苷-3’,5’-磷酸,它是細胞內的第二信使,參與細胞內多種代謝反應如調節血糖平衡、促進脂肪水解產生ATP供能以及通過激活碳酸酐蛋白激酶使后者激活碳酸酐酶調節細胞的酸堿平衡。也有臨床研究表明cAMP與多種疾病關系密切,例如高血壓、冠心病、糖尿病等,由此開發以cAMP為基礎的藥物治療這些疾病。在蛋白質的合成中,基因的轉錄和翻譯都受到cAMP的影響。因此,醫學實驗和研究工作均需要大量的cAMP。傳統的合成cAMP的方法主要是化學合成法,該方法多采用吡啶作溶劑,不僅會對環境造成污染,也嚴重影響工人的身體健康。現有技術中,生產cAMP主要包括兩種方法,一種是在傳統化學方法的基礎上進行改進,減少污染。另一種則是利用腺苷酸環化酶催化ATP生產cAMP。目前,并無利用固定化腺苷酸環化酶產cAMP的技術。因此利用固定化腺苷酸環化酶產cAMP將會為cAMP的生產提供一個新的方向。
1975年,Porath首次利用固定化金屬螯合親和層析技術(IMAC)分離蛋白質,開始將金屬離子作為一種親和配基使用,開創蛋白質親和技術的新領域。固定金屬親和吸附技術與傳統的親和技術相比具有成本低,吸附劑制備容易,分離過程簡單等諸多優點。正因為這些優點,此技術越來越廣泛的應用于酶的固定化上。IMAC中常見的吸附劑包括LX-1000IDA等。LX-1000IDA的載體為瓊脂糖凝膠,亞氨基二乙酸(IDA)是其螯合基,它可通過形成五元環與金屬形成穩定螯合物,把金屬離子束縛在一定的空間區域內。IDA與二價鎳的結合實際上是其上面的一個氮原子、兩個氧原子與二價鎳螯和。IDA具有很多優點,例如體積小、具有親水性、與金屬離子螯和后呈電中性。這些優點使吸附劑在與蛋白質結合時可以減少空間阻礙和非特異性吸附。當然,LX-1000IDA也有其缺點,IDA的價格相對于其它常用的樹脂貴,這就增加了工業化生產的成本。同時,以IDA為螯和劑的吸附劑還存在一個不可忽視的問題,如果IDA與金屬離子結合不牢固,會造成蛋白質的污染甚至變性。在分離一些治療用的蛋白時,金屬離子如Ni2+、Cu2+的泄露會對人體產生嚴重的危害。
技術實現要素:
本發明要解決的技術問題是,提供一種高效的丙酮丁醇梭菌生物膜中胞外多糖的分離提取方法。(提供一種高效、安全生產cAMP的方法)
為解決上述技術問題,本發明提供如下技術方案:
一種純化耦合固定化腺苷酸環化酶的制備方法,包括如下步驟:
(1)制備親和吸附介質:將5~100g的表面修飾亞氨基二乙酸的金屬螯合樹脂載體加入到10~200mL、0.01~1mol/L的NiCl2.6H2O溶液中,在25~30℃、150~200rpm條件下振蕩2~4h,抽濾獲得親和吸附介質;
(2)酶的固定化:取0.1~1g步驟(1)得到的親和吸附介質,加入1.5~15mL濃度為0.1~2mg/mL的腺苷酸環化酶溶液,所述腺苷酸環化酶上帶有組氨酸標簽,在25~30℃、150~200rpm條件下振蕩2~4h,離心,得到固定化腺苷酸環化酶。
其中,所述的表面修飾亞氨基二乙酸的金屬螯合樹脂載體按照如下方法制備如下:
(1a)將瓊脂糖按6%~12%溶于水中制成水相,趁熱緩慢傾倒于油相中,攪拌均勻,所述的油相組成如下:甲苯、三氯甲烷、Span-80的體積比為72~80:28~40:1~2,將混合物于50~60℃條件下保溫3~5min,篩選出粒徑為60目的瓊脂糖微球,洗凈;
(2a)稱取15~20g瓊脂糖微球加入到30~40mL、2mol/L的NaOH水溶液中,加入100~110mg硼氫化鈉、3~4mL環氧氯乙烷,30~35℃振蕩,在10~12h內陸續滴加15~20mL NaOH和9~12mL環氧氯乙烷,再繼續震蕩反應10~12h,用水洗凈載體;
(3a)將步驟(2a)中得到的載體加入到40~50mL、2mol/L的Na2CO3溶液中,加入4~5g的IDA于30~35℃搖床中振蕩20~24h,用水沖洗干凈,得到表面修飾亞氨基二乙酸的金屬螯合樹脂載體。
其中,所述的腺苷酸環化酶溶液按照如下方法制備:
(1)重組菌的構建:將來源于節桿菌CGMCC 3584的腺苷酸環化酶克隆到質粒上,將重組質粒轉化大腸桿菌E.coli,得到重組菌。
(2)誘導表達:將重組菌接至5mL的LB液體培養基中,30℃、200r/min搖床培養12h得種子液,轉接4mL的種子液于100mL的LB液體培養基中,30℃、200r/min搖床培養至OD 600達到0.8,加入終濃度為0.6mmol/L的IPTG誘導6h,誘導結束后,5000r/min離心10min收集發酵液,去上清,菌體零下20℃凍存備用。
(3)破碎菌體:取6g菌體加入到1.5L的0.1mol/L的Tris-HCl緩沖液,濃縮4倍,用勻質機將其破壁,破壁時的壓強大約在500~900kPa,收集到的上清液即為腺苷酸環化酶溶液。
上述純化耦合固定化腺苷酸環化酶的制備方法制備得到的固定化腺苷酸環化酶在本發明的保護范圍之內。
上述固定化腺苷酸環化酶在催化合成環磷酸腺苷中的應用。
其中,催化反應體系如下:
腺苷酸環化酶9.85~10.23U/mg、ATP 29.8~30.2g/L、丙酮酸2.6~2.7g/L、MgCl2.6H2O15~16g/L,氨水調節PH8.0~8.5;
催化反應條件如下:25~30℃、150~200rpm反應8~12h。
有益效果:
現有技術中,生產cAMP主要包括兩種方法,一種是在傳統化學方法的基礎上進行改進,雖然可以降低污染,但是生產過程較為復雜并且沒有真正消除污染,另一種則是利用腺苷酸環化酶催化ATP生產cAMP,此方法雖然高效簡便無污染,但是所用腺苷酸環化酶不能重新利用、酶活容易受損失。本發明中固定化腺苷酸環化酶產cAMP的技術不僅保留了上述方法的優點,還彌補這些方法中的不足。此方法的突出優勢包括酶活高、能反復使用、酶活損失少。
附圖說明
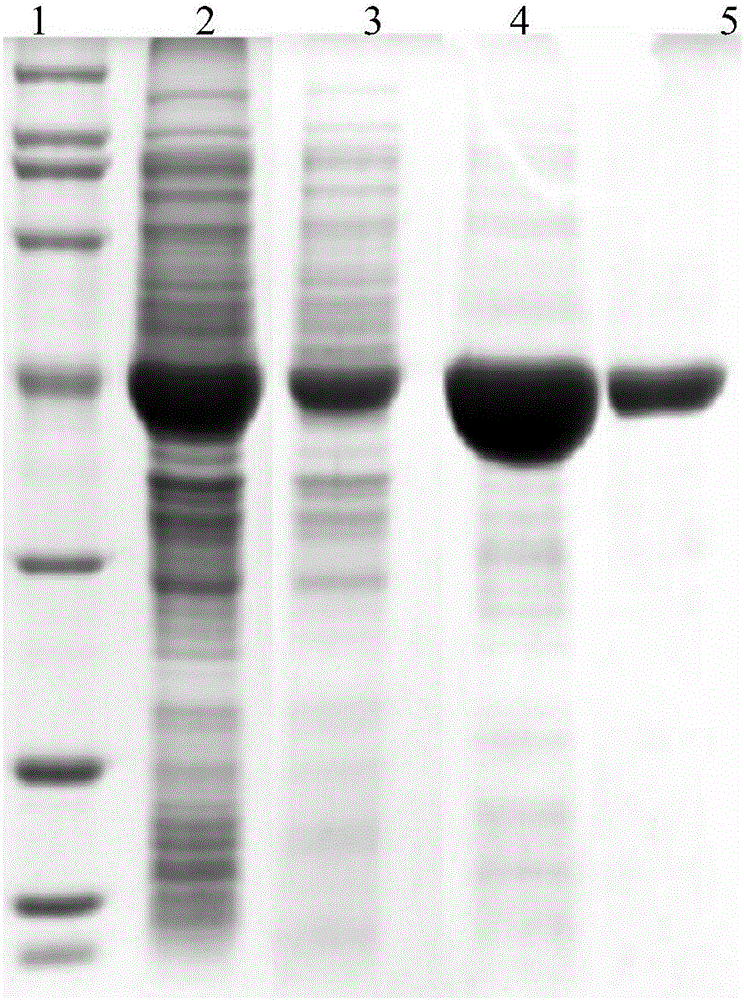
圖1:酶液及吸附后酶液的電泳圖,泳道1為純化前的粗酶液,泳道2、3為純化后的流出液,4為marker。
圖2:純化蛋白的電泳圖,泳道1為marker,泳道2為固定前的粗酶液,泳道3為固定后剩余的酶液,泳道4為固定后未洗滌洗脫液,泳道5為固定后洗滌洗脫液。
圖3:修飾IDA樹脂載體微球形貌圖。
圖4:載體介質表面結構。
圖5:載體內部結構剖面圖。
圖6:載體修飾Ni2+之后內部結構剖面圖。
圖7:固定化酶批次反應圖。
具體實施方式
根據下述實施例,可以更好地理解本發明。然而,本領域的技術人員容易理解,實施例所描述的內容僅用于說明本發明,而不應當也不會限制權利要求書中所詳細描述的本發明。
實施例1:
表面修飾亞氨基二乙酸的金屬螯合樹脂載體按照如下方法制備如下:
(1a)將瓊脂糖按6%~12%溶于水中制成水相,趁熱緩慢傾倒于油相中,攪拌均勻,所述的油相組成如下:甲苯、三氯甲烷、Span-80的體積比為72~80:28~40:1~2,將混合物于50~60℃條件下保溫3~5min,篩選出粒徑為60目的瓊脂糖微球,洗凈;
(2a)稱取15~20g瓊脂糖微球30~40mL、2mol/L的NaOH水溶液中,加入100~110mg硼氫化鈉、3~4mL環氧氯乙烷,30~35℃振蕩,在10~12h內陸續滴加15~20mL NaOH和9~12mL環氧氯乙烷,再繼續震蕩反應10~12h,用水洗凈載體;
(3a)將步驟(2a)中得到的載體加入到40~50mL、2mol/L的Na2CO3溶液中,加入4~5g的IDA于30~35℃搖床中振蕩20~24h,用水沖洗干凈,得到表面修飾亞氨基二乙酸的金屬螯合樹脂載體。
實施例2:Ni2+吸附量的測定
稱取2.38g的NiCl2.6H2O定容至100mL的容量瓶中,溶液中Ni2+濃度為0.1mol/L。取5mL定容至500mL的容量瓶中,再從500mL溶液中取出10mL定容至200mL容量瓶中,此時溶液中Ni2+濃度為5×10-5mol/L,最后從200mL溶液中依次取出5mL、10mL、20mL、50mL各定容至100mL容量瓶中,相對應的Ni2+濃度為2.5×10-5mol/L、1×10-5mol/L、5×10-6mol/L和2.5×10-6mol/L。用丁二酮肟分光光度法測量溶液中Ni2+含量,將配制好的各濃度的Ni2+溶液各吸取10mL于25mL容量瓶中,空白對照吸取10mL純水,加2mL檸檬酸銨溶液和1mL碘溶液于試料中,加水至20mL搖勻,加2mL丁二酮肟溶液,搖勻,加2mL的Na2-EDTA溶液,加水至標線,搖勻。用10mm比色皿,以水為參比液,在530nm波長下測量顯色液的吸光度并減去空白試驗的吸光度。以各濃度為橫坐標,吸光度為縱坐標作圖。
由標準曲線可以算出1g樹脂吸附的Ni2+濃度為4.68×10-5mol/L,約為0.278mg。實施例3:酶蛋白吸附量的測定
先配制1g/L的標準蛋白質溶液,取7只試管分別標號,按如下表格加入各試劑,于595nm處測量吸光度,以A595為縱坐標,標準蛋白濃度為橫坐標,在坐標軸上繪制標準曲線。用已經獲得的親和吸附介質吸附酶液,酶液用量15mL,于25℃、150r/min振蕩2個小時,結束后依照上述操作,測出其A595nm,然后利用標準曲線求出蛋白含量。取原酶液、吸附完的上清液以及用500mmol咪唑洗脫固定化酶后的洗脫液進行凝膠電泳實驗,結果如圖1和圖2。由標準曲線可以算出1g樹脂可以吸附的蛋白量大約為2.623mg;圖1中上清液在45KD處的條帶變暗說明了制備的親和吸附介質對于蛋白的純化及吸附具有效果;圖2中用咪唑洗脫得到的單一條帶進一步表明制備的親和吸附介質對于蛋白純化及吸附具有良好的效果。
表1蛋白質濃度測定表
實施例4:載體及Ni2+修飾載體后的電鏡掃描
將本發明的亞氨基二乙酸修飾的樹脂微球載體進行電鏡掃描,以及吸附Ni2+后的載體進行電鏡掃描,得到圖2。圖2是修飾IDA樹脂載體微球形貌圖;圖3是載體介質表面結構的電鏡掃描圖片;圖4是載體內部結構剖面的電鏡掃描圖片;圖5是載體修飾Ni2+之后內部結構剖面的電鏡掃描圖片。由圖片可以看出,該載體表面及內部均有許多孔洞及凹坑,這種孔量豐富的結構更有利于酶的固定化。
實施例5:固定化酶使用穩定性的研究。
稱取10g已制備好的固定化酶,于4℃下貯藏,定期測定其酶活。固定化酶的儲存穩定性測試結果如圖6所示,圖6表明固定化酶的穩定性很好,經8批次的重復使用,固定化酶的相對酶活仍可達初始值的90%以上。固定化酶酶活為9.85~10.23U/mg,游離酶酶活為3.04~5.10U/mg。
- 還沒有人留言評論。精彩留言會獲得點贊!