水稻FAH基因在水稻育性控制中的應用的制作方法
本發明屬于基因工程應用技術領域,涉及水稻FAH基因在控制水稻育性方面的應用,具體是通過抑制水稻FAH基因的表達創建水稻雄性不育材料。
背景技術:
水稻是重要的糧食作物,其生產對我國糧食的供給具有重要的意義。雜交水稻的推廣,使水稻產量得到大幅度提高,一定程度上緩解了我國人口迅速增長對糧食需求急劇增長的壓力。雜交水稻是選用遺傳上具有一定差異的優良水稻品種為親本,采用“三系法”或“二系法”等生產具有雜種優勢的雜交種。雜交種在產量、生長勢、生活力、繁殖力等方面都優于雙親。“三系法”是利用不育系、保持系和恢復系進行雜交育種,是水稻育種和推廣的一個巨大成就。其中,雄性不育系雌蕊發育正常,而雄蕊的發育退化或敗育,不能自花授粉結實;保持系雌雄蕊發育正常,將其花粉授予雄性不育系的雌蕊,不僅可結種子,而且播種后仍可獲得雄性不育植株;恢復系花粉授予不育系的雌蕊,所產生的種子播種后,長成的植株又恢復了育性。雄性不育性的利用是制備雜交水稻的重要環節。但是從自然界中尋找的不育系并不多。利用基因工程的方法獲得不育系是一條有效的途徑。如通過干擾某些基因的表達使花粉敗育獲得不育系(de Groot et al,2004;Chen et al,2007;Shi et al,2015)。
FAH基因編碼的延胡索酰乙酰乙酸水解酶參與酪氨酸降解途徑。在擬南芥中編碼FAH的基因突變后會造成擬南芥在短日照條件下的細胞死亡(Han et al,2013)。但是,目前尚未有關于水稻FAH基因在控制育性方面的研究報道。
技術實現要素:
本發明的目的在于,針對上述現有技術的不足,提供水稻FAH基因在水稻育性控制中的應用,為培育水稻不育系提供新的方法。
為達上述目的,本發明所采用的技術方案是:水稻FAH基因在控制水稻育性中的應用,該FAH基因的核苷酸序列如SEQ ID No.3所示。其中,該水稻FAH基因在育性控制方面的應用是指干擾該基因的表達降低水稻植物的育性,即該基因的表達降低使水稻植物的育性降低。
本發明通過基因工程手段將該FAH基因與干擾表達載體連接后,轉化至其它植物如水稻中,抑制該基因在轉化后的植物體內的表達,可以使該植物的育性降低。
本發明同時提供上述水稻FAH基因在培育水稻雄性不育植株中的應用,該FAH基因的核苷酸序列如SEQ ID No.3所示。
本發明還提供一種培育水稻雄性不育植株的方法,該方法是將含權利要求1所述FAH基因的干擾表達載體導入水稻植株中,能抑制水稻中FAH基因的表達,使水稻育性降低,該水稻植株經培育即得水稻雄性不育植株。
本發明克隆了水稻FAH基因,分析該基因在水稻不同組織中的表達,發現該基因在水稻幼穗中的表達水平最高。進一步將該基因與植物干擾表達載體連接重組后,轉化至水稻日本晴中,發現轉基因水稻中該基因的表達水平降低,并且轉基因水稻的花粉活力和育性都降低。通過對水稻中該基因的表達干擾,降低其在水稻中的表達水平,可以獲得雄性不育的轉基因水稻,這些不育系能用于雜交水稻的生產。另外可以利用該基因抑制其它植物中其同源基因的表達,而控制其它植物的育性。
附圖說明
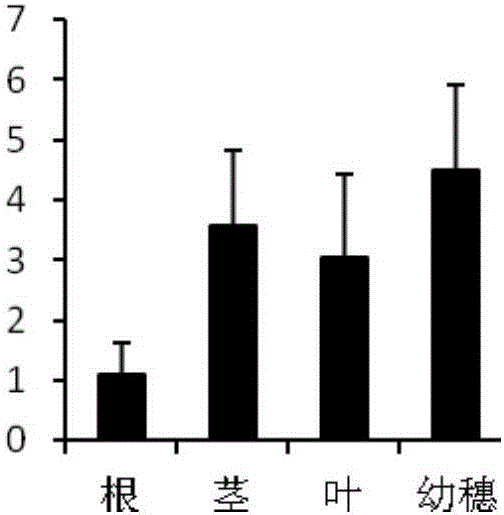
圖1為水稻FAH基因在水稻不同組織中的表達分析。
圖2為FAH基因干擾表達轉基因水稻的鑒定。
其中,A:FAH基因干擾表達轉基因水稻的PCR鑒定;WT表示非轉基因對照水稻;1-4表示FAH干擾表達轉基因水稻;
B:FAH基因干擾表達轉基因水稻中FAH基因的表達分析;WT表示非轉基因對照水稻;1,3,4表示FAH干擾表達轉基因水稻。
圖3是FAH基因干擾表達轉基因水稻的育性觀察。
其中,A:FAH基因干擾表達轉基因水稻植株的觀察;B:FAH基因干擾表達轉基因水稻種子的觀察;C:FAH基因干擾表達轉基因水稻花粉活力的觀察。A、B、C中的WT表示非轉基因對照水稻,RNAi表示FAH干擾表達轉基因水稻。
具體實施方式
實施例1水稻FAH基因cDNA的克隆及其序列分析
將水稻日本晴種子于37℃催芽1天后,播種于溫室中,取三葉期水稻葉片提取RNA。RNA的提取采用大連TAKARA公司的RNAiso Plus試劑進行,具體操作步驟如下:①取100mg水稻葉片,液氮研磨成粉末后,加入1ml RNAiso Plus溶液,充分混勻后,室溫放置5min,12000rpm/min離心5min,取上清液;②加入200ul氯仿于上清液中,充分混勻后,室溫靜置5min,12000rpm/min離心10min,取上清液;③加入500ul異丙醇,充分混勻后,室溫靜置10min,12000rpm/min離心15min,取沉淀;④沉淀用500ul 75%乙醇洗滌兩次;⑤去乙醇,沉淀自然干燥后,用20ul雙蒸水溶解后備用。RNA反轉錄成cDNA,采用YOYOBO公司的ReverTra Ace qPCR RT Master Mix with gDNA Remover試劑盒進行。具體操作如下:取1ug RNA和適量雙蒸水混勻,總體積為12ul,65℃處理5min,冰上迅速冷卻后,加入4ⅹDNase Mix 4ul,37℃處理5min。加入5ⅹRT Master Mix 4ul,37℃處理15min后,再于50℃處理5min,98℃處理5min,終止反應。
根據Genbank中水稻日本晴FAH(序列號AK070521.1)基因的序列,設計引物FAHF(5′-ATCTGCGCCTATTTATTGCGGCCTCT-3′,見SEQ ID No.1)和FAHR(5′-GACTTCAAATAAGTTCTTATTGTAACTGGAG-3′,見SEQ ID No.2)。以反轉錄獲得的cDNA為模板,采用RT-PCR法克隆水稻日本晴的FAH基因。PCR反應體系為25ul,其中5×TransStart FastPfu Buffer 5ul、2.5mM dNTP 2.5ul、10mM引物FAHF 1ul、10mM引物FAHR 1ul、cDNA 10ng、TransStart FastPfu DNA Polymerase 0.5ul,補ddH2O至25ul;反應程序為:95℃預變性2min,95℃變性20S,62℃退火20S,72℃延伸1min20S,循環35次,72℃最后延伸10min。獲得的FAH基因由華大基因公司測序,序列分析表明,克隆的FAH基因序列與Genbank中日本晴的FAH基因序列完全一致。說明克隆的基因為水稻日本晴的FAH基因。該水稻FAH基因的cDNA序列見SEQ ID No.3,其編碼區包含1290個核苷酸(見SEQ ID No.4),編碼一個長度為430個氨基酸的蛋白質。
實施例2 FAH基因在水稻不同組織中的表達分析
以孕穗期的水稻日本晴的根、莖、葉和幼穗為材料,分析FAH基因在水稻不同組織中的表達水平。
該孕穗期的水稻日本晴的根、莖、葉和幼穗的RNA的提取及反轉錄方法同實施例1。采用熒光定量PCR法分析FAH基因在不同組織中的表達水平。根據克隆的FAH基因序列,設計熒光定量PCR引物OSFAH1(5′-CGCCAGGAAACGCTCAAC-3′,見SEQ ID No.5)和OSFAH2(5′-GTCGCTCATGGGAACAAGG-3′,見SEQ ID No.6)。以OSFAH1和OSFAH2為引物,水稻各個組織的RNA反轉錄產物為模板,反應體系為20ul(模板400ng,OSFAH1和OSFAH2各0.8ul,美國ROCH公司的熒光定量試劑FastStart Universal SYBR Green Master(ROX)10ul,補雙蒸水至總體積為20ul),以水稻OsUBQ5基因(Genbank序列號:AK061988)為內參,OsUBQ5基因的熒光定量PCR引物為:OsUBQ51(5′-ACCACTTCGACCGCCACTACT-3,見SEQ ID No.7);OsUBQ52(5′-ACGCCTAAGCCTGCTGGTT-3′,見SEQ ID No.8)。采用美國伯樂公司的CFX Connect Real-Time PCR System熒光定量PCR儀進行熒光定量PCR反應。反應程序為:95℃預變性10min;95℃變性15sec,60℃延伸1min,共40個循環。FAH在水稻不同組織中的表達水平見圖1,實驗結果表明,FAH基因在水稻幼穗中的表達水平最高,說明該基因在水稻幼穗的發育中發揮著重要的功能。
實施例3 FAH基因干擾表達轉基因水稻的鑒定
為進一步鑒定FAH基因在水稻幼穗發育中的功能,本發明構建了FAH基因的干擾表達載體,并轉化水稻日本晴,觀察FAH干擾表達轉基因水稻的育性。具體步驟如下:
A.根據已克隆的水稻FAH基因的序列(如SEQ ID No.3所示),采用Premier 5軟件設計特異性引物P1(CAGCTTGTTGCAAGGGT,見SEQ ID No.9)和P2(GACTTCAAATAAGTTCTTATTGTAAC,見SEQ ID No.10),以已克隆的FAH基因為模板,采用高保真酶TransStart FastPfu DNA Polymerase(TRNAsGen)PCR擴增FAH基因序列,PCR反應體系為25ul,其中5×TransStart FastPfu Buffer 5ul,2.5mM dNTP 2.5ul,10mM引物P1 1ul,10mM引物P2 1ul,水稻FAH基因cDNA 10ng,TransStart FastPfu DNA Polymerase 0.5ul,補ddH2O至25ul;反應程序為:95℃預變性2min,95℃變性20S,54℃退火20S,72℃延伸20S,循環35次,72℃最后延伸10min。純化PCR擴增產物。載體ptENTRA經XcmI(大連寶生物)酶切,酶切體系為20μl,其中10x buffer M 2ul、ptENTRA 0.5μg、XcmI 1ul(1U/1ul),補ddH2O至20ul,37℃酶切過夜。酶切產物純化后,采用T4 DNA Ligase(Fermentas)連接擴增的水稻FAH基因和載體ptENTRA。FAH基因與ptENTRA載體按照3:1的分子比例混合,連接體系20ul,其中10xT4 DNA Ligase Buffer 2ul、T4 DNA Ligase 1ul,補ddH2O至20ul,16℃連接過夜。采用熱激法轉化大腸桿菌DH5α,在含Kan 50ug/ml的LB的培養基上篩選轉化子,通過菌落PCR和測序進一步驗證轉化子,從而獲得FAH基因與載體ptENTRA重組的載體。將該載體用Invitrogen(上海)公司的LR CLONASE ENZYME MIX同源重組酶和植物干擾表達載體pANDA進行同源重組。反應體系為:含FAH基因的ptENTRA載體150ng、干擾表達載體pANDA150ng,加入TE緩沖液至總體積為8ul,加入2ul LR CLONASE ENZYME MIX后,25℃處理過夜。再加入1ul蛋白酶K于反應體系中,37℃處理10min,終止反應。取該反應產物1ul轉化大腸桿菌DH5α,在含Kan 50ug/ml和潮霉素50ug/ml的LB培養基上篩選轉化子,FAH基因干擾表達載體經酶切和測序進行進一步鑒定。
B.將構建好的FAH基因干擾表達載體采用電激轉化法轉化農桿菌GV3101,在含50ug/ml Kan、50ug/ml慶大霉素、20ug/ml利福平和50ug/ml潮霉素的YEB培養基上篩選耐性轉化子。
C.FAH干擾表達載體轉化水稻日本晴:將含FAH基因干擾表達載體的農桿菌送武漢伯遠生物科技有限公司進行水稻的轉化,轉化的水稻品種為日本晴。
D.FAH基因干擾表達轉基因水稻的鑒定:
取轉基因水稻幼葉,采用CTAB法提取DNA。具體操作如下:取100mg水稻葉片,液氮研磨成粉末后,加入600ul 2%CTAB溶液(由100mmol/l pH 8.0 Tris-HCl、20mmol/l EDTA、1.4mol/l NaCl及2%CTAB組成),充分混勻后,65℃水浴30min;待材料冷卻至室溫后,加入600ul氯仿,充分混勻后,10000rpm/min離心10min;取上清液加入600ul預冷的異丙醇,混勻后,10000rpm/min離心10min,取沉淀。沉淀用600ul 75%的乙醇洗滌2次,去乙醇,自然干燥備用。用30ul雙蒸水溶解提取的DNA,加入1ul RNA酶,37℃處理30min,處理的DNA溶液用于后續的PCR實驗。
根據干擾表達載體pANDA的序列以及FAH基因的序列,設計引物GUSlinker(CCGAATACGGCGTGGAT,見SEQ ID No.11)和P2(GACTTCAAATAAGTTCTTATTGTAAC,見SEQ ID No.10)。以GUSlinker和P2為引物,前述的DNA溶液為模板,PCR鑒定轉基因植株。PCR反應體系為25ul,其中5×TransStart FastPfu Buffer 5ul、2.5mM dNTP 2.5ul、10mM引物GUSlinker 1ul、10mM引物P2 1ul、轉基因水稻DNA 10ng、TransStart FastPfu DNA Polymerase 0.5ul,補ddH2O至25ul。反應程序為:95℃預變性2min,95℃變性20S,54℃退火20S,72℃延伸1min,循環35次,72℃最后延伸10min。PCR結果見圖2A。圖2A顯示,非轉基因對照材料中未擴增到任何帶,而轉FAH基因干擾表達載體的水稻植株中擴增出預期大小的目的帶,表明FAH基因的干擾載體已經轉入水稻中。同時提取轉基因材料葉片中的RNA,采用熒光定量PCR檢測轉基因水稻中FAH基因的表達水平。RNA提取及其反轉錄以及熒光定量PCR的操作同實施例1。實驗結果表明,轉FAH基因干擾表達載體的水稻中FAH基因的表達低于非轉基因材料中FAH的表達水平,說明FAH干擾表達載體的導入干擾了日本晴中FAH基因的表達,使該基因的表達水平降低,見圖2B。
實施例4 FAH干擾表達轉基因水稻的育性觀察
水稻花粉活力實驗采用碘-碘化鉀染色法。具體操作如下,取同時期的轉基因水稻材料及其對照的成熟花藥置于載玻片上,用鑷子將其搗碎,使花粉粒釋放出來,再加入1滴1%的碘-碘化鉀溶液進行染色,染色后置于顯微鏡下觀察。染成藍色的花粉粒是具有活力的花粉粒,染成黃褐色的花粉粒為發育不良活性低的花粉粒。觀察轉基因材料及其對照的花粉活力以及育性,結果見圖3,顯示,非轉基因對照水稻籽粒飽滿,而轉FAH基因干擾表達載體的水稻籽粒為秕谷(圖3B)。進一步鑒定轉基因水稻植株的花粉粒的活力,發現其花粉粒被染成黃褐色,而非轉基因對照水稻的花粉粒除少數幾個外,其余的被染成藍色(圖3C)。這些結果表明轉基因水稻材料的花粉活力和育性都下降,而花粉無活力則造成轉基因水稻材料的不育。因此,通過干擾水稻中FAH的表達,可以影響水稻花粉的活力,從而獲得水稻雄性不育植株。
綜上所述,經過這些實驗,發明人證明了水稻FAH基因在植物育性方面有著重要的功能。通過將該基因與植物干擾表達載體連接后,轉化植物,干擾轉化植物內FAH同源基因的表達,能獲得育性降低的植物,為培育植物不育系奠定了理論和生產實踐基礎。
參考文獻:
1.de Groot P,Weterings K,de Been M,Wittink F,Hulzink R,Custers J,van Herpen M,Wullems G(2004)Silencing of the pollen-specific gene NTP303and its family members in tobacco affects in vivo pollen tube growth and results in male plants.Plant Mol Biol 55:715-726。
2.Chen RZ,Zhao X,Shao Z,Wei Z,Wang YY,Zhu LL,Zhao J,Sun MX,RF He,GC He(2007)Rice UDP-Glucose pyrophosphorylase1is essential for pollen callose deposition and its cosuppression results in a new type of thermosensitive genic male sterility.Plant Cell 19:847-861。
3.Shi X,Sun X,Zhang Z,Feng D,Zhang Q,Han L,Wu J,Lu T(2015)GLUCAN SYNTHASE-LIKE 5(GSL5)plays an essential role in male fertility by regulating callose metabolism during microsporogenesis in rice.Plant Cell Physiol 56:497-509。
4.Han CY,Ren CM,Zhi TT,Zhou Z,Liu Y,Chen F,Peng W,Xie DX(2013)Disruption of fumarylacetoacetate hydrolase causes spontaneous cell death under short-day conditions in Arabidopsis.Plant Physiol 162:1956-1964。
SEQUENCE LISTING
<110> 湖南農業大學
<120> 水稻FAH基因在水稻育性控制中的應用
<130> 011
<160> 11
<170> PatentIn version 3.3
<210> 1
<211> 26
<212> DNA
<213> 合成
<400> 1
atctgcgcct atttattgcg gcctct 26
<210> 2
<211> 31
<212> DNA
<213> 合成
<400> 2
gacttcaaat aagttcttat tgtaactgga g 31
<210> 3
<211> 1618
<212> DNA
<213> Oryza sativa
<400> 3
atctgcgcct atttattgcg gcctcttctt cctcctctcc tcgcctcgcc tcgctcttcc 60
actgttcatc tgcgccacga cacgacacga cacgacacga gacgagagag gagtcggcaa 120
tggcggaggg gtcgcggtcg ccgctgaggt cgttcgtgga ggtggcgccg gggtcgcact 180
tccccatcca gaacctcccc ttcggggtct tccgccgcag gggctcgccg gagccggagc 240
cgccgcgccc ggccgtcgcc atcggggact tcgcgctcga cctcgccgcc gtctccgacg 300
cgggcctctt ccacgggccc ctcctctccg cctccccctg cttccgccag gaaacgctca 360
acatgttcct ggggatgggg cgtccggcct ggaaggaggc gcgcgccacg ctgcagaaga 420
tcctctcagc tgatgagccg gttttgcgtg acaacgaggc cttgaagaag aagtgccttg 480
ttcccatgag cgacacagag atgcttctgc caatcacggt aggagactac accgacttct 540
tttgttctgt gcaccatgca aggaattgtg ggttcatctt ccgtgggcca cagaccccag 600
tcaacccaaa ttggtttcag cttccagtag gttatcatgg tcgtgcatcc tctgtgattg 660
tatctggaac agacatcatt cgacccaaag ggcaaggcca tccaacagga gattctcgac 720
cttattttgg tccttctaag aagcttgatt ttgaacttga gatggcagcc attgttggac 780
cagggaatga attgggaaaa cctatcgata ttaatgatgc tgaagaacat atctttggcc 840
taatgataat gaatgattgg agtgccagag atatccaagc ttgggaaact atacctcttg 900
gacctttcct tgggaaaagt ttcagtacca cagtatcacc ctggatcgtt actatggatg 960
ccctaaagcc tttcacctgt gaagctccta agcaggaacc tgaacctttg ccttacttag 1020
ctgaaaagaa ccacgtaaac tacgatattc ctcttgaggt ctggattaag cccaaggagc 1080
aaagtgaacc atcaatggtt gcaaagagta acttcaagca tctgtattgg actttaacac 1140
agcaactagc acaccacact gttaatggat gcaatctgag accaggggat atgtttgcaa 1200
ctggcacact aagcggacct gagacagaat ctttgggatg tttgctggag ctaacatgga 1260
atgggcagaa ggagatatca gttggaaact cgacccgcaa gttcctagaa gatggggatg 1320
aggtcatctt gacagcttgt tgcaagggtg aaggctacaa tgtcggattc ggaacctgca 1380
ctgggaaggt tctgcctgca cttccatgat ccaacatata gaggatagcc tgctttcatc 1440
tcatcagtgt gtcaataatc tctgaagaaa gcatgcaatg aggcaatgta tctagctagt 1500
tacatctata ttttagtgct tagtgatggt aaaaatacta ataaggtatg cttccctgag 1560
ctttacagaa gggatgtaat taatgttctc cagttacaat aagaacttat ttgaagtc 1618
<210> 4
<211> 1290
<212> DNA
<213> Oryza sativa
<400> 4
atggcggagg ggtcgcggtc gccgctgagg tcgttcgtgg aggtggcgcc ggggtcgcac 60
ttccccatcc agaacctccc cttcggggtc ttccgccgca ggggctcgcc ggagccggag 120
ccgccgcgcc cggccgtcgc catcggggac ttcgcgctcg acctcgccgc cgtctccgac 180
gcgggcctct tccacgggcc cctcctctcc gcctccccct gcttccgcca ggaaacgctc 240
aacatgttcc tggggatggg gcgtccggcc tggaaggagg cgcgcgccac gctgcagaag 300
atcctctcag ctgatgagcc ggttttgcgt gacaacgagg ccttgaagaa gaagtgcctt 360
gttcccatga gcgacacaga gatgcttctg ccaatcacgg taggagacta caccgacttc 420
ttttgttctg tgcaccatgc aaggaattgt gggttcatct tccgtgggcc acagacccca 480
gtcaacccaa attggtttca gcttccagta ggttatcatg gtcgtgcatc ctctgtgatt 540
gtatctggaa cagacatcat tcgacccaaa gggcaaggcc atccaacagg agattctcga 600
ccttattttg gtccttctaa gaagcttgat tttgaacttg agatggcagc cattgttgga 660
ccagggaatg aattgggaaa acctatcgat attaatgatg ctgaagaaca tatctttggc 720
ctaatgataa tgaatgattg gagtgccaga gatatccaag cttgggaaac tatacctctt 780
ggacctttcc ttgggaaaag tttcagtacc acagtatcac cctggatcgt tactatggat 840
gccctaaagc ctttcacctg tgaagctcct aagcaggaac ctgaaccttt gccttactta 900
gctgaaaaga accacgtaaa ctacgatatt cctcttgagg tctggattaa gcccaaggag 960
caaagtgaac catcaatggt tgcaaagagt aacttcaagc atctgtattg gactttaaca 1020
cagcaactag cacaccacac tgttaatgga tgcaatctga gaccagggga tatgtttgca 1080
actggcacac taagcggacc tgagacagaa tctttgggat gtttgctgga gctaacatgg 1140
aatgggcaga aggagatatc agttggaaac tcgacccgca agttcctaga agatggggat 1200
gaggtcatct tgacagcttg ttgcaagggt gaaggctaca atgtcggatt cggaacctgc 1260
actgggaagg ttctgcctgc acttccatga 1290
<210> 5
<211> 18
<212> DNA
<213> 合成
<400> 5
cgccaggaaa cgctcaac 18
<210> 6
<211> 19
<212> DNA
<213> 合成
<400> 6
gtcgctcatg ggaacaagg 19
<210> 7
<211> 21
<212> DNA
<213> 合成
<400> 7
accacttcga ccgccactac t 21
<210> 8
<211> 19
<212> DNA
<213> 合成
<400> 8
acgcctaagc ctgctggtt 19
<210> 9
<211> 17
<212> DNA
<213> 合成
<400> 9
cagcttgttg caagggt 17
<210> 10
<211> 26
<212> DNA
<213> 合成
<400> 10
gacttcaaat aagttcttat tgtaac 26
<210> 11
<211> 17
<212> DNA
<213> 合成
<400> 11
ccgaatacgg cgtggat 17
- 還沒有人留言評論。精彩留言會獲得點贊!