一種殼聚糖?海藻酸鹽多孔凝膠及其制備和應用方法與流程
本發明屬于高分子材料領域,具體來說,涉及一種殼聚糖-海藻酸鹽多孔凝膠及其制備和應用方法。
背景技術:
水凝膠是在水中溶脹并保持大量的水分而又不溶解的聚合物。高分子水凝膠是由高分子骨架、水、交聯劑組成的三維體系,具有復雜空間網狀結構,有著廣泛的應用。在醫學領域:用作藥物釋放的載體,水凝膠兼備儲存藥物、控制釋放速度、驅動釋放三種功能,既能調節制劑的強度和硬度,又能起到促進分解、賦形的作用,還能遮蔽醫藥品的苦味和氣味,可用于口服、鼻腔、口腔、直腸、眼部、注射等給藥途徑。用作傷口敷料,水凝膠材料直接用于與人體組織接觸,可防止體外微生物的感染,抑制體液的損失,傳輸氧到傷口可加速上皮細胞生長,加速新微血管增生,隔絕細菌侵犯,抑制細菌繁殖,促進傷口的愈合。水凝膠因具有生物相容性、生物降解性、高含水量和細胞膜粘附性而應用于組織工程。
近年來,隨著醫學技術的進步,對于由外傷、意外或者癌癥所帶來的器官或組織的損傷的修復技術得到了極大的提高,然而,器官或組織的移植仍然是被病人廣泛接受的治療方法。由于自體移植會給患者帶來二次傷害和痛苦,異體移植有很多諸如排異、器官來源受限等問題,運用組織工程(Tissue engineering)的方法來減少病痛和排異給治療帶來了很大的希望。組織工程的方法主要是用可降解的三維(3-D)人工材料的結構來誘導病人自體細胞的生長,達到器官或組織再生的目的。當新的器官和組織完成再生后,人工材料也隨著時間降解完畢。
雖然對于不同的器官或組織需要不同形態特點的材料,但是這些3-D誘導材料卻有一些共同的要求:(1)3-D材料要與被替代的組織具有相似性;(2)這些材料需要具備開孔的結構并且孔的尺寸要合適;(3)材料要有合適的機械性能使之可以維持預先設計的組織結構并且可以承受應用于原始組織的裝載物;(4)材料需要時可降解的并且要具有合適的降解速率;(5)材料需要不會引起發炎癥狀或者可以減輕發炎癥狀。綜上,具有可降解性、良好生物相容性和良好的機械性能的多孔水凝膠就是一種十分優良的組織工程3-D誘導材料。
技術實現要素:
技術問題:本發明所要解決的技術問題是:提供一種殼聚糖-海藻酸鹽多孔凝膠及其制備和應用方法,該水凝膠具有多重網絡的結構,具有良好的機械性能、溶脹性能和降解性能,使得其在組織工程支架中具有很好的應用。
技術方案:為解決上述技術問題,本發明采用的技術方案是:
第一方面,本發明實施例提供一種殼聚糖-海藻酸鹽多孔凝膠,該多孔凝膠按照質量份數,包括以下組分:
殼聚糖:1~3份,
海藻酸鹽:1~3份,
一價金屬鹽溶液:94~98份,
殼聚糖的天然交聯劑、海藻酸鹽的離子交聯劑、發泡劑,以及表面活性劑;
一價金屬鹽溶液的質量濃度為0.01~0.5%;
所述殼聚糖的天然交聯劑的質量是所述殼聚糖質量的0.5~5%;
所述海藻酸鹽的離子交聯劑為二價金屬鹽,所述二價金屬鹽質量是所述海藻酸鹽質量的2~30%;
所述發泡劑的質量是多孔凝膠總質量的0.1~15%;
所述表面活性劑的質量是多孔凝膠總質量的0.1~15%。
結合第一方面,作為第一種可能實施方案,所述的殼聚糖的天然交聯劑為京尼平。
結合第一方面,作為第二種可能實施方案,所述的二價金屬鹽為鈣鹽、鍶鹽或者鋇鹽,且金屬鹽具有可溶性或者微溶性。
結合第一方面,作為第三種可能實施方案,所述的發泡劑是碳酸鹽或者酸式碳酸鹽。
結合第一方面,作為第四種可能實施方案,所述的表面活性劑為陽離子型表面活性劑、陰離子型表面活性劑或者非離子表面活性劑。
結合第一方面,作為第五種可能實施方案,所述的一價金屬鹽溶液為氯化鈉溶液或者氯化鉀溶液。
結合第一方面,作為第六種可能實施方案,所述的多孔凝膠中形成三重網絡,分別為殼聚糖和殼聚糖的天然交聯劑形成的共價交聯網絡,海藻酸鹽和海藻酸鹽的離子交聯劑之間形成的離子交聯網絡,以及殼聚糖上的-NH2和海藻酸鈉上的-COOH之間的相互作用形成的第三重網路。
第二方面,本發明實施例提供一種殼聚糖-海藻酸鹽多孔凝膠的制備方法,該制備方法包括以下步驟:
步驟10)將質量份數為1~3份的殼聚糖加入47~49份的一價金屬鹽的乙酸溶液中,攪拌均勻,使殼聚糖完全溶解,形成殼聚糖溶液;
將質量份數為1~3份的海藻酸鹽加入47~49份的一價金屬鹽溶液中,攪拌均勻,使海藻酸鹽完全溶解,形成海藻酸鹽液溶;
步驟20)攪拌海藻酸鹽溶液,向海藻酸鹽溶液中加入殼聚糖的天然交聯劑,表面活性劑,然后加入發泡劑、殼聚糖溶液,最后加入海藻酸鈉的離子交聯劑,攪拌1~15min,加冰袋冷卻超聲1~60min,隨后用封口膜封裝,形成均勻的發泡體系;
步驟30)將步驟20)形成的發泡體系于15~60℃水浴培養4~48h,得到殼聚糖-海藻酸鈉多孔凝膠。
結合第二方面,作為第一種可能實施方案,所述一價金屬鹽溶液的質量濃度為0.01~0.5%;
所述殼聚糖的天然交聯劑的質量是所述殼聚糖質量的0.5~5%;
所述海藻酸鹽的離子交聯劑為二價金屬鹽,所述二價金屬鹽質量是所述海藻酸鹽質量的2~30%;
所述發泡劑的質量是多孔凝膠總質量的0.1~15%;
所述表面活性劑的質量是多孔凝膠總質量的0.1~15%。
第三方面,本發明實施例提供一種所述的殼聚糖-海藻酸鹽多孔凝膠作為生物醫用材料的應用。
有益效果:與現有技術相比,本發明所制備出的殼聚糖海藻酸鈉的多孔凝膠,具有良好的機械性能。與單一的海藻酸鹽的水凝膠或者單獨的殼聚糖水凝膠相比,本發明所制備出的多孔凝膠在機械性能上有很大的提高。本發明制備的殼聚糖海藻酸鈉多孔凝膠,具有強于殼聚糖水凝膠、海藻酸鈉水凝膠的強度,同時又具有多孔結構,此外還具有良好的溶脹和降解性能。因此,本發明的多孔凝膠可以在組織工程支架方面將具有良好的應用。
附圖說明
圖1是本發明中所制備的多孔凝膠中形成的三重互穿網絡的結構圖示意圖;
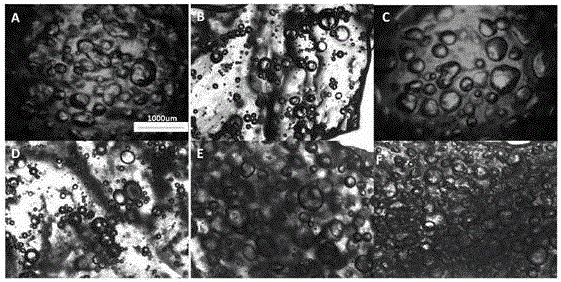
圖2是本發明實施例1-6所制備的凝膠的多孔結構顯微鏡圖;
圖3是本發明實施例1-6所制備的凝膠進行機械性能測試的線條圖;
圖4是本發明實施例1以及對比例所制備的多孔凝膠在不同pH下的溶脹性能圖;
圖5是本發明實施例1以及對比例所制備的多孔凝膠在pH7.4下的降解性能圖。
具體實施方式
下面結合具體的實施例對本發明作進一步的描述,以便本領域的技術人員進一步理解本發明,但以下實施例并不以任何形式限制本發明。
本發明實施例的殼聚糖-海藻酸鹽多孔凝膠,按照質量份數,包括以下組分:
殼聚糖:1~3份,
海藻酸鹽:1~3份,
一價金屬鹽溶液:94~98份,
殼聚糖的天然交聯劑、海藻酸鹽的離子交聯劑、發泡劑,以及表面活性劑;
一價金屬鹽溶液的質量濃度為0.01~0.5%;
所述殼聚糖的天然交聯劑的質量是所述殼聚糖質量的0.5~5%;
所述海藻酸鹽的離子交聯劑為二價金屬鹽,所述二價金屬鹽質量是所述海藻酸鹽質量的2~30%;
所述發泡劑的質量是多孔凝膠總質量的0.1~15%;
所述表面活性劑的質量是多孔凝膠總質量的0.1~15%。
上述實施例中,作為優選,所述的殼聚糖的天然交聯劑為京尼平(genipin)。所述的二價金屬鹽為鈣鹽、鍶鹽或者鋇鹽,且金屬鹽具有可溶性或者微溶性。可溶性的鈣鹽、鍶鹽、鋇鹽,通過離子交聯海藻酸鈉結構中的G段或MG段形成交聯網絡;微溶性的鈣鹽、鍶鹽、鋇鹽,由于已溶解出的部分離子與海藻酸鈉發生交聯,從而促進微溶性鹽在水中的溶解和電離,最終使微溶性鹽中的二價離子全部釋放出來,參與海藻酸鈉的交聯過程。所述的發泡劑是碳酸鹽或者酸式碳酸鹽。所述的表面活性劑為陽離子型表面活性劑、陰離子型表面活性劑或者非離子表面活性劑。所述的一價金屬鹽溶液為氯化鈉溶液或者氯化鉀溶液。
上述殼聚糖-海藻酸鹽多孔凝膠中形成三重網絡,分別為殼聚糖和殼聚糖的天然交聯劑形成的共價交聯網絡,海藻酸鹽和海藻酸鹽的離子交聯劑之間形成的離子交聯網絡,以及殼聚糖上的-NH2和海藻酸鈉上的-COOH之間的相互作用形成的第三重網路。
上述殼聚糖-海藻酸鹽多孔凝膠的制備方法,該制備方法包括以下步驟:
步驟10)將質量份數為1~3份的殼聚糖加入47~49份的一價金屬鹽的乙酸溶液中,攪拌均勻,使殼聚糖完全溶解,形成殼聚糖溶液;將質量份數為1~3份的海藻酸鹽加入47~49份的一價金屬鹽溶液中,攪拌均勻,使海藻酸鹽完全溶解,形成海藻酸鹽液溶。
步驟20)攪拌海藻酸鹽溶液,向海藻酸鹽溶液中加入殼聚糖的天然交聯劑,表面活性劑,然后加入發泡劑、殼聚糖溶液,最后加入海藻酸鈉的離子交聯劑,攪拌1~15min,加冰袋冷卻超聲1~60min,隨后用封口膜封裝,形成均勻的發泡體系。
步驟30)將步驟20)形成的發泡體系于15~60℃水浴培養4~48h,得到殼聚糖-海藻酸鈉多孔凝膠。
上述的殼聚糖-海藻酸鹽多孔凝膠可作為生物醫用材料。
如圖1所示,以Ca2+作為離子交聯劑、NaCl作為金屬鹽為例,按照上述制備方法制備的多孔凝膠內部形成了三重網絡結構,包括殼聚糖和京尼平形成的共價交聯網絡,海藻酸鈉和離子交聯劑之間形成的離子交聯網絡以及殼聚糖上的-NH2和海藻酸鈉上的-COOH之間的相互作用形成的第三重網絡。
在制備過程中,殼聚糖的天然交聯劑可以與殼聚糖發生化學交聯,形成第一重交聯網路,二價金屬離子可以與海藻酸鹽結構中的G段和MG段交聯形成第二重交聯網絡。同時當將殼聚糖和海藻酸鹽混合后,由于二者因靜電相互作用在相界面形成聚電解質,而不能使二者形成均勻的交聯網絡。在該體系中,一價金屬鹽的加入,減弱了殼聚糖和海藻酸鹽的相互作用,使得通過攪拌海藻酸鹽和殼聚糖被混合均勻,同時海藻酸鹽和殼聚糖之間仍存在離子的相互作用,形成第三重的交聯網絡。因為三重網絡的形成,使得多孔凝膠能夠具有優良的多孔結構、溶脹性能和降解性能的同時,也能具有良好的機械性能。
下面通過試驗,來具體驗證本發明凝膠具有良好的多孔結構、溶脹性能、降解性能以及機械性能。
試驗提供六個實施例和三個對比例。六個實施例都是按照本發明的制備方法制備凝膠(CA porous)。各實施例中各物質的用量,單位:mg,如表1所示;各物質采用的具體種類如表2所示。三個對比例分別為對比例1:殼聚糖凝膠(chitosan);對比例2:海藻酸鈉凝膠(alginate);對比例3:殼聚糖海藻酸鈉復合凝膠(CA)。
表1
表2
對上述6個實施例的多孔凝膠進行顯微鏡拍攝,如圖2所示。在圖2中,圖A對應實施例1的顯微鏡圖,圖B對應實施例2的顯微鏡圖,圖C對應實施例3的顯微鏡圖,圖D對應實施例4的顯微鏡圖,圖E對應實施例5的顯微鏡圖,圖F對應實施例6的顯微鏡圖。從圖2可以看出:隨發泡劑和表面活性劑量的增加,殼聚糖-海藻酸鈉多孔水凝膠中的氣泡和孔不斷的增加。實施例6中,水凝膠體系中的孔最多,孔大小也最均勻。
對上述實施例和對比例,分別進行機械性能、溶脹性能和降解性能測試。
其中,機械性能測試用旋轉流變儀,30mm的夾具,在25℃,1Hz的頻率下,在0.1rad s-1-110rad s-1下分別測試了所制備的chitosan-genipin的水凝膠、海藻酸鈉-Ca2+的水凝膠、chitosan-海藻酸鈉復合水凝膠和不同發泡劑用量的多孔凝膠的機械性能。用儲存模量(G’)和損耗模量(G”)來表示。結果如圖3所示。從圖3中的儲存模量(G’)曲線中可以明顯的看出,實施例1的機械性能最優。
溶脹性能測試按照如下方法進行:將溶脹平衡的所制備水凝膠用刀片切成樣品塊,每種水凝膠切出12份,冷凍干燥,稱重后,分別放入pH1.2的HCl溶液、pH5.6的乙酸-乙酸鈉的緩沖溶液、pH7.4的磷酸鹽緩沖溶液和pH9.3的硼酸鹽緩沖溶液中,每種溶液中放3個平行樣。溶脹24h后,用濾紙吸去表面的水分,稱重獲得水凝膠溶脹后的濕重,每隔2h再稱重,直至質量不再增加為止,獲得水凝膠的干重。通過式(1)計算水凝膠在不同pH條件下的溶脹性能。
其中:Swellingratio表示水凝膠的溶脹性能;wd表示水凝膠的干重;ws表示水凝膠溶脹后的濕重;
通過式(1)計算每種溶液中的3個平行樣的平均溶脹性能作為該水凝膠在該溶液中的溶脹性能。
圖4示出了殼聚糖凝膠(chitosan)、海藻酸鈉凝膠(algiante)、殼聚糖海藻酸鈉復合凝膠(CA)以及本發明實施例1所制備出的多孔凝膠(CA porous)在不同pH值下的溶脹性能。從圖4可以看出,本發明實施例提供的多孔凝膠的在不同pH環境下,具有良好的溶脹性能。
降解性能測試按照如下方法進行:將溶脹平衡的水凝膠切出的樣品塊,每種水凝膠取3份,分別放入到每個孔盛有5mL的1.5ug/mL的溶菌酶溶液的12孔細胞培養板中,每天更換新的溶菌酶溶液,確保酶的活性。定時取出水凝膠樣品,用濾紙吸取表面的水分后,稱量重量,體外降解率用凝膠失重率(Weightloss%)來表示,如式(2)所示。
其中:w0表示水凝膠的原始質量,wt表示降解時間為t后,水凝膠的質量。
圖5提供了殼聚糖凝膠(chitosan)、海藻酸鈉凝膠(algiante)、殼聚糖海藻酸鈉復合凝膠(CA)以及本發明實施例1所制備出的多孔凝膠(CA porous)在pH7.4的PBS緩沖溶液中的降解性能示意圖。從圖5可以看出,本發明實施例制備的多孔凝膠既能在前期保持一定的穩定性,又在后期表現出較高的降解性能。
本領域的技術人員應該了解,本發明不受上述具體實施例的限制,上述具體實施例和說明書中的描述只是為了進一步說明本發明的原理及其效果,在不脫離本發明精神和范圍的前提下,本發明還會有各種變化和改進,這些變化和改進都落入要求保護的本發明范圍內。本發明要求保護的范圍由權利要求書及其等效物界定。
- 還沒有人留言評論。精彩留言會獲得點贊!