一種同步提高自養微藻的葉黃素和碳水化合物產量的方法與流程
本發明涉及一種自養培養微藻的發酵工藝,具體涉及一種同步提高自養微藻的葉黃素和碳水化合物產量的方法。
背景技術:
微藻具有光合作用效率高、生長速率快等特點,在某些特定培養條件下,微藻還可改變其細胞組成成分,從而高效積累某一細胞產物,如蛋白質、碳水化合物、油脂或色素等。其中,微藻碳水化合物和油脂可分別用作生物酒精發酵的原料和生物柴油的生產。然而,目前在微藻生物燃料應用方面,單一細胞成分(碳水化合物或油脂)的開發利用在經濟上還是不可行的。
葉黃素是一種含氧的類胡蘿卜素,由于具有較強的抗氧化和抗炎作用,被廣泛應用于食品、飼料添加劑、醫藥和保健品等行業,而微藻則被認為是商業葉黃素的新興來源(Fernandez-Sevilla JM, Fernandez FGA, Grima EM. Biotechnological production of lutein and its applications [J]. Appl. Microbiol. Biot., 2010, 86(1): 27-40)。已有研究表明,在使用微藻粗油進行生物柴油制備過程中,可同步進行微藻葉黃素的耦合生產(Prommuak C, Pavasant P, Quitain A T, et al. Simultaneous production of biodiesel and free lutein from Chlorella vulgaris [J]. Chem. Eng. Technol., 2013, 36(5): 733-739)。此外,也有研究者致力于將提完粗油后的藻渣(富含碳水化合物)用作生物乙醇發酵的原料(Lee OK, Oh YK, Lee EY. Bioethanol production from carbogydrate-enriched residual biomass obtained after lipid extraction of Chlorella sp. KR-1 [J]. Bioresour. Technol., 2015, 196: 22-27)。為減少微藻生物燃料的開發利用成本,對微藻細胞進行多組分綜合利用,以及耦合生產高附加值產品,已是微藻生物精煉的發展趨勢(Markou G, Nerantzis E. Microalgae for high-value compounds and biofuels production: A review with focus on cultivation under stress conditions [J]. Biotechnol. Adv., 2013, 31(8): 1532-1542)。截至目前,已有較多文獻集中于微藻細胞單一成分(如葉黃素、蛋白質、油脂或碳水化合物等)的生產研究,而對微藻培養可同時積累多種附加產物的研究還鮮有報道。Araya等(Araya B, Gouveia L, Nobre B, et al. Evaluation of the Simultaneous Production of Lutein and Lipids Using a Vertical Alveolar Panel Bioreactor for Three Chlorella species [J]. Algal Res., 2014, 6: 218-222)考察了小球藻同時生產葉黃素和油脂的情況,發現其中Chlorella vulgaris 1803的葉黃素產率和油脂產率可分別達0.51 mg/L/d和11.12 mg/L/d,而Chlorella zofingiensis B 32的葉黃素產率和油脂產率分別為0.53 mg/L/d和10.95 mg/L/d。Dineshkumar等(Dineshkumar R, Dash SK, Sen R. Process integration for microalgal lutein and biodiesel production with concomitant flue gas CO2 sequestration: a biorefinery model for healthcare, energy and environment [J]. RSC Adv., 2015, 5(90): 73381-73394)通過人工神經網絡建模優化小球藻Chlorella minutissima同時生產葉黃素和油脂的培養條件,最終其最高葉黃素產率和油脂產率可分別達4.32 mg/L/d和142.2 mg/L/d。然而,由于微藻葉黃素積累需在氮源非限制條件下,而碳水化合物或油脂積累則需在氮源限制條件下,因此微藻葉黃素積累與碳水化合物或油脂積累往往存在相悖的技術問題。目前為止,尚沒有一種成熟的培養方法可以同步提高微藻的葉黃素產量和碳水化合物產量。
技術實現要素:
為了彌補上述現有技術的不足,本發明提出一種自養培養微藻的發酵工藝,通過自養微藻可同步提高其葉黃素和碳水化合物產量。采用該發酵工藝,有利于提高微藻葉黃素含量和碳水化合物含量,能夠在較短發酵周期內同步實現微藻葉黃素和碳水化合物的高產量積累,從而降低生產成本,可為微藻生物燃料和葉黃素的耦合生產提供一種新方法。
本發明的技術方案包括以下步驟:
1)種子培養:從固體平板上刮取藻種接種于裝有種子培養基的光生物反應器中,控制反應器中藻細胞初始濃度為5~75 mg/L,培養過程中,溫度控制在25~35℃,光照強度控制在150~900 μmol/m2/s,在所通氣體中二氧化碳濃度保持在0.03~10%,通氣量控制在0.01~0.5 VVM,培養3~7天。
2)發酵培養:將步驟1)的種子,以1~10% (v/v)的接種量接入裝有發酵培養基的光生物反應器中,發酵過程中,溫度控制在25~35℃,在所通氣體中二氧化碳濃度保持在0.03~10%,通氣量控制在0.01~0.5 VVM;初始光照強度控制在60~300 μmol/m2/s,之后光照強度每12小時提高50~150 μmol/m2/s,直至發酵結束。同時待發酵培養基中初始氮源濃度降至0~10 mg/L時,開始恒速流加氮濃度為2-14 g/L的氮源,流加速度為1~10 mg/L/h;發酵周期4~6天,生物量濃度4~9 g/L,葉黃素產量20~60 mg/L,碳水化合物產量1.4~3.3 g/L。
在步驟1)中,種子培養基組成為硝酸鈉0.5~1.5 g/L,磷酸氫二鉀0.0183~0.183 g/L,七水硫酸鎂0.035~0.350 g/L,二水氯化鈣0.015~0.150 g/L,磷酸二氫鉀0.048~0.480 g/L,氯化鈉0.015~0.150 g/L,六水氯化鐵0.770~7.770 mg/L,乙二胺四乙酸二鈉0.440~10.250 mg/L,七水硫酸鋅0.025~0.250 mg/L,七水硫酸鈷0.016~0.160 mg/L,五水硫酸錳0.184~1.840 mg/L。
在步驟2)中,發酵培養基組成為初始氮濃度30~200 mg/L,氯化鈉0.015~0.150 g/L,二水氯化鈣0.015~0.150 g/L,七水硫酸鎂0.025~0.250 g/L,碳酸氫鈉0.025~2.5 g/L,磷酸氫二鉀0.035~0.350 g/L,磷酸二氫鉀0.075~0.750 g/L,六水氯化鐵0.002~0.050 g/L,硼酸0.011~0.110 mg/L,七水硫酸錳0.069 ~0.690 mg/L,七水硫酸鋅0.187~1.870 mg/L,二水鉬酸銨0.00124~0.0124 mg/L,無水硫酸銅0.0025~0.025 mg/L。
在步驟2)中,發酵培養基的初始氮源種類為硝酸鈉、硝酸鉀、氯化銨、硫酸銨、碳酸氫銨、硝酸銨、尿素中的一種。
在步驟2)中,流加氮源的種類為硝酸鈉、硝酸鉀、氯化銨、硫酸銨、碳酸氫銨、硝酸銨、尿素中的一種。
上述一種同步提高自養微藻的葉黃素和碳水化合物產量的方法中,所述光生物反應器為封閉式的平板式光生物反應器、柱式光生物反應器或管道式光生物反應器。
上述一種同步提高自養微藻的葉黃素和碳水化合物產量的方法中,所述藻種為小球藻屬微藻。
本發明的顯著優點在于:本發明充分利用了微藻葉黃素和碳水化合物生物合成的特點,通過逐步提高光照強度、以及恒速流加維持發酵液中氮源濃度的發酵方式,可同步實現微藻葉黃素和碳水化合物的高產量積累,且發酵周期短,生產成本低,生產工藝簡單。同時該方法還適用于對各種小球藻進行葉黃素或碳水化合物生產方法的改進,能夠顯著提高利用小球藻同時生產葉黃素和生物燃料的工業化前景,可為后續開發低成本的微藻生物精煉技術提供一條新途徑。
附圖說明
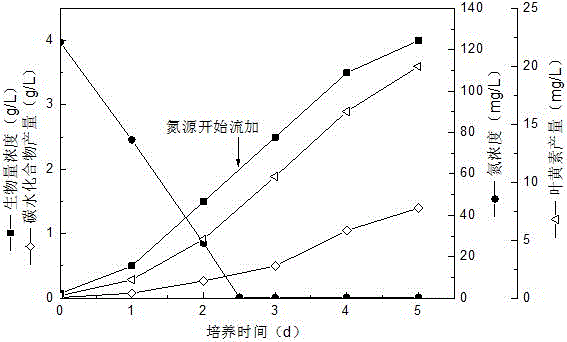
圖1為實施例1中20 L柱狀光生物反應器中小球藻生物量濃度、氮源濃度、葉黃素產量和碳水化合物產量的變化趨勢圖。
圖2為實施例1中小球藻類胡蘿卜素組成的HPLC圖譜。
圖3為實施例1中小球藻碳水化合物組成的HPLC圖譜。
具體實施方式
下面結合附圖對本發明的實施例作詳細說明:本實施例在以本發明技術方案為前提下進行實驗,給出了詳細的實施方式和具體的操作過程,但本發明的保護范圍不限于下述的實施例。
本發明具體實施方式中采用的微藻均為小球藻(Chlorella sorokiniana),購自中科院水生生物研究所淡水藻種庫,編號為FACHB-275。
實施例1
1)種子培養:從固體平板上刮取藻種,接種于裝有900 mL種子培養基的1 L柱狀光生物反應器中,控制反應器中藻細胞初始濃度為15 mg/L,培養過程中,溫度控制在26℃,光照強度控制在600 μmol/m2/s,在所通氣體中二氧化碳濃度保持在2.5%,通氣量控制在0.2 VVM,培養4天。種子培養基組成為硝酸鈉0.75 g/L,磷酸氫二鉀0.0383 g/L,七水硫酸鎂0.075 g/L,二水氯化鈣0.025 g/L,磷酸二氫鉀0.088 g/L,氯化鈉0.025 g/L,六水氯化鐵1.770 mg/L,乙二胺四乙酸二鈉5.500 mg/L,七水硫酸鋅0.073 mg/L,七水硫酸鈷0.016 mg/L,五水硫酸錳0.584 mg/L。
2)發酵培養:將步驟1)的種子,以5% (v/v)的接種量接入裝有16 L發酵培養基的20 L柱狀光生物反應器中,發酵過程中,溫度控制在26℃,在所通氣體中二氧化碳濃度保持在2.5%,通氣量控制在0.2 VVM;初始光照強度控制在150 μmol/m2/s,之后光照強度每12小時提高100 μmol/m2/s,直至發酵結束。同時待發酵培養基中初始氮源濃度降至0 mg/L時,開始恒速流加氮濃度為12 g/L的硝酸鈉,流加速度為2.0 mg/L/h;發酵培養基組成為硝酸鈉0.75 g/L,氯化鈉0.025 g/L,二水氯化鈣0.025 g/L,七水硫酸鎂0.075 g/L,碳酸氫鈉0.025 g/L,磷酸氫二鉀0.075 g/L,磷酸二氫鉀0.175 g/L,六水氯化鐵0.005 g/L,硼酸0.061 mg/L,七水硫酸錳0.169 mg/L,七水硫酸鋅0.287 mg/L,二水鉬酸銨0.00124 mg/L,無水硫酸銅0.0025 mg/L。
在整個發酵培養過程中,每隔一定時間取樣測定生物量濃度、葉黃素含量和碳水化合物含量。生物量濃度采用細胞干重法測定,葉黃素含量和類胡蘿卜素組成通過HPLC測定,碳水化合物含量及其組成通過HPLC測定。由圖1的發酵過程曲線可知,通過發酵培養5 天,微藻生物量濃度可達4.0 g/L,葉黃素產量為20 mg/L,碳水化合物產量為1.4 g/L。
藻體胡蘿卜素組成的HPLC圖譜見圖2,通過與相應標準品的HPLC保留時間進行比較,可確定類胡蘿卜素組成主要為紫黃素、新黃素、葉黃素、α-胡蘿卜素和β-胡蘿卜素,其中葉黃素含量可占總類胡蘿卜素含量約60%。
藻體碳水化合物組成的HPLC圖譜見圖3,通過與相應標準品的HPLC保留時間進行比較,可確定碳水化合物組成主要為葡萄糖,可占總碳水化合物含量約80%。
實施例2
1)種子培養:從固體平板上刮取藻種,接種于裝有900 mL種子培養基的1 L柱狀光生物反應器中,控制反應器中藻細胞初始濃度為75 mg/L,培養過程中,溫度控制在30℃,光照強度控制在900 μmol/m2/s,在所通氣體中二氧化碳濃度保持在1.0%,通氣量控制在0.5 VVM,培養3天。種子培養基組成為硝酸鈉0.5 g/L,磷酸氫二鉀0.0183 g/L,七水硫酸鎂0.035 g/L,二水氯化鈣0.015 g/L,磷酸二氫鉀0.048 g/L,氯化鈉0.015 g/L,六水氯化鐵0.770 mg/L,乙二胺四乙酸二鈉0.44 mg/L,七水硫酸鋅0.025 mg/L,七水硫酸鈷0.016 mg/L,五水硫酸錳0.184 mg/L。
2)發酵培養:將步驟1)的種子,以1% (v/v)的接種量接入裝有16 L發酵培養基的20 L柱狀光生物反應器中,發酵過程中,溫度控制在30℃,在所通氣體中二氧化碳濃度保持在1.0%,通氣量控制在0.5 VVM;初始光照強度控制在50 μmol/m2/s,之后光照強度每12小時提高50 μmol/m2/s,直至發酵結束。同時待發酵培養基中初始氮源濃度降至0 mg/L時,開始恒速流加氮濃度為2 g/L的氯化銨,流加速度為10 mg/L/h;發酵培養基組成為氯化銨0.47 g/L,氯化鈉0.015 g/L,二水氯化鈣0.015 g/L,七水硫酸鎂0.025 g/L,碳酸氫鈉1.26 g/L,磷酸氫二鉀0.035 g/L,磷酸二氫鉀0.075 g/L,六水氯化鐵0.002 g/L,硼酸0.011 mg/L,七水硫酸錳0.069 mg/L,七水硫酸鋅0.187 mg/L,二水鉬酸銨0.00124 mg/L,無水硫酸銅0.0025 mg/L。
檢測方法同實施例1。發酵培養6 天,微藻生物量濃度可達4.0 g/L,葉黃素產量為25.2 mg/L,碳水化合物產量為1.60 g/L。
實施例3
1)種子培養:從固體平板上刮取藻種,接種于裝有900 mL種子培養基的1 L柱狀光生物反應器中,控制反應器中藻細胞初始濃度為15 mg/L,培養過程中,溫度控制在28℃,光照強度控制在600 μmol/m2/s,在所通氣體中二氧化碳濃度保持在3.0%,通氣量控制在0.2 VVM,培養4天。種子培養基組成為硝酸鈉0.75 g/L,磷酸氫二鉀0.0383 g/L,七水硫酸鎂0.075 g/L,二水氯化鈣0.025 g/L,磷酸二氫鉀0.088 g/L,氯化鈉0.025 g/L,六水氯化鐵1.770 mg/L,乙二胺四乙酸二鈉5.500 mg/L,七水硫酸鋅0.073 mg/L,七水硫酸鈷0.016 mg/L,五水硫酸錳0.584 mg/L。
2)發酵培養:將步驟1)的種子,以7% (v/v)的接種量接入裝有16 L發酵培養基的20 L平板式光生物反應器中,發酵過程中,溫度控制在28℃,在所通氣體中二氧化碳濃度保持在3.0%,通氣量控制在0.2 VVM;初始光照強度控制在150 μmol/m2/s,之后光照強度每12小時提高100 μmol/m2/s,直至發酵結束。同時待發酵培養基中初始氮源濃度降至5 mg/L時,開始恒速流加氮濃度為12 g/L的氯化銨,流加速度為4 mg/L/h;發酵培養基組成為氯化銨0.47 g/L,氯化鈉0.025 g/L,二水氯化鈣0.035 g/L,七水硫酸鎂0.125 g/L,碳酸氫鈉1.68 g/L,磷酸氫二鉀0.125 g/L,磷酸二氫鉀0.300 g/L,六水氯化鐵0.005 g/L,硼酸0.061 mg/L,七水硫酸錳0.169 mg/L,七水硫酸鋅0.287 mg/L,二水鉬酸銨0.00124 mg/L,無水硫酸銅0.0025 mg/L。
檢測方法同實施例1。發酵培養5 天,微藻生物量濃度可達7 g/L,葉黃素產量為42 mg/L,碳水化合物產量為2.5 g/L。
實施例4
1)種子培養:從固體平板上刮取藻種,接種于裝有900 mL種子培養基的1 L柱狀光生物反應器中,控制反應器中藻細胞初始濃度為5 mg/L,培養過程中,溫度控制在32℃,光照強度控制在150 μmol/m2/s,在所通氣體中二氧化碳濃度保持在10%,通氣量控制在0.04 VVM,培養7天。種子培養基組成為硝酸鈉1.5 g/L,磷酸氫二鉀0.183 g/L,七水硫酸鎂0.30 g/L,二水氯化鈣0.15 g/L,磷酸二氫鉀0.30 g/L,氯化鈉0.15 g/L,六水氯化鐵5.770 mg/L,乙二胺四乙酸二鈉9.500 mg/L,七水硫酸鋅0.250 mg/L,七水硫酸鈷0.160 mg/L,五水硫酸錳1.80 mg/L。
2)發酵培養:將步驟1)的種子,以10% (v/v)的接種量接入裝有16 L發酵培養基的20 L平板式光生物反應器中,發酵過程中,溫度控制在32℃,在所通氣體中二氧化碳濃度保持在10%,通氣量控制在0.04 VVM;初始光照強度控制在300 μmol/m2/s,之后光照強度每12小時提高150 μmol/m2/s,直至發酵結束。同時待發酵培養基中初始氮源濃度降至10 mg/L時,開始恒速流加氮濃度為14 g/L的氯化銨,流加速度為4 mg/L/h;發酵培養基組成為氯化銨0.47 g/L,氯化鈉0.15 g/L,二水氯化鈣0.15 g/L,七水硫酸鎂0.125 g/L,碳酸氫鈉1.68 g/L,磷酸氫二鉀0.125 g/L,磷酸二氫鉀0.300 g/L,六水氯化鐵0.05 g/L,硼酸0.110 mg/L,七水硫酸錳0.669 mg/L,七水硫酸鋅1.500 mg/L,二水鉬酸銨0.0124 mg/L,無水硫酸銅0.025 mg/L。
檢測方法同實施例1。發酵培養4 天,微藻生物量濃度可達5 g/L,葉黃素產量為30 mg/L,碳水化合物產量為1.5 g/L。
以上所述僅為本發明的較佳實施例,凡依本發明申請專利范圍所做的均等變化與修飾,皆應屬本發明的涵蓋范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!