由干細胞制備心外膜細胞的方法與流程
本申請涉及由多能干細胞制備心外膜細胞的方法,并且還涉及由多能干細胞制備血管平滑肌細胞和心臟成纖維細胞的方法,以及通過上述方法制備的心外膜細胞、血管平滑肌細胞和心臟成纖維細胞及其用途如心外膜細胞用于心臟損傷修復與篩選治療心臟損傷的新療法,以及再分化為血管平滑肌細胞用于疾病和藥物篩選模型,血管組織工程。
背景技術:
心外膜系細胞在胚胎心臟發育過程中是必需的。心外膜細胞的前體細胞:前心外膜細胞,源自臟壁中胚層,在心管的流入道處緊挨心房和靜脈竇后部的位置發育。前心外膜細胞的精準來源位置并不十分清楚,然而遺傳譜系追蹤實驗顯示前心外膜細胞與心肌細胞共同來自一個心臟形成前體細胞庫。在心臟發育的環化階段,前心外膜細胞向心管方向遷移,并逐漸覆蓋整個心臟的表面形成心外膜。此后,一部分的心外膜細胞經過上皮向間充質轉化過程侵入到心肌層。這些心外膜來源的細胞進一步分化為血管平滑肌和心臟成纖維細胞。其中血管平滑肌參與構建心臟冠狀血管,心臟成纖維細胞主要構建心臟結構。除此之外,心外膜細胞還能通過分泌視黃酸、FGF9、IGF2、FSTL1等因子來促進心肌的增殖、成熟或再生。
在成年哺乳動物心臟中,絕大部分的心外膜細胞不再表達胚胎期的分子標記基因TBX18和WT1。心梗或胸腺素β4注射能夠激活這兩個基因在成體心外膜和心外膜下層細胞中的再表達,使其活化并分化為平滑肌和成纖維細胞以促使心梗區新血管的生成。此外,有研究顯示將人心外膜來源細胞移植到小鼠心梗模型中能夠提高發生心梗的小鼠心臟機能和血管再生。除此之外,在小鼠和豬的心梗模型中證明心外膜所分泌的FSTL1能促進成體心肌細胞再生。這些實驗表明心外膜細胞,尤其是表達TBX18和WT1的心外膜細胞是治療心梗的潛在移植細胞來源。
最近世界上有兩個利用細胞因子如:FGF2、BMP4、activin A、VEGF和WNT3A以及含動物源成分的培養基來分化WT1+心外膜細胞的方法報道。這兩種方法成本高昂,操作復雜,其分化培養基中所含動物源成分不利于所分化心外膜細胞的臨床使用和研究。這些缺點阻礙了心外膜細胞的大規模研究及使用。本發明解決了這幾個缺點。
技術實現要素:
在一個實施方案中,本發明提出了利用一種由小分子化合物高效誘導的心肌前體細胞來誘導前心外膜細胞的方法。所述方法包括在干細胞的分化起始階段利用WNT信號激動劑如CHIR99021來誘導中胚層細胞,而后利用WNT信號通路抑制劑如IWR1來促進心肌前體細胞的形成。在該種分化方法下能得到極高比例的心肌前體細胞。
在另一個實施方案中,本發明提供了利用小分子化合物高效誘導心肌前體細胞為前心外膜細胞的方法。所述方法包括利用視黃酸(RA)和WNT信號激動劑CHIR99021來協同誘導TBX18和WT1雙陽性的前心外膜細胞。還提供了由上述方法產生的前心外膜細胞。進一步提供了包含已分化形成中胚層并經刺激視黃酸和WNT信號通路的外源性試劑處理的干細胞的組合物。
在另一個實施方案中,本發明提供了由多能干細胞生成心外膜細胞的方法。所述方法包括:1)將多能干細胞與試劑CHIR99021接觸來誘導中胚層細胞分化;2)經所述試劑CHIR99021誘導的中胚層細胞與另一種試劑IWR1相接觸以形成心肌前體細胞;3)已分化形成的心肌前體細胞經RA和CHIR99021處理,形成TBX18和WT1雙陽性的前心外膜樣的細胞。4)前心外膜細胞經過低密度傳代獲得典型的心外膜形態。還提供了由上述方法產生的前心外膜細胞和心外膜細胞。
在另一個實施方案中,本發明提供了將所分化的心外膜細胞再分化為功能性血管平滑肌和心臟成纖維細胞的方法。所述方法為利用細胞因子TGFβ1和bFGF誘導功能性血管平滑肌,利用bFGF和血清誘導心臟成纖維細胞。
在另一個實施方案中,本發明提供了將所分化的心外膜細胞再分化為功能性血管平滑肌的方法。所述方法包括:1)傳代后一天的心外膜細胞利用TGFβ1處理四天;2)TGFβ1處理過的細胞利用bFGF再處理四天得到平滑肌樣的細胞;3)再次使用TGFβ1處理所述平滑肌樣的細胞六天,使其成熟。還提供了由上述方法產生的功能性平滑肌細胞。
在另一個實施方案中,本發明提供了將所分化的心外膜細胞再分化為心臟成纖維細胞的方法。所述方法包括:1)傳代后一天的心外膜細胞利用bFGF處理八天;2)再次使用bFGF并補加胎牛血清處理上述細胞六天。還提供了由上述方法產生的心臟成纖維細胞。
在另一個實施方案中,本發明提供了了一種不需要細胞因子,利用化學成分已知、不含動物源成分的培養基來分化人心外膜細胞的方法。該方法只使用三種小分子化合物在15天內就能將80%的人多能干細胞分化為TBX18+/WT1+心外膜細胞。并且經過傳代后這些細胞呈現典型的心外膜形態,并發生EMT分化為功能性平滑肌細胞和成纖維細胞。與前兩種方法比較,該方法高效、穩定、成本低廉、分化過程不含免疫原成分,非常適合大規模分化及后期移植研究。
更具體地,本發明提供以下各項:
1.由多能干細胞制備心外膜細胞的方法,所述方法包括:1)通過激活WNT信號通路將所述多能干細胞誘導分化成中胚層細胞;2)通過抑制WNT信號通路使步驟1)中獲得的中胚層細胞轉化成心肌前體細胞;3)通過激活視黃酸信號通路和WNT信號通路使步驟2)中獲得的心肌前體細胞轉化成前心外膜細胞;以及4)由步驟3)中獲得的前心外膜細胞制備心外膜細胞。
2.根據1所述的方法,其中所述多能干細胞是人多能干細胞,優選地,所述人多能干細胞是人胚胎干細胞或人誘導多能干細胞。
3.根據1所述的方法,其中步驟1)中的激活WNT信號通路是通過添加WNT信號通路配體如WNT3a,或添加GSK-3抑制劑如CHIR99021、BIO,或添加與Axin有關的激動劑如HLY78來實現的,優選地,是通過添加CHIR99021來實現的。
4.根據1所述的方法,其中步驟2)中的抑制WNT信號通路是通過添加內源性的WNT抑制因子如DKK1,或添加控制WNT信號和分泌的抑制劑如IWP2,或添加與β-catenin降解、Axin穩定相關的抑制劑如IWR1、XAV939來實現的,優選地,是通過添加IWR1來實現的。
5.根據1所述的方法,其中步驟3)中的激活WNT信號通路是通過添加WNT信號通路配體如WNT3a,或添加GSK-3抑制劑如CHIR99021、BIO,或添加與Axin有關的激動劑如HLY78來實現的,優選地,是通過添加CHIR99021來實現的。
6.根據1所述的方法,其中步驟3)中的激活視黃酸信號通路是通過添加視黃酸受體的配體如全反式視黃酸、9-順式視黃酸,或添加視黃酸前體如視黃醇、維他命A來實現的,優選地,是通過添加全反式視黃酸來實現的。
7.根據1所述的方法,其中步驟3)中獲得的前心外膜細胞是TBX18和WT1雙陽性的前心外膜細胞。
8.根據1所述的方法,其中在步驟4)中,將步驟3)中獲得的前心外膜細胞經過低密度傳代來制備心外膜細胞。
9.通過1-8中任一項所述的方法制備的心外膜細胞。
10.根據9所述的心外膜細胞用于心臟損傷修復的用途。
11.制備血管平滑肌細胞的方法,所述方法包括:1)通過激活WNT信號通路將所述多能干細胞誘導分化成中胚層細胞;2)通過抑制WNT信號通路使步驟1)中獲得的中胚層細胞轉化成心肌前體細胞;3)通過激活視黃酸信號通路和WNT信號通路使步驟2)中獲得的心肌前體細胞轉化成前心外膜細胞;4)由步驟3)中獲得的前心外膜細胞制備心外膜細胞;5)將步驟4)中獲得的心外膜細胞用TGFβ1處理;6)將經過步驟5)的細胞用bFGF處理;以及7)將經過步驟6)的細胞再次用TGFβ1處理。
12.通過11所述的方法制備的血管平滑肌細胞。
13.制備心臟成纖維細胞的方法,所述方法包括:1)通過激活WNT信號通路將所述多能干細胞誘導分化成中胚層細胞;2)通過抑制WNT信號通路使步驟1)中獲得的中胚層細胞轉化成心肌前體細胞;3)通過激活視黃酸信號通路和WNT信號通路使步驟2)中獲得的心肌前體細胞轉化成前心外膜細胞;4)由步驟3)中獲得的前心外膜細胞制備心外膜細胞;5)將步驟4)中獲得的心外膜細胞用bFGF處理;以及6)將經過步驟5)的細胞用bFGF加胎牛血清處理。
14.通過13所述的方法制備的心臟成纖維細胞。
附圖說明
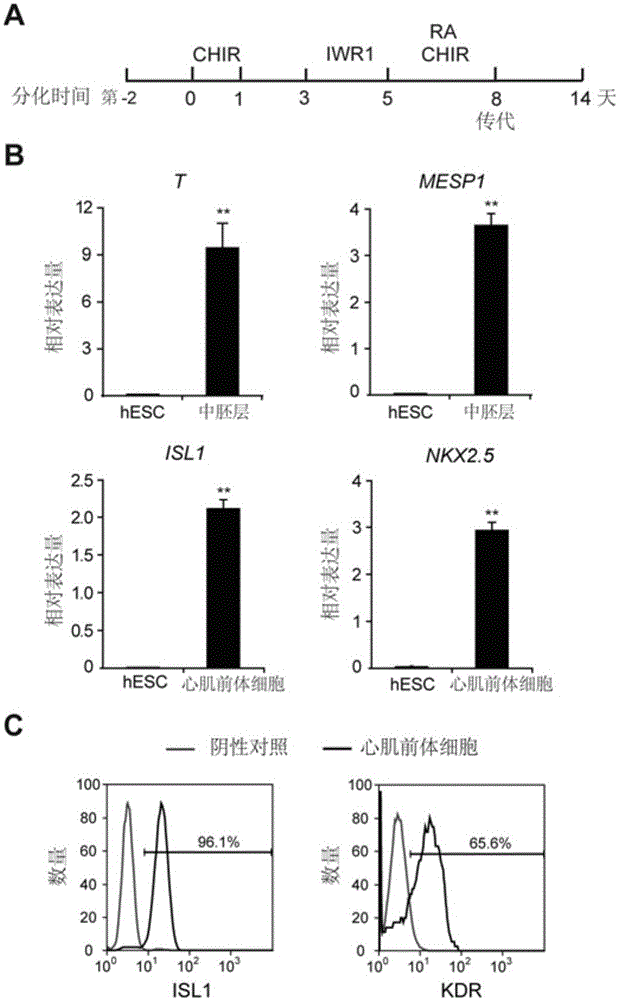
圖1展示了人胚胎干細胞(hESC)向心肌前體細胞分化。(A)本發明所使用心外膜樣細胞分化程序。(B)qRT-PCR分析中胚層分子標記T和MESP1在分化第2天以及心肌前體細胞分子標記ISL1和NKX2.5在分化第5天細胞中的表達水平。基因的相對表達以看家基因TBP作為基因標準。(C)流式檢測分化第5天細胞中ISL1+和KDR+細胞比例。同型對照抗體作為陰性對照。
圖2展示了WNT信號促進心肌前體細胞向WT1+/cTnT-非心肌細胞分化。(A)qRT-PCR分析心外膜基因TBX18和WT1在第14天細胞中的表達水平。基因的相對表達以看家基因TBP作為基因標準。(B)流式分析不同CHIR濃度處理組中WT1+細胞的比例。RA,1μM;IWR1,5μM;CHIR,0–12μM;—,DMSO。(C)qRT-PCR分析cTnT在RA和RA/CHIR處理組中的相對表達水平。以TBP作為看家基因比較。(D)流式檢測分化第14天細胞中cTnT+細胞比例。一抗同型對照作為陰性對照,RA分化的心肌細胞作為陽性對照。(E)在RA和RA/CHIR處理組中免疫熒光共染WT1和cTnT,顯示CHIR的添加改變了細胞命運。比例尺:100μm。統計數據:誤差線,sem;(n=3);*p<0.05,**p<0.01,與單加RA組相比較。
圖3展示了RA促進WT1+細胞中TBX18的表達。(A)qRT-PCR分析心外膜基因TBX18和WT1在第14天細胞中的相對表達水平。在CHIR濃度固定下,TBX18的表達水平隨RA濃度的提高而增大,而WT1的表達水平不受影響。以TBP作為看家基因比較,統計數據:誤差線,sem;(n=3);*p<0.05,**p<0.01,與單加CHIR相比較。(B)流式分析不同濃度RA處理組中WT1+細胞的比例。RA,0-5μM;BMS493,1μM;CHIR,5μM。(C)高內涵細胞成像分析TBX18+/WT1+細胞的比例。誤差線,sem;(n=3);**p<0.01,與單加CHIR相比較。(D)免疫熒光共染TBX18和WT1。RA處理顯著提高了TBX18+/WT1+細胞的比例。比例尺:100μm。
圖4展示了體外分化的心外膜細胞的形態和分子特征。(A)CHIR單獨處理和RA/CHIR處理細胞在不同天數內的明場圖和免疫熒光圖。注意兩組細胞形態的不同以及ZO1表達的不同。比例尺:100μm。(B)EMT的兩個分子標記VIM、ZEB1在不同天數的心外膜樣細胞中相對表達變化。(C)qRT-PCR分析BNC1、UPK1B、ANXA8、GPM6A和FSTL1在不同細胞內的相對表達水平。以TBP作為看家基因比較。誤差線,sem;(n=3);*p<0.05,**p<0.01。
圖5展示了人誘導多能干細胞(hiPSC)向心外膜樣細胞分化。(A)TBX18和WT1共染第14天hiPSC來源的前心外膜樣細胞。絕大部分細胞是TBX18和WT1雙陽性的細胞。(B)高內涵成像檢測hiPSC分化成TBX18和WT1雙陽性細胞的比例。(C)WT1和ZO1共染第15+2天hiPSC-EPL細胞。hiPSC-EPL細胞呈典型的心外膜樣形態。比例尺:100μm。
圖6展示了心外膜樣(EPL)細胞向平滑肌分化的潛能。(A)EPL細胞向平滑肌細胞分化的程序示意圖。(B)qRT-PCR分析ACTA2、CNN1、TAGLN和MYH11在不同處理組中的相對表達水平。以TBP作為看家基因比較。誤差線,sem;(n=3);**p<0.01,與空白處理組相比較。(C)CNN1和TAGLN在TGFβ1+bFGF處理組和空白處理組中的免疫熒光共染。比例尺:100μm。(D)流式檢測TGFβ1+bFGF處理組和空白處理組中CNN1+/TAGLN+平滑肌細胞比例。鼠和兔同型IgG作為陰性對照。
圖7展示了EPL分化的平滑肌細胞經激動劑處理后的功能分析。(A)流式檢測Fluo-4AM預染的各處理組細胞經卡巴膽堿處理后的相對平均熒光強度隨時間變化曲線。以卡巴膽堿未處理前的平均熒光強度為標準比較。誤差線,sem;(n=3);*p<0.05,**p<0.01,與空白處理組相比較。(B)去氧腎上腺素處理后空白處理組與TGFβ1+bFGF+TGFβ1組中有鈣瞬變活動的細胞比例。誤差線,sem;(n=3組);**p<0.01,與空白處理組相比較。(C)鈣成像檢測EPL分化的平滑肌對去氧腎上腺素處理的功能反應。F/F0為與基線值相比較的平均熒光強度。空白處理組與TGFβ1+bFGF+TGFβ1處理組各取5個有鈣活動的細胞檢測。(D)去氧腎上腺素處理后的鈣瞬變振幅。(E)去氧腎上腺素處理后的鈣瞬變持續時間。(F)Fluo-4AM預染的細胞在去氧腎上腺素處理前后細胞面積的變化。(G)去氧腎上腺素處理后空白處理組與TGFβ1+bFGF+TGFβ1組中有鈣瞬變活動的細胞面積變化。每組各取10個細胞檢測。
圖8展示了EPL細胞向心臟成纖維細胞分化的潛能。(A)EPL細胞向心臟成纖維細胞分化的程序示意圖。(B)qRT-PCR分析POSTN和FSP1在不同處理組和人包皮成纖維細胞中的相對表達水平。以空白處理組作為基準比較。誤差線,sem;(n=3);**p<0.01,與空白處理組相比較。(C)流式分析空白處理組和bFGF+血清處理組中POSTN陽性細胞比例。(D)免疫熒光顯示POSTN和COL1表達于bFGF+血清處理過的EPL細胞。比例尺:100μm。
具體實施方式
下面的實施例僅用于進一步闡釋本發明的內容,而不意欲在任何方面限制本發明。本領域技術人員將領會,可對下述具體實施方式進行修飾而仍不偏離所附的權利要求所要求保護的本發明的范圍、精神和主旨。
在下面的所有實施例中,如無特別聲明,均采用本領域技術人員慣常所用的方法、儀器、試劑和實驗方案等。分化基礎培養基為RPMI 1640(Gibco),分化補充劑使用本實驗室開發的S12(正申請專利)或商業化補充劑B27(Gibco)。以下所有實施例中,如無特別聲明,均采用S12為分化補充劑。
本發明所涉及使用的人多能干細胞為商業化使用的、來自己建立的細胞系的人胚胎干細胞系,如H1、H7、H9(Wicell Research Institute,Madison,WI)等;以及體外各種方法(如OCT4、NANOG、KLF4、SOX2等轉錄因子表達或小分子化合物誘導)得到的人誘導多能干細胞系(hIPS)。
實驗所用抗體如下:
流式一抗:ISL1(Santacruz,sc23590);cTnT(R&D,MAB1874);WT1(Abcam,ab89901);CNN1(Sigma,C2687);TAGLN(Abcam,ab14106);POSTN(Abcam,ab14041);Rabbit IgG(Abcam,ab199376)和mouse IgG1(Sigma,M5284)作為同型對照。熒光一抗:KDR-PE(R&D,FAB357P);c-KIT-APC(R&D,FAB332A)。
流式二抗:Alexa488donkey anti-goat IgG(Jackson,705-545-147);Alexa488goat anti-rabbit IgG(Jackson,111-545-003);Alexa488goat anti-mouse IgG(Jackson,115-545-003);PE goat anti-rabbit IgG(Sungene Biotech,GR200G-09C)。
熒光染色一抗:WT1(Abcam,ab89901);cTnT(R&D,MAB1874);TBX18(Santa Cruz,sc17869);ZO1(Invitrogen,339100);CNN1(Sigma,C2687);TAGLN(Abcam,ab14106);POSTN(Abcam,ab14041);COL1(Abcam,ab90395);CD31(Abcam,ab28364)。
熒光染色二抗:Alexa594goat anti-rabbit IgG(Jackson,111-585-003);Alexa488goat anti-mouse IgG(Jackson,115-545-003);Alexa488donkey anti-goat IgG(Jackson,705-545-147);Alexa594donkey anti-rabbit IgG(Jackson,711-585-152);Alexa488-goat anti-rabbit IgG(Jackson,111-545-003)。
目前所報道的心外膜細胞分化方法比較復雜,使用含動物源成分的分化系統使得培養的細胞含有免疫原成份,對后續的細胞移植的臨床研究和治療不利。除此之外,大量細胞因子的使用使得分化成本高昂、分化體系不穩定。這些都大大阻礙了心外膜細胞的應用前景。本文提出了一種將人多能干細胞在體外分化成前心外膜樣細胞的新方法。此方法使用化學成分已知的培養基和小分子化合物,使分化的細胞中有約80%是TBX18+/WT1+雙陽性的細胞。該研究還發現WNT信號的激活使心肌前體細胞的命運從心房肌細胞向WT1+非心肌細胞改變。而RA能夠提高WT1+細胞中TBX18的表達而不影響WT1的表達。使用小分子化合物同時激活心肌前體細胞中的WNT和RA通路就能決定前心外膜細胞的分化命運。
這些前心外膜樣的細胞經過低密度傳代后呈現出典型的心外膜形態特征,表達上皮樣細胞的分子標記ZO1,并能夠自發發生上皮向間充質的轉化。這些心外膜樣的細胞還表達促心肌增殖因子FSTL1和心外膜特異基因BNC1、UPK1B、ANXA8和GPM6A。這些細胞發生EMT后能夠部分(~40%)分化成平滑肌細胞,TGFβ1和bFGF的處理能顯著提高平滑肌的分化比例(~90%)。流式檢測鈣活動和鈣成像實驗證實這些平滑肌具有正常的鈣處理能力和收縮功能,并且TGFβ1和bFGF誘導的平滑肌相較于未處理組的平滑肌其鈣處理能力和收縮能力更強。除此之外,小分子誘導產生的心外膜樣細胞也具有向心臟成纖維細胞分化的潛能。bFGF和血清誘導使心外膜樣細胞高表達心臟成纖維細胞分子標記POSTN,并分泌基質蛋白Collagen 1。
在SHH6期的雞胚中,側板中胚層前部分由前到后分布著生心中胚層(心區)、靜脈竇前體細胞和前心外膜前體細胞。RALDH2(RA合成的限速酶)表達于側板中胚層的后半部分細胞中。RALDH2的前緣與心區的后部相重合,而心區的后部將來發育成心房肌細胞。有實驗已經證明RA決定心肌前體細胞向心房肌細胞的分化。因此,可以推測胚胎中位于心房前體細胞后方的靜脈竇前體細胞和前心外膜的前體細胞的發育也都受到RA信號的影響。在同一時期,WNT-8c和WNT信號競爭性抑制劑Crescent分居胚胎首尾兩端。將來發育成心房肌的心區后部細胞位于Crescent區域內,而前心外膜的前體細胞位于WNT信號區域。由于心肌前體細胞與前心外膜前體細胞可能來自于同一個生心中胚層細胞庫,因此,可以假設心房肌和心外膜的發育都需要RA信號,而WNT信號誘導了心房肌細胞和前心外膜的命運分離。為了證明這一假設,發明人嘗試在心房肌細胞分化的時間窗口上添加WNT通路激動劑CHIR用于心外膜細胞的分化。本文不僅揭示了心外膜分化的調控機制,而且還提供了將多能干細胞定向分化成相對均勻心外膜樣細胞的方法。
人多能干細胞向心肌前體細胞分化。分化步驟:(1)分化前兩天種板細胞,將人多能干細胞接種到用Vitronectin等基質包被的24孔板中,使細胞密度為2.5×105個/ml,加入10μM Y27632(sigma)防止細胞死亡。1ml/孔細胞懸液種板。5%CO2恒溫培養箱(Thermo)中培養。(2)24孔板中的細胞長滿后分化開始,記為第0天。吸棄培養基,加入含6μM CHIR99021(CHIR,Tocris)的分化培養基RPMI 1640(Gibco)+S12(不含insulin),1ml/孔。置于5%CO2恒溫培養箱中培養24h。(3)第1天,吸棄舊培養基,加入新鮮的分化培養基(不含insulin),1ml/孔。放回5%CO2恒溫培養箱中培養48小時。(4)第3天,吸棄舊培養基,加入含5μM IWR1(sigma)的分化培養基(不含insulin),1ml/孔。放回5%CO2恒溫培養箱中培養48小時。(5)第5天,得到心肌前體細胞,可以進行繼續分化。
在本文的心肌分化體系和方法下(圖1.A),在分化第2天利用實時熒光定量PCR(qRT-PCR)檢測了中胚層marker:T和MESP1的表達。相比較于未分化的胚胎干細胞(hESC),CHIR的處理顯著提高了中胚層基因的表達(圖1.B)。此后,結果也顯示第5天時心肌前體細胞的marker:ISL1和NKX2.5高表達(圖1.B)。流式結果顯示90%以上的細胞呈ISL1陽性,60%以上的細胞呈KDR陽性(圖1.C)。KDR是一個心肌與血管的前體細胞marker。這些結果證明在該分化系統下,第5天得到的細胞是心肌前體細胞。
WNT信號改變心肌前體細胞向心房肌細胞分化的命運。分化步驟:(1)分化的第5天,吸棄舊培養基,加入含1uM全反式RA(sigma)和0-12uM CHIR的分化培養基(此后分化培養基都含insulin),1ml/孔。放回5%CO2恒溫培養箱中培養72小時。(2)第8天,分化的細胞傳一次代(0.25%Trypsin-EDTA消化2min,胎牛血清中和),24孔板里的2孔細胞傳到6孔板里的1孔里。加入含10μM Y27632的分化培養基,1mL/孔。放回5%CO2恒溫培養箱中培養48小時。(3)第10-14天,每兩天吸棄舊培養基,加入新鮮的分化培養基,1mL/孔。放回5%CO2恒溫培養箱中培養48小時。
根據我們的假設,為了得到心外膜細胞,本研究在心房肌分化程序的第5天加入不同濃度的CHIR(1-12uM),檢測第14天細胞的基因表達水平。結果顯示,在加入RA的同時加入CHIR能顯著提高心外膜特異性基因TBX18和WT1的表達水平。在CHIR濃度為5uM時(RA/CHIR 5),TBX18和WT1的表達水平達到最高值(圖2.A)。然而,隨著CHIR濃度進一步的提高,TBX18和WT1的表達水平也逐漸下降。說明WNT通路的激活需要維持在一定的范圍內。流式分析的結果也顯示RA/CHIR 5組的WT1+細胞最多,超過90%(圖2.B)。除此之外,qRT-PCR的結果也顯示RA/CHIR5處理(RA/CHIR)導致心肌特異基因cTnT表達水平的急劇降低(圖2.C),暗示RA/CHIR處理的細胞不再是心肌細胞。流式結果確認在RA/CHIR處理的細胞中,只有不到3%的細胞是cTnT+心肌細胞(圖2.D)。cTnT和WT1的免疫共染實驗顯示RA和RA/CHIR處理得到的細胞分別是WT1-/cTnT+心肌細胞和WT1+/cTnT-非心肌細胞(圖2.E)。為了對RA分化的心肌細胞定型,對RA分化的心肌細胞進行膜片鉗檢測動作電位,結果顯示超過90%的細胞呈現心房肌樣的動作電位(結果未顯示)。以上實驗說明WNT信號通路能激活心肌前體細胞中WT1的表達,進而讓原本心房肌分化的細胞命運向WT1+/cTnT-非心肌細胞方向轉變。
RA協同WNT信號誘導心肌前體細胞向前心外膜樣細胞分化。分化步驟:(1)分化的第5天,吸棄舊培養基,加入含5uM CHIR和0-5uM RA的分化培養基(此后分化培養基都含insulin),1ml/孔。放回5%CO2恒溫培養箱中培養72小時。(2)第8天,分化的細胞傳一次代(0.25%Trypsin-EDTA消化2min,胎牛血清中和),24孔板里的2孔細胞傳到6孔板里的1孔里。加入含10μM Y27632的分化培養基,1mL/孔。放回5%CO2恒溫培養箱中培養48小時。(3)第10-14天,每兩天吸棄舊培養基,加入新鮮的分化培養基,1mL/孔。放回5%CO2恒溫培養箱中培養48小時。
為了優化WT1+/cTnT-非心肌細胞分化過程中RA的濃度,在D14檢測了固定CHIR濃度(5uM)下不同濃度RA對TBX18和WT1表達水平的影響。qRT-PCR結果顯示在CHIR存在條件下,激活或抑制RA通路(BMS493,RA信號通路抑制劑)不會明顯改變WT1的表達水平(圖3.A)。流式分析的結果確認了各處理組都能分化出80%以上的WT1+細胞(圖3.B)。然而有趣的是TBX18的表達水平隨RA濃度的提高而增高,顯示出RA濃度依賴的表達模式。在RA濃度為1或5uM時,TBX18的表達值達到最高,約為單加CHIR處理組的5倍(圖3.A)。由于高濃度的RA容易導致細胞死亡,本研究以后的實驗都選擇1uM的RA和5uM的CHIR進行心外膜的分化。為了確認TBX18表達對RA的依賴性,本研究利用免疫熒光共染TBX18和WT1的方法估算了不同處理組中各種細胞的比例(圖3.D)。嘗試幾支商業化的TBX18抗體做流式分析后發現然而沒有合適做流式的抗體。因此,本研究通過高內涵成像分析的方法來估計。最后,通過三次獨立的實驗我們統計出RA/CHIR處理組的細胞中有83.5%的細胞是TBX18+/WT1+雙陽性細胞;CHIR單獨處理的細胞中有43.0%的細胞是TBX18+/WT1+雙陽性細胞;而如果抑制RA信號(BMS493/CHIR組),僅有27.8%的細胞是TBX18+/WT1+雙陽性細胞(圖3.C)。這些實驗說明了WNT信號能夠激活心肌前體細胞中WT1的表達,而RA則提高了TBX18在這些WT1+細胞中的表達比例。由此,本發明把RA/CHIR處理得到的第14天TBX18+/WT1+細胞稱為前心外膜樣(proepicardium-like,pEPL)的細胞。綜上所述,心肌前體細胞向心外膜細胞的分化需要RA信號和WNT信號的協同作用。
心外膜樣細胞的形態和分子特征形成。實驗步驟:(1)為了得到上皮樣的心外膜細胞,在第14天時用0.25%Trypsin-EDTA在37℃將分化的細胞消化2min。(2)加入預熱的分化培養基(含10%FBS)中和,用槍頭吹打細胞使其完全形成單細胞懸液,轉移到50ml離心管中,補加E8培養基到30ml,1000轉/min離心5min。(3)去掉上清加入少量分化培養基重懸細胞,用血球計數板測量細胞密度。補加分化培養基,使細胞密度為20萬/孔或4萬/孔接種到用Vitronectin包被的6孔板或24孔板中。加入終濃度為10μM的Y27632,用移液器吹打均勻。(4)隔日(第15天)換新的分化培養基,此后每兩天換一次分化培養基。
在胚胎和成年心臟中,心外膜是一層覆蓋在心臟表面的上皮樣細胞。這些細胞緊密相連,呈鵝卵石狀鑲嵌在一起,并在相接觸的細胞膜上表達上皮緊密連接標記基因ZO1。然而,胚胎干細胞分化的第14天pEPL細胞在六孔板中呈細胞團存在。為了得到上皮樣的心外膜細胞,將第14天pEPL細胞進行低密度(2.5×104cells/cm2)傳代。傳代后一天(第15天),這些細胞變圓、貼壁面積變大,但是細胞也變得很薄(圖4.A)。這些形態特點很符合上皮細胞的特征。再經過兩天(第15+2天)的增殖,這些細胞連成一片,形成鵝卵石鑲嵌排列。WT1和ZO1的免疫熒光共染實驗顯示這些細胞的細胞膜連接處都表達ZO1。又兩天后(第15+4天),WT1的表達持續降低,而ZO1的表達有所增強。然而,此后ZO1的表達急劇降低。在D15+8已經幾乎看不到WT1和ZO1的表達(圖4.A),細胞也不再緊密連接,VIM和ZEB1的qRT-PCR結果顯示心外膜細胞發生了EMT(圖4.B)。與pEPL細胞不同,CHIR單獨處理得到的細胞以相同的密度傳代后不能形成上皮樣的形態。免疫熒光共染實驗結果也證明這些細胞在第15+2天也只表達極少的ZO1(圖4.A)。為了進一步驗證傳代后的pEPL細胞能夠類比于心外膜細胞,利用qRT-PCR分析了心外膜分泌的心肌再生因子FSTL1和心外膜特異基因(BNC1、UPK1B、ANXA8和GPM6A)在心肌以及不同天數的pEPL細胞中的表達水平(圖4.C)。在胚胎和成體階段,FSTL1表達于心外膜而不是心肌層。BNC1、UPK1B、ANXA8和GPM6A相對高表達于成體小鼠的心外膜。結果顯示,相較于心肌細胞,這些基因在pEPL細胞中提高了表達,尤其是在第15+8天的pEPL細胞中。由于第15+8天的pEPL細胞不再表達WT1,這些細胞像是發生了EMT的EDPCs細胞或者成體心外膜細胞。綜上所述,pEPL細胞傳代后呈現心外膜細胞的形態特征并表達心外膜特異的基因。本發明把第15天后經過傳代的pEPL細胞稱之為心外膜樣(epicardium-like,EPL)細胞。
為了驗證本文的分化方法對于多能干細胞具有普適性,通過使用與胚胎干細胞分化相同的程序在體外嘗試把兩株hiPSC-XVF細胞系也分化為心外膜細胞。統計三次獨立實驗的免疫熒光染色結果,RA/CHIR處理的細胞在第14天時平均有約78%的細胞是TBX18+/WT1+雙陽性細胞(圖5.A、B)。而經過傳代后,這些細胞具有與hESC-EPL細胞相同的形態,共表達WT1和ZO1(圖5.C)。因此,本文的分化方法也可以利用誘導多能干細胞來分化hiPSC-EPL細胞。這對于針對心梗病人的心外膜細胞移植治療具有重要的意義。
心外膜樣細胞向平滑肌細胞分化。分化步驟:(1)第15天的心外膜樣細胞在6孔板或24孔板中用含5ng/mL TGFβ1的分化培養基處理4天,3ml/孔或1ml/孔,每2天換一次液。5%CO2恒溫培養箱中培養。(2)第15+4天的心外膜樣細胞用含10ng/mL bFGF的分化培養基處理4天,3ml/孔或1ml/孔,每2天換一次液。5%CO2恒溫培養箱中培養。(3)第15+8天時用含5ng/mL TGFβ1的分化培養基繼續處理6孔板或24孔板中的心外膜樣細胞6天,每2天換一次液。5%CO2恒溫培養箱中培養。
將分化(圖6.A)八天后(第15+8天)的細胞進行qRT-PCR檢測。結果顯示,平滑肌特異基因(ACTA2、CNN1、TAGLN和MYH11)在TGFβ1+bFGF處理組的表達水平高于空白處理組約2.5倍,也遠高于陰性對照hESCs細胞(圖6.B)。免疫熒光實驗也顯示TGFβ1+bFGF處理組比未處理組表達更多的CNN1和TAGLN蛋白(圖6.C)。流式分析顯示TGFβ1+bFGF處理組中接近90%的細胞是CNN1+/TAGLN+細胞,而空白處理組只有40%的細胞是CNN1+/TAGLN+細胞(圖6.D)。這些數據顯示,TGFβ1+bFGF處理能促使EPL更高效率的向平滑肌方向分化。TGFβ1常用于體外促進平滑肌細胞成熟。為了促使分化的平滑肌細胞更加成熟,將第15+8天TGFβ1+bFGF處理過的細胞再用TGFβ1處理六天。qRT-PCR結果顯示,相比于未額外處理組(第15+8+6天,TGFβ1+bFGF+空白處理),TGFβ1的再處理(第15+8+6天,TGFβ1+bFGF+TGFβ1)提高了這幾個平滑肌特異基因的表達,尤其是MYH11(成熟平滑肌的marker),提高了約一倍(圖6.B)。
隨后,從功能上描述這些EPL來源細胞的特征。在血管中血壓是通過血管平滑肌的舒張和收縮來調節的。血管平滑肌的收縮是由胞內Ca2+水平變化引起的。卡巴膽堿(carbachol)、去氧腎上腺素(phenylephrine)等激動劑能夠促使平滑肌肌漿網內的鈣釋放,引起平滑肌收縮。這一過程可以被鈣敏感的染料Fluo-4AM所追蹤。為了檢測EPL不同處理組細胞的鈣活動,利用流式的方法檢測在EPL來源細胞中預染的Fluo-4熒光值在卡巴膽堿加入前后的變化。HeLa細胞(陰性對照)在卡巴膽堿加入30秒后幾乎沒有明顯的熒光值變化,顯示細胞內未有鈣流活動。空白處理組有一個較低的熒光值變化,而TGFβ1+bFGF處理過的細胞有一個較高的熒光值變化,并且TGFβ1+bFGF+TGFβ1組有著更高的熒光變化值(圖7.A)。這說明TGFβ1+bFGF+TGFβ1處理過的細胞具有更強的鈣活動,為了更直觀、精確地揭示未處理組和TGFβ1+bFGF+TGFβ1處理組的平滑肌在鈣活動上的區別,本研究利用鈣成像檢測去氧腎上腺素處理前后兩組細胞的鈣瞬變(圖7B、C)。結果顯示,空白處理組中約有40%細胞具有鈣瞬變,而TGFβ1+bFGF+TGFβ1處理組中絕大部分細胞(>80%)具有鈣瞬變(圖7.B)。這一結果與流式檢測平滑肌效率的結果相似。相較于空白處理組,TGFβ1+bFGF+TGFβ1處理組中能夠發生鈣瞬變細胞的鈣活動振幅更高,持續時間更長(圖7.D、E)。TGFβ1+bFGF+TGFβ1處理組的細胞在去氧腎上腺素處理后比空白處理組細胞發生更明顯的收縮(圖7.F、G)。綜上所述,TGFβ1+bFGF+TGFβ1處理能夠提高EPL細胞向功能性平滑肌細胞分化的比例,并通過增強細胞的鈣處理能力來增加平滑肌對激動劑的反應能力。
心外膜樣細胞向心臟成纖維細胞分化。分化步驟:(1)第15天的心外膜樣細胞在6孔板或24孔板中用含10ng/mL bFGF的分化培養基處理8天,3ml/孔或1ml/孔,每2天換一次液。5%CO2恒溫培養箱中培養。(2)第15+8天時用含10ng/mL bFGF和10%胎牛血清(bFGF+血清)的分化培養基繼續處理6孔板和24孔板中的心外膜樣細胞6天,每2天換一次液。5%CO2恒溫培養箱中培養。
心臟中的成纖維細胞主要來自于心外膜細胞。為了檢測EPL細胞向成纖維細胞分化的潛能,本研究利用qRT-PCR檢測了EPL細胞經過bFGF處理十四天(圖8.A)后胞內POSTN的表達水平。POSTN是心臟成纖維細胞胚胎時期表達的特異分子標記。分析結果顯示bFGF處理明顯提高了POSTN的表達水平(圖8.B)。如果在bFGF處理的最后六天補加血清(bFGF+血清),結果顯示細胞內POSTN的表達水平急劇上升,比人包皮成纖維細胞(human foreskin fibroblasts,HFFs)還要高17倍。相反的,FSP1,一個廣泛的成纖維細胞分子標記但并不在胚胎心臟成纖維細胞中表達的基因,在bFGF+血清處理細胞中的表達水平要遠遠低于其在HFFs中的表達(圖8.B)。流式結果分析表明,bFGF+血清處理的細胞中有近90%的細胞呈POSTN陽性(圖8.C)。除此之外,免疫熒光實驗顯示,相較于未處理組,bFGF+S處理的細胞不僅表達POSTN,還產生一種由心臟成纖維細胞所分泌的基質蛋白—Collagen1(COL1)(圖8.D)。以上結果顯示,EPL細胞有向心臟成纖維細胞分化的潛能。
討論
RA信號在Iyer的心外膜分化體系中起到決定性的作用。相反地,Witty在分化心外膜過程中沒有加入外源性的RA。但也不能排除內源性的RA起到一定的作用,因為在他們的培養基中可能含有維生素A—RA的前體化合物。在他們的實驗中沒有TBX18蛋白表達水平的數據,因此無法與其比較所分化TBX18+/WT1+細胞比例的高低。本研究的實驗證明去掉RA不改變WT1的表達水平,但能降低TBX18+/WT1+細胞的比例。與此實驗現象相似,RALDH2—/—突變小鼠的前心外膜表觀并無太大異常。這說明RA并不是心外膜命運決定的統治性信號。然而,在Iyer的實驗中RA對心外膜基因的誘導表達起到了決定性的作用。這個結果可能的原因是在其分化程序中長時間地使用了高濃度的RA來處理細胞。他們得到了WT1和TCF21異質性表達的細胞群,只有60%的細胞是WT1+細胞。考慮到心外膜細胞來源的復雜性,他們得到的心外膜細胞跟我們得到的心外膜細胞可能是不同類別的心外膜細胞。本研究的實驗證明,在心外膜分化過程中,RA起到協助WNT信號來決定心外膜細胞的命運、促進細胞的增殖和在傳代后賦予細胞心外膜典型形態的作用。雖然TBX18和WT1同為心外膜的marker,但兩者之間并未有相互調控的作用。因此,它們對RA的濃度產生不同的效應是可能的。在小鼠突變體中,TBX18-/-和RALDH2-/-的心外膜表型相似,損害較小。而WT1-/-的心外膜受到嚴重的損害。這暗示WT1并不受RA信號的調控,而TBX18可能是RA信號調控的下游基因。具體的機制尚不清楚。由于WNT和RA信號激活的時間窗口是在第5-8天,而TBX18和WT1上調的時間是在第10天以后,因此WNT和RA信號通路并不直接調控TBX18和WT1的表達。具體過程中間的調控基因和下游通路是什么并不清楚。難以通過其他實驗(chip-seq,熒光素酶檢測分析等)更好地證明WNT激活WT1,RA提高TBX18的表達比例。
在Witty和Iyer的干細胞培養及心外膜分化過程中使用了含動物源成份的培養基和大量的細胞因子。一方面,這些可能含有病原體和免疫原的細胞使得對心梗的細胞移植治療面臨巨大的風險。另一方面,由于細胞因子價格昂貴,批次穩定性差,保存不易等原因使得在體外成規模的分化心外膜細胞面臨不小的困難。可喜的是,本文的分化系統解決了這兩個難題。本文所使用的E8培養基和實驗室自己開發的S12培養基成分明確,不含動物源成分,價格低廉。小分子化合物比細胞因子穩定性好,實驗可重復性高,價格也低廉。因此,我們的分化系統為體外大量分化心外膜細胞用于心外膜相關研究和心臟組織修復的臨床使用提供了良好的方法。
目前心臟損傷后的細胞移植治療還很少用到心外膜細胞。心梗發生后,患者本身的心外膜細胞會被激活成“胚胎”狀態,迅速增殖并分化,參與形成纖維化的疤痕組織。因此,雖然心外膜細胞也參與心梗后新血管的生成,但其對心臟的損傷修復作用并不太大。然而,FSTL1的發現讓我們對心外膜細胞在心臟損傷修復中的潛能有了新的認識。心梗后的心外膜不再表達FSTL1,而動物心梗模型顯示FSTL1具有促進原位心肌增殖的能力。因此,將體外分化得到的能夠表達FSTL1的心外膜細胞移植到受損的心臟處可能有助于心肌的再生。此外,心外膜細胞還有促進心肌成熟的功能。而心肌成熟是心肌細胞移植治療心臟損傷所面臨的一個難題。因此,體外分化的心外膜細胞與心肌細胞的共同移植可能是細胞移植治療心臟損傷中更具發展潛力的方法。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 從人胎盤羊膜制備羊膜間充質干細胞的方法及其應用與流程
- 一種臍療貼的制備方法及應用與流程
- 一種干細胞制劑及其在制備治療慢性腎炎的藥物中的應用的制作方法與工藝
- 臍帶間充質干細胞在制備治療角膜損傷的干細胞制劑中的應用的制作方法與工藝
- 臍帶間充質干細胞聯合黃芪多糖在制備治療高血糖和糖尿病腎病藥物中的應用的制作方法與工藝
- 由臍帶間充質干細胞制備CD34陽性細胞的方法與流程
- 基因重組干細胞制劑的制備方法及其在皮膚損傷修復、瘢痕抑制中的應用與流程
- 一種大規模制備人臍帶間充質干細胞因子用誘導分泌培養基的制作方法與工藝
- 一種人母乳干細胞的制備方法及其應用與流程
- 間充質干細胞聯合維生素E在制備腎臟組織細胞修復藥物中的應用的制作方法與工藝