一種酶活提高的天冬酰胺酶突變體的制作方法
本發明涉及一種酶活提高的天冬酰胺酶突變體,屬于酶工程技術領域。
背景技術:
L-天冬酰胺酶(EC 3.5.1.1)是一種有抗癌活性的蛋白酶,能專一催化L-天冬酰胺水解成天冬氨酸和NH3。L-天冬酰胺酶的生理作用主要表現為對某些腫瘤的抑制作用,尤其對急性白血病和惡性淋巴腫瘤有效。L-天冬酰胺酶已成為治療白血病非常有效的藥物,對骨髓細胞沒有抑制作用。
L-天冬酰胺酶可以減少食物中丙烯酰胺的生成。丙烯酰胺主要是由食品原料中的還原糖和天冬酰胺在高溫加熱過程中通過美拉德反應生成,在食物中加入天冬酰胺酶可以水解天冬酰胺,從源頭上減少丙烯酰胺的生成。
一些微生物、哺乳動物及植物被證實含有L-天冬酰胺酶。因為動物血清中L-天冬酰胺酶含量低,且提取工藝復雜,微生物具有易培養,成本低等優點,成為學者研究的重點,目前研究的產L-天冬酰胺酶微生物主要包括Escherichia coli、Erwinia carotovora、Erwinia chrysanthemi等,但野生菌株L-天冬酰胺酶產量低,近年來利用基因工程技術將L-天冬酰胺酶基因克隆到大腸桿菌中,獲得L-天冬酰胺酶的高效表達,利用工程菌產L-天冬酰胺酶已成為一個重要來源。
L-天冬酰胺酶有兩種類型,L-天冬酰胺酶I和L-天冬酰胺酶II,Escherichia coli、Erwinia chrysanthemi、B.subtilis等均包含這兩種L-天冬酰胺酶,研究證實僅L-天冬酰胺酶II具有抗癌作用,來自Escherichia coli和Erwinia chrysanthemi的L-天冬酰胺酶II已被開發為治療急性淋巴細胞白血病的有效藥物,目前研究的大部分是具有抗腫瘤效果的L-天冬酰胺酶II。
目前的研究表明,基因工程手段是提高天冬酰胺酶產量的主要方法,不同來源的天冬酰胺酶已在大腸桿菌,枯草芽孢桿菌,酵母等不同宿主中獲得表達,但其產量仍不高。目前報道的最高產量為228U/mL(Wang Y,Qian S,Meng G,Zhang S(2001)Cloning and expression of L-Asparaginase gene inEscherichiacoli.Appl BiochemBiotechnol 95(2):93-101)。另外,常規的提高的重組蛋白表達水平的方法主要是更換強啟動子,高分泌能力高的信號肽等等。
技術實現要素:
本發明的第一個目的是提供一種天冬酰胺酶突變體,是將SEQ ID NO.1所示天冬酰胺酶氨基酸序列第29位谷氨酸定點突變為其它氨基酸;所述其它氨基酸包括:谷氨酰胺,精氨酸,蘇氨酸,賴氨酸,天冬酰胺。
在本發明的一種實施方式中,所述其他氨基酸還包括丙氨酸、半胱氨酸、組氨酸、異亮氨酸、甘氨酸、亮氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、絲氨酸、色氨酸、酪氨酸、纈氨酸。
在本發明的一種實施方式中,所述的天冬酰胺酶突變體序列如SEQ ID NO.2,或SEQ ID NO.3,或SEQ ID NO.4,或SEQ ID NO.5,或SEQ ID NO.6所示。
本發明的第二個目的是提供編碼所述天冬酰胺酶突變體的基因。
本發明的第三個目的是提供含有所述基因的載體或細胞系。
本發明的第四個目的是提供一種表達所述突變體的基因工程菌。
在本發明的一種實施方式中,所述基因工程菌以pP43NMK為載體,以枯草芽孢桿菌為宿主。
在本發明的一種實施方式中,所述枯草芽孢桿菌是枯草芽孢桿菌WB600。
本發明的第五個目的是提供一種提高天冬酰胺酶的方法,是對天冬酰胺酶活性位點附近氨基酸進行定點飽和突變;所述活性位點氨基酸是第29位谷氨酸。
在本發明的一種實施方式中,所述天冬酰胺酶序列如SEQ ID NO.1所示。
本發明的第六個目的是提供所述突變體在制備藥物方面的應用。
本發明還提供所述基因工程菌在制備含天冬酰胺的產品中的應用。
本發明的有益效果:本發明通過定點飽和突變改變蛋白質分子活性位點附近氨基酸殘基,提高天冬酰胺酶催化效率,進一步提高天冬酰胺酶產量。本發明構建的天冬酰胺酶分泌能力增強的重組枯草芽孢桿菌可將天冬酰胺酶酶活較出發菌株提高2.37倍。改造后的基因工程菌產酶能力顯著提高,搖瓶發酵生產天冬酰胺酶酶活達到320U/mL,為目前報道的搖瓶的最高的產量,更適合工業應用,可降低生產成本,提高生產效率。
附圖說明
圖1定點突變E29后ASN產量;
圖2定點突變E29后ASN蛋白表達水平;泳道1~6分別為原始菌株WT,突變體E29Q,突變體E29R,突變體E29T,突變體E29K,突變體E29N;
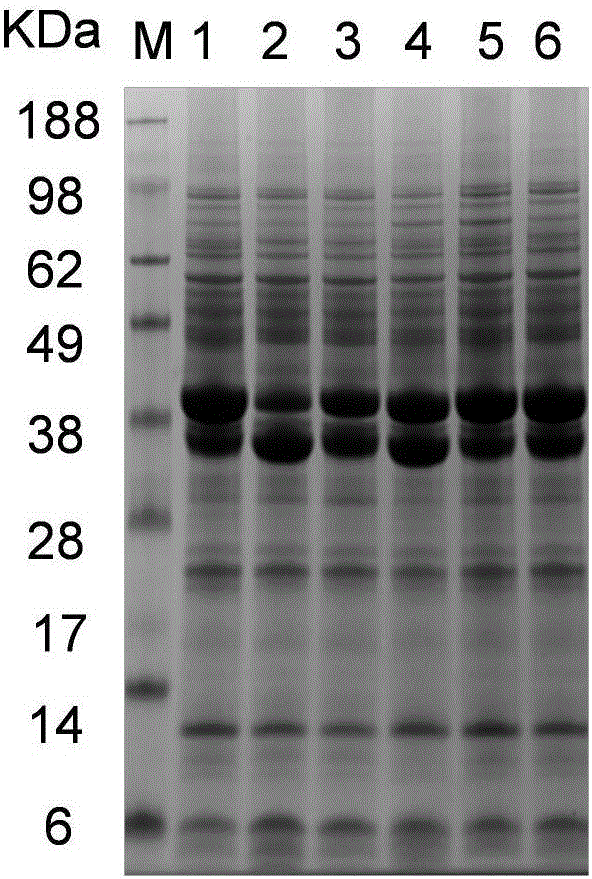
圖3 SDS-PAGE分析突變體的純化水平;泳道1~6分別為原始菌株WT,突變體E29Q,突變體E29R,突變體E29T,突變體E29K,突變體E29N。
具體實施方式
培養基:
LB培養基:胰蛋白胨10g/L、酵母粉5g/L、NaCl 10g/L,pH7.0;
發酵培養基:大豆蛋白胨10g/L,玉米漿5g/L,尿素1g/L,蔗糖35g/L,磷酸氫二鉀2.3g/L,磷酸二氫鉀1.7g/L,硫酸鎂0.75g/L,氯化鈉5g/L;調節pH6.8-7.0。
天冬酰胺酶酶活力的測定:
采用分光光度法測定天冬酰胺酶酶活。1個單位天冬酰胺酶酶活定義為:在37℃反應條件下,每分鐘內能催化L-天冬酰胺釋放1μmol NH3所需要的酶量為一個酶活單位(U/ml)。酶活測定條件:37℃條件下,1ml 10mM K2HPO4-KH2PO4(pH7.5),0.1ml 189mM天冬酰胺,0.1ml發酵上清液,保溫30分鐘,0.5ml 1.5M TCA終止反應。利用ShimadzuUV-1240在436nm處測定吸光值,通過硫酸銨繪制標準曲線,根據標準曲線計算酶活。
表1引物序列
實施例1枯草芽孢桿菌來源天冬酰胺酶晶體結構模擬
以已報道的Erwinia chrysanthemi天冬酰胺酶(PDB code:1hg0)為模板(Structural basis for the activity and substrate specificity ofErwinia chrysanthemi L-Asparaginase,2001年公開)(兩者氨基酸相似度為58.1%),利用在線模擬軟件SWISS-MODEL,模擬枯草芽孢桿菌來源的天冬酰胺酶的晶體結構。
實施例2定點突變E29天冬酰胺酶菌株構建
設計的上下游引物P1、P2(如表1所示),以pP43H-D30質粒為模版進行PCR,構建E29飽和突變菌株。PCR條件為:98℃3min,98℃30S,55℃90S、72℃8min,34個循環。PCR擴增體系:模板1μL,上下游引物各1μL,dNTP Mix4μL,5×primeSTARBuffer10μL,滅菌的雙蒸水32.5μL,prime STARDNA聚合酶0.5μL。采用膠回收試劑盒對PCR產物進行純化和回收,電泳檢驗回收產物的濃度。DpnI消化處理PCR回收產物,將其轉化到感受態E.coil JM109,用氨芐青霉素LB平板,挑取陽性菌落。37℃搖床過夜培養后提取質粒,命名為pP43H-D30/E29X,再轉入枯草芽孢桿菌WB600,以獲得E36飽和突變的突變菌株WB43H-D30/E29X(X表示突變后的氨基酸)。
實施例3高分泌能力天冬酰胺酶生產菌株的驗證
挑選實施例2中轉化子接種到裝有LB液體培養基96孔板中,37℃,培養6h,轉接到發酵培養基中,接種量按體積比為5%,培養48h。收集發酵上清,檢測發酵上清酶活。挑選產量提高的菌株進行搖瓶發酵,對天冬酰胺酶活力進行測定,結果如圖1所示。與出發菌株比較,突變株的酶活顯著提高,其中E29R酶活達到320U/mL。蛋白電泳顯示,突變后菌株目標蛋白表達水平均沒有顯著變化(圖2)。同時表明E29定點飽和突變后并沒有影響ASN在B.subtilis中的分泌。
發酵上清液經Ni2+親和層析柱純化得到電泳純的ASN飽和突變體(圖3),并檢測酶學性質,如表2所示,與野生酶相比,Km降低1.3-1.8倍,Kcat值提高1.41-2.2倍,而催化效率(Kcat/Km)提高為野生酶的1.8-2.8倍。與之相對性的,我們發現產量提高的突變體的比酶活也顯著提高,其中E29Q比酶活較野生酶提高2.15倍,達到258.8U/mg。通過檢測突變體在65℃的半衰期表明,除E29K外,突變體半衰期(t1/2)顯著的提高,其中E29Q達到150min,較野生酶提高2.37倍。分析自由能結果表明,突變體自由能分別提高1.5-2.2kJ·mol-1。上述結果表明,定點飽和突變E29能顯著的提高ASN的底物結合能力、催化效率和熱穩定性。
表2突變體酶學性質
雖然本發明已以較佳實施例公開如上,但其并非用以限定本發明,任何熟悉此技術的人,在不脫離本發明的精神和范圍內,都可做各種的改動與修飾,因此本發明的保護范圍應該以權利要求書所界定的為準。
- 還沒有人留言評論。精彩留言會獲得點贊!