一種控制菌絲體生長形態的方法與流程
本發明涉及生物工程技術領域,尤其涉及一種控制菌絲體生長形態的方法。
背景技術:
絲狀真菌在工業化生產中有著廣泛的應用,產品涵蓋了工業酶制劑(如淀粉酶、纖維素酶、蛋白酶、脂肪酶等)、有機酸、抗生素等。在產業化生產中,深層發酵的絲狀真菌在通常情況下存在3種形態:團塊狀、絮狀和球狀。不同形態的絲狀真菌會直接影響發酵體系中物性參數、基質傳遞等,所以生長形態對發酵產品的生成,發酵過程的控制至關重要。絲狀真菌的生長形態對細胞代謝途徑、產物積累及分離提取均有顯著影響,因此如何控制絲狀真菌的生長形態,最大化提高目標產物產量成工業生產研究的重點。
團塊狀的菌體形態在發酵過程中接種量難于控制,且極大地限制了菌體內部的傳氧、傳質,產物產量明顯偏低,而且在攪拌式發酵罐發酵過程中,會纏繞在攪拌器上或者附壁,最終導致不能得到目標產品,發酵失敗;絮狀菌體營養物質和氧氣在其內部傳輸較為順利,但其能增加發酵液黏度,流變性相對較差,降低物質、氧氣在發酵液中的傳遞效率,同時還極易纏繞攪拌槳,使發酵產物產量、發酵罐性能降低;球狀形態可以克服以上不足,改善發酵液的流變特性,有效提高傳質、傳氧性能,降低能耗,但若菌球過大,菌球內部傳質、傳氧將發生困難,影響產物積累,因此規則的、適宜大小的球狀真菌則有利于酶制劑、有機酸等產品的生產。
然而,生長形態發育作為絲狀真菌生命體的一種本能表現形式,受到影響因素多且過程復雜,比如說菌種自身的影響、生長營養環境的影響、發酵操作條件的影響等等,最終使得絲狀真菌的形態不能控制為理想的形態,或者菌球控制的重復性以及平行性不好。這就使得高效簡便的形態控制技術顯得尤其重要。在絲狀真菌發酵過程中,不同代謝產物所適宜的形態不同,在不同形態下,代謝產物的積累差異明顯,球狀成為許多產品生產的首選形態,在固定化技術迅速發展的今天,控制菌體生長成為菌球的自固化技術得到了巨大的發展。
環境是影響菌球形成的重要因素,不同環境條件下獲得的菌球結構及大小各異。影響菌球形成及特性的因素一般有pH、接種孢子、培養基成分、攪拌轉速等,通過對這些因素的調控可以獲得產物積累的最佳形態。
Liu Y,Liao W,Chen SL.“Study of pellet formation of filamentous fungi Rhizopus oryzae using a multiple logistic regression model.”Biotechnol Bioeng,2008,99(1):117-128.中報道了:綜合考察了孢子濃度、葡萄糖、尿素、磷酸鹽、金屬離子的濃度、發酵體系pH、通風攪拌對絲狀真菌生長形態的影響,pH和接種量是影響絲狀真菌形態的主要原因,通過降低抱子濃度,嚴格調控范圍,有效將絲狀真菌控制為球狀。該技術方案的策略是:通過改變微生物生長環境,抑制微生物的生長,最終達到控制菌球形態的目的。其缺點在于,對pH的調節要求很高,常常要求將酸度調整精確到小數點后兩位,這使得難以在工業生產中放大。另外,一些產品的特性要求一定的酸度范圍,也使該技術方案的應用受到限制。
Driouch H,Sommer B,Wittmann C.“Morphology engineering of Aspergillus niger for improved enzyme production.”Biotechnol Bioeng,2010,105(6):1058-1068.中報道了:利用微粒子在流場中與生產菌株的作用可以作為形態控制的有效策略。在利用黑曲霉產酶的時候,在發酵體系中加入二氧化硅等微粒子,有效將微生物體系的形態控制為絲狀,達到了高產的目的。其技術方案的前提是,該類型的菌種由于自身的生長特性,不因為環境的改變而能很好的形成菌球。在不同的發酵體系中,進行有機酸及某些酶制劑等產品的發酵生產時,球狀是最佳的生產形態,添加微粒子的技術路線并不能有效地將絲狀真菌控制為菌球形態。
綜上所述,現有技術工藝條件苛刻,操作方法繁復,不能解決有效控制絲狀真菌發酵形態的問題。因此,設計高效便捷的技術方案以控制絲狀真菌發酵生長形態,成為必然需求。
技術實現要素:
本發明的目的在于提供一種控制菌絲體生長狀態的方法,所述方法能夠高效便捷地控制絲狀真菌發酵過程中的生長形態,且該方法操作簡單,普適性強,適宜在工業生產中放大。
為達到此發明目的,本發明采用以下技術方案:
第一方面,本發明提供了一種控制菌絲體生長形態的方法,所述方法包括:在絲狀真菌發酵過程的菌絲體生長階段,向發酵液中添加法尼醇,并繼續發酵以獲得球狀的絲狀真菌菌絲體;
其中,所述法尼醇添加的終濃度為150-1000μM。
所述法尼醇添加的終濃度為150μM、160μM、170μM、180μM、190μM、200μM、210μM、220μM、230μM、240μM、250μM、260μM、270μM、280μM、290μM、300μM、310μM、320μM、330μM、340μM、350μM、360μM、370μM、380μM、390μM、400μM、430μM、450μM、480μM、500μM、530μM、550μM、580μM、600μM、630μM、650μM、680μM、700μM、730μM、750μM、780μM、800μM、830μM、850μM、880μM、900μM、930μM、950μM、980μM或1000μM、。
本發明中,法尼醇作為真菌群體感應系統中研究最廣泛的群體感應分子,它能有效改變白色念珠菌的菌體形態,抑制其從酵母形態向菌絲形態的轉變,因此,將適當濃度的法尼醇作為外源添加物補充到發酵培養基中可以有效控制絲狀真菌菌體形態。
本發明中,將特定濃度的法尼醇溶液加入到絲狀真菌發酵培養基中,將絲狀真菌菌絲體形態控制為球狀。
優選地,所述法尼醇添加的終濃度180-800μM,優選為200-600μM。
優選地,以法尼醇溶液的形式向發酵液中添加法尼醇,所述法尼醇溶液的配制溶劑為乙醇、正丙醇、異丙醇和正丁醇中的一種或至少兩種的混合,優選為乙醇或異丙醇。
優選地,所述絲狀真菌為曲霉屬、根霉屬、木霉屬或栓菌屬中的任意一種或至少兩種的組合,優選為曲霉屬、根霉屬或木霉屬中的任意一種或至少兩種的組合。
優選地,所述控制菌絲體生長形態的方法,具體包括如下步驟:
(1)將預培養的種子培養液接種到發酵培養基中,進行發酵培養;
(2)在所述發酵培養過程的菌絲體生長階段,向發酵液中添加法尼醇溶液;
(3)在菌絲體生長結束后收集菌體,觀察菌絲體生長形態。
優選地,所述步驟(1)中發酵培養基包括如下組分:碳源1-50g/L,氮源1-20g/L,KH2PO4 0.5-5g/L,MgSO4·7H2O 0.1-2g/L,FeSO4·7H2O 0.01-0.1g/L,CaCl2·2H2O 0.01-0.1g/L。
優選地,所述碳源為甘油、葡萄糖或蔗糖中的任意一種或至少兩種的混合。
優選地,所述氮源為大豆蛋白胨、尿素或(NH4)2SO4中的任意一種或至少兩種的混合。
優選地,所述種子培養液接種到發酵培養基,所述種子培養液按體積比的接種量為3-15%,例如可以是3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%或15%,優選為4-12%,進一步優選為6-10%。
優選地,所述發酵培養的pH為4.0-6.0,例如可以是4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9或6.0,優選為4.5-5.5。
優選地,所述發酵培養的溫度為20-40℃,例如可以是20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃或40℃,優選為23-36℃,進一步優選為26-32℃。
優選地,所述發酵培養的攪拌速率為50-200rpm,例如可以是50rpm、60rpm、70rpm、80rpm、90rpm、100rpm、110rpm、120rpm、130rpm、140rpm、150rpm、160rpm、170rpm、180rpm、190rpm或200rpm,優選為100-180rpm。
優選地,所述發酵培養的時間為48-168h,例如可以是48h、50h、52h、54h、55h、58h、60h、62h、65h、68h、70h、72h、75h、78h、80h、82h、85h、88h、90h、92h、95h、98h、100h、102h、105h、108h、110h、112h、115h、118h、120h、122h、125h、128h、130h、135h、138h、140h、142h、145h、148h、150h、155h、158h、160h、162h、165h或168h。
優選地,所述步驟(2)向發酵液中添加法尼醇溶液,所述法尼醇為一次性或分多次添加,優選一次性添加。
所述法尼醇溶液采用0.22μm濾膜過濾除菌。
優選地,所述法尼醇溶液的濃度為所述添加的終濃度的200-2000倍,例如可以是如200倍、400倍、600倍、800倍、1000倍、1200倍、1400倍、1600倍、1800倍、2000倍,優選為500-1500倍,進一步優選為800-1200倍。
優選地,所述法尼醇溶液的添加時間為所述步驟(1)中發酵培養過程的第0-48h,例如可以是0h、2h、4h、6h、8h、10h、12h、14h、16h、18h、20h、22h、24h、26h、28h、30h、32h、34h、36h、38h、40h、42h、44h、46h、48h,優選為第4-36h,更優選為第12-24h。
優選地,所述發酵培養過程中菌絲體生長的時間為0-48h,例如可以是0h、2h、4h、6h、8h、10h、12h、14h、16h、18h、20h、22h、24h、26h、28h、30h、32h、34h、36h、38h、40h、42h、44h、46h、48h,優選為12-40h,進一步優選為20-36h。
作為優選技術方案,所述控制菌絲體生長形態的方法,具體包括如下步驟:
(1’)在溫度20-40℃、pH4.0-6.0、攪拌速率50-200rpm的條件下,將預培養的絲狀真菌種子液以體積比3-15%接種到發酵培養基中,進行發酵培養;
(2’)在所述發酵培養過程的第0-48h,一次性向發酵液中添加法尼醇溶液至法尼醇的終濃度為110-400μM;
(3’)在菌絲體生長結束后收集菌體,觀察菌絲體生長形態。
與現有技術相比,本發明具有以下有益效果:
(1)本發明提供的控制菌絲體生長形態的方法,能夠高效便捷地控制絲狀真菌發酵過程中的生長形態,提高絲狀真菌的發酵產率,洛伐他汀含量提高了1.6倍,胞外多糖含量提高了2.1倍;
(2)本發明的方法操作簡單,易于放大生產,適于大規模發酵,從而有效控制絲狀真菌菌體的形態,滿足規模化應用的要求。
附圖說明
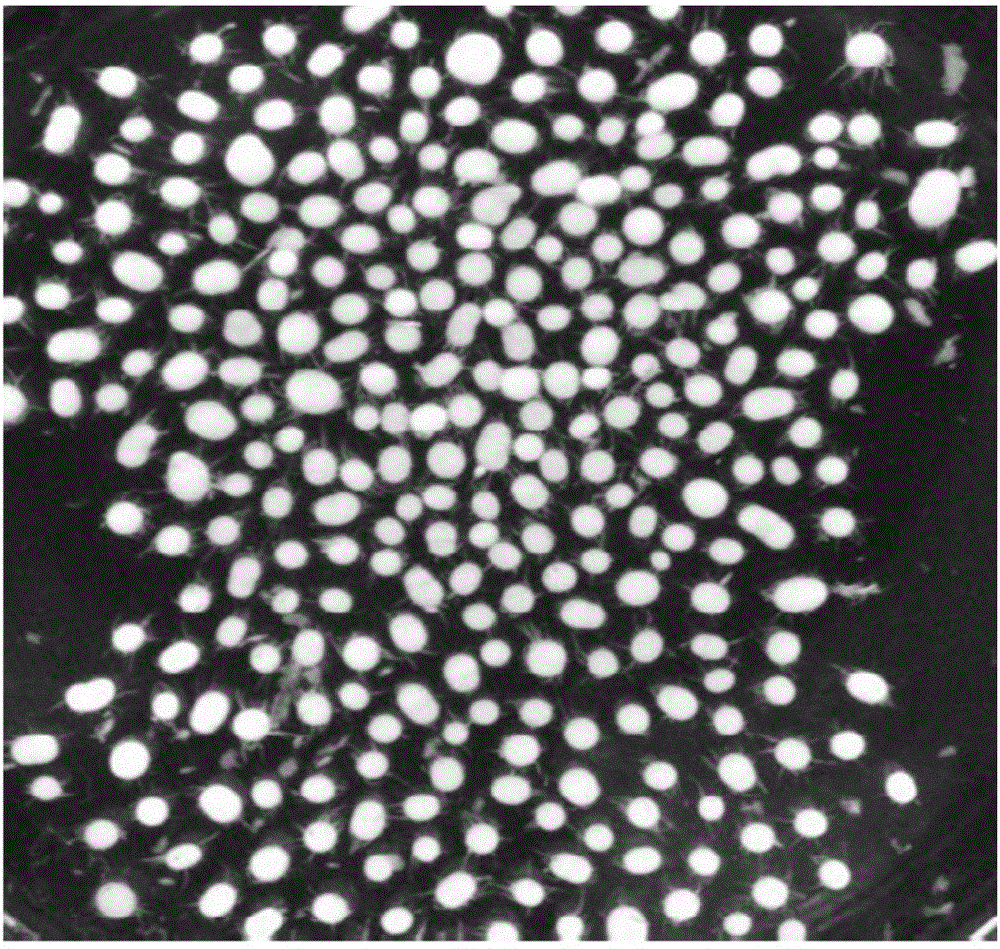
圖1為本發明實施例1培養的黑根霉的形態圖;
圖2為本發明實施例2培養的黑曲霉的形態圖。
具體實施方式
下面通過具體實施方式來進一步說明本發明的技術方案。本領域技術人員應該明了,所述實施例僅僅是幫助理解本發明,不應視為對本發明的具體限制。
下述實施例中所使用的實驗方法如無特殊說明,均為常規方法。
下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。
菌種:本實施例的菌種均是工業生產中常用的具有典型代表的絲狀真菌:
黑根霉(Rhizopus nigricans 41346)孢子懸浮液;
黑曲霉(Aspergillus niger 2106)孢子懸浮液;
紅曲霉(Monascus purpureus 5013)孢子懸浮液;
變色栓菌(Trametes versicolor 14001)。
實施例1
本實施例說明利用法尼醇控制菌絲體形態的方法:
(1)培養基的配制:基礎培養基包括,葡萄糖20g/L,(NH4)2SO4 5g/L,KH2PO4 4g/L,MgSO4·7H2O 2g/L,FeSO4·7H2O 0.1g/L,CaCl2·2H2O 0.5g/L,葡萄糖分開滅菌,115℃滅菌30min;
(2)種子培養:往步驟(1)所述培養基中加入黑根霉孢子懸浮液1mL,28℃、160rpm培養20小時,將培養物均質后即為種子液;
(3)將法尼醇按200mM的濃度溶解于乙醇中,0.22μm濾膜過濾除菌,制得法尼醇溶液;
(4)在整個培養過程的第0h,加入法尼醇溶液至發酵液中的濃度達到200μM,不加入法尼醇的培養基作為對照;
(5)發酵培養:將種子液按6%(v/v)接種量接入步驟(1)所述新鮮培養基,28℃、160rpm培養48小時,收集菌體。
結果如圖1所示,顯示加入法尼醇的培養基中菌絲體為表面光滑的球狀。
實施例2
本實施例說明一種利用法尼醇控制菌絲體形態的方法:
(1)培養基的配制:基礎培養基包括,蔗糖50g/L,尿素10g/L,KH2PO41g/L,MgSO4·7H2O 1g/L,CaCl2·2H2O 0.05g/L,葡萄糖分開滅菌,115℃滅菌30min;
(2)種子培養:往步驟(1)所述培養基中加入黑曲霉孢子懸浮液1mL,30℃、150rpm培養36小時,將培養物均質后即為種子液;
(3)將法尼醇按200mM的濃度溶解于乙醇中,0.22μm濾膜過濾除菌,制得法尼醇溶液;
(4)在整個培養過程的第0h,加入法尼醇溶液至發酵液中的濃度達到150μM,不加入法尼醇的培養基作為對照,用HCl調控pH為6.0;
(5)發酵培養:將種子液按6%(v/v)接種量接入步驟(1)所述新鮮培養基,30℃、200rpm培養72小時,收集菌體。
結果如圖2所示,顯示加入法尼醇的培養基中菌絲體為表面多毛的球狀。
實施例3
本實施例說明一種利用法尼醇控制菌絲體生長形態方法進行洛伐他汀發酵生產:
(1)培養基的配制:基礎培養基包括,甘油5%,葡萄糖10g/L,大豆蛋白胨2g/L,(NH4)2SO4 2g/L,KH2PO4 1.5g/L,MgSO4·7H2O 1g/L,FeSO4·7H2O0.05g/L,CaCl2·2H2O 0.05g/L,葡萄糖分開滅菌,115℃滅菌30min;
(2)種子培養:往步驟(1)所述培養基中加入紅曲霉孢子懸浮液1mL,30℃、200rpm培養48小時,將培養物均質后即為種子液;
(3)將法尼醇按200mM的濃度溶解于乙醇中,0.22μm濾膜過濾除菌,制得法尼醇溶液;
(4)在整個培養過程的第48h,加入步驟(3)中的法尼醇溶液至發酵液中的濃度達到500μM,不加入法尼醇的培養基作為對照;
(4)發酵培養:將種子液按10%(v/v)接種量接入步驟(1)所述新鮮培養基,30℃、200rpm培養21天,獲得表面光滑的球狀菌體,該細胞菌體可以用作發酵生產洛伐他汀;
(5)洛伐他汀的提取和檢測:取1體積的勻漿發酵液與4體積的無水甲醇,30℃、200rpm搖床振蕩提取3h,12000rpm離心10min,上清液經0.22um濾膜過濾,HPLC上樣檢測。
HPLC檢測條件:色譜柱250mm×4.6mm C18柱;紫外檢測器:檢測波長237nm;流動相為70%乙腈(色譜純磷酸調pH至2.6-2.8);流速0.6ml/min;進樣量10uL;
結果顯示:發酵液中的洛伐他汀含量為0.64g/L,對照組中洛伐他汀含量為0.4g/L。
實施例4
本實施例說明一種利用法尼醇控制菌絲體生長形態方法進行胞外多糖發酵生產:
(1)預培養:采用常用土豆培養基配制方法配制預培養用的培養基,其中土豆200g/L、葡萄糖20g/L;將變色栓菌菌絲體接種于該培養基中,于26℃、150r/min條件下培養7天;將培養物均質后按10%(v/v)接種量接入新鮮培養基,26℃、150r/min條件下培養5天,即得預培養的種子液。
(2)發酵培養基的配制:葡萄糖40g/L,大豆蛋白胨10g/L,KH2PO4 2g/L,MgSO4·7H2O 2g/L,葡萄糖分開滅菌,115℃滅菌30min;
(3)將法尼醇按200mM的濃度溶解于乙醇中,0.22μm濾膜過濾除菌,制得法尼醇溶液;
(4)在整個培養過程的第0h,加入法尼醇溶液至發酵液中的濃度達到1mM,不加入法尼醇的培養基作為對照;
(5)發酵培養:將種子液按10%(v/v)接種量接入步驟(2)所述新鮮培養基,26℃、50rpm培養168小時,獲得表面毛茸茸的膨大的球狀菌體,該細胞菌體可以用作發酵生產胞外多糖;
(6)胞外多糖的提取和檢測:取1體積的發酵液與4體積的95%乙醇,振蕩搖勻,4℃靜止過夜,12000rpm離心10min,沉淀物經95%乙醇、70%乙醇各洗滌兩次,即得粗胞外多糖。
檢測:苯酚-硫酸法檢測總糖含量,DNS法檢測摻雜的還原糖含量,胞外多糖含量=總糖含量-還原糖含量;
結果顯示:發酵液中的胞外多糖含量為2.5g/L,對照組中胞外多糖含量為0.81g/L,相比提高了2.1倍。
對比例1
該對比例于實施例1的不同之處僅在于,所述加入法尼醇溶液至發酵液中的濃度達到120μM,除此之外,其余試劑和試劑用量以及培養方法均與實施例1相同。
結果顯示培養基中菌絲體為絮狀。
對比例2
該對比例于實施例2的不同之處僅在于,所述加入法尼醇溶液至發酵液中的濃度達到100μM,除此之外,其余試劑和試劑用量以及培養方法均與實施例2相同。
結果顯示培養基中菌絲體為團簇狀。
對比例3
該對比例于實施例3的不同之處僅在于,所述加入法尼醇溶液至發酵液中的濃度達到60μM,除此之外,其余試劑和試劑用量以及培養方法均與實施例3相同。
結果顯示:發酵液中的洛伐他汀含量為0.5g/L。
對比例4
該對比例于實施例4的不同之處僅在于,所述加入法尼醇溶液至發酵液中的濃度達到60μM,除此之外,其余試劑和試劑用量以及培養方法均與實施例4相同。
結果顯示:發酵液中的胞外多糖的含量為1.2g/L。
申請人聲明,本發明通過上述實施例來說明本發明的工藝方法,但本發明并不局限于上述工藝步驟,即不意味著本發明必須依賴上述工藝步驟才能實施。所屬技術領域的技術人員應該明了,對本發明的任何改進,對本發明所選用原料的等效替換及輔助成分的添加、具體方式的選擇等,均落在本發明的保護范圍和公開范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!