一種人尿液復合陽離子抗菌肽的制備方法與流程
本發明屬于生物化學、生物技術、生物制品領域,具體涉及一種人尿液復合陽離子抗菌肽的制備方法。
背景技術:
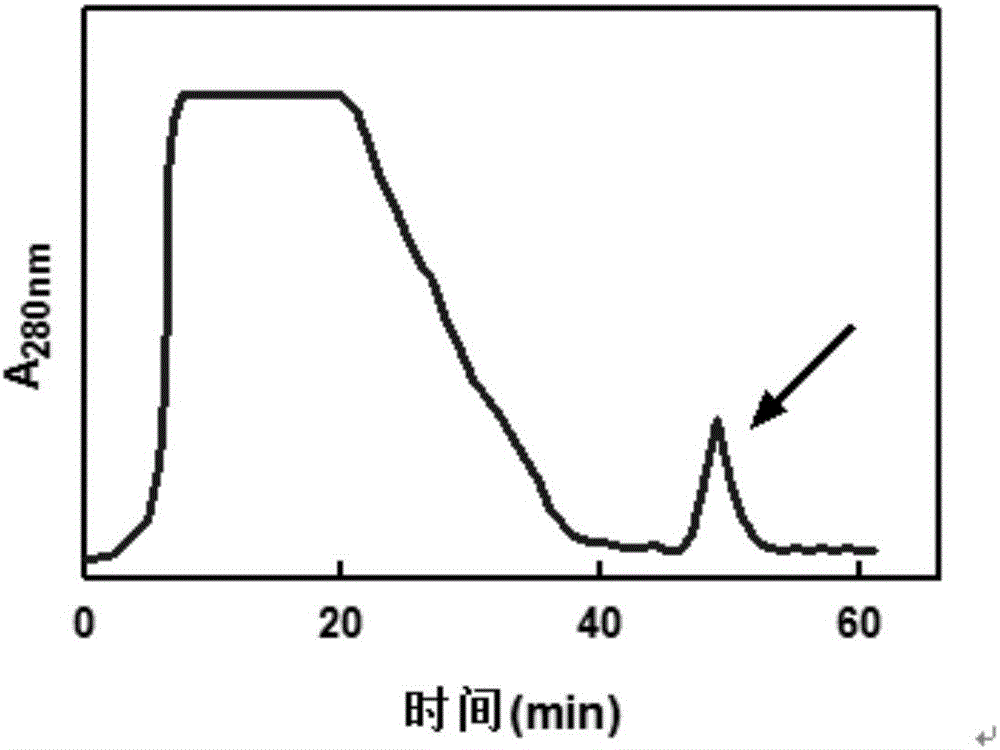
:抗菌肽或類似抗菌肽的小分子陽離子肽類廣泛存在于生物界,包括細菌、動植物和人類。這種內源性的抗菌肽一般經誘導合成,在機體抵抗病原體的入侵方面起著重要的作用,更被認為是缺乏特異性免疫功能的低等生物的重要防御成分。抗菌肽一般由20-60個氨基酸殘基組成,分子量在2000-7000Da左右,這類活性多肽多數具有強堿性、熱穩定性以及廣譜抗菌等特點。大多數對革蘭氏陽性菌有較強的殺滅作用,有些則對革蘭氏陰性菌和革蘭氏陽性菌均起作用。抗菌肽還對某些真菌、原生動物,尤其對耐藥性細菌有殺滅作用,并能選擇殺傷腫瘤細胞,抑制病毒復制。因此,抗菌肽極具藥用開發前景。迄今為止從不同生物體內分離得到的抗菌肽已不下200種,主要集中在昆蟲方面的研究,僅從昆蟲體內分離獲得到的就多達170余種。異源抗菌肽具有免疫原性,限制了其在人體內的相關試驗研究。相對于昆蟲抗菌肽,人源抗菌肽的相關研究報道較少。健康成人尿液作為傳統生化制藥原料,已有很長的一段歷史。包括尿激酶、尿胰蛋白酶抑制劑、尿激肽原酶等來源于人尿的供注射用的天然蛋白類藥物已廣泛應用于臨床,其安全性及有效性已得到廣泛證實。以往小分子肽類的常規分離手段主要是采用有機溶液、有機酸抽提或低濃度乙酸溶液浸提得到粗品,多種色譜方法組合(分子篩、離子交換、疏水層析等)進行分離,甚至采用反相高效液相色譜法進行精細純化,整個分離純化過程中需要進行抗菌活性跟蹤測定。柱層析分離法制備抗菌肽,處理液體量有限,并不適合大規模放大。而且經多步層析分離,收率不高,低豐度的抗菌肽類往往丟失,最終一般僅能分離得到高豐度的抗菌肽。近年來,超濾法(又稱切向流過濾)替代分子篩層析,在復合抗菌肽的分離中應用較多。相比分子篩層析,超濾法處理液體量大,工作效率大大提高,適合于放大生產。但單純依靠超濾法進行分子量分級,最終制備的復合抗菌肽純度不高,尤其是以一些昆蟲體酶解液為原料時,僅憑超濾法純化往往混雜有小分子無抗菌活性的水解肽類。技術實現要素:本發明的目的是提供一種人尿液復合陽離子抗菌肽的制備方法。本發明提供了一種制備抗菌物質的方法,包括如下步驟:(a1)取原料,采用1kDa截留分子量的超濾膜包依次進行濃縮和透析,收集截留液;所述原料為原料甲或原料乙;所述原料甲為人尿液;所述原料乙為將人尿液過濾收集的濾液;(a2)取步驟(a1)得到的截留液,采用nkDa截留分子量的超濾膜包依次進行濃縮和透析,收集透過液;n為30-50之間的數字;(a3)取步驟(a2)得到的透過液,進行弱陽離子交換層析,收集pH7.5條件下帶正電的組分。本發明還保護一種制備抗菌物質的方法,包括如下步驟:(b1)取原料,采用1kDa截留分子量的超濾膜包依次進行濃縮和透析,收集截留液;所述原料為原料甲或原料乙;所述原料甲為人尿液;所述原料乙為將人尿液過濾收集的濾液;(b2)取步驟(b1)得到的截留液,采用nkDa截留分子量的超濾膜包依次進行濃縮和透析,收集透過液;n為30-50之間的數字;(b3)取步驟(b2)得到的透過液,進行弱陽離子交換層析,收集等電點為8.5以上的組分。以上任一所述方法中,n具體可為30或50。本發明還保護一種制備抗菌物質的方法,包括如下步驟:(c1)從人尿液中收集分子量為1kDa-50kDa的組分;(c2)從步驟(c1)得到的物質中收集等電點為8.5以上的組分。本發明還保護一種制備抗菌物質的方法,包括如下步驟:(d1)從人尿液中收集分子量為1kDa-50kDa的組分;(d2)從步驟(d1)得到的物質中收集pH7.5條件下帶正電的組分。以上任一所述方法中,所述“從人尿液中收集分子量為1kDa-50kDa的組分”是通過步驟(e1)和(e2)實現的。所述步驟(e1)為:取原料,采用1kDa截留分子量的超濾膜包依次進行濃縮和透析,收集截留液;所述原料為原料甲或原料乙;所述原料甲為人尿液;所述原料乙為將人尿液過濾收集的濾液。所述步驟(e2)為:取步驟(e1)得到的截留液,采用50kDa截留分子量的超濾膜包依次進行濃縮和透析,收集透過液。所述“從步驟(c1)得到的物質中收集等電點為8.5以上的組分”或“從步驟(d1)得到的物質中收集pH7.5條件下帶正電的組分”是通過步驟(e3)實現的。所述步驟(e3)為:將步驟(c1)或步驟(d1)收集的組分進行弱陽離子交換層析。以上任一所述方法中,所述過濾是采用孔徑為100μm的濾紙或孔徑為0.22μm的濾膜或孔徑為0.45μm的濾膜。以上任一所述方法中,所述透析使用的透析液為pH7.5、10mmol/L的磷酸鹽緩沖液。以上任一所述方法中,所述弱陽離子交換層析的洗脫液為乙酸體積百分含量為5%的乙酸水溶液。以上任一所述方法中,所述弱陽離子交換層析的填充介質為CMSepharoseFastFlow。以上任一所述方法中,所述弱陽離子交換層析的步驟為:將所述步驟(a2)得到的透過液或步驟(b2)得到的透過液或步驟(e2)得到的透過液上樣,然后用磷酸鹽緩沖液進行洗滌,然后采用乙酸體積百分含量為5%的乙酸水溶液洗脫,通過監測A280nm收集洗脫峰。所述磷酸鹽緩沖液為10mmol/LpH7.5的磷酸鹽緩沖液。所述洗滌采用5倍柱體積磷酸鹽緩沖液。以上任一所述方法中,所述弱陽離子交換層析的步驟為:以10mL/min的流速上樣所述步驟(a2)或步驟(b2)或步驟(e2)得到的透過液;上樣結束后,用5倍柱體積的10mmol/LpH7.5磷酸鹽緩沖液進行清洗,至流出液A280nm接近基線水平;然后采用乙酸體積百分含量為5%的乙酸水溶液洗脫,監測流出液A280nm,收集洗脫峰。所述弱陽離子交換層析的步驟具體為:先用10mmol/LpH7.5的磷酸鹽緩沖液平衡柱子至pH穩定,然后以10mL/min的流速上樣所述步驟(a2)或步驟(b2)或步驟(e2)得到的透過液;上樣結束后,用5倍柱體積的10mmol/LpH7.5磷酸鹽緩沖液進行清洗,至流出液A280nm接近基線水平;采用乙酸體積百分含量為5%的乙酸水溶液洗脫吸附組分,監測流出液A280nm,收集洗脫峰。所述洗脫峰對應的保留時間為40-60min。以上任一所述方法中,所述人尿液、所述截留液和所述透過液的體積比為50∶1∶10。以上任一所述方法中,所述步驟(a3)或步驟(b3)或步驟(c2)或步驟(d2)后還包括將收集的組分進行冷凍干燥,得到抗菌物質。本發明還保護利用以上任一所述的方法制備得到的產品。本發明還保護所述產品的應用,為如下(1)或(2):(1)作為抑菌產品;(2)制備抑菌產品。以上任一所述抗菌物質或抑菌產品針對的微生物為細菌。所述細菌具體可為大腸桿菌。人尿液有望成為人源抗菌肽的理想原料來源,主要是基于以下兩方面原因。一方面,健康人群中尿路感染并不常見,正常成人尿液是無菌的,這與泌尿系統完善的固有免疫相關,其中就有尿路上皮細胞可分泌各類組成型和誘導型抗菌肽有關。另一方面,尿液蛋白質主要來源于人血漿蛋白質通過腎小球濾過。理論上,分子量小于5500Da的物質可自由通過腎小球濾過,隨著分子量提高,濾過率降低,血紅蛋白分子量為64500Da,濾過率僅有3%。研究表明,腎小球濾過膜除對分子大小具有選擇性,對電荷同樣有選擇性,正電荷分子更易濾過。上述腎小球濾過分子的選擇性均符合陽離子抗菌肽的生化特性,所以,人尿液集合了血漿和泌尿系統兩種來源的抗菌肽類,有望成為人源抗菌肽的新來源。本發明提供的方法工藝簡單、成本低廉、不涉及有害溶劑,采用超濾法將人尿蛋白進行分子量分級,大分子量尿蛋白組分是傳統尿活性蛋白,如白蛋白、尿激酶、尿胰蛋白酶抑制劑等的理想原料來源,而抗菌肽存在于小分子組分中。利用抗菌肽富含堿性氨基酸,在中性偏堿的條件下帶正電荷的這一生化特性,采用弱陽離子交換柱層析在上樣環節即選擇性吸附陽離子抗菌肽,達到純化的目的。制備工藝針對抗菌肽的生化特性,采用兩種不同原理的分離手段相結合,最終制備純度較高的人源復合陽離子抗菌肽。本發明對于抗菌肽的研制具有重要意義。附圖說明圖1為實施例1中各步分離組分SDS-PAGE電泳圖譜。圖2為實施例1中弱陽離子交換層析圖譜。圖3為實施例1中各步分離組分HPLC檢測圖譜。圖4為實施例2中各步分離組分抗菌檢測結果。圖5為實施例2中抗菌肽等電聚焦電泳圖譜。具體實施方式以下的實施例便于更好地理解本發明,但并不限定本發明。下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的試驗材料,如無特殊說明,均為自常規生化試劑商店購買得到的。以下實施例中的定量試驗,均設置三次重復實驗,結果取平均值。大腸桿菌BL21(DE3):Novagen公司,產品目錄號:69450。1kDa截留分子量的超濾膜包:Millipore公司,產品目錄號:P2PLACC05。50kDa截留分子量的超濾膜包:Millipore公司,產品目錄號:P2B050A01。30kDa截留分子量的超濾膜包:Millipore公司,產品目錄號:P2B030A01。實施例1、抗菌肽的制備1、取50L尿液(收集自50位健康成年男性,均為8h內采集的新鮮尿液),采用布氏漏斗減壓抽濾(濾紙孔徑為100μm),收集濾液。2、取全部步驟1得到的濾液,采用1kDa截留分子量的超濾膜包依次進行50倍濃縮和透析(采用5LpH7.5、10mmol/L的磷酸鹽緩沖液作為透析液;透析的目的是除去色素、尿素等雜質),收集截留液(理論上含有全尿蛋白),得到1L截留液。相關參數:MilliporePellicon超濾系統,0.5m21kDa截留分子量的超濾膜包,進口壓力25-30Psi,循環口壓力10-15Psi,壓力差維持在15Psi以上。3、取全部步驟2得到的截留液,采用50kDa截留分子量的超濾膜包依次進行濃縮和透析(采用10LpH7.5、10mmol/L的磷酸鹽緩沖液作為透析液),分別收集截留液(理論上含有分子量為50kDa以上的尿蛋白)和透過液(理論上含有分子量小于50kDa的尿蛋白),得到10L透過液。相關參數:MilliporePellicon超濾系統,0.1m250kDa截留分子量的超濾膜包,進口壓力25-30Psi,循環口壓力10-15Psi,壓力差維持在15Psi以上。4、分別取步驟2得到的截留液、步驟3得到的截留液和步驟3得到的透過液,進行15%SDS-PAGE,結果如圖1所示。圖1中,泳道1為蛋白marker,泳道2為步驟2得到的截留液,蛋白條帶較多且分子量分布很寬,泳道3為步驟3得到的截留液,泳道4為步驟3得到的透過液,蛋白分子量集中在20kDa以下(見箭頭指示)。5、取全部步驟3得到的透過液,進行弱陽離子交換層析。弱陽離子交換層析的相關參數:填充介質為CMSepharoseFastFlow,柱子直徑為2.6cm,柱床體積為50mL;監測A280nm值;第0min時,先用pH7.5、10mmol/L的磷酸鹽緩沖液平衡柱子至pH穩定,然后以10mL/min的流速上樣步驟3得到的透過液,然后用5倍柱體積的pH7.5、10mmol/L磷酸鹽緩沖液洗滌直至A280nm接近基線水平,然后用5%(體積分數)乙酸水溶液洗脫,收集洗脫峰(洗脫峰對應的保留時間為40-60min)對應的過柱后溶液,弱陽離子交換層析譜圖如圖2所示。6、分別取步驟3得到的透過液和步驟5得到的洗脫峰對應的過柱后溶液,進行凝膠過濾HPLC檢測。凝膠過濾HPLC檢測的相關參數:色譜柱為TosohTSKG2000SWxl分析柱,規格為7.8mm(ID)×30cm(L);上樣體積為20μL,檢測波長為280nm;流動相為含300mmol/LNaCl和25mmol/LPBS的緩沖液(pH7.0),流速為0.5mL/min。檢測結果如圖3所示。圖3中,圖3A為步驟3得到的透過液組分,呈多峰分布,圖3B為CMSepharoseFastFlow吸附組分,即5%(體積分數)乙酸水溶液洗脫組分,分子量很小且分布非常均一,呈單一峰,與抗菌肽特征相符;圖3C為圖3A和圖3B兩圖的疊加。7、將步驟5得到的洗脫組分進行冷凍干燥,得到干粉203mg。干粉即為目的產物,抗菌物質I(又稱為復合陽離子抗菌肽I)。8、取50L尿液(收集自50位健康成年男性,均為8h內采集的新鮮尿液),采用0.22μm的濾膜過濾,收集濾液。采用30kDa截留分子量的超濾膜包替代50kDa截留分子量的超濾膜包,將濾液按照步驟2-5的方法處理,得到抗菌物質II(又稱為復合陽離子抗菌肽II)200mg。實施例2、抗菌肽的檢測1、以大腸桿菌BL21(DE3)作為測定菌株,瓊脂糖擴散法測定各步純化組分的抗菌活性。1號樣品:實施例1步驟2得到的截留液樣品。2號樣品:實施例1步驟3得到的透過液樣品。3號樣品:實施例1步驟3得到的截留液樣品。4號樣品:實施例1步驟7得到的抗菌肽樣品。5號樣品:實施例1步驟8得到的抗菌肽樣品。具體步驟如下:(1)將大腸桿菌BL21(DE3)接種至LB液體培養基中,37℃、250rpm振蕩培養12小時,得到菌濃度為2×109CFU/mL的菌液。(2)將LB固體培養基加熱至融化,放置到瓶體不燙手(溫度在45℃左右),取100μL步驟(1)得到的菌液接種至20mL的LB固體培養基中,室溫放置至平板凝固,打孔。(3)將1-5號樣本用1kDa透析袋進行透析(pH7.5、10mmol/L的磷酸鹽緩沖液),完成溶液置換,收集透析液。(4)采用pH7.5、10mmol/L的磷酸鹽緩沖液將步驟(3)收集的1-5號樣本透析液稀釋為各稀釋液,各稀釋液中的蛋白質濃度見表1。(5)向步驟(2)的平板中加入步驟(4)的各稀釋液(每孔20μL)。(6)將步驟(5)的平板37℃培養12h,并測量抑菌圈直徑,結果見表1和圖4。表11-5號樣品的稀釋液濃度及抑菌圈直徑測量結果樣本編號稀釋液中的蛋白質濃度抑菌圈直徑1號300μg/ml2.5cm2號10μg/ml1.8cm3號260μg/ml0cm4號5μg/ml2.2cm5號5μg/ml2.2cm結果表明,全尿蛋白(1號樣品)具有明顯抗菌活性,經50kDa超濾按分子量范圍對全尿蛋白進行分級分離后,抗菌活性主要集中在小分子尿蛋白組分(2號樣品),而大分子尿蛋白組分(3號樣品)并沒有觀察到抑菌圈。經弱陽離子交換層析捕獲得到的陽離子肽類(4號樣品和5號樣品)則表現出了強抗菌活性。2、等電聚集電泳對實施例1步驟7得到的抗菌物質I和步驟8得到的抗菌物質II的等電點進行分析,采用兩性電解質Ampholite3-10范圍。結果如圖5所示。圖5為抗菌物質I的分析結果。結果表明,抗菌物質I的等電點按照兩性電解質pH分布,由陰極至陽極pH值由10.0到3.0逐漸降低。與預期結果相符,尿來源抗菌肽基本是由堿性多肽組成,條帶均位于堿性區域。抗菌物質II的等電點分析結果與抗菌物質I的分析結果相同。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1