抗EGFR和抗CD3雙特異抗體及其應用的制作方法
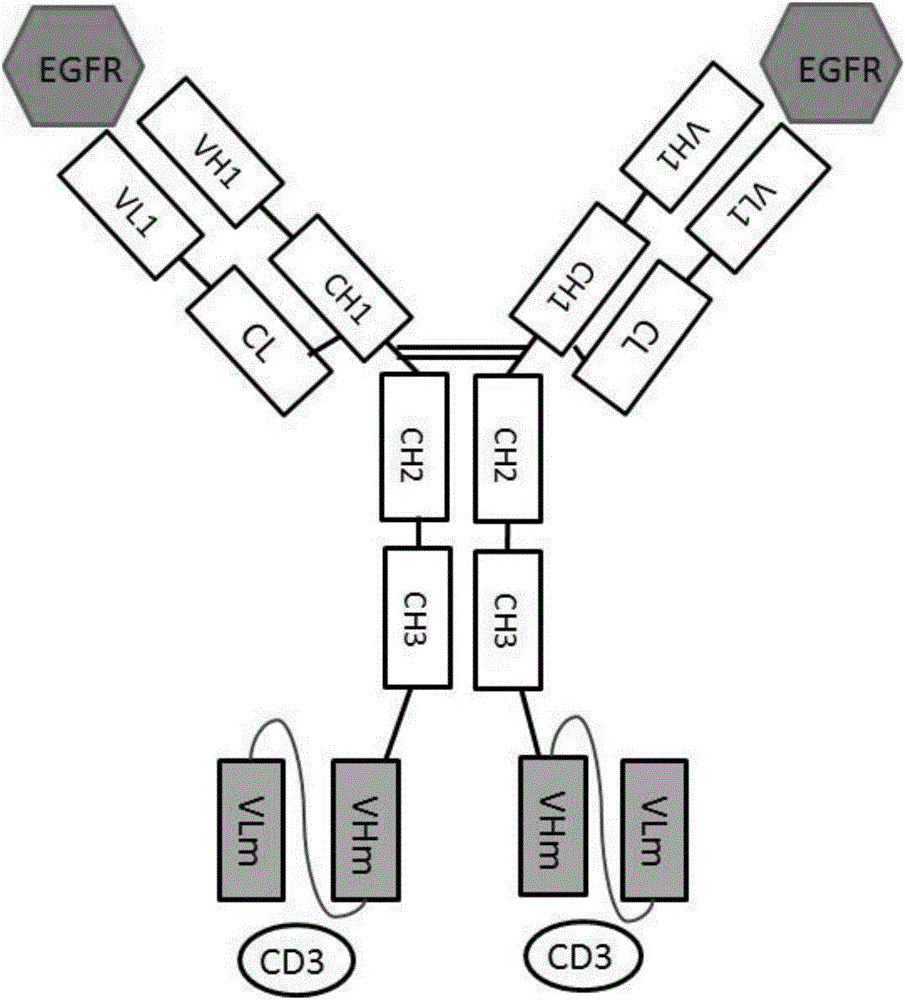
本發明涉及生物技術領域,具體涉及一種針對EGFR和CD3的雙特異性抗體的構建和制備方法,以及該抗體在疾病中的應用。
背景技術:
雙特異性抗體(bispecific antibody,BiAb)是由兩種不同的抗體片段構成的人工抗體,能夠特異性識別和結合兩個不同的抗原或兩個不同的抗原表位。
單克隆抗體廣泛應用于癌癥、炎癥和其它疾病的治療,由于這些抗體所針對的都是單一的靶標,很多患者不能充分響應單一的療法,時常出現抗藥性。雙特異性抗體能夠同時識別兩個不同的抗原或抗原表位,可以作為一種媒介重新定向免疫效應細胞,如自然殺傷細胞和T細胞,加強對腫瘤細胞的殺傷功能。此外,雙特異性抗體還可以定位于同一個細胞的兩個不同的抗原,導致細胞信號的改變,包括癌癥擴散信號或炎癥信號。經過長時間的研究和發展,出現了多種形式的雙特異性抗體,如雙特異性微抗體、雙鏈抗體、單鏈雙價抗體和多價雙特異性抗體等。這些雙特異性抗體基本上分為兩大類:含有Fc的和不含有Fc的。前者具有較好的溶解性、穩定性和半衰期,而Fc介導的抗體依賴的細胞毒性作用(ADCC)和補體依賴性細胞溶解效應(CDC)可以帶來一些治療所需的附加效應。相比之下,缺乏Fc的雙特異性抗體完全依賴其抗原結合能力發揮其治療作用;另外Fc蛋白可以延長藥物蛋白(或多肽)在體內的半衰期,從而延長活性分子在體內的作用時間。
腫瘤細胞表面抗原表皮生長因子受體(EGFR):表皮生長因子受體廣泛分布于除血管組織外的上皮細胞膜上,是一個跨膜蛋白,分子量約為l80KDa,具有配體誘導酪氨酸蛋白激酶活性,它是ErbB這個保守的受體家族中的一員,這個家族的其他成員包括HER2/Neu/ErbB2,HER3/ErbB3和HER4/ErbB4。ErbB受體的共同特征是:包含一個胞外(EC)配體結合區,由兩個重復的富含半胱氨酸的區域組成的單一跨膜區,以及含有酪氨酸蛋白激酶和自身磷酸化位點的胞內序列;配體和受體結合后,引起受體的二聚化作用,形成同型或異型二聚體;二聚化的受體發生交聯磷酸化,激活胞內區的TK亞區,從而激發下一級信號傳導,導致細胞增殖、轉化。EGFR與腫瘤細胞的增殖、血管生成、腫瘤侵襲、轉移及細胞凋亡的抑制有關,其機制包含有:EGFR的高表達引起下游信號傳導的增強,突變型EGFR受體或配體表達的增加導致EGFR的持續活化,自分泌環的作用增強,受體下調機制的破壞,異常信號傳導通路的激活等。研究表明EGFR在很多實體瘤中高表達或異常表達,與腫瘤細胞的增殖、血管生成、腫瘤侵襲、轉移及細胞凋亡的抑制有關。EGFR的過表達在腫瘤的演進中發揮著重要作用,如膠質細胞瘤、肺癌、前列腺癌、胰腺癌等組織中都有EGFR的過度表達。
免疫細胞表面抗原分化簇3(CD3):CD3分子是T細胞膜上的重要分化抗原,是成熟T細胞的特征性標志,由6條肽鏈組成,以非共價鍵與T細胞抗原受體(TCR)組成TCR-CD3復合體,不僅參與TCR-CD3復合體的胞漿內組裝,而且通過各多肽鏈胞漿區的免疫受體酪氨酸活化基序(immunoreceptor tyrosine-based activation motif,ITAM)傳遞抗原刺激信號。CD3分子的主要功能為:穩定TCR結構,傳遞T細胞活化信號,當TCR特異性識別并結合抗原后,CD3參與將信號轉導到T細胞胞漿內,作為誘導T細胞活化的第一信號,在T細胞抗原識別和免疫應答產生過程中具有極其重要的作用。
在醫學中,特別是腫瘤的免疫治療中,雙特異性抗體具有良好的效果和前景,能夠同時結合腫瘤細胞和免疫細胞上的特異性抗原-抗免疫活性細胞CDl6或CD3的部分,具有激活NK細胞或T細胞作用,而抗腫瘤的特異性抗原部分可以結合腫瘤細胞,將免疫細胞靶向到腫瘤細胞,提高局部NK細胞或T細胞濃度,從而使免疫效應細胞對腫瘤細胞起到特異性殺傷作用。現有技術中,還沒有成功上市的EGFR和CD3雙特異性抗體藥物產品,該項技術有待研究。
相對于中國專利CN201510030519.9,本發明是采用四價雙特異性抗體,完整的保留了抗EGFR抗體的生物學活性;四價雙特異能夠更好的識別腫瘤抗原和效應細胞(T細胞和NK細胞等),從而能夠更好地發揮雙特異抗體的生物學活性。美國專利US9249217B2則采用ScFv-ScFv(BITE)形式,而BITE是二價的且沒有Fc片段。與BITE相比,本發明除了具有四價抗體的優勢外,還含有Fc片段;Fc片段可以延長效應分子在體內的半衰期,從而延長了效應分子在體內的作用時間。
技術實現要素:
本發明中提供了一種雙特異性抗體,該雙特異性抗體在抗EFGR的C-端增加了抗CD3的ScFv序列,這種雙特異抗體保留了抗EGFR抗體完整分子結構,同時增加了結合CD3抗原的能力,這樣既保持了原有EGFR抗體在體內生物學活性,同時通過特異性識別兩種不同的抗原,靶向免疫效應細胞到腫瘤細胞,從而增加了免疫效應細胞殺傷腫瘤細胞的效果。
本發明提供了抗EGFR和抗CD3雙特異抗體及其應用,
包含(a)完整的單克隆抗體,(b)單鏈抗體ScFv和(c)連接子;所述(a)與EGFR抗原特異性結合并且由兩條抗體重鏈和兩條抗體輕鏈組成;所述(b)與免疫細胞抗原CD3特異性結合,所述(b)為兩條單鏈抗體ScFv;所述(b)為兩條單鏈抗體ScFv;所述(b)的兩條單鏈抗體ScFv分別通過所述(c)連接子linker與所述(a)的兩條重鏈的C末端連接。
其中,所述雙特異抗體中所述(c)連接子linker的氨基酸序列為(GGGGX)n,X包含Ser或Ala,X優選Ser;n為1-4的自然數,n優選3。
其中,所述雙特異性抗體(a)完整的單克隆抗體是由兩條輕鏈和兩條重鏈組成,每條重鏈和輕鏈之間通過二硫鍵連接,兩條重鏈之間通過鉸鏈區的二硫鍵連接。所述重鏈和輕鏈的可變區特異性結合腫瘤細胞表面EGFR抗原。
其中,所述(a)完整的單克隆抗體的重鏈恒定區為IgG1、IgG2、IgG3或IgG4中的一種,優選IgG2。
其中,所述(a)完整的單克隆抗體的重鏈可變區氨基酸序列為SEQ ID NO 1、SEQ ID NO 2或SEQ ID NO 3中的一種;所述(a)完整的單克隆抗體的輕鏈可變區的氨基酸序列為SEQ ID NO 4、EQ ID NO 5或SEQ ID NO 6中的一種。所述(b)單鏈抗體ScFv的重鏈可變區的氨基酸序列為SEQ ID NO 8,所述(b)單鏈抗體ScFv的輕鏈可變區的氨基酸序列為SEQ ID NO 9。
其中,所述(b)兩條單鏈抗體ScFv的氨基酸序列均為SEQ ID NO 7。
其中,每個(b)單鏈抗體ScFv是由重鏈可變區、(c)連接子linker和輕鏈可變區組成,所述重鏈可變區和輕鏈可變區特異性結合免疫細胞表面CD3抗原;所述(c)連接子linker的氨基酸序列為(GGGGS)n,n為1-4的自然數,優選為(GGGGS)3。
其中,構建雙特異抗體的表達載體,其中所述雙特異抗體可以構建到一個載體中,或者分別構建到兩個不同的載體上。
其中,通過基因工程方法將構建好的載體轉染到宿主細胞中,所述宿主細胞包含原核細胞、酵母或哺乳動物細胞,如CHO細胞、NS0細胞或其他哺乳細胞,優選為CHO細胞。
其中,通過常規的免疫球蛋白方法,包含蛋白質A親和層析和離子交換、疏水層析或分子篩方法獲得所述雙特異性抗體。
其中,所述雙特異性抗體用于EGFR高表達或非正常表達的腫瘤組織的治療及其他EGFR過表達引起疾病的治療。
其中,所述完整的單克隆抗體為全長抗體。
采用上述技術方案,包括以下有益技術效果:
本發明的雙特異性抗體是采用四價抗體的形式,這種形式的四價抗體完整的保留了結合腫瘤抗原的抗體序列,具有較高的親和力。同時四價雙特異抗體可以更好的連接腫瘤細胞和效應細胞,從而更有利于發揮雙特異抗體的生物學功能。相對于現在常用的BITE雙特異抗體形式,本發明中的分子還包括了Fc片段;Fc片段的存在可以延長藥物分子在體內的半衰期,從而能夠使藥物分子更好的發揮作用,降低病人用藥頻率,減輕病人的痛苦。本發明用于高表達或非正常表達EGFR腫瘤組織的治療,以及其他EGFR過表達引起疾病的治療。
附圖說明
圖1示例性示出了雙特異抗體的分子示意圖;
圖2示例性示出了雙特異分子質粒表達的構建圖;
圖3示例性示出了純化后的雙特異分子的變性SDS電泳圖;
圖4示例性示出了ELISA法檢測雙特異分子與抗原的結合能力;
圖5示例性示出了雙特異抗體與A431細胞的結合;
圖6示例性示出了雙特異抗體與Jukart細胞的結合;
圖7示例性示出了雙特異抗體介導的PBMC對A431的結合;
圖8示例性示出了雙特異抗體介導的PBMC對H520的殺傷效果。
具體實施方式
下面通過具體的實施例并結合附圖對本發明做進一步的詳細描述。
本發明提供了抗EGFR和抗CD3雙特異抗體及其應用,包含(a)完整的單克隆抗體,(b)單鏈抗體ScFv和(c)連接子;所述(a)與EGFR抗原特異性結合并且由兩條抗體重鏈和兩條抗體輕鏈組成;所述(b)與免疫細胞抗原CD3特異性結合,所述(b)為兩條單鏈抗體ScFv;所述(b)為兩條單鏈抗體ScFv;所述(b)的兩條單鏈抗體ScFv分別通過所述(c)連接子linker與所述(a)的兩條重鏈的C末端連接。
進一步優選地,所述雙特異抗體中所述(c)連接子linker的氨基酸序列為(GGGGX)n,X包含Ser或Ala,X優選Ser;n為1-4的自然數,n優選3。
進一步優選地,所述雙特異性抗體(a)完整的單克隆抗體是由兩條輕鏈和兩條重鏈組成,每條重鏈和輕鏈之間通過二硫鍵連接,兩條重鏈之間通過鉸鏈區的二硫鍵連接。所述重鏈和輕鏈的可變區特異性結合腫瘤細胞表面EGFR抗原。
進一步優選地,所述(a)完整的單克隆抗體的重鏈恒定區為IgG1、IgG2、IgG3或IgG4中的一種,優選IgG2。
進一步優選地,所述(a)完整的單克隆抗體的重鏈可變區氨基酸序列為SEQ ID NO 1、SEQ ID NO 2或SEQ ID NO 3中的一種;其中,
SEQ ID NO 1(尼妥珠單克隆抗體的重鏈可變區氨基酸序列):
QVQLQQPGAELVKPGASVKLSCKASGYTFTNYYIYWVKQRPGQGLEWIGGINPTSGGSNFNEKFKTKATLTVDESSTTAYMQLSSLTSEDSAVYYCTRQGLWFDSDGRGFDFWGQGTTLTVSS;
SEQ ID NO 2(西妥昔單克隆抗體的重鏈可變區氨基酸序列):QVQLKQSGPGLVQPSQSLSITCTVSGFSLTNYGVHWVRQSPGKGLEWLGVIWSGGNTDYNTPFTSRLSINKDNSKSQVFFKMNSLQSNDTAIYYCARALTYYDYEFAYWGQGTLVTVSA;
SEQ ID NO 3(帕尼單抗單克隆抗體的重鏈可變區氨基酸序列):
QVQLQESGPGLVKPSETLSLTCTVSGGSVSSGDYYWTWIRQSPGKGLEWIGHIYYSGNTNYNPSLKSRLTISIDTSKTQFSLKLSSVTAADTAIYYCVRDRVTGAFDIWGQGTMVTVSS。
其中,所述(a)完整的單克隆抗體的輕鏈可變區的氨基酸序列為SEQ ID NO 4、EQ ID NO 5或SEQ ID NO 6中的一種,
SEQ ID NO 4(尼妥珠單克隆抗體的輕鏈可變區氨基酸序列):
DVLMTQIPLSLPVSLGDQASISCRSSQNIVHSNGNTYLDWYLQKPGQSPNLLIYKVSNRFSGVPDRFRGSGSGTDFTLKISRVEAEDLGVYYCFQYSHVPWTFGGGTKLEIK;
SEQ ID NO 5(西妥昔單克隆抗體的輕鏈可變區氨基酸序列):
DILLTQSPVILSVSPGERVSFSCRASQSIGTNIHWYQQRTNGSPRLLIKYASESISGIPSRFSGSGSGTDFTLSINSVESEDIADYYCQQNNNWPTTFGAGTKLELK;
SEQ ID NO 6(帕尼單抗單克隆抗體的輕鏈可變區氨基酸序列):
DIQMTQSPSSLSASVGDRVTITCQASQDISNYLNWYQQKPGKAPKLLIYDASNLETGVPSRFSGSGSGTDFTFTISSLQPEDIATYFCQHFDHLPLAFGGGTKVEIK。
進一步優選地,所述(b)單鏈抗體ScFv的重鏈可變區的氨基酸序列為SEQ ID NO 8,所述(b)單鏈抗體ScFv的輕鏈可變區的氨基酸序列為SEQ ID NO 9;其中,
SEQ ID NO 8(抗CD3單鏈抗體的重鏈可變區氨基酸序列):
DIKLQQSGAELARPGASVKMSCKTSGYTFTRYTMHWVKQRPGQGLEWIGYINPSRGYTNYNQKFKDKATLTTDKSSSTAYMQLSSLTSEDSAVYYCARYYDDHYCLDYWGQGTTLTVSS;
SEQ ID NO 9(抗CD3單鏈抗體的輕鏈可變區氨基酸序列):
DIQLTQSPAIMSASPGEKVTMTCRASSSVSYMNWYQQKSGTSPKRWIYDTSKVASGVPYRFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPLTFGAGTKLELK。
進一步優選地,所述(b)兩條單鏈抗體ScFv的氨基酸序列均為SEQ ID NO 7;其中,
SEQ ID NO 7(抗CD3單鏈抗體氨基酸序列):
DIKLQQSGAELARPGASVKMSCKTSGYTFTRYTMHWVKQRPGQGLEWIGYINPSRGYTNYNQKFKDKATLTTDKSSSTAYMQLSSLTSEDSAVYYCARYYDDHYCLDYWGQGTTLTVSSGGGGSGGGGSGGGGSDIQLTQSPAIMSASPGEKVTMTCRASSSVSYMNWYQQKSGTSPKRWIYDTSKVASGVPYRFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPLTFGAGTKLELK。
進一步優選地,每個(b)單鏈抗體ScFv是由重鏈可變區、(c)連接子linker和輕鏈可變區組成,所述重鏈可變區和輕鏈可變區特異性結合免疫細胞表面CD3抗原;所述(c)連接子linker的氨基酸序列為(GGGGS)n,n為1-4的自然數,優選為(GGGGS)3。
進一步優選地,將構建好的載體轉染到宿主細胞中,所述宿主細胞包含原核細胞、酵母或哺乳動物細胞,如CHO細胞、NS0細胞或其他哺乳細胞,優選為CHO細胞。
進一步優選地,所述雙特異性抗體用于EGFR高表達或非正常表達的腫瘤組織的治療及其他EGFR過表達引起疾病的治療。
具體實施例1、雙特異抗體分子的表達載體的構建
a)雙特異瞬時表達載體構建
按照圖1中雙特異抗體的形式設計相應的基因序列。選擇PTSE作為表達載體去克隆和表達抗EGFR的輕鏈基因和抗EGFR重鏈—CD3的ScFV融合基因。輕鏈基因和融合基因分別在編碼區序列兩側加入Sall、BamHl酶切位點,兩條基因由中美泰和生物技術(北京)有限公司合成并分別克隆到PUC19載體中。將兩個質粒分別轉化到TOP感受態(匯天東方,貨號HT702-03)中,用康為世紀小提試劑盒(貨號CW0500)進行小提后與載體分別用限制性內切酶Sall-HF和BamHI-HF酶切,進行同源重組,分別得到含有輕鏈及融合基因的表達載體(示意圖見圖2A和圖2B),質粒分別命名為:PTSE-JY016L-TetBiAb、PTSE-JY016H-TetBiAb。
b)雙特異穩轉表達載體構建
選擇PGN-2CMV作為表達載體去克隆和表達抗EGFR的輕鏈基因和抗EGFR重鏈-CD3的ScFV融合基因,該載體包括篩選標記Neomycin和GS,含有兩個CMV啟動子及相應的結構單元。設計輕鏈及融合基因的引物并引入Kozak序列、信號肽及相應的酶切位點,由中美泰和生物技術(北京)有限公司進行合成。以質粒PTSE-JY016L-TetBiAb、PTSE-JY016H-TetBiAb為模板,PCR擴增出相應的條帶并與載體進行同源重組(質粒圖譜見圖2C)。
具體實施例2、雙特異抗體分子的表達與純化
a)四價抗體的表達
利用無內毒素大提試劑盒(康為世紀,CW2104)進行質粒大提,具體操作步驟按照試劑盒提供的說明書進行操作。
人胚腎細胞(HEK293ES懸浮細胞)在FreeStyle 293Expressi on Medium(Gibco,12338-026)中培養,細胞每隔一到兩天傳代一次,傳代后細胞起始密度維持在0.2~0.6×106/ml,細胞培養體積為搖瓶容積的15~35%,細胞培養瓶放在搖床(搖床轉速:135rpm,溫度:37℃,CO2:5%)中培養。轉染前一天,將處于對數生長期,生長狀態良好的HEK293ES細胞,傳代到細胞密度為0.5×106/ml,放搖床(135rpm,37℃,5%CO2)培養過夜,待第二天進行轉染。
轉染前將準備好的1×106/ml細胞懸液在搖床(135rpm,39℃,5%CO2)培養2h,轉染時,依次加入PTSE-antiEGFR-H-TetBiAb(終濃度0.5μg/ml)、PTSE-antiEGFR-L(終濃度0.5μg/ml)、聚乙烯亞胺PEI(Sigma)(終濃度2ug/ml),混勻,一起共轉染到HEK293ES懸浮細胞中,之后,置于搖床(135rpm,39℃,5%CO2)培養40min。轉染后的細胞繼續在135rpm,37℃,5%CO2搖床中培養,表達抗EGFR×CD3的四價抗體。轉染96小時后離心收獲表達上清。
b)四價雙特異抗體的純化
表達上清用0.22uM濾膜過濾,利用親和層析柱從表達上清中獲得帶有Fc結構域的抗體。平衡緩沖液和洗脫緩沖液分別為50mM Tris-HCl0.15M NaCl PH7.0和0.1M檸檬酸-檸檬酸鈉PH3.0。通過陽離子交換層析獲得目標雙特異抗體,陽離子交換柱為HiTrap SP FF,通過平衡緩沖20mM PB PH6.3平衡SP層析柱,用洗脫緩沖液20mMPB+1M NaCl(PH6.3)進行洗脫,最后用PBS緩沖液進行換液濃縮。純化后的雙特異分子還原SDS-PAGE如圖3所示。其中Bispecific-1的EGFR抗體序列為尼妥珠單抗(nimotuzumab)序列;Bispecific-2的EGFR抗體序列為西妥昔單抗(Cetuximab);Bispecific-3的EGFR抗體序列為帕尼單抗(Panitumumab)。
具體實施例3:雙特異抗體分子與CD3和EGFR分子結合情況
用pH9.6的碳酸鹽緩沖液包被EGFR胞外區或者CD3E與CD3G亞基胞外區的二聚體,100ng/孔/100ul,4℃包被過夜。用300ul/孔含0.1%的PBS(PBS-T)緩沖液洗五次,再加入1%BSA-PBS溶液在室溫封閉2h。加入不同稀釋度的雙特異抗體或者是對應的抗體。各種雙特異抗體(或抗體)最高濃度是1uM,3倍稀釋做10個梯度,最后一個孔只加稀釋液PBS作為陰性對照,37℃孵育1h。用300ul/孔PBS-T溶液洗五次,再加入用1%BSA-PBS溶液1:40000稀釋的Anti-Human Fc-HRP二抗37℃孵育1h。用100ul/孔的TMB顯色試劑盒顯色,室溫顯色8min,然后用2M H2SO4終止顯色,50ul/孔,450nm/630nm讀數。實驗結果如圖4所示,所有雙特異抗體結合EGFR的能力均與其對應的單抗能力相似[即由尼妥珠單抗序列構建的雙特異抗體結合EGFR的能力與尼妥珠單抗的相似(圖4A);由西妥昔單抗序列構建的雙特異抗體結合EGFR的能力與西妥昔單抗的相似(圖4B);由帕尼單抗序列構建的雙特異抗體結合EGFR的能力與帕尼單抗的相似(圖4C)];而各種雙特異抗體結合CD3E和CD3G二聚體的能力相近(圖4D)。結果表明了文中采用的雙特異抗體的形式幾乎完整的保留了原先抗體結合抗原的能力;而且CD3的ScFv結合CD3的能力與其連接的不同抗體無關(圖4D)。
具體實施例4、雙特異抗體分子與過表達EGFR或CD3細胞結合情況
a)雙特異性抗體與A431細胞的結合情況
本發明采用過表達EGFR的腫瘤細胞系(A431)來檢測不同的雙特異抗體與細胞表面EGFR的結合情況,采用相對應的抗體做陽性對照,用人的IgG(hIgG)作為同型對照。用0.25%胰酶消化、離心收集A431細胞。同時稀釋各種抗體,最高濃度為1uM,3倍梯度稀釋。將收集的細胞用PBS+1%BSA洗三遍,再加PBS+1%BSA重懸細胞,然后鋪細胞于96孔板中,每孔1×105個細胞,加入100ul稀釋好的雙特異性抗體,室溫孵育1小時;離心去上清,用PBS洗細胞三遍,再用稀釋好的Alexa488標記的抗人IgG-Fc抗體重懸細胞,室溫避光孵育1小時,PBS洗三遍,再用100ul PBS重懸,用流式細胞儀檢測熒光強度。結果用Graphpad Prism分析。結果顯示(圖5),每種雙特異抗體與A431的結合能力與其對應的抗體具有可比性,而hIgG與A431的結合力很弱。證明雙特異抗體較好的保持了其母本抗體的特異結合細胞表面EGFR特異結合的活性。
b)雙特異抗體與Jurkat細胞結合情況
Jurkat細胞過表達CD3,可以用來檢測雙特異抗體與細胞表面CD3的結合情況。雙特異抗體與Jurkat細胞結合情況實驗過程與實施例4a類似,區別在于Jurkat細胞是懸浮細胞,而A431是貼壁細胞。離心收集Jurkat細胞,加入各種抗體,其余操作與A431實驗相同。結果顯示(圖6),同型對照結合Jurkat的能力很弱;不同的雙特異抗體均能夠很好的結合細胞,而且三種雙特異抗體結合Jurkat細胞的能力一致,表明了圖1的雙特異抗體中抗CD3的ScFv結合細胞表面抗原的能力不受與它連接的抗體影響。
具體實施例5、雙特異抗體分子介導的PBMC對效應細胞的殺傷作用
a)A431或H520細胞PKH26標記
A431是一種過表達EGFR的腫瘤細胞株;而H520則不表達EGFR。本實驗采用A431作為實驗細胞株;而H520作為陰性對照。
取2×106個細胞于1.5ml離心管中1500rpm離心5min,棄完全培養基,用無血清的培養基分別清洗細胞兩次;用PKH26試劑盒中的DiluentC溶液重懸細胞,然后加入等體積的2×P KH26染料液(配制比例:0.4μl染料原液溶于100μl的Diluent C),混勻后室溫放置1min。反應結束后,立即加入與管中溶液等體積的0.5%BSA-PBS溶液終止反應,再加入1ml相應的完全培養基稀釋重懸細胞,1500rpm離心5min收集細胞沉淀。用完全培養基重懸后與細胞培養瓶中培養待用。
b)PBMC分離
在50ml管中加入20ml單個核細胞分離液;用全血稀釋液將采集到的血液按1:1進行稀釋處理,混勻后沿康寧管內壁勻速緩慢的鋪至分離液上層,每管內加入稀釋后全血體積為20ml;待各管加液完畢后放入提前預冷至22℃的離心機內,600g水平離心15min(加減速設置為1);離心完成后取出離心管,用移液器小心吸取置于分離液和血清間呈圓弧狀分布的細胞層—單個核細胞(PBMC),置于新的50ml管中;按照1:5比例在細胞液中加入細胞洗滌液,充分混勻后離心,棄上清,再重復洗滌一次,收集細胞沉淀,用RPMI-1640培養基重懸,培養于細胞瓶中待用。
c)CD3+T細胞磁珠分選
PBS(Ph7.2,含0.5%BSA,2mM EDTA),過濾除菌,同時避免產生氣泡。
離心去血小板(20度,200g,10-15分鐘),然后30μm濾膜去除細胞團塊。收集PBMC細胞:200g離心10分鐘,棄上清。2x107細胞重懸于60μl buffer+20μl FcR Blocking Reagent中。加入20μl磁珠,混勻,2-8℃孵育15分鐘;加入1-2ml buffer,300g,離心10分鐘,棄盡上清;500μl重懸。將分選柱置于分選架上,500μl潤洗;加入細胞懸液,收集未結合細胞;柱體頂端液體流盡后,500μl洗三次;將分選柱從分選架上取下,置于收集管中,1ml快速沖洗,收集細胞,計數并觀察活細胞比例。
d)雙特異抗體效應功能檢測
按照終濃度1uM起,1:3倍比稀釋,10梯度,2復孔;同時設立2個無藥物對照孔,用培養基補足體積,將標記后的A431或H520細胞(2×104個/孔/50μl)與CD3+T細胞(2×105個/孔/50μl),按照所需用量混勻后分至V-bottom 96孔板各孔,同時設立以下三個流式對照孔:①無標記的Raji細胞(2×104個/孔)②PKH26標記后的細胞(2×104個/孔);③CD3+T細胞(2×105個/孔)。培養18小時,孵育結束后按照1:50000的比例加入TO-PRO3染料,37℃避光孵育10min;同時設立一個流式對照④TO-PRO3標記后的細胞。3000rpm離心5min后棄部分培養基上清,用0.5%BSA-PBS溶液重懸,流式檢測。
計算公式:
細胞死亡率%=(1-PKH26+TOPRO3-細胞數目(藥物作用組)/PKH26+TOPRO3-細胞數目(無藥物作用組))X100
e)結果分析
由圖7可知,雙特異抗體分子介導的PBMC對過表達EGFR的A431效應細胞有非常好的殺傷作用;而他們對應的抗體和hIgG則殺傷效果很弱。同時所有的雙特異抗體對不表達EGFR的H520細胞殺傷效果都非常弱,且與同型對照hIgG類似(圖8)。這表明了所有構建的雙特異抗體對靶細胞的殺傷作用是特異的;三種不同的雙特異抗體殺傷特異性靶細胞的能力相似,而且細胞死亡率在80%左右。以上表明了圖1中雙特異抗體具有良好的生物學活性。
以上所述僅為本發明的優選實施例而已,并不用于限制本發明,對于本領域的技術人員來說,本發明可以有各種更改和變化。凡在本發明的精神和原則之內,所作的任何修改、等同替換、改進等,均應包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 用于治療HBV感染和相關病癥的三特異性結合分子的制造方法與工藝
- 對磺胺類藥物具有特異性的固相微萃取纖維的制備方法與流程
- 一種檢測豬初乳中抗PEDV特異性IgA抗體的夾心ELISA試劑盒的制造方法與工藝
- 用于施用CD19xCD3雙特異性抗體的給藥方案的制造方法與工藝
- 雙特異性抗?VEGF/抗?ANG?2抗體及其在治療眼血管疾病中的應用的制造方法與工藝
- 特異性人EWS?FLI1融合蛋白抗體的制備方法及在制備尤文肉瘤診斷抗體試劑的應用與制造工藝
- 雙特異性四價抗體及其制造和使用方法與制造工藝
- 利用特異性揮發物篩選昆蟲相關嗅覺蛋白的方法與制造工藝
- 使用與表面偶聯的單特異性四聚抗體復合物組合物從樣品中分離出靶實體的方法與制造工藝
- 抗-WT1/HLA雙特異性抗體的制造方法與工藝