生物學雌性避孕藥的制作方法
本申請是2011年5月4日提交的同名發明專利申請201180022904.9的分案申請。
發明領域
本發明提供了工程化以表達抑制精子運動性,受精或其組合的抗體片段的共生生物,及含有所述共生生物的組合物。本發明提供了此類工程化共生生物或含有所述共生生物的組合物作為避孕藥的用途。
發明背景
需要開發新的避孕藥,以對所有個體提供方便的生育控制,而不受社會,財政或教育的限制。
盡管目前有許多不同的避孕藥可用,但沒有一種避孕藥是沒有問題的。到目前為止,最常用的避孕藥是口服的雌激素,孕酮,或其組合的制劑,盡管所述制劑是有效的,但已提示所述制劑在某些群體中在長期使用的情況下可能引起腫瘤。
屏障方法,如隔膜或子宮內裝置,顯示出降低的效果,以及不依從性(對于前者),和更大的盆腔炎性疾病的風險(在使用后者的情況下)。殺精子劑也被用于這方面,但其效果較差,并且,更高的性傳播疾病的風險與其使用相關。
因此,需要與上面的限制無關的、易于使用的微創(minimallyinvasive)避孕藥。
發明概述
在一個實施方案中,本發明提供了基因工程化的細胞,其產生抗精子抗原的抗體片段,并由此可以用作避孕藥。
在一個實施方案中,本發明提供了工程化的雌性生殖道共生細菌,其中所述細菌被工程化以表達抗精子的抗體或其片段,其能有效阻止精子運動性,精子-卵子融合或卵子的精子穿透,或其組合。在某些實施方案中,抗體片段是單鏈fv分子(scfv)。
在某些實施方案中,對精子抗原特異的抗體片段是來自人的或人源化的。在某些實施方案中,抗體片段與精子上頂體或質膜位置的抗原或其片段特異性相互作用。在某些實施方案中,抗體片段與精子頸部區域位置的抗原或其片段特異性相互作用。在某些實施方案中,抗體片段從工程化細菌中分泌,而在某些實施方案中,抗體片段與細菌細胞壁結合或相連接。
在某些實施方案中,工程化細菌是乳桿菌(lactobacillus),或在某些實施方案中,是乳球菌(lactococcus)。在某些實施方案中,工程化細菌是大腸桿菌(escherichiacoli)nissle1917株。在某些實施方案中,工程化細菌是戈登氏鏈球菌(s.gordonii)。在某些實施方案中,工程化細菌是詹氏乳桿菌(l.jensenii)或卷曲乳桿菌(l.crispatus)。
在某些實施方案中,scfv跟與seqidno:1或2有至少90%同一性的肽特異性相互作用。在某些實施方案中,scfv具有與seqidno:8有至少90%的同一性的序列。在某些實施方案中,scfv由多核苷酸編碼,該多核苷酸具有與seqidno:7有至少90%同一性的序列。
在某些實施方案中,本發明提供了包含本文所述的工程化細菌的組合物。在某些實施方案中,組合物是陰道栓劑,乳膏或泡沫的形式。在某些實施方案中,避孕藥與陰道環結合或包含于陰道環上。
在某些實施方案中,本發明提供了避孕的方法,所述方法包括將雌性對象生殖道細胞與在雌性對象中足以抑制或阻止精子運動性,精子-卵子融合或卵子穿透的量的本發明所述的工程化細菌相接觸的步驟。在某些實施方案中,依據該方面,該方法包括將足以抑制或阻止的量的包含工程化細菌的組合物施用到有此需要的雌性對象的生殖道中。
在某些實施方案中,本發明提供了降低雌性群體妊娠的發生率的方法,所述方法包括將雌性對象的生殖道細胞與在雌性對象中足以削弱,抑制或阻止精子運動性,精子-卵子融合或卵子穿透的量的本發明所述的工程化細菌相接觸的步驟,由此降低雌性的妊娠的發生率并由此降低雌性群體中的妊娠的發生率。
在某些實施方案中,本發明提供了降低雌性群體受精的發生率的方法,所述方法包括將雌性對象生殖道細胞與在雌性對象中足以削弱,抑制或阻止精子運動性,精子-卵子融合或卵子穿透的量的本發明所述的工程化細菌相接觸的步驟,由此降低雌性中的受精發生率并由此降低雌性群體中的受精的發生率。
在某些實施方案中,本發明提供了本發明描述的工程化細菌或組合物在制備用于降低雌性群體妊娠的發生率的藥物中的用途。在某些實施方案中,本發明提供了本發明描述的工程化細菌或組合物在制備用于降低雌性群體受精的發生率的藥物中的用途。
附圖簡述
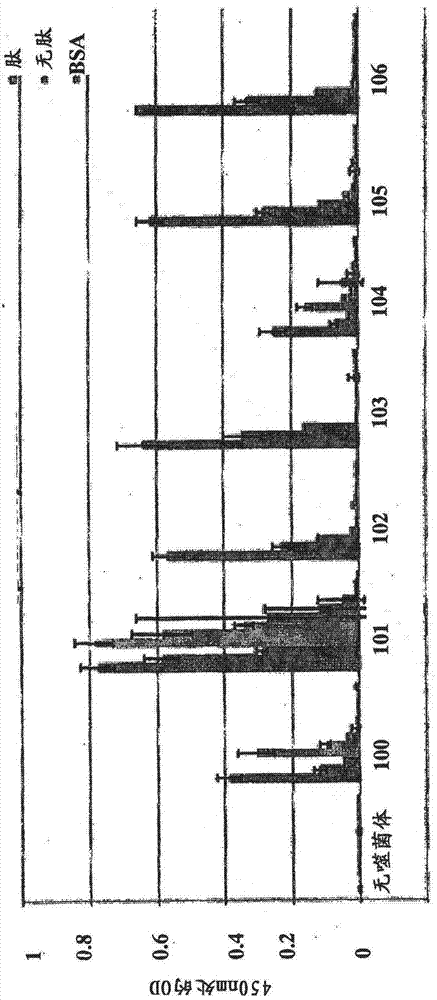
圖1以圖形方式描述了通過elisa測定法確定的,分離并克隆的噬菌體展示的scfv對精子肽的相對親和力。1-3列顯示了三種scfv與源于精子fa-1的肽的結合,而4-6列顯示了三種scfv與源于精子ylp(12)的肽的結合。bsa用作陰性結合對照。
圖2描述了分離并克隆的一些噬菌體展示的scfv對用作探針的(probed)精子肽的相對親和力。當與肽相關的od值更高(與bsa對照或未與肽溫育的樣品相比)時,克隆被認為具有高親和力。特別地,克隆102,103,105和106顯示出對于肽相對高的親和力,并且進一步描述了克隆102的體外和體內特征。
圖3以圖形方式描述了鑒定一系列非結合scfv的elisa結合測定的結果,這些非結合scfv隨后被用作對照與克隆102進行比較,如圖2所示,發現克隆102對用作探針的肽具有良好的親和力。在該情況下,通常使用一個這樣的scfv克隆,j112。也測試了對照a和b,其分別為不含有scfv噬菌體或不含有肽和scfv的樣品。通過測量樣品中的od(用抗噬菌體hrp標記的抗體(抗pviii的抗體)進行探測)來檢測結合。
圖4a是pslp111.1載體的質粒圖譜。圖4b是描繪質粒的ncoi和noti消化產物的照片。使用ncoi-和noti在37℃剪切質粒三小時。在幾個代表性克隆中清楚地顯示了質粒插入物。
圖5a分別描述了j102的核酸和氨基酸序列(seqidno:7-8)。圖5b描述了j102scfv中的各個結構域。
圖6描述了表達j102的乳桿菌與鼠精子在體外的特異性結合。圖6a是顯示表達scfv的乳桿菌與小鼠精子的顯著結合的光顯微照片,幾乎每個進行評價的精子細胞都顯示顯著的染色。圖6b是表達j112的乳桿菌(用作對照)的光顯微照片,其中沒有明顯可見的與鼠精子的結合。
圖7以圖形方式描述了表達j102的乳桿菌的功效的體內證實。圖7a繪制了,在兩個試驗中被施以表達抗精子scfvj102的詹氏乳桿菌或表達不結合精子的scfv(j112)的對照乳桿菌的雌性小鼠的妊娠率;在每個試驗中,相對于j112處理的小鼠,j102處理的小鼠中顯示出了有效的避孕。圖7b繪制了,如圖7a所述進行的兩個試驗的每一個試驗中的幼崽總數和每籠幼崽數目;與對照相比,在表達j102的詹氏乳桿菌的情況下,幼崽總數和每籠幼崽數目都被減少。
發明詳述
在一個實施方案中,本發明提供了重組的細胞(在一個實施方案中,其包括微生物在內),以及使用其以產生殺精子化合物的方法。在一個實施方案中,所述方法和細胞提供了有效的避孕方法。
在一個實施方案中,重組的細胞是雌性生殖道共生生物。在一個實施方案中,共生生物是細菌。
在一個實施方案中,重組的細胞是非哺乳動物細胞,其存留在雌性生殖道粘膜中足以表達干擾精子運動性,精子-卵子融合或卵子的精子穿透的化合物的一段時間。在某些實施方案中,當在被處理對象的雌性生殖道中由定殖于此的共生生物表達時,化合物在所述對象中導致降低的繁殖力。在某些實施方案中,當在被處理對象的雌性生殖道中表達時,化合物在施以這樣的共生生物的群體中導致降低的妊娠率。
在一個實施方案中,本發明提供了表達殺精子化合物的工程化共生生物,此類生物能夠定殖于雌性生殖道或其區域之中。
在一個實施方案中,細胞被工程化以表達核酸片段,所述核酸片段包括編碼序列之前(5’非編碼序列)和之后(3’非編碼序列)的調節序列,且能夠被表達為特定蛋白。
可以通過本領域技術人員知曉的任何方法,將基因工程化的細菌工程化為在特定基因中具有缺陷,或者可以通過本領域已知的方法,將工程化生物工程化以過表達特定基因。
在一個實施方案中,將構建體引入本發明的細菌,以便能夠為基因敲除過程選擇細菌中的同源重組事件。本領域普通技術人員可以容易地設計敲除構建體,包括陽性和陰性選擇基因,以有效選擇經歷該構建體的同源重組事件的轉染的細胞。
在另一個實施方案中,基因表達、活性和功能的變化,尤其是基因表達的增強,減弱,和消除,可以使用整合入細胞基因組的基因構建體來實現。在另一個實施方案中,基因表達,活性和功能的變化可以使用染色體外的基因構建體來實現,并且在一個實施方案中,該構建體保持在染色體外。
在一個實施方案中,術語構建體或載體是指,含有已亞克隆入載體中的目的序列的核酸運載工具。
為了產生本發明的載體,可以將編碼目的序列的多核苷酸連接入適于轉導/轉化原核細胞并在轉導/轉化的細胞內指導重組產物表達的合適的表達載體系統。應當理解,可以通過常用的重組技術容易地修飾此類合適的載體系統,以替換,復制或突變已有的啟動子或增強子序列和/或導入任何另外的多核苷酸序列,例如編碼另外的選擇標記的序列或者編碼報告基因的序列。
根據另一個實施方案,載體進一步包括調節元件,如調節分離的核酸的表達的啟動子。已知此類啟動子為轉錄所需的順式作用序列元件,因為其用于結合dna依賴性rna聚合酶,而該酶轉錄位于其下游的序列。在另一個實施方案中,載體可以包括誘導型啟動子,或組成性表達目的序列的啟動子。
本發明的載體可以進一步包括復制起點,并可以在多于一個種類的原核細胞中增殖,并且在某些實施方案中,可以構建載體以便于其在所選擇的生物的基因組中整合。在其他實施方案中,如技術人員所理解的,載體可以是例如質粒,桿狀病毒穿梭載體(bacmid),噬菌粒或噬菌體,或任何適合的載體。
此類載體的實例在下文實施例部分描述并使用。然而,技術人員將理解,本發明不限于任何此類載體的使用,并且本領域中為了優化插入或納入的序列(載體用作所述序列的基因遞送/工程化運載工具)的異源表達的目的,創建新的載體和/或修飾已有的載體是常規的。
適合使用的載體的一些例子包括:m.posno等,applenvironmicrobiol.1991june;57(6):1822-1828;mshimizu-kadota等,applenvironmicrobiol.1991november;57(11):3292-3300;t.duong等,microbialbiotechnologyvolume4,issue3,pages357-367,may2011;vvaleshin等,mikrobiologiiavolume:69,issue:1,pages:75-80;x.liu等,antimicrobialagentsandchemotherapy2006,vol.50,no.10,pp.3250-3259;wo/2005/112567;lucavangelista等,antimicrobialagentsandchemotherapy,july2010,pp.2994-3001,vol.54,no.7;美國專利7,179,458;美國專利7,754,467;carenj.chancey等.thejournalofimmunology,2006,176:5627-5636;美國專利5,733,540等。
可以通過本領域公知的多種方法來實現在細胞中納入所需核酸序列。可以使用核酸構建體來穩定或瞬時轉染或轉導細胞。
本領域中有許多已知的技術可以用于將載體導入本發明的細胞,例如但不限于,直接dna攝取技術,和噬菌體,質粒,線性dna或脂質體介導的轉導,受體介導的攝取,以及使用磷酸鈣介導的和deae-葡聚糖介導的導入方法的磁電穿孔(magnetoporation)方法,電穿孔或脂質體介導的轉染(關于進一步的細節,參見例如,"methodsinenzymology"vol.1-317,academicpress,currentprotocolsinmolecularbiology,ausubelf.m.等(編)greenepublishingassociates,(1989)和molecularcloning:alaboratorymanual,第二版,sambrook等.coldspringharborlaboratorypress,(1989),或其他標準實驗手冊)。還涉及使用核酸包覆的顆粒的轟擊。應當理解,可以使用任何此類方法來將需要的序列導入細胞,以產生本發明的細胞,和實施本發明的方法。
電穿孔已被成功用于轉化多種細胞。
也可以使用依賴于供體和受體細胞的直接接觸的細菌接合來將基因轉移入細菌。細菌接合過程可以包括,將“供體”和“受體”細胞互相緊密接觸地混合在一起。結合通過在供體和受體細菌間形成細胞質連接而發生,并且新合成的供體dna被直接轉移入受體細胞。接合中的受體通過水平轉移從供體細菌接收dna。接合轉移中的供體可以具有接合質粒,接合轉座子,或可移動的質粒。
在某些情況下,接合僅需要供體和受體。這發生在待轉移的質粒是接合的和可移動的自傳播質粒(即,攜帶tra基因和編碼mob蛋白的基因)時。通常,該過程包括下列步驟:1)雙鏈質粒dna在orit的特定位置上產生切口;2)單鏈dna通過孔或菌毛結構被釋放給受體;3)dna釋放酶(relaxase)在orit切割雙鏈dna并結合至釋放的5’末端(形成作為中間結構的松弛小體);和4)隨后,輔助蛋白復合體在orit裝配以促進dna轉移過程。
將供體質粒轉移到受體也可能需要“三親本”接合。在這種類型的接合中,涉及供體細胞,受體細胞,和“助手”質粒。供體細胞攜帶可移動的質粒或接合轉座子。可移動的載體含有orit(編碼切口酶的基因),并具有編碼mob蛋白的基因;然而,單獨的mob蛋白不足以實現基因組的轉移。因此,除非助手質粒提供適合的接合系統(位于供體中或“助手”細胞中),否則可移動的質粒不能夠促進自身的轉移。需要接合質粒來形成配合對并轉移dna,因為該質粒編碼參與孔或菌毛形成的轉移用蛋白(tra)。
當用于例如細胞,或核酸,蛋白,或載體時,術語“重組的”或“重組改變的”表示,已通過導入異源核酸或蛋白或者改變天然核酸或蛋白而修飾細胞,核酸,蛋白,或載體,或者表示,細胞源自如此修飾的細胞。因此,例如,重組的細胞表達在天然(非重組)形式的細胞中未發現的基因,或者表達在非重組細胞中異常表達,低表達或完全不表達的天然基因。
當用于核酸時,術語“異源”表示,核酸包含兩個或更多個的子序列,這些子序列在天然狀態下未發現與異源核酸中的關系相同的相互關系。例如,通常重組產生核酸,其具有兩個或更多個來自不相關的基因且被安排以產生新的功能性核酸的序列,例如來自一個來源的啟動子和來自另一個來源的編碼區。類似地,異源蛋白表示,蛋白包含兩個或更多個的子序列,這些子序列在天然狀態下未發現與異源蛋白中的關系相同的相互關系(如,融合蛋白)。
術語“表達盒”是重組或合成產生的核酸,其具有一系列允許特定核酸在宿主細胞中轉錄的特定的核酸元件。表達盒可以是質粒,病毒,或核酸片段的一部分。通常,表達載體包含可操作地連接至啟動子的待轉錄的核酸。
在另一個實施方案中,用于本發明的核酸包括,制自核苷酸類似物的rna或dna類似物。該術語包括由天然發生的核酸堿基,糖和共價核苷間(骨架)連接組成的寡核苷酸,以及具有類似作用的具有非天然發生部分的寡核苷酸。相比于天然形式,此類經修飾的或取代的寡核苷酸經常是優選的,因為其具有期望的性質,例如,增強的細胞攝取,增強的對核酸靶的親和力,在核酸酶存在時增加的穩定性和/或有效的基因沉默。
可以通過任何合成或重組過程,如本領域公知的過程來產生用于本發明的核酸。可以通過本領域已知的技術手段進一步修飾核酸,以改變生物物理學或生物學性質。例如,可以修飾核酸以增加其對抗核酸酶的穩定性(例如“封端”),或改變其親脂性,溶解性,或與互補序列的結合親和力。
也可以通過本領域已知的方法化學合成本發明的dna。例如,可以通過本領域已知的方法從四種核苷酸整體或部分化學合成dna。這樣的方法包括caruthers(1985)中描述的那些。也可以通過制備重疊的雙鏈寡核苷酸,填充間隙,并將末端連接在一起來合成dna(一般參見sambrook等.(1989)和glover等.(1995))。可以通過定點誘變從野生型dna制備表達蛋白的功能性同源物的dna(參見例如,zoller等(1982);zoller(1983);和zoller(1984);mcpherson(1991))。可以通過本領域已知的方法擴增獲得的dna。一種適合的方法是saiki等(1988),mullis等,美國專利號4,683,195,和sambrook等(1989)中描述的聚合酶鏈式反應(pcr)方法。
在另一個實施方案中,可以在克隆入載體,例如粘粒,噬菌體,質粒,或bac(細菌人工染色體)中的基因組dna上進行體外轉座。可以使用克隆入等位基因置換載體的基因組dna,在非天然具有能力的生物中進行類似的高密度誘變(參見例如,美國專利號6,207,384,所述方法可用于工程化本文描述的生物)。
就例如它們的轉化能力,表達異源蛋白的能力,和/或粘膜表面,來選擇適合的細菌宿主菌株。可使用標準技術,如氯化銣法或電穿孔,來使細菌宿主具有轉化能力(參見例如,wei等,j.microbiol.methods21:97-109(1995))。
可以通過修改例如luchansky等(j.dairysci.74:3293-3302(1991))中描述的標準方法來進行共生生物例如詹氏乳桿菌的電穿孔轉化。簡言之,在mrs培養基中培養新鮮接種的詹氏乳桿菌(如,在37℃和5%co2下培養到0.6-0.7的od600)。細菌細胞被收獲,清洗,并再懸浮于冷的蔗糖和mgcl2溶液中。隨后將感受態細胞與dna混合并進行電穿孔。然后,允許細胞恢復,然后將細胞涂板于含有抗生素等選擇劑的選擇性瓊脂平板上。隨后將工程化的細胞施用給對象,例如,以栓劑,乳膏或泡沫劑型。
任選地,在將本發明的細菌導入陰道之前,可以使用抗生素預處理來預清理原住細菌的粘膜表面(參見例如,freter等,infect.immun.,39:686-703(1983))。抗生素可以口服提供或直接施用至陰道。
在某些實施方案中,本發明提供了選擇按照本發明方法工程化的細菌菌株的非限制性方法,這些菌株能有效地定殖到施加細菌的粘膜表面上,該方法可包括,在動物或人粘膜層上重復選擇快速定殖的細菌。例如,將野生型細菌菌株施加到粘膜表面,并重復分離和體外培養所述細菌,在每一步都返回到粘膜表面。在某些實施方案中,依照這個方面,最終獲得具有增強的定殖能力的細菌。
在另一個實施方案中,本發明提供了按照本發明方法工程化細菌菌株的非限制性方法,這些菌株能有效地定殖到施加細菌的粘膜表面上,該方法可包括在重組細菌表面上表達融合蛋白。融合蛋白由與目的多肽連接的宿主結合結構域構成。宿主結合結構域允許細菌以高親和力與所選宿主粘膜表面上的某些決定簇(蛋白或碳水化合物)結合,由此賦予細菌超過原住菌群(microflora)的生存優勢。
另一個工程化本發明細菌菌株的示例性方法包括通過以噬菌體導入基因來誘導原住菌群表達異源蛋白。已經開發了多種噬菌體載體以用于不同細菌中。例如,可以使用基于溫和噬菌體adh的噬菌體載體(參見例如,raya等,j.bacteriol.174:5584-5592(1992)和fremaux等,gene125:61-66(1993))。該載體在確定的噬菌體(attp)和細菌(attb)附著位點上位點特異性整合入宿主染色體。類似地,可以使用乳桿菌特異性噬菌體來將載體或其他多核苷酸轉導入乳桿菌染色體。乳桿菌特異性噬菌體包括mv4(auvray等,j.bacteriol.,179:1837-1845(1997)),adh(fremaux等,gene126:61-66(1993)),gle(kakikawa等,gene175:157-165(1996)),以及屬于陰道乳桿菌分離株中的bradley組a或b的那些(kilic等,clin.diagn.lab.immunol.8:31-39(2001))。
也可以將不刺激粘膜上皮細胞的某些制劑加入到單位劑量的細菌中以輔助定殖。粘膜表面上的許多細菌分泌包膜材料,所述包膜材料聯合形成覆蓋整個粘膜表面的生物膜。添加消化該生物膜材料的酶以促進工程化細菌穿透生物膜(從而更成功地定殖)可能是有益的。這樣的酶包括dna酶,肽酶,膠原酶,透明質酸酶,和其他碳水化合物降解酶。也可以添加工程化細菌本身對其不易感的抗生素來降低粘膜表面原住細菌的數量,以便于工程化細菌的有效定殖。
使用p59(vandervossen等,appl.environ.microbiol.58:3142-3149(1992))或p23(elliot等cell36:211-219(1984))啟動子的異源多核苷酸或多肽的表達可以是組成型的。可選地,表達可以在誘導型啟動子的控制下。例如,芽孢桿菌淀粉酶(weickert等,j.bacteriol.171:3656-66(1989))或木糖(kim等gene181:71-76(1996))啟動子以及乳球菌乳鏈球菌素啟動子(eichenbaum等,appl.environ.microbiol.64:2763-2769(1998))可以用于驅動誘導型表達。此外,可以使用酸或堿誘導的啟動子。例如,可以使用在陰道的相對酸性的條件下具有活性的啟動子(例如,美國專利號6,242,194描述的那些)。可選地,可以使用由陰道中響應精液的變化來誘導的啟動子。例如,使用堿誘導的啟動子來響應由精液導入而引起的陰道的增加的堿性條件而誘導表達。
已知多種信號和錨定序列指導多肽至膜,胞外間隙或細胞壁表達(如,通過與肽葡聚糖共價連接)。示例性的信號序列包括,來自噬淀粉乳桿菌(lactobacillusamylovorus)的α-淀粉酶的信號序列(giraud&cuny,gene198:149-157(1997))或者來自卷曲乳桿菌的s-層基因(cbsa)的信號序列(例如,mkknlrivsaaaaallavapvaa(seqidno:3)或mkknlrivsaaaaallavatvsa(seqidno:4))。信號序列通常位于多肽的氨基末端。
錨定序列通常位于被編碼的蛋白序列的羧基末端。錨定序列包括例如,細胞壁結合序列;序列lpq(s/a/t)(g/a),其中括號中的殘基表示該位置的不同選項;和疏水序列,以及任選地,帶電荷的序列。在某些實施方案中,錨定序列包含:
vtrtinvvdpitgkistsvqtakftredknsnagytdpvtgkttmnpwtpakqglravnveqikgyvakvdgnvdavvvtpdsanmvvtityqankpegqnitnkkdtvpdpadgiknkddlpdgtkytwkevpdvnsvgektgivtvtfpdgtsvdvkvtvyvdpvvesnrdtlskeantgntnvakaatvtsskveskktlpqtgskteqvgilglaiatvgsllglgvnrkkrqk(seqidno:5);或,
kkaeevknnsnatqkevddatnnlkqaqndldgqttdkskldeaiksaddtkstdkynnasddtkskfdealkkaeevknnsnatqkevddatknlkqaqndldgqttnkdaindaikdannakgtdkynnasddtkskfddalkkaedvkndsnanqkevddatknlkntlnnlkgqpakkanliaskdnakihkqtllpqtgtetnpltaigiglmalgagifakkkrkddea(seqidno:6),或,
與seqidno:5或seqidno:6基本相同的序列。
可以使用標準方法確定多肽的正確定位和折疊。例如可以通過下述來獲得乳桿菌的細胞壁富集的級分:將細菌懸浮于緩沖溶液(如,25%蔗糖,1mmedta,10mmtris-hcl,ph8.0),隨后用細胞壁降解酶(如,溶菌酶和變溶菌素)進行處理,并接著以差速離心分離出得到的原生質體(piard等.,j.bacteriol.179:3068-3072(1997))。可以通過western印跡法來篩選級分,以確認在細胞壁中的表達。
也可以使用標準方法來確定表達的多肽的折疊和生物學活性。例如,使用對天然折疊的多肽特異的抗體的elisa測定可以用于確認多肽的折疊和三維結構。當然,生物學活性測定將依多肽的活性而變化。例如,對于與精子結合的多肽,可以使用標準結合測定來檢測表達的多肽。
當合成在宿主細胞中具有改善的表達的基因時,期望的是設計該基因,以便其密碼子使用頻率接近于宿主細胞的優選密碼子使用頻率。合成的基因的優選密碼子使用頻率與宿主細胞使用的頻率的百分比偏差可以通過下述來計算:首先確定單個密碼子的使用頻率與宿主細胞的頻率的百分比偏差,隨后獲得所有密碼子的平均偏差。
可以改變編碼特定多肽的多核苷酸序列,以與特定宿主的密碼子使用一致。例如,乳桿菌的密碼子使用可以用于衍生編碼本發明多肽并包含優選的乳桿菌密碼子的多核苷酸。宿主細胞所顯示的優選密碼子使用頻率,可以通過對宿主細胞表達的大量基因中的優選密碼子使用頻率求平均來計算。該分析優選限于宿主細胞高表達的基因。例如,pouwels&leunissen(nucleicacidsres.22:929-936(1994))提供了各種乳桿菌物種所顯示的高表達基因的密碼子使用頻率。密碼子使用表也可以通過因特網獲得。
在另一個實施方案中,本發明涉及的載體進一步包括編碼標記多肽的異源核酸序列的插入。標記多肽可以包括,例如,綠色熒光蛋白(gfp),ds-紅(紅色熒光蛋白),分泌型堿性磷酸酶(seap),β-半乳糖苷酶,螢光素酶,或任何數量的本領域技術人員已知的其他報告蛋白。
通過修飾來自維多利亞多管水母(aequoreavictoria)的天然發生的gfp的氨基酸序列,已經設計了多種具有有用的激發和發射光譜的多管水母相關的gfp(prasher等,1992,gene,111:229-233;heim等,1994,proc.natl.acad.sci.u.s.a.,91:12501-12504;pct/us95/14692)。
在一個實施方案中,將具有編碼殺精子化合物的序列的核酸轉移入異源生物,導致表達。
檢測表達產物的方法是本領域公知的,并且在一個實施方案中,可以包括,rna印跡,pcr,hplc,質譜,elisa,ria,或蛋白印跡分析[參見“cellbiology:alaboratoryhandbook”,volumesi-iiicellis,j.e.,編(1994);“currentprotocolsinimmunology”volumesi-iiicoliganj.e.,ed.(1994);stites等(編)]。
在某些實施方案中,可以將抗生素抗性盒導入本發明描述的生物中,作為確認導入的構建體的表達的標記物。在某些實施方案中,將抗生素易感盒導入生物,作為導入對象的構建體的安全方案,并且在某些實施方案中,用于消除避孕效果,促進安全方式懷孕,例如,通過給對象注射短療程抗生素治療(其清除生物學避孕藥)。
在某些實施方案中,本發明提供了表達殺精子化合物的工程化細胞。在一個實施方案中,殺精子化合物可以包括抗精子的抗體或其片段,其能有效阻止精子運動性,精子-卵子融合或卵子的精子穿透,或其組合。
抗體例如作為完整的免疫球蛋白或多種良好表征的片段存在。在某些實施方案中,scfv片段被考慮作為工程化生物,組合物,試劑盒的一部分,且用于本發明的方法中。在某些實施方案中,其他考慮的片段包括f(ab')2,一種fab'單體。fab'單體本質上是具有鉸鏈區的一部分的fab(見paul(編)fundamentalimmunology,第三版,ravenpress,ny(1993))。盡管各種抗體片段以完整抗體的消化進行定義,但技術人員理解,這樣的片段可以通過化學方法或通過使用重組dna方法從頭合成。因此,本發明中使用的術語抗體也包括通過修飾完整抗體而產生的抗體片段,或者使用重組dna方法從頭合成的抗體片段(如,單鏈fv(scfv))。
本發明描述了制備此類細胞的示例性方法,然而技術人員理解,任何殺精子化合物或化合物的組合可以在共生生物中重組產生。
在某些實施方案中,使用抗體片段,其在各種動物物種中是殺精子的,或否則抑制精子運動性,或精子-卵子融合能力或卵子的精子穿透。例如,在某些實施方案中,抗體片段,如scfv,與在動物物種和人中保守的高度保守的精子特異性表位特異性相互作用,從而可以在動物模型中進行體內效果測試,而相同抗體片段例如人scfv或其人源化形式的驗證可以在人體臨床試驗中進行。
在某些實施方案中,如本領域技術人員理解的,此類抗體/抗體片段可以如本發明中例舉的,或如xu,等archandrol.1994sep-oct;33(2):141-4;clarke等,archandrol.1995jul-aug;35(1):21-7;wo0107083a1;美國專利號5,830,472,5,753,231,5,227,160中描述的,或通過任何適合的方法來產生。工程化共生生物以表達這樣的化合物也可以通過任何方法,如pnas102:11993-11998(2003)中描述的方法來完成。
完全人的抗體/抗體片段用于人類女性的避孕是特別理想的。可以通過本領域已知的多種方法來制備人抗體/抗體片段,包括本發明中描述的,使用源自人免疫球蛋白序列的抗體/抗體片段文庫的噬菌體展示方法。參見美國專利號4,444,887和4,710,111;以及wo98/46645;wo99/50433;wo98/24893;wo98/16654;wo96/34096;wo96/33735;和wo91/10741,其各自以引用方式整體納入本文,并且包括下文提供的實施例。
應當理解,本文中引用的任何參考文獻被認為以引用方式整體納入本文。
也可以使用不能表達功能性內源免疫球蛋白,但可以表達人免疫球蛋白基因的轉基因小鼠來生產人抗體或抗體片段,例如scfv。關于這種生產人抗體的技術的概述,可參見lonberg和huszar,1995。關于這種生產人抗體和人單克隆抗體的技術以及生產此類抗體及其片段的方案的詳細討論,可參見例如,wo98/24893;wo92/01047;wo96/34096;wo96/33735;ep0598877;美國專利號5,413,923;5,625,126;5,633,425;5,569,825;5,661,016;5,545,806;5,814,318;5,885,793;5,916,771;5,939,598;其以引用方式整體納入本文。此外,公司如abgenix,inc.(freemont,calif.),kirin,inc.(japan),medarex(nj)和genpharm(sanjose,calif.)可使用與上面所描述的技術類似的技術來提供抗所選抗原的人抗體。
也可以通過davis等(美國專利號4,179,337)所描述的方法和偶聯劑來修飾本發明的抗體,以產生基本上不誘導免疫原性應答的抗體片段。
在某些實施方案中,本發明提供了包含本發明所描述的工程化細菌的組合物。
在某些實施方案中,組合物可以包含本發明所描述的工程化細菌,其中組合物包含表達不同的異源抗精子劑的細菌,所述細胞包含于相同組合物中,作為施用的單位劑量的一部分。在某些實施方案中,表達不同的異源抗精子劑的此類細菌可以依對特定抗原或表位的特異性而變化,或者依片段所結合的抗原或表位而變化,或者依對表位的親和力而變化,或者依其所衍生自的同種型而變化,或依這些的組合而變化。
在某些實施方案中,此類組合物也可以包括表達相同或不同異源抗精子劑的不同細菌菌株,所述菌株也包含在相同組合物中,作為施用的單位劑量的一部分。
在某些實施方案中,組合物是陰道栓劑,液體,噴霧劑,泡沫,乳膏,摩絲,或任何適合陰道遞送的運載體的形式。
在某些實施方案中,工程化的細菌或含有其的組合物被施用至或包含于陰道環中,所述陰道環隨后被施用給雌性對象。在某些實施方案中,本發明涉及避孕套,其含有施用于避孕套外表面并且被保持的工程化的細菌或包含所述細菌的組合物,以便在性交期間避孕套的佩戴者可以將工程化的細菌轉移給其雌性伴侶。
在某些實施方案中,術語“包含”或其語法形式,是指含有所指示的活性劑,如本發明的工程化共生生物或者本發明描述的噬菌體,以及含有其他活性劑和制藥工業中已知的藥學可接受的載體,賦形劑,潤滑劑,穩定劑等。在某些實施方案中,術語“基本上由……組成”是指這樣的組合物,其僅有的活性成分是所指示的活性成分,即本發明描述的工程化共生生物,但還可以包括用于穩定,保存制劑等,但不直接參與避孕效果的其他試劑/組分/化合物。在某些實施方案中,術語“基本上由……組成”可以指這樣的組分,其通過與工程化共生生物的機制不同的機制發揮避孕效果,其增強避孕效果或延長避孕效果或具有這兩種效果。在某些實施方案中,術語“基本上由……組成”可以指這樣的組分,其促進工程化共生生物的釋放(例如通過增強工程化共生生物從栓劑制劑或其他制劑中釋放),促進有效定殖,促進均勻定殖,和其他想要的效果,其促進工程化共生生物的活性,但并非工程化共生生物的組分。在某些實施方案中,此類試劑可以包括,誘導編碼的抗精子劑表達的試劑,或在某些實施方案中,增強編碼的抗精子劑表達的試劑。在某些實施方案中,術語“組成”是指這樣的組合物,其含有活性成分和藥學上可接受的載體或賦形劑。
工程化細菌至期望的粘膜表面的遞送,依賴于該區域的可到達性和局部條件。例如,工程化細菌可以被置于鹽溶液,乳膏,栓劑中或者泡沫中以遞送到陰道粘膜上。泡沫可以包括,如一種或多種疏水改性的多糖,如纖維素和殼聚糖。纖維素包括,例如,羥乙基纖維素,羥丙基纖維素,甲基纖維素,羥丙基甲基纖維素,羥乙基甲基纖維素等。殼聚糖包括,例如,下面的殼聚糖鹽;殼聚糖乳酸鹽,殼聚糖水楊酸鹽,殼聚糖吡咯烷酮羧酸鹽,殼聚糖衣康酸鹽,殼聚糖煙酸鹽,殼聚糖甲酸鹽,殼聚糖乙酸鹽,殼聚糖沒食子酸鹽,殼聚糖谷氨酸鹽,殼聚糖馬來酸鹽,殼聚糖天冬氨酸鹽,殼聚糖乙醇酸鹽,和季胺取代的殼聚糖及其鹽等。泡沫也可以包括其他組分,例如水,乙醇,異丙醇,甘油,丙三醇,丙二醇,和山梨糖醇。任選地,殺精子劑可包括于細菌組合物中。泡沫和泡沫遞送運載體的其他例子描述于例如美國專利號5,595,980和4,922,928中。
在某些實施方案中,細菌可以作為栓劑或子宮托來遞送,參見例如,美國專利號4,322,399。在某些實施方案中,本發明的細菌在例如美國專利號6,468,526中描述的保存基質中制備,并且在由可溶聚合物材料和/或就溶解特性選擇的復合碳水化合物材料制成的可溶元件中遞送,以便其在使用前基本保持固體形式,并且在使用時由于人的體溫和濕度而溶解,并以期望的定時釋放和劑量來釋放藥劑材料。參見例如,美國專利號5,529,782。細菌也可以在如美國專利號4,693,705中描述的海綿遞送運載體中遞送。
在某些實施方案中,需要定期重復將工程化細菌應用于粘膜表面;優化的給藥間隔可以常規地確定,但會隨不同的粘膜環境和細菌菌株而變化。在某些實施方案中,給藥間隔可以在每天一次到每2-4周或更長時間一次之間變化。在某些實施方案中,根據雌性月經周期進行施用,以便施用在月經停止或近似停止之后進行,從而在由此處理的雌性排卵之前優化定殖。
在導入噬菌體以轉化天然乳桿菌的某些實施方案中,可以操縱所選噬菌體的核酸,以便異源基因替換編碼噬菌體衣殼蛋白的基因,從而使噬菌體是復制缺陷的。將這些重組dna分子加入含有功能性噬菌體蛋白的細胞裂解液,將導致攜帶異源基因的功能性噬菌體顆粒的組裝。隨后這些復制缺陷型噬菌體顆粒可以被導入到所需的粘膜表面上以感染所選的細菌菌群。通常的劑量是施加到粘膜表面的108-1012pfu/ml。溶液與處理的表面的比率應接近0.1=1.0ml每平方厘米粘膜表面。運載體與上文描述的細菌運載體類似。
在某些實施方案中,本發明提供了避孕的方法,所述方法包括,將雌性生殖道細胞與本發明描述的工程化細菌接觸的步驟。在某些實施方案中,依據該方面,所述方法包括,將含有工程化細菌的組合物(在某些實施方案中,包括本發明描述的組合物)施用到有此需要的雌性對象的生殖道中。在某些實施方案中,本發明也提供了,將雌性生殖道與本發明描述的噬菌體接觸,其又導致共生菌群的原位工程化,以獲得本發明描述的工程化細菌。
在某些實施方案中,術語“接觸”或“施用”是指直接和間接暴露于所指材料。
在某些實施方案中,施用到雌性生殖道的劑量可以為105-109個重組細菌。在某些實施方案中,針對特定宿主或群體優化劑量。在某些實施方案中,此類優化的劑量可以為107-109個重組細菌,或106-108個重組細菌,或108-109個重組細菌。
證明有效避孕的各種方法是本領域已知的,所有這些方法被認為可用于本發明,其中的某些方法在本文中進行了例舉。
在一個實施方案中,通過評價施用了本發明避孕藥的雌性動物每繁殖周期產生的后代數,來確定本發明生物學避孕藥的避孕效果。例如,在對例如小鼠施用生物學避孕藥1到3天后,將雌性小鼠個體與雄性小鼠置于籠中。隨后在交配后1-7天之間移走雄性小鼠。然后每天觀察雌性小鼠的幼崽出生。通過施用后妊娠的減少和/或每窩產仔數目的減少來確定施用的避孕藥的避孕效果。例如對于每窩平均產生3個或更多個后代的動物物種(例如,如下文例舉的,當使用遠親雜交品系時,小鼠平均每窩產生11個或更多個后代),如果妊娠率或每窩產仔數目降低10%-100%,30%-100%,或50%至100%,或60%-100%,70%-100%,或80%至100%,或90%-100%,或95%-100%,或更多,則避孕蛋白可以被認為是有效的。如本發明中例舉的,當評價表達j102的詹氏乳桿菌菌株的避孕效果時,觀察到至少50%的避孕效果,而且,由于本文進行的定殖研究顯示乳桿菌在約50%的小鼠中良好定殖,因此預期,已知更易于接受乳桿菌定殖的其他動物將具有更高的避孕效果。
如果每窩產仔數目降低至少50%,則避孕藥被認為是有效的,因此,圖7表明產生了有效的生物學雌性避孕藥,其包括表達抗精子劑的工程化共生生物。
在某些實施方案中,可以通過測量粘膜分泌物中表達的抗體的水平來確定本發明避孕藥的有效性。也可以,例如在性交后收集的分泌物中,通過以免疫組化技術觀察與精子結合的抗體來評價避孕藥的有效性。
如本文中例舉的,當將表達抗精子scfv的詹氏乳桿菌定殖到小鼠時,觀察到50-58%之間的妊娠率的降低,并且每籠和由此每小鼠產生的后代數目的同時降低也很顯著。
在一個實施方案中,表達抗精子劑的共生生物可以被進一步工程化,以表達有效對抗被處理雌性中引起性傳播疾病的生物的感染的試劑。在一個實施方案中,如本領域技術人員理解的,引起性傳播疾病的生物是衣原體,hiv,hpv等等。
在一個實施方案中,有效對抗被處理雌性中引起性傳播疾病的生物的感染的此類試劑,可以干擾所述生物的感染,或在另一個實施方案中,此類試劑可以降低感染幾率或感染負荷。在某些實施方案中,此類試劑可以干擾生物感染的發病機制。應理解,在該方面設想了有效對抗被處理雌性中引起性傳播疾病的生物的感染的任何試劑的進一步摻入,并且其被視為本發明的一部分。
依據這方面,在某些實施方案中,本發明的避孕藥可以被視為組合的避孕-抗-std療法。
盡管預期本發明的工程化共生生物可以被進一步工程化,例如以表達抗衣原體scfv,或者抗hpv或抗hivscfv,或者其他抗hiv試劑,例如藍藻抗病毒蛋白(cyanovirin),但應理解,雌性生殖道中野生型乳桿菌定殖的存在提供抗std感染的保護。還預期,本發明的表達抗精子劑的工程化生物,與單獨的野生型乳桿菌相比,在降低使用本文描述的此類生物的雌性群體中的性傳播疾病的發生率方面,一樣有效,或在某些實施方案中,更有效。
應當理解,適用于本發明的任何或所有方法的本文描述的任何實施方案,被視為本發明的一部分。本說明書中引用的所有出版物和專利申請以引用的方式納入本文,如同每一個單獨的出版物或專利申請被明確和單獨地指明以引用方式納入本文。
本領域技術人員理解,可以在其中進行形式和細節的各種變化,而不背離附屬的權利要求書中所示的本發明的精神和范圍。通過使用不超過常規的試驗,本領域技術人員將認識到或能夠確認本文描述的本發明具體實施方案的許多等同形式。此類等同形式意欲包括在權利要求書的范圍中。
應理解,除非有相反指示或者根據上下文可以明顯得出,否則本文中涉及物品的詞如“a”“an”和“the”表示一個或多于一個。除非有相反指示或者根據上下文可以明顯得出,否則如果一個,多于一個,或所有組成員存在于,用于,或以其他方式與給定的產品或方法相關,那么在組的成員間包括“或”或者“和/或”的權利要求或描述被認為是滿足的。本發明包括這樣的實施方案,其中確切的一個組成員存在于,用于,或以其他方式與給定的產品或方法相關。本發明也包括這樣的實施方案,其中多于一個或全部的組成員存在于,用于,或以其他方式與給定的產品或方法相關。此外,應當理解,除非另外指出或除非其對于本領域技術人員而言明顯引起矛盾或不一致,否則本發明在各種實施方案中提供了所有的變化,組合,及排列,其中來自一個或多個所列的權利要求的一個或多個限定,要素,子句,描述性術語等被引入從屬于相同基礎權利要求的另一個權利要求。當要素以列表(如馬庫什形式等)存在時,應當理解,要素的每個亞組也被公開,并且可以從組中移除任何要素。應當理解,通常,當發明或發明的方面被稱為包含特定要素,特征等時,本發明的某些實施方案或本發明的某些方面由或基本上由這樣的要素,特征等組成。為了簡單起見,在本發明的言語中未明確陳述這些實施方案的每一種情況。為方便起見,某些權利要求以從屬權利要求的形式存在,但申請人保留以獨立權利要求的形式重寫任何從屬權利要求(以包括該權利要求所從屬的獨立權利要求和任何其他權利要求的要素或限定)的權利,并且這樣重寫的權利要求被認為在所有方面等同于從屬權利要求,無論其在以獨立權利要求的形式重寫之前是何種形式(修改或未修改的)。
下文意欲以舉例說明的目的提供材料,方法和實施例(作為實施/執行本發明的方式),而不意欲是限制性的。
實施例
一般來說,本文使用的術語和本發明中使用的實驗方法包括分子,生化,微生物和重組dna技術。此類技術已在文獻中得到詳細解釋。參見例如,"molecularcloning:alaboratorymanual"sambrook等,(1989);"currentprotocolsinmolecularbiology"volumesi-iiiausubel,r.m.,編.(1994);ausubel等,"currentprotocolsinmolecularbiology",johnwiley和sons,baltimore,maryland(1989);perbal,"apracticalguidetomolecularcloning",johnwiley&sons,newyork(1988);watson等,"recombinantdna",scientificamericanbooks,newyork;birren等(編)"genomeanalysis:alaboratorymanualseries",vols.1-4,coldspringharborlaboratorypress,newyork(1998);美國專利號4,666,828;4,683,202;4,801,531;5,192,659和5,272,057中描述的方法;"cellbiology:alaboratoryhandbook",volumesi-iiicellis,j.e.,編(1994);"currentprotocolsinimmunology"vplumesi-iiicoliganj.e.,編(1994);stites等(編),"basicandclinicalimmunology"(第八版),appleton&lange,norwalk,ct(1994);mishell和shiigi(編),"selectedmethodsincellularimmunology",w.h.freeman和co.,newyork(1980);可使用的免疫測定法在專利和科技文獻中得到廣泛描述,參見例如,美國專利號3,791,932;3,839,153;3,850,752;3,850,578;3,853,987;3,867,517;3,879,262;3,901,654;3,935,074;3,984,533;3,996,345;4,034,074;4,098,876;4,879,219;5,011,771和5,281,521;"oligonucleotidesynthesis"gait,m.j.,編(1984);"nucleicacidhybridization"hames,b.d.,和higginss.j.,編(1985);"transcriptionandtranslation"hames,b.d.和higginss.j.編(1984);"animalcellculture"freshney,r.i.,編(1986);"immobilizedcellsandenzymes"irlpress,(1986);"apracticalguidetomolecularcloning"perbal,b.,(1984);以及"methodsinenzymology"vol.1317,academicpress;"pcrprotocols:aguidetomethodsandapplications",academicpress,sandiego,ca(1990);marshak等,"strategiesforproteinpurificationandcharacterization-alaboratorycoursemanual"cshlpress(1996),所有這些文獻以引用方式納入本文,如同在本文中進行了完整的描述。其他的一般參考在本文件中提供。其中的方法被認為是本領域公知的并被提供以方便讀者。其中包含的所有信息以引用方式納入本文。
實施例1
抗人精子抗體的制備
通過將p3-x63-ag8-653小鼠骨髓瘤細胞與來自balb/c小鼠(其用tergitolnp-40去垢劑溶解的人附睪精子免疫)的淋巴細胞融合,來制備抗人精子抗原的單克隆抗體。在間接免疫熒光法中,就對甲醇固定的精子是頂體陽性的和對未固定的精子是質膜陽性的,測試得自注射了這些雜交瘤的小鼠的腹水。驗證抗體與鼠和兔精子的交叉反應性。
如所述的(naz,r.k.等procnatlacadsciusa(1986)83(15):5713-7),通過使用單克隆抗體ma-24的免疫親和層析,從脫氧膽酸或者二碘水楊酸鋰溶解的小鼠睪丸中純化受精抗原,fa-1。如上制備另外的抗fa-1單克隆抗體,并且也驗證其與人和兔精子的交叉反應性。
實施例2
抗人精子抗體的克隆
rna制備:
選擇分泌殺精子或減少精子細胞運動性的抗體的雜交瘤細胞。將細胞培養并計數,以便使用fasttrack2.0試劑盒(invitrogen)處理1千萬個細胞以收集rna。使用去垢劑裂解和蛋白降解緩沖液從細胞中直接分離總rna。隨后使用其中mrna結合到oligodt樹脂上的修改的aviv和leder方案分離poly(a)+rna。隨后用低鹽緩沖液清洗樹脂以去除多余的總rna,且poly(a)+rna被從樹脂上洗脫。260nm和280nm處的光譜分析指示poly(a)+rna的終濃度。
poly(a)+rna的反轉錄和擴增
鑒定抗體的表位識別區域和互補決定區(cdr),并設計作為探針檢測ig重鏈和輕(κ)鏈亞單位的寡核苷酸。
重鏈寡核苷酸獲自ig-prime試劑盒(novagen),并用dh2o稀釋到1.0μg/μl的終濃度。
使用promega的accessrt-pcr系統在單個反應中進行各雜交瘤poly(a)+rna的反轉錄和聚合酶鏈式反應擴增。簡言之,將5μg雜交瘤poly(a)+rna,1μg每條適合的引物(用于重鏈的引物1和2,用于輕鏈的引物3和4),1μl10mmdntp混合物,10μl5×amv反轉錄緩沖液,2μl25mmmgso4,1μlamv反轉錄酶,1μltfl聚合酶和30μl無核酸酶的dh2o在0.5ml的微量離心管中混合。依照標準方案進行pcr反應并優化循環溫度和時間。在瓊脂糖凝膠上分析擴增的產物,并進行凝膠純化。
抗體克隆和測序
將經凝膠純化的產物亞克隆到適合的載體上,所述載體產生高產量的產物。將載體,緩沖液,cdna和t4dna連接酶在室溫下孵育1小時,并隨后在65℃加熱10分鐘。使用超級感受態(supercometent)大腸桿菌細胞,將dna加入到細胞中并在冰上孵育,隨后在42℃加熱,并加入soc培養基。隨后細胞在37℃搖動水浴中孵育1小時。然后將這些細胞涂布在含選擇化合物的lb皮氏培養皿上并在37℃孵育過夜。選擇陽性克隆并培養以純化質粒。
依照制造商說明書,使用qiagen-tip20柱純化質粒。
為了確認cdna插入物在純化的質粒中的存在,以適合的限制性內切酶消化每個克隆,并且將消化產物在瓊脂糖凝膠上電泳。對含有插入物的克隆進行測序。
重鏈和輕鏈克隆的序列分析
依照制造商說明書,使用fidelity試劑盒(oncor)測序陽性克隆。測序反應物由質粒dna,引物(如位于pcr-script載體5’克隆位點上游的t3引物),和dh2o組成,其被加熱到95℃5分鐘,加入退火緩沖液,隨后反應物在37℃孵育15分鐘。通過添加反應緩沖液,33pαatp,t4dna聚合酶和dh2o來標記反應物,并在400℃孵育15分鐘,隨后加入a,c,g或t終止混合物并在40℃孵育5分鐘。通過加入蛋白酶k溶液來終止反應,并在加載于丙烯酰胺測序凝膠上之前將其加熱到95℃。凝膠隨后在2000伏下電泳2小時,在whatman3mm濾紙上在真空下干燥,并在室溫下暴露至x射線膠片過夜。在膠片顯影后,在燈箱上判讀凝膠。
也可以使用自動化dna測序儀(如abiprism377)進行測序。對于每個克隆,將cdna和引物與四種染料標記的雙脫氧核苷酸以及amplitaq聚合酶fs混合。將整個反應物加載到單個泳道中,在36cm便于讀取的5.0%丙烯酰胺凝膠上電泳。用激光掃描與ccd相機成像來實現單獨的電泳片段的實時檢測。
表達載體的構建
獲得如mccrackena.等(2000)arch.microbial.173:383-389;perez-casal,j.等(2003)mol.microbiol.8:809-819;krugerc.等(2002)naturebiotechnology20:702-706;rao,s.等(2005)pnas102:11993-11998;liux.等(2006)antimicrobialagentsandchemotherapy50:3250-3259;delriob.等(2008)clinicalandvaccineimmunology15:1429-1435;美國專利號7,312,076,或歐洲專利號1011721b1中描述的表達載體,或者其變體可以通過本領域已知的方法制備。
可選地,如下構建載體:
通過將大腸桿菌復制起點從pbluescript亞克隆到骨架載體(fons,m.,等(1997)plasmid37,199-203)中,并隨后去除全長的m6編碼區(psti)來創建穿梭載體。將該質粒用smai消化,用ndei部分消化,用dna聚合酶i(klenow片段)填充并自連接。得到的質粒含有與乳桿菌兼容的復制起點(repa)和陽性選擇標記,如抗生素抗性基因,并已用于在多種乳桿菌物種中表達異源蛋白。
將擴增的抗體片段克隆入載體
將對應于重鏈和輕鏈的擴增產物凝膠純化并重懸浮于dh2o中。可以通過組裝pcr(stemmerw.p.等,(1995)gene164:49-53)重新編碼(recode)抗體,以更密切符合最佳乳桿菌密碼子使用。
通過pcr擴增來構建表達盒,并將其亞克隆入載體的適合位點。表達盒含有四種組件,包括乳桿菌兼容性啟動子元件,抗體片段,用于分泌的信號序列或細胞壁錨定結構域。在每種組件之間從5'到3'端分別放置獨特的限制性位點。通過使用pfudna聚合酶來進行每個組件的pcr擴增。通過用5'-gtggagctccccgaaaagccctgacaaccc-3'和5'-ggaaacacgctagcactaacttcatt-3'引物擴增來產生來自乳酸乳球菌(lactococcuslactis)的p23啟動子(vandervossen,j.m.,等(1987)appl.environ.microbiol.53,2452-2457)。為指導抗體的分泌,設計引物以擴增在5'和3'末端分別具有獨特位點的,從推定的核糖體結合位點到信號肽酶切割位點的卷曲乳桿菌s-層基因(cbsa)序列。隨后,對應于mkknlrivsaaaaallavapvaa的擴增的s-層信號核苷酸序列(cbsass)被消化并用于克隆到表達盒中。
將產物連接到載體中,將taa終止密碼子插入到錨定基序的n-末端以確保分泌。在轉化到乳桿菌菌株中之前進行序列驗證。
乳桿菌轉化
細菌菌株和培養。卷曲乳桿菌,格氏乳桿菌(l.gasseri)和詹氏乳桿菌等的天然發生的人陰道分離株可以從健康志愿者的陰道拭樣獲得,或者可選地,可以使用商業上可獲得的菌株,將其在37℃(5%co2/95%空氣)下用deman,rogosaandsharpe(mrs)培養基或rogosasl培養基(difco)培養。對于蛋白表達分析,也使用medium199(invitrogen)。通過電穿孔將質粒導入大腸桿菌dh12s(invitrogen)中。為了保持質粒,在37℃將轉化的大腸桿菌dh12s在補充了紅霉素(300μg/ml)的lb培養基(difco)中培養。基本上如對于格氏乳桿菌所描述的(luchansky,j.b.,tennant,m.c.&k1aenhammer,t.r.(1991)j.dairysci.74,3293-3302),通過電穿孔將質粒轉化入詹氏乳桿菌中。轉化的詹氏乳桿菌在含有20μg/ml紅霉素的液體培養基中常規地增殖。
如下文所述探測工程化乳桿菌的抗精子活性。
實施例3
一系列抗精子scfv的產生
文庫構建
使用人scfv絲狀噬菌體展示文庫,以分離抗精子蛋白的人vh-vl緊密聯系(tethered)的可變結構域。使用根據在vbase(http://vbase.mrccpe.cam.ac.uk)獲得的序列而設計的引物并按照barbas&lerner(barbas,bain等1992procnatlacadsciusa89(10):4457-61;gram,marconi等1992procnatlacadsciusa89(8):3576-80;zebedee,barbas等1992procnatlacadsciusa89(8):3175-9;barbas,amberg等1993gene137(1):57-62),winter(hawkins,russell等1992jmolbiol226(3):889-96;hawkins和winter1992eurjimmunol22(3):867-70;hoogenboom,marks等1992immunolrev130:41-68;hoogenboom和winter1992immunolrev130:41-68;marks,griffiths等,1992biotechnology(ny)10(7):779-83;marks,hoogenboom等,1992jbiolchem267(23):16007-10;marks和winter1992behringinstmitt(91):6-12;orlandi,gussow等,1992biotechnology24:527-31;tomlinson,walter等1992jmolbiol227(3):776-98)和benhar實驗室(azriel-rosenfeld,valensi等2004jmolbiol335(1):177-92)之前描述的技術來制備人scfv文庫。使用人脾臟和外周血淋巴細胞cdna作為模板,進行抗體基因的pcr擴增。在該文庫中,人重鏈和輕鏈可變結構域的庫被以組合的方式聯系在一起,以產生所有可能的vh-vl人工結合分子的組合,所述人工結合分子與m13絲狀噬菌體p3基因融合,隨后融合的蛋白在噬菌體表面上展示(通常平均每個噬菌體單個拷貝)。
精子抗原
分別從精子抗原fa-1和ylp(12)設計肽。下面的肽1是從抗原fa-1設計的35個殘基的肽,而下面的肽2是ylp(12)肽。所述肽被生物素化以易于與下面所述方法中的磁珠結合。由于肽序列相對較短,肽2在生物素與肽之間加入了連接物。如下文所述,針對兩種肽篩選噬菌體展示scfv文庫。
抗體篩選
文庫儲備物在lb+amp(100μg/ml)+1%葡萄糖中在37℃下培養。加入助手噬菌體m13ko7,并且培養物與助手噬菌體一起在100μg/mlamp+30μg/mlkan存在下在30℃孵育過夜。以4000rpm旋轉培養物10分鐘,上清通過0.45微米過濾器過濾,加入1/5體積的peg/nacl,將濾液置于冰上最少1小時,隨后以4000rpm旋轉30分鐘,之后將含噬菌體的沉淀物懸浮于pbs中。以4%bsa封閉噬菌體最少30分鐘,并按照r.kontermann和s.dubel(編),antibodyengineeringvol.1,springer-verlagberlinheidelberg2010,pages267-287中描述的方案,完成基于磁珠的抗體選擇。以2%bsa進行封閉最少30分鐘。將封閉的珠粒加入封閉的噬菌體中,然后取出珠粒,由此取出結合鏈霉親和素的所有噬菌體。隨后將封閉的噬菌體與生物素孵育30分鐘,接著與珠粒孵育30分鐘,之后棄去珠粒。
將噬菌體與下列肽孵育1小時:
acgvsrpviacsvtikegsqlkqqiqsiqqsierl(seqidno:1)-----生物素;和ylpvgglrrigg(seqidno:2)----ahx---并隨后與珠粒孵育30分鐘,清洗并洗脫。隨后將中和的洗脫液與dh5αf+細胞在37℃混合60分鐘并在lb+100μg/mlamp+1%葡萄糖平板上培養過夜。淘選的步驟被重復多個循環。
抗體片段特異性
使用肽作為探針進行elisa測定,并通過o.d.評估片段相對親和力。
將用淘選出的噬菌體(如上所述)感染的大腸桿菌tg-1鋪板以產生個體菌落。將這些菌落挑入平底無菌96孔板的孔中的100μlytag培養基中并在30℃,以150rpm搖動培養。將10μl噬菌體轉移到含有90μlytag+2.5μl/ml(5x108cfu)m13ko7助手噬菌體的新鮮96孔板中,并在37℃在不搖動的情況下培養30分鐘,隨后以150rpm搖動培養30分鐘。板在4000rpm,14℃下離心5分鐘,棄去上清。加入200μl/孔的ytak(含有卡那霉素)并將板在30℃,150rpm下搖動培養過夜。隨后細菌平板在4000rpm,4℃下離心5分鐘,然后將與100μlpbst混合的100μl上清用于elisa。
將100μl/孔的抗原和對照抗原鋪于elisa平板上4℃過夜,以包被平板。elisa平板用清洗緩沖液(300μl/孔的pbst)清洗一次,并用3%牛奶/pbs在室溫下(rt)封閉1小時。平板用清洗緩沖液清洗一次。隨后向平板中加入噬菌體并在室溫下孵育1小時,接著以清洗緩沖液清洗3次。加入50-100μl/孔的hrp綴合的抗噬菌體,稀釋的抗m13噬菌體抗體,并在室溫孵育1小時。在用清洗緩沖液清洗3次之后,加入100μl/孔的opd底物溶液,在室溫下孵育20分鐘。隨后以50ml1mhcl溶液終止反應,在450nm處讀板。使用辣根過氧化物酶(hrp)標記的抗噬菌體抗體實現檢測,使用自動化elisa讀取器讀取從底物-酶反應得到的顏色。
另一個elisa方案用2μg/mlbsa-生物素(在pbs中)在室溫下包被平板2小時。平板用pbst清洗并隨后用2μg/ml鏈霉親和素(在pbs中)在室溫下包被2小時,并再次用pbst清洗。平板隨后用2μg/ml的肽在pbs中在4℃包被過夜,用pbst清洗一次并用3%牛奶/pbs溶液在37℃封閉1小時,該方案的其余部分與上述方案相同,除了平板用50μl/孔的在sddw中稀釋4倍的tmb(四甲基聯苯胺)終止試劑顯影,并在5分鐘后用50μl/孔的1mh2so4終止之外。
結果
圖1以圖形方式描述了分離并克隆的噬菌體展示的scfv對用作探針的精子肽的相對親和力。1-3列顯示了三種scfv與源于fa-1的肽的結合,而4-6列顯示了三種scfv與源于ylp(12)的肽的結合。bsa被用作陰性結合對照。與對照相比,所述scfv顯示出顯著的對所指示的肽的親和力。圖2描述了分離并克隆的某些噬菌體展示的scfv對用作探針的精子肽的相對親和力。圖3顯示了鑒定一系列非結合scfv的elisa結合測定的結果,這些非結合scfv隨后被用作對照。在本文中,通常使用一個這樣的scfv克隆,j112。克隆j102顯示出比其他克隆以及對照a和b更大的親和力,對照a和b分別為不含有scfv噬菌體,或不含有肽和scfv的樣品。通過測量用抗噬菌體hrp標記的抗體(抗pviii的抗體)探測的樣品中的od來檢測結合。這些scfv中的一些隨后用于下面的實施例中,按照其所適合的,用作對照和避孕藥。
實施例4
表達scfv的工程化乳桿菌
抗體克隆和測序
按照既有方案,通過用ncoi和noti酶切消化,將scfv從噬菌粒基因組中釋放,以在噬菌體克隆中展示完整的scfv片段。將凝膠純化的產物亞克隆到dr.josseegers饋贈的pslp111.1載體中,其產生高產量的產物。圖4a中提供了載體的圖譜。通過用獨特的引物pcr擴增scfv來進行亞克隆,所述引物在5'引物上含有ncoi限制性位點而在3'引物上含有asci位點(5'-gcgccatggccgaggtgcagctgttg,3'-gcgggcgcgccccagcacagtgagtttggtccc)。凝膠純化擴增的dna,并且通過用ncoi和asci切割來激活限制性位點。隨后,限制性酶切的dna片段被再次凝膠純化,并且被連接到(使用t4連接酶)之前已用ncoi和asci酶切并凝膠純化的pslp111.1載體上。連接化合物用于轉化大腸桿菌dh5α,所述大腸桿菌dh5α用氯化鈣技術(maniatis)制備為感受態。將轉化的細菌涂布于lb瓊脂氯霉素平板上(10微克/ml),在孵育過夜后挑取菌落,并且從24個菌落中制備質粒dna。使用qiagenminiprep質粒試劑盒從這些菌落中制備質粒dna,并用ncoi和asci進行酶切,以鑒定含有適合大小的dna插入物的菌落。隨后如下文所述,將陽性克隆轉移到詹氏乳桿菌中。
依照制造商說明書,使用qiagen-tip20柱純化質粒。
為了確認cdna插入物在純化的質粒中的存在,以ncoi-asci消化每個克隆,并且將消化的產物在瓊脂糖凝膠上電泳。對含有插入物的克隆進行測序。
重鏈和輕鏈克隆的序列分析
通過weizman研究所的測序服務來測序陽性克隆,其中以按照制造商說明書的所有條件和試劑使用abi自動測序儀。使用的初始測序引物為:
正向ccatgattacgccaagcttgggagcc(seqidno:9)
反向gaattcaaccttcaaattgcc(seqidno:10)
將擴增的抗體片段克隆入載體
將凝膠純化的擴增產物亞克隆入載體的適合位點。表達盒含有四個組件,包括與乳桿菌兼容的啟動子元件,抗體片段,用于分泌的信號序列或細胞壁錨定結構域。
在轉化入乳桿菌菌株之前,進行序列驗證。
乳桿菌轉化
使用編號25258的詹氏乳桿菌菌株atcc人陰道分離株,并將其在37℃(5%co2/95%空氣)下用deman,rogosaandsharpe(mrs)培養基(difco)培養。通過氯化鈣技術將含有插入片段的pslp111.1導入詹氏乳桿菌。轉化的詹氏乳桿菌在含有10μg/ml紅霉素的液體培養基中常規地增殖。
精子結合和運動性測定
按照既有的方案分離小鼠精子[liuz等,journalofbiologicalchemistry(2010)285,2758-2770]。將106個精子懸于錐形管里的精子緩沖液(ham'sf-10,補充有21mmhepes;4mm碳酸氫鈉;0.6%人血清白蛋白;3.6ml乳酸鈉(60%儲備液)和慶大霉素:10微克/ml)中,以促進其游到管頂部的能力的方式保存精子,其中通過取出小體積(數百微升)的緩沖液來收集能動的精子。通過血球計數器驗證精子計數,并以1:1或1:2的精子:乳桿菌(cfu)的比率孵育精子。
分離小鼠精子,并通過使用噬菌體展示scfv的結合測定來評估scfv與精子的結合。如上所述的游動測定用于選擇能動的精子,其被分離并置于腔室玻片中,風干,隨后將含有目的scfv的噬菌體(108)應用于腔室中,并孵育1小時,清洗,隨后用以1:200稀釋的連接至hrp的抗-cp8抗體(enco,israel)探測精子,隨后清洗腔室,并以dab和過氧化物顯影。
結果
圖4b顯示了質粒的ncoi和noti消化產物。以ncoi-和noti在37℃酶切質粒3小時。
發現一種實施的scfv,j102具有對高度保守的精子抗原的高結合親和力。測序該克隆得到了如圖5a-5b中所示的完整dna和蛋白序列(seqidno:7-8)。
就與人和鼠精子的結合探測scfvj102等。盡管scfvj102是來自人的片段,但fa-1抗原的物種間的高度保守性導致j102能與鼠和人精子結合,如體外測定所確定的。圖6a顯示了表達scfv的乳桿菌與小鼠精子的顯著結合,其中幾乎每一個評價的精子細胞都顯示出顯著的染色,然而表達抗非精子抗原的scfv的對照乳桿菌未與鼠精子顯著結合(圖6b)。人精子結合研究與小鼠中的發現一致(數據未顯示)。
如上文方法部分中所描述的,以人精子進行運動性研究。雖然表達無關對照的乳桿菌在體外顯示對精子運動性的中度影響,但是當使用表達結合精子的scfv的乳桿菌時,觀察到削弱精子運動性的顯著效果,其包括在檢測scfvj102的效果的測定中發現,與對照相比,運動性降低了50%,這表明了表達結合精子的scfv的乳桿菌干擾精子功能的潛力。
實施例5
工程化詹氏乳桿菌的抗精子活性
受精的抑制
將各個物種的105個精子在相關和對照抗體(以1:50,1:5或1:1稀釋),或者產生對照和相關抗體的構建體的溶液中冷孵育過夜,然后加入卵子,此時允許精子與卵子的結合進行1小時。隨后清洗卵子,確定每個卵子結合的精子的數量,并將其表示為與對照樣品結合的精子數的百分數。進一步評價具有最大抑制百分數的構建體。
體內受精抑制研究
將純化的相關抗體片段,純化的對照抗體片段,表達相關抗體片段的工程化乳桿菌,和表達對照抗體片段的工程化乳桿菌注入雌性(小鼠,兔)陰道內。在將各種試劑施用到雌性陰道內后的多個點將1只雄性與2-4只雌性關在一起。分組后24小時,每日目視檢查雌性中陰道栓的存在。標記雌性以在它們之間進行區分(例如通過連續耳部打孔)和任選地,在交配開始后兩周,將雌性移到單獨的籠中。3周后,計數產仔的懷孕雌性和后代。隨后選擇具有最大避孕活性的構建體并進行進一步的評價/優化。
如下進行融合抑制測定。年輕雌性小鼠(8-10周齡)被腹膜內注射5個單位的在0.9%nacl中的孕馬血清(pms)。48小時后,小鼠被腹膜內注射5個單位的在0.9%nacl中的hcg(人絨毛膜促性腺激素)以觸發超排卵。注射hcg14-16小時后,收集排出的卵母細胞并用透明質酸酶處理以去除卵丘細胞。用蛋白酶混合物去除透明帶。將無透明帶的卵子在培養基中與指定濃度的肽孵育30分鐘[hogan,b.等,manipulatingthemouseembryo,91-101,(1986)]。從雄性小鼠附睪收集的精子通過孵育來催熟,并如fleming和yanagimachi[gameteres.4,253-273(1981)]所述進行頂體反應,然后在對照和相關抗體,和表達對照和相關抗體的構建體的存在下被加入到卵子中,并孵育15分鐘。隨后卵子被轉移到無精子培養基中,并孵育另外1小時45分鐘。隨后如primakoff等[j.cell.biol.104,141(1987)]所述,固定并染色卵子。隨后計數膨脹的精子頭部的總數。膨脹的精子頭部是精子和卵子已經融合的標志。
基于這些觀察,計算若干指數。通過將膨脹的頭部的總數除以卵子的總數來確定受精指數(f.i.)。受精率(f.r.)為受精的卵子的百分數。通過將實驗肽的受精指數除以對照肽的受精指數來確定抑制百分數。選擇具有最大活性的構建體。
實施例6
用作有效避孕藥的工程化的詹氏乳桿菌
按照實施例4中描述的方法,檢測其他動物物種。評價了兔,大鼠,豚鼠,迷你豬,猴子和其他物種。在該情況下,評價了數種構建體,并且注意動物物種的差異。在每個動物品系中確定每種構建體的有效性百分數。
此外,使用從驗證了繁殖力的雄性獲得的精液,對每個物種進行aif,其中評估了精子計數和運動性。陰道內施用表達相關和對照抗體片段的乳桿菌,并在施用后的不同時間進行aif。在人工授精時,通過注射例如100iuhcg來誘導排卵。在排卵和人工授精后,允許雌性完成懷孕過程以評估其潛在的致畸效果。
評價給雌性施用的乳桿菌對照和表達相關抗體片段的乳桿菌在生殖道中的持久性。
為此,通過將無菌pbs反復吹吸入陰道口來收集陰道分泌物。通過在微量離心機中短暫旋轉來混合液體和粘液,測定上清液中scfv的存在。通過elisa確定血清和陰道清洗物中的抗精子抗體片段的滴度。
進行時間進程研究。將施用了乳桿菌的雌性重復地與雄性關在一起,并評估妊娠率/避孕效果,將其作為施用后時間的函數。
實施例7
表達結合精子的scfv的詹氏乳桿菌是小鼠的有效避孕藥
小鼠施用和交配研究
用0.1ml/gm體重的氯胺酮溶液(濃度100mg/ml),0.5ml賽拉嗪(濃度20mg/ml)和8.5ml0.9%生理鹽水麻醉雌性icr小鼠。隨后麻醉的小鼠被陰道內施以108個新鮮培養的指數中期的(通過od來確定)工程化詹氏乳桿菌j102或對照j112株。(n=12只小鼠每組)。施用之后,雌性被保持仰面,骨盆向上傾斜30-60分鐘。每日給雌性施用乳桿菌,進行3天,隨后與年齡匹配的icr品系雄性交配。將雄性與雌性關在一起7天,在此期間將雄性每隔一天輪換,然后移走。然后目視評估雌性中栓的存在,記錄懷孕的小鼠的數目和每籠產生的后代的數目。
小鼠定殖研究
在第一次陰道內施用后12到24小時之間,雌性被以拭子擦拭或灌洗陰道,并將回收的樣品/液體涂布在含氯霉素的mrs平板上并在37℃培養24小時。菌苔的存在用作陰道定殖的指示。
結果
小鼠定殖研究表明,高達50%的灌洗液產生了菌苔,這表明,在單次陰道內施用后,高達50%的小鼠中發生了定殖。在通過擦拭來顯示定殖的動物中發現,施用的乳桿菌的陰道內持久性高至施用后5天。
進行兩個單獨的實驗,其中雌性被施以表達抗精子scfv的詹氏乳桿菌或對照菌株,并且在每個實驗中,都證實了有效的避孕(圖7a)。雖然在每個實驗中,92%的對照雌性懷孕,但是用表達抗精子scfv的詹氏乳桿菌處理的雌性顯示出妊娠率的明顯降低(58%或50%)。
作為施用表達抗精子scfv的詹氏乳桿菌的結果,總后代數目和每籠的后代數目,與對照相比,也降低(圖7b)。基于這些發現,與對照相比,被處理的雌性中每只小鼠的后代數目也降低。
實施例8
生物學避孕藥的安全性
評價工程化乳桿菌對陰道應激性的影響。以乳桿菌陰道內處理動物例如小鼠,每日一次,進行連續10-30天。隨后處死動物,并通過肉眼和顯微鏡檢查生殖道。
檢查陰道組織的上皮潰瘍,水腫,白細胞浸潤和血管充血,將其作為導入乳桿菌,和表達對照和相關抗體的工程化乳桿菌的函數。將用工程化乳桿菌處理的動物與施用了天然分離株的動物,以及未處理的動物相比較。如果存在的話,將注意到生殖道組織學的改善。
實施例9
避孕藥的可逆性
盡管重復交配但仍然沒有妊娠(由于施用乳桿菌)的雌性動物被施以抗生素并進行交配。評價妊娠,作為工程化乳桿菌的可逆性的量度。類似地,評價動物生殖道中乳桿菌的持久性。在指示工程化乳桿菌群體的減少或消失后,將動物進行交配,并確定它們的妊娠次數(gravidity)。
一旦已經在適合的動物模型中進行了安全性和有效性研究(例如,如上文所描述的),則隨后也考慮進行人體臨床試驗。
本說明書還包括下列內容:
1.基因工程化的雌性生殖道共生細菌,其中所述基因工程化的細菌被工程化以表達抗精子劑。
2.實施方式1的工程化細菌,其中所述抗精子劑是抗精子的scfv抗體片段。
3.實施方式2的工程化細菌,其中所述抗精子的scfv抗體片段是人的或人源化的。
4.實施方式2的工程化細菌,其中所述scfv抗體片段與頂體或質膜特異性相互作用。
5.實施方式2的工程化細菌,其中所述scfv抗體片段與精子頸部區域特異性相互作用。
6.實施方式2的工程化細菌,其中所述scfv抗體片段與精子fa-1抗原或其片段特異性相互作用。
7.實施方式2的工程化細菌,其中所述scfv抗體片段跟與seqidno:1或2具有至少90%同一性的肽特異性相互作用。
8.實施方式2的工程化細菌,其中所述scfv抗體片段具有與seqidno:8具有至少90%同一性的序列。
9.實施方式2的工程化細菌,其中所述scfv抗體片段由多核苷酸編碼,該多核苷酸具有與seqidno:7具有至少90%同一性的序列。
10.實施方式1的工程化細菌,其中所述共生細菌是乳桿菌。
11.實施方式8的工程化細菌,其中所述共生細菌是詹氏乳桿菌,卷曲乳桿菌或干酪乳桿菌。
12.實施方式1的工程化細菌,其中所述共生細菌是乳球菌。
13.實施方式1的工程化細菌,其中所述共生細菌是大腸桿菌nissle1917株。
14.實施方式1的工程化細菌,其中所述共生細菌是戈登氏鏈球菌。
15.包含實施方式1的工程化細菌的組合物。
16.實施方式15的組合物,其中所述組合物是陰道栓劑,海綿,乳膏或泡沫的形式。
17.實施方式15的組合物用于雌性避孕方法的用途。
18.實施方式15的組合物在制備用于降低雌性群體妊娠的發生率的藥物中的用途。
19.實施方式15的組合物在制備用于降低雌性群體受精的發生率的藥物中的用途。
20.實施方式1的工程化細菌在制備用于降低雌性群體妊娠的發生率的藥物中的用途。
21.實施方式1的工程化細菌在制備用于降低雌性群體受精的發生率的藥物中的用途。
22.插入陰道的裝置,其包含實施方式1的工程化細菌。
23.實施方式22的插入陰道的裝置,其中所述裝置是插入陰道的環。
24.避孕的方法,所述方法包括將雌性對象生殖道細胞與在所述雌性對象中能有效抑制或阻止精子運動性、精子-卵子融合或卵子穿透的量的實施方式1的工程化細菌相接觸的步驟。
25.實施方式24的避孕方法,所述方法包括將雌性對象生殖道細胞與在所述雌性對象中能有效抑制或阻止精子運動性,精子-卵子融合或卵子穿透的量的實施方式15的組合物相接觸的步驟。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種多孔硅光子晶體生物檢測方法與流程
- 流式細胞術檢測豬外周血T淋巴細胞亞群的方法與流程
- 一種醫療檢測用漂烘裝置的制造方法
- 利用真菌胞外酶與微生物交替進行的雙重強化采油方法與流程
- 一種用于EB病毒熒光定量PCR檢測的引物和探針組、及試劑盒的制造方法與工藝
- 一種用于鑒定川貝母及偽品的熒光PCR檢測引物、探針組合物、試劑盒及檢測方法與應用與流程
- 一種與水稻稻瘟病抗性基因緊密連鎖的分子標記、引物及其應用的制造方法與工藝
- 一種與油菜株高主效QTL位點qPHC2緊密連鎖的分子標記及應用的制造方法與工藝
- AUDG介導的多交叉置換擴增結合生物傳感的核酸檢測技術的制造方法與工藝
- 一種檢測CALR基因突變的內參擴增引物組合物及其擴增體系的制造方法與工藝
- 一種基于熒光PCR檢測ESR1基因突變的引物及探針的制造方法與工藝
- 一種用于檢測乳制品中熒光假單胞菌的分子標記及其應用的制造方法與工藝
- 一種用于檢測水產品中副溶血弧菌的分子標記及其應用的制造方法與工藝
- 一種用于檢測草莓灰霉病菌的分子標記及其應用的制造方法與工藝
- 一種用于檢測B族鏈球菌四環素耐藥基因的分子標記及其應用的制造方法與工藝
- 一種用于檢測糞腸球菌慶大霉素耐藥基因的分子標記及其應用的制造方法與工藝
- 一種用于檢測奶牛乳腺炎性金黃色葡萄球菌青霉素耐藥基因的分子標記及其應用的制造方法與工藝
- 與甘藍葉片表皮毛有無緊密相關的分子標記及其應用的制造方法與工藝
- 檢測黃杉大小蠹的引物、試劑盒及檢測方法與流程
- 一種用于紫斑牡丹與中原牡丹的分子鑒定方法與流程