一種消除PCR反應試劑自帶的內源核酸污染的方法與流程
本發明屬于生物
技術領域:
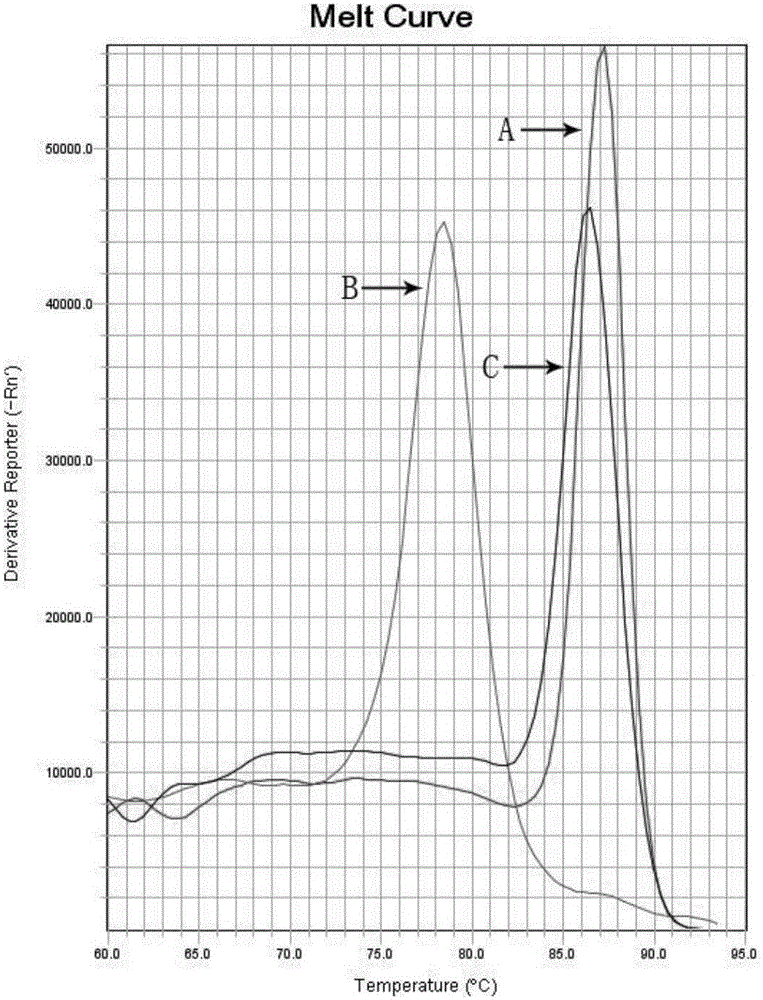
,涉及一種基于II型限制性核酸內切酶消除PCR反應試劑自帶的內源核酸污染的方法。技術背景聚合酶鏈式反應(Polymerasechainreaction,PCR),是現階段體外酶促合成特異DNA片段的一種常用且高靈敏度的方法。然而,過高的靈敏度使得PCR反應會因為核酸污染而產生假陽性結果,這是PCR方法面臨的最大問題。雖然最常見的PCR污染是產物污染,但是在配置PCR反應體系的各種原材料中也存在著能夠引起假陽性實驗結果的污染源。在PCR反應試劑中,DNA聚合酶主要來源于大腸桿菌工程菌株,目前市面上銷售的DNA聚合酶都不能保證其中沒有細菌DNA,只是DNA的拷貝數多與少的問題。同時,市面上銷售的dNTP也主要消化自細菌基因組DNA,因此也不能保證其中沒有基因組DNA的存在。因此,在進行實時熒光定量PCR時,在沒有產物污染的情況下,也存在由于設計的引物與內源核酸匹配而引起假陽性結果的可能。目前,常用的和主流的防污染方法主要針對PCR產物,對于反應原材料中攜帶性核酸污染的去除研究較少,主要是通過過濾的方式盡可能的去除內源污染。但是使用過濾法不能完全去除內源性核酸,同時還會產生大量的浪費。技術實現要素:本發明的目的是提供一種消除聚合酶鏈式反應體系原材料中自帶的內源污染,排除由于內源核酸而產生的PCR假陽性實驗結果。而本發明采取的利用II型限制性核酸內切酶建立的防止內源性污染方法既能夠去除內源核酸又不會產生不必要的浪費。本發明包括的實驗步驟:(1)、依據供貨商提供的資料確定DNA聚合酶和dNTP的來源菌株,利用NCBI數據庫,以來源菌株的種類為首選,對設計的引物進行序列比對,找尋潛在的結合位點,確認可能存在的污染片段。(2)、對污染片段進行酶切位點分析,找出序列中存在的限制性核酸內切酶,選取適宜的II型限制性核酸內切酶。(3)、將PCR反應體系在適宜的酶切溫度下孵育一段時間,從而使得所述的限制性核酸內切酶完全消化反應體系中存在的內源核酸污染。(4)、滅活PCR反應體系中的所述IIS型限制性內切酶,從而獲得II型限制性內切酶被滅活的PCR反應體系。(5)、對步驟(4)中獲得的PCR反應體系進行分裝機模板的添加,然后進行PCR擴增,當內源核酸污染被除去后,NTC空白對照將因為沒有模板而無法獲得PCR產物,顯示為陰性狀態。在優選例中,所述的污染是步驟(3)之前的,能夠干擾步驟(5)的實驗結果,源于反應原材料自有的內源核酸DNA。在優選例中,在步驟(3)中,在適宜的酶切溫度下的孵育時間為5-50分鐘,最佳地孵育時間為10-15分鐘。在優選例中,在步驟(4)中,最適的II限制性核酸內切酶的滅活溫度下的孵育時間為5-15分鐘,最佳地孵育時間為10分鐘。在優選例中,所述的II型限制性核酸內切酶選自下組:BamHI、DpnI、EcoRI、EcoRV、HindIII、KpnI、PstI、SacI、SalI、XbaI;本發明的有益效果:(1)、本發明方法可以消除PCR反應原材料中的內源核酸DNA,不影響正常擴增和特異性,不存在試劑的浪費;(2)、本發明方法可以單獨的對各反應原材料進行處理,也可以對配置好的PCR反應體系進行處理;(3)、本發明方法的反應體系仍然是PCR標準體系,若是對配置好的PCR反應體系進行處理,只需向原有的PCR體系中加入適宜的II型限制性核酸內切酶,不改變PCR反應程序即可消除內源性核酸污染。附圖說明圖1:實施例酶切消化特異性試驗結果,其中A為處理的PCR反應液加細菌DNA的實驗結果;B為處理的PCR反應液加無核酸無核酸酶水的實驗結果;C為未處理的PCR反應液加無核酸無核酸酶水的實驗結果。具體實施方法下面以具體實施例進一步闡明本發明。應理解,這些實施例僅用于說明本發明而不用于限制本發明的范圍。此外,應理解,在閱讀了本發明講授的內容之后,本領域的技術人員可以對本發明作各式改動,但這些等價形式同樣落于本申請所附權利要求書所限定的范圍。下列實施例未注明具體條件的實驗方法,通常按照常規條件,如:分子克隆操作手冊,或按照制造廠商所建議的條件。II型限制性核酸內切酶EcoRI為ThermoFisherScientific公司產品。實施例為了考察本方法對反應原材料攜帶的內源核酸DNA的去除效果,以處理的PCR反應液加大腸埃希菌DNA為陽性對照1,以未處理的PCR反應液加無核酸無核酸酶水為陽性對照2,以處理的PCR反應液加無核酸無核酸酶水為陰性對照進行PCR程序運行。1、引物設計依據NCBI數據庫中提供的大腸埃希菌的基因序列為模板設計引物,如下:上游引物:TCCTACGGGAGGCAGCAGT下游引物:GGACTACCAGGGTATCTAATCCTGTT2、PCR體系PCR體系(20ul)處理的PCR反應液(ul)未處理的PCR反應液(ul)10XTaqBuffer22dNTP(25mM)0.240.24正向引物(10uM)0.40.4反向引物(10uM)0.40.4模板22TaqDNA聚合酶(5U/ul)0.20.2SYBRGreen染料(10X)0.80.8EcoRI(1U/ul)0.025--水11.85511.96注:反應液分裝入反應管后再加入模板。3、反應參數(1)、反應液消化處理過程37℃10分鐘EcoRI消化配置的反應液中的內源核酸DNA80℃10分鐘滅活EcoRI(2)、分裝反應液,并分別向其中加入細菌DNA和無核酸無核酸酶的水。(3)、PCR運行程序Step195℃,10分鐘Step2(40循環)95℃,5秒;60℃,45秒Step3熔解曲線生成4、實驗結果為了評價本發明是否能消除反應原材料中的內源核酸污染,我們在上述條件下,將反應液分成3組用實時熒光定量PCR進行驗證,熔解曲線的實驗結果如圖1所示。其中A為處理的PCR反應液加細菌DNA的實驗結果;B為處理的PCR反應液加無核酸無核酸酶水的實驗結果;C為未處理的PCR反應液加無核酸無核酸酶水的實驗結果。由圖1可見,未經II型限制性核酸內切酶消化的PCR反應液能夠以原材料中自帶的內源核酸DNA為模板進行PCR擴增(C),使得實驗結果呈現假陽性。而經II型限制性核酸內切酶消化的PCR反應液因為沒有適合的模板進行PCR擴增(B),使得結果表現正常為陰性。同時,經II型限制性核酸內切酶消化的PCR反應液以細菌DNA為模板能夠進行正常的PCR擴增,表明PCR反應體系是可用的。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1