檢測禽流感病毒亞型的熒光定量PCR引物、探針和試劑盒及檢測方法與流程
本發明屬于生物工程技術領域,具體涉及檢測禽流感病毒的熒光定量PCR引物、探針和試劑盒及檢測方法。
背景技術:
流感病毒(influenza virus)屬正粘病毒科,其基因組為分節段的單股負鏈RNA,按照M蛋白和NP蛋白的特征,流感病毒分為甲(A)、乙(B)、丙(C)型,其中A型流感病毒除了感染人外,還可感染家禽,使感染的家禽患禽流感(avian influenza,AI)。根據AIV的血凝素(HA)和神經氨酸酶(NA)抗原差異,AIV可分為16個HA亞型(H1~H16)和9個NA亞型(N1~N9)。1918年西班牙流感由H 1N1亞型引起,造成約5000萬人死亡;1957年由H2N2亞型引起的“亞洲流感”造成約280萬人死亡;1968年由H3N2引起的“香港流感”造成約100萬人死亡。因此,流感病毒能給人類、自然和社會帶來嚴重的危害,所以,對流感病毒的鑒定和早期診斷是非常有重要的。
隨著分子生物的發展,熒光定量PCR技術廣泛應用于實驗室病毒病的診斷中,例如,張磊等人報道為了預防和控制北京地區甲型流感蔓延,采用實時熒光定量檢測方法對流感樣病例咽拭子中檢測甲型流感病毒,以了解甲型流感病毒在該地區的流行情況(2009~2010年北京地區甲型流感檢測分析,張磊,中國病原生物學雜志,2011,6(2),104~107)。而家禽中,主要流行的是H9N2、H5N1以及H7N3亞型流感病毒,具有致病性強,危害極大,高致病性禽流感可導致高達100%的發病率和病死率,并可直接感染人并致人死亡。秦智峰等人對致病性強的H5、H7、H9亞型禽流感病毒進行同時集成化快速檢測,結果與經典檢測方法的符合率達100%,但是檢測結果H5、H7、H9亞型的敏感性分別為1000、1000、500個拷貝數,敏感性較低。
技術實現要素:
有鑒于此,本發明的目的在于提供一種檢測禽流感病毒的引物、探針和熒光定量PCR檢測方法及應用,檢測敏感性高、特異性好,并且同時能進行H5、H7及H9亞型流感病毒分型鑒定。
為了實現上述發明目的,本發明提供以下技術方案:
本發明提供了檢測H5、H7和H9亞型流感病毒的多重熒光定量PCR引物和探針,所述引物和探針包括以下序列:
所述H9亞型流感病毒的探針具有如SEQ ID No.1所示的核苷酸序列;
所述H9亞型流感病毒的正向引物具有如SEQ ID No.2所示的核苷酸序列;
所述H9亞型流感病毒的反向引物具有如SEQ ID No.3所示的核苷酸序列;
所述H7亞型流感病毒的探針具有如SEQ ID No.4所示的核苷酸序列;
所述H7亞型流感病毒的正向引物具有如SEQ ID No.5所示的核苷酸序列;
所述H7亞型流感病毒的反向引物具有如SEQ ID No.6所示的核苷酸序列;
所述H5亞型流感病毒的探針具有如SEQ ID No.7所示的核苷酸序列;
所述H5亞型流感病毒的正向引物具有如SEQ ID No.8所示的核苷酸序列;
所述H5亞型流感病毒的反向引物具有如SEQ ID No.9所示的核苷酸序列。
本發明還提供了一種同時檢測H5、H7和H9亞型流感病毒的多重熒光定量PCR試劑盒,包括2×緩沖液、陽性質粒標準品和權利要求1所述的H5、H7和H9亞型流感病毒的引物對和探針。
優選的,還包括流感病毒M基因的正向引物、流感病毒M基因的反向引物和流感病毒M基因的探針。
優選的,所述流感病毒M基因的如SEQ ID No.10所示的探針核苷酸序列;所述M基因正向引物如SEQ ID No.11所示的核苷酸序列;所述M基因的反向引物如SEQ ID No.12所示的核苷酸序列。
優選的,包括2×緩沖液10ml,4nmol/μl正向引物4μl,4nmol/μl反向引物4μl,1nmol/μl探針4μl,共4種探針,陽性質粒標準品1ml。
本發明還提供了所述引物和探針或者所述的試劑盒檢測H5、H7和H9亞型流感病毒的方法,包括以下步驟:
(1)提取待檢測樣品的RNA,將所述RNA經反轉錄得到cDNA;
(2)以所述步驟(1)中的cDNA或者陽性質粒為模板,與探針建立反應體系,進行多重熒光定量PCR擴增,得到熒光曲線和Ct值;
(3)根據所述步驟(2)中得到的熒光曲線和Ct值,得到樣品中的流感病毒亞型類別。
優選的,所述多重熒光定量PCR擴增的反應體系:2×緩沖液10μl,40pmol/μl正向引物0.4μl,40pmol/μl反向引物0.4μl,10pmol/μl探針各0.2μl/種,共4種探針,陽性質粒標準品或樣品cDNA 1μl,補DEPC水至20μl。
優選的,所述多重熒光定量PCR擴增的反應程序:95℃變性5min,以95℃5s,54℃20s,40個循環,在54℃進行熒光檢測。
優選的,所述陽性質粒標準品的制備方法包括以下步驟:
A、分別提取H5、H7和H9亞型流感病毒樣本的總RNA;
B、將所述步驟A中得到的H5、H7和H9亞型流感病毒的總RNA分別進行反轉錄,得到H5、H7和H9亞型流感病毒的cDNA;
C、采用SEQ IDNo.13和SEQ ID No.14所示的核苷酸序列分別作為上游引物和下游引物擴增H5亞型流感病毒特異性目標片段,采用SEQ ID No.15和SEQ ID No.16所示的核苷酸序列分別作為上游引物和下游引物擴增H7亞型流感病毒特異性目標片段,采用SEQ ID No.17和SEQ ID No.18所示的核苷酸序列分別作為上游引物和下游引物擴增H9亞型流感病毒特異性目標片段,采用SEQ ID No.19和SEQ ID No.20所示的核苷酸序列分別作為上游引物和下游引物擴增流感病毒M基因的特異性目標片段,得到H5,H7,H9亞型流感病毒和流感病毒M基因特異性目的片段;
D、將所述步驟C得到的H5、H7特異性目的片段融合成H5-H7融合片段,將得到的H9和M基因特異性目的片段融合成一條H9-M融合片段,再將H5-H7融合片段和H9-M融合片段融合成一條H5-H7-H9-M片段,將所述H5-H7-H9-M片段連接到pMD18T載體上轉入大腸桿菌中,得到陽性質粒標準品。
優選的,所述步驟D中H5-H7融合片段的融合的體系為:2mmol/L超高保真DNA聚合酶緩沖液25μl,1U/μl的超高保真DNA聚合酶1μl,10mmol/L dNTP(每種)1μl,100ng/μl的H5亞型流感病毒的特異性目的片段1μl,100ng/μlH7亞型流感病毒的特異性目的片段1μl,10μmol/L上下游引物各2μl,滅菌水17μl,總體系為50μl。
優選的,所述步驟D中H9-M融合片段的融合的體系優選為用2mmol/L的超高保真DNA聚合酶緩沖液25μl,1U/μl超高保真DNA聚合酶1μl,10mmol/L的dNTP(每種)1μl,100ng/μl的H9亞型流感病毒的特異性目的片段1μl,100ng/μl的流感病毒M基因的特異性目的片段1μl,10μmol/L上下游引物各2μl,滅菌水17μl,總體系為50μl。
優選的,所述步驟D中H5-H7-H9-M片段的融合的體系優選為用2mmol/L超高保真DNA聚合酶緩沖液25μl,1U/μl的超高保真DNA聚合酶1μl,10mmol/L的dNTP(每種)1μl,100ng/μl的H5-H7融合片段1μl,100ng/μl的H9-M融合片段1μl,10μmol/L的上下游引物各2μl,滅菌水17μl,總體系為50μl。
本發明提供了檢測H5、H7和H9亞型流感病毒的多重熒光定量PCR引物和探針,所述引物結合探針能采用多重熒光定量PCR同時檢測H5、H7和H9亞型流感病毒具體為哪種亞型,不同亞型的引物之間互相沒有影響,并且特異性強,檢測靈敏度為10~50拷貝數,對靶序列可以準確定量、定性檢測,重復性好,可信度高。
本發明提供的一種同時檢測H5、H7和H9亞型流感病毒的多重熒光定量PCR試劑盒,包括緩沖液、引物對、探針和陽性質粒標準品,所述試劑盒能準確同時檢測待測樣品為H5、H7和H9亞型流感病毒中的哪種亞型;所述試劑盒檢測靈敏度為10~50拷貝數,敏感度高,特異性強,不僅能夠定性檢測還能定量檢測,滿足高標準的要求;所述試劑盒中各引物和探針不交叉,對檢測結果沒有任何影響。
本發明提供的所述引物和探針或者所述的試劑盒檢測H5、H7和H9亞型流感病毒的方法,具有特異性強,靈敏度高的特點,同時具有良好的穩定性。另外,本發明提供的方法采用基因融合的質粒做陽性標準品,避免多次更換陽性標準品的繁瑣操作,大大縮短檢測時間和檢測次數,樣品可在2小時內完成檢測,同時采用標準陽性質粒得到的標準曲線其相關系數R2=0.999,擴增效率均是109%,說明得到的標準曲線的線性關系很好,確保得到準確地檢測結果。
附圖說明
圖1為本發明實施例1中H9亞型流感病毒標準曲線;
圖2為本發明實施例1中H7亞型流感病毒標準曲線;
圖3為本發明實施例1中H5亞型流感病毒標準曲線;
圖4為本發明實施例1中流感病毒M基因的標準曲線;
圖5為本發明實施例1中H9亞型流感病毒的擴增曲線;
圖6為本發明實施例1中H7亞型流感病毒的擴增曲線;
圖7為本發明實施例1中H5亞型流感病毒的擴增曲線;
圖8為本發明實施例1中流感病毒M基因的擴增曲線;
圖9為本發明實施例3中引物探針具有特異性。
具體實施方式
本發明提供了檢測H5、H7和H9亞型流感病毒的多重熒光定量PCR引物和探針,所述引物和探針包括以下序列:
所述H9亞型流感病毒的探針具有如SEQ ID No.1所示的核苷酸序列;
所述H9亞型流感病毒的正向引物具有如SEQ ID No.2所示的核苷酸序列;
所述H9亞型流感病毒的反向引物具有如SEQ ID No.3所示的核苷酸序列;
所述H7亞型流感病毒的探針具有如SEQ ID No.4所示的核苷酸序列;
所述H7亞型流感病毒的正向引物具有如SEQ ID No.5所示的核苷酸序列;
所述H7亞型流感病毒的反向引物具有如SEQ ID No.6所示的核苷酸序列;
所述H5亞型流感病毒的探針具有如SEQ ID No.7所示的核苷酸序列;
所述H5亞型流感病毒的正向引物具有如SEQ ID No.8所示的核苷酸序列;
所述H5亞型流感病毒的反向引物具有如SEQ ID No.9所示的核苷酸序列。
本發明提供了檢測H5、H7和H9亞型流感病毒的多重熒光定量PCR引物和探針,所述引物具有特異性強、靈敏度高,對靶序列準確定性檢測,重復性好,可信度高的特點。
本發明中,所述引物和探針的來源均是利用引物設計軟件得到的。本發明中,所述引物設計優選包括以下步驟:根據GenBank中禽流感病毒AIV的H5、H7和H9亞型禽流感病毒血凝素基因序列,用DNAMAN軟件進行同源性分析,采用Primer Express5.0軟件,在其保守區域設計特異性引物和TaqMan熒光探針。
在本發明中,本發明對引物合成沒有特殊限制,采用本領域技術人員所熟知的合成方法即可。在本發明實施例中,所述特異性引物的合成委托專業的引物合成機構合成得到。
在本發明中,所述探針為TaqMan熒光探針。所述的TaqMan熒光探針標記一個報告熒光基團和一個淬滅熒光基團。
本發明中,所述報告熒光基團優選為FAM,JOE,Cy5和ROX,且4種探針標記不同的報告基團以區別不同亞型流感病毒熒光定量PCR的熒光信號;所述淬滅熒光基團優選為BHQ1和BHQ2。
本發明還提供了一種同時檢測H5、H7和H9亞型流感病毒的多重熒光定量PCR試劑盒,包括緩沖液、陽性質粒標準品和權利要求1所述的H5、H7和H9亞型流感病毒的引物對和探針。
本發明提供的所述試劑盒能準確同時檢測待測樣品為H5、H7和H9亞型流感病毒中的哪種亞型,所述試劑盒檢測敏感度高,特異性強,不僅能夠定性檢測還能定量檢測,滿足高標準檢測的要求。
在本發明中,所述試劑盒還包括流感病毒M基因的正向引物、流感病毒M基因的反向引物和流感病毒M基因的探針。所述流感病毒M基因的探針具有如SEQ ID No.10所示的核苷酸序列;所述M基因正向引物如SEQ IDNo.11所示的核苷酸序列;所述M基因的反向引物如SEQ ID No.12所示的核苷酸序列。所述M基因引物及探針參照禽流感病毒實驗室操作標準獲得。
在本發明中,所述試劑盒包括2×緩沖液。本發明對所述緩沖液的pH值沒有特殊要求,采用本領域技術人員所熟知的用于熒光定量PCR的緩沖液的pH值即可。
在本發明中,所述2×緩沖液優選包含Taq酶和dNTP的熒光定量PCR用緩沖液。本發明對所述緩沖液的種類沒有特殊限制,采用本領域技術人員所熟知的緩沖液的種類即可。本發明實施例中,所述緩沖液選用TaKaRa公司的Premix Ex Taq(probe qPCR)緩沖液,貨號為RR390。
在本發明中,所述試劑盒中提供了各組分的規格。本發明中,所述各組分的體積優選為2×緩沖液10ml,4nmol/μl正向引物4μl,4nmol/μl反向引物4μl,1nmol/μl探針各4μl,共4種探針,陽性質粒標準品1ml。
在本發明中,所述陽性質粒標準品的來源為發明人制備得到。
在本發明中,所述陽性質粒標準品的制備方法優選包括以下步驟:
A、分別提取H5、H7和H9亞型流感病毒樣本的總RNA;
B、將所述步驟A中得到的H5、H7和H9亞型流感病毒的總RNA分別進行反轉錄,得到H5、H7和H9亞型流感病毒的cDNA;
C、以所述步驟B得到的cDNA為模版,采用SEQ ID No.13和SEQ ID No.14所示的核苷酸序列分別作為上游引物和下游引物擴增H5亞型流感病毒特異性目標片段,采用SEQ ID No.15和SEQ ID No.16所示的核苷酸序列分別作為上游引物和下游引物擴增H7亞型流感病毒特異性目標片段,采用SEQ ID No.17和SEQ ID No.18所示的核苷酸序列分別作為上游引物和下游引物擴增H9亞型流感病毒特異性目標片段,采用SEQ ID No.19和SEQ ID No.20所示的核苷酸序列分別作為上游引物和下游引物擴增流感病毒M基因特異性目標片段,得到H5,H7,H9亞型流感病毒和流感病毒M基因特異性目的片段;
D、將所述步驟C得到的H5、H7特異性目的片段融合成H5-H7融合片段,將得到的H9和M基因特異性目的片段融合成一條H9-M融合片段,再將H5-H7融合片段和H9-M融合片段融合成一條H5-H7-H9-M融合片段,將所述H5-H7-H9-M片段連接到pMD18T載體上轉入大腸桿菌中,得到陽性質粒標準品。
在本發明中,所述步驟D中H5-H7融合片段的融合體系優選為:2mmol/L超高保真DNA聚合酶緩沖液25μl,1U/μl的超高保真DNA聚合酶1μl,10mmol/L dNTP(每種)1μl,100ng/μl的H5亞型流感病毒的特異性目的片段1μl,100ng/μl H7亞型流感病毒的特異性目的片段1μl,10μmol/L上下游引物各2μl,滅菌水17μl,總體系為50μl。
在本發明中,所述步驟D中H9-M融合片段的融合的體系優選為用2mmol/L的超高保真DNA聚合酶緩沖液25μl,1U/μl超高保真DNA聚合酶1μl,10mmol/L的dNTP(每種)1μl,100ng/μl的H9亞型流感病毒的特異性目的片段1μl,100ng/μl的流感病毒M基因的特異性目的片段1μl,10μmol/L上下游引物各2μl,滅菌水17μl,總體系為50μl。
在本發明中,所述步驟D中H5-H7-H9-M片段的融合的體系優選為用2mmol/L超高保真DNA聚合酶緩沖液25μl,1U/μl的超高保真DNA聚合酶1μl,10mmol/L的dNTP(每種)1μl,100ng/μl的H5-H7融合片段1μl,100ng/μl的H9-M融合片段1μl,10μmol/L的上下游引物各2μl,滅菌水17μl,總體系為50μl。
在本發明中,所述步驟D中融合的程序具體優選為:95℃預變30s;95℃變性15s,54℃退火15s,72℃延伸1min,擴增30個循環;72℃總延伸5min。
在本發明中,所述融合成H5-H7融合片段所用的引物優選為SEQ ID No.14所示的核苷酸序列和SEQ ID No.15所示的核苷酸序列進行融合。
在本發明中,所述融合成H9-M基因融合片段所用的引物優選為SEQ ID No.18所示的核苷酸序列和SEQ ID No.19所示的核苷酸序列進行融合。
在本發明中,H5-H7-H9-M融合片段所用的引物優選為SEQ ID No.16所示的核苷酸序列和SEQ ID No.17所示的核苷酸序列進行融合。
在本發明中,所述陽性質量標準品通過菌落PCR的方法進行驗證。本發明對所述菌落PCR的方法沒有特殊限制,采用本領域技術人員所熟知的菌落PCR的方法進行驗證即可。
得到陽性菌后,本發明將得到的陽性質粒標準品送樣測序以確定得到的陽性質粒標準品為包含有H5-H7-H9-M融合片段的陽性質粒,然后對陽性菌進行質粒提取,得到陽性質粒標準品。
得到陽性質粒標準品后,本發明對所述陽性質粒標準品進行濃度測定,得到一定拷貝數的陽性質粒標準品。
在本發明中,所述測定質粒濃度沒有特殊限制,采用本領域技術人員所熟知的質粒測定濃度的方法即可。在本發明,實施例中測定質粒濃度通過采用Eppendorf公司公司生產的型號為NanoDrop2000的核酸測定儀進行測定質粒濃度。
在本發明中,所述一定拷貝數的陽性質粒的計算公式優選為拷貝數(copies)=(質量/分子量)×6.0×1023。所述一定拷貝數的陽性質粒標準品的濃度為以10倍系列稀釋陽性質粒標準品至下限達100拷貝數/ul,上限達107拷貝數/ul。
在本發明中,所述正向引物是包括H5、H7和H9亞型禽流感病毒血凝素基因的正向引物和禽流感病毒M基因的正向引物。所述H5、H7和H9亞型禽流感病毒血凝素基因的正向引物和禽流感病毒M基因的正向引物盛裝在正向引物試劑瓶中,形成體積為4μl,質量濃度為4nmol/μl的正向引物,每種正向引物的濃度為1nmol/μl。
在本發明中,所述反向引物是包括H5、H7和H9亞型禽流感病毒血凝素基因的反向引物和禽流感病毒M基因的反向引物。所述H5、H7和H9亞型禽流感病毒血凝素基因的反向引物和禽流感病毒M基因的反向引物盛裝在一個反向引物的試劑瓶中,形成體積為4μl,質量濃度為4nmol/μl的正向引物,每種反向引物的濃度為1nmol/μl。
在本發明中,所述探針是包括H5、H7和H9亞型禽流感病毒血凝素基因的探針和禽流感病毒M基因的探針。所述H5、H7和H9亞型禽流感病毒血凝素基因的探針和禽流感病毒M基因的探針分別盛裝在單獨的試劑瓶中,共4瓶探針,每瓶探針的體積為1μl,質量濃度為1nmol/μl的探針。
本發明還提供了所述引物和探針或者所述的試劑盒檢測H5、H7和H9亞型流感病毒的方法,包括以下步驟:
(1)提供待檢測樣品的RNA,將所述RNA經反轉錄得到cDNA;
(2)以所述步驟(1)中的cDNA或者陽性質粒標準品為模板,與引物對和探針建立反應體系,進行多重熒光定量PCR擴增,得到熒光曲線和Ct值;
(3)根據所述步驟(2)中得到的熒光曲線和Ct值,得到樣品中的流感病毒亞型類別。
本發明提供的所述引物和探針或者所述的試劑盒檢測H5、H7和H9亞型流感病毒的方法,所述方法具有特異性強,靈敏度高、穩定性好的特點;同時檢測時間短,檢測次數少,得到的檢測結果準確度好。
首先提取待檢測樣品的RNA,將所述RNA經反轉錄得到cDNA。
在本發明的實施例中,所述檢測樣品為2015年4月到2016年1月采自浙江余姚地區的100份雞病變組織。
在本發明中,所述RNA提取的方法沒有特殊限制,采用本領域技術人員所熟知的RNA提取方法即可。本發明實施例中,所述RNA提取的方法采用的是Trizol法。
在本發明中,所述反轉錄具體步驟優選為:取總RNA 10.5μl加入20μl反轉錄體系中,所述反轉錄體系包含4μl 5×反轉錄緩沖液、2μl 10mmol/L dNTP、1μl 50mmol/L反轉錄引物、2μl 5μ/μl反轉錄酶和0.5μl 40μ/μl RNA酶抑制劑,輕輕混勻后于42℃水浴1h,最后冰浴2min,得到cDNA。
得到cDNA后,本發明以cDNA或陽性質粒標準品為模版,與引物對和探針建立反應體系,進行多重熒光定量PCR擴增,得到熒光曲線和Ct值。
在本發明中,所述引物對包括序列表中H9亞型流感病毒中SEQ ID No.2、SEQ IDNo.3所示核苷酸序列,H7亞型流感病毒中SEQ ID No.5、SEQ ID No.6所示核苷酸序列、H5亞型流感病毒中SEQ ID No.8、SEQ ID No.9所示核苷酸序列和流感病毒M基因中SEQ ID No.11、SEQ ID No.12所示核苷酸序列。
在本發明中,所述探針包括序列表中H9亞型流感病毒中SEQ ID No.1所示核苷酸序列、H7亞型流感病毒中SEQ ID No.3所示核苷酸序列、H5亞型流感病毒中SEQ IDNo.6所示核苷酸序列和流感病毒M基因中SEQ ID No.10所示核苷酸序列。
在本發明中,所述多重熒光定量PCR擴增的反應體系優選為:2×緩沖液10μl,40pmol/μl正向引物0.4μl,40pmol/μl反向引物各0.4μl,10pmol/μl探針0.2μl/種,共4種探針,陽性質粒標準品或樣品cDNA 1μl,補DEPC水至20μl。
在本發明中,所述多重熒光定量PCR擴增的反應程序優選為:95℃變性5min;以95℃5s,54℃20s,共40個循環,在54℃進行熒光檢測。
在本發明中,所述陽性質粒包含H5、H7和H9亞型流感病毒特異性片段和流感病毒M基因的特異性片段。
在本發明中,所述多重熒光定量PCR擴增優選在LightCycler96熒光定量PCR儀上,產自Roche Diagnostics公司。
得到熒光曲線和Ct值后,本發明根據得到的熒光曲線和Ct值,判斷樣品中的流感病毒亞型類別。
在本發明中,所述根據熒光曲線判斷樣品中的流感病毒亞型類別優選根據不同熒光曲線的熒光信號顏色和信號強度來判斷屬于流感病毒亞型的類別。
在本發明中,所述判斷的方法優選當Ct值>35循環為陰性,Ct值≤35循環為陽性。
下面結合實施例對本發明提供的檢測禽流感病毒亞型的熒光定量PCR引物、探針和試劑盒及檢測方法進行詳細的說明,但是不能把它們理解為對本發明保護范圍的限定。
實施例1
引物設計
根據GenBank中AIV的M基因以及H5、H7和H9亞型禽流感病毒血凝素基因序列,用DNAMAN軟件進行同源性分析,采用Primer Express5.0軟件,在其保守區域設計特異性引物和TaqMan熒光探針。其中,M基因引物及探針參照禽流感病毒實驗室操作標準獲得。將設計得到H5、H7和H9亞型禽流感病毒的引物對和探針和M基因引物對及探針委托上海生物工程公司進行合成。
RNA提取
取適量雞胚尿囊液,12000rpm離心5min,取500μl上清,向其中加入700μlTrizol,振蕩混勻,靜置10min,4℃12000rpm離心15min,取上清加入500μl異丙醇中,混勻,4℃靜置15min,15000rpm離心10min,棄上清,溫和用1mL75%乙醇洗滌沉淀,勿將沉淀重懸,7500rpm離心5min,控干盡量棄凈液體,加入20μl無核酸酶水,渦旋混勻,置于-80℃保存。
反轉錄
取總RNA 10.5μl加入20μl反轉錄體系中,其中包含4μl 5×反轉錄Bμffer、2μl dNTPmix(10mmol/L)、1μl 12bp引物(50mmol/L,5’-AGCAAAAGCAGG-3’)、2μlAMV反轉錄酶(5U/μl)和0.5μl RNA酶抑制劑(40U/μl),輕輕混勻后于42℃水浴1h,最后冰浴2min,然后用于熒光定量PCR或置20℃保存備用。
重組質粒的構建
M基因特異性引物和H5、H7、H9亞型特異性引物分別擴增各段基因,切膠回收,將4段基因按照H5、H7、H9和M基因的順序進行融合,首先將H5基因和H7基因融合,融合體系為:高保真酶緩沖液25μl,高保真酶1μl,dNTP 1μl,H5的特異性目的片段1μl,H7的特異性目的片段1μl,滅菌水21μl,總體系為50μl,按照下列程序進行融合:95℃預變30s,95℃變性15s,54℃退火15s,72℃延伸1min,擴增30個循環,72℃總延伸5min,切膠回收獲得H5-H7融合產物。H9基因和M基因按照以上體系及條件進行融合,獲得H9-M融合產物。將H5-H7融合產物和H9-M融合產物繼續按照如上所述條件進行融合,最終得到H5-H7-H9-M融合產物,并連接到pMD-18T載體上,菌液PCR驗證陽性者送測序。按照質粒提取說明書操作,抽提質粒。通過NanoDrop2000(Eppendorf公司)測定質粒濃度,測定DNA濃度后,按公式計算標準品的拷貝數,拷貝數(copies)=(質量/分子量)×6.0×1023。以10倍系列稀釋質粒標準品至下限達100拷貝數/μl,上限達到107拷貝數/μl。
用10倍系列稀釋質粒標準品,經熒光定量PCR儀檢測后,計算Ct值并繪制標準曲線。取濃度為1.0×101拷貝數/μl~1.0×107拷貝數/μl的標準品模板進行熒光定量PCR擴增并建立標準曲線;多重熒光定量PCR反應體系,2×緩沖液10μl,40pmol/μl正向引物0.4μl,40pmol/μl反向引物0.4μl,10pmol/μl探針0.2μl,共4種探針,陽性質粒標準品1μl,補DEPC水至20μl;反應程序為95℃變性5min;以95℃5s,54℃20s,40個循環,在54℃進行熒光檢測。
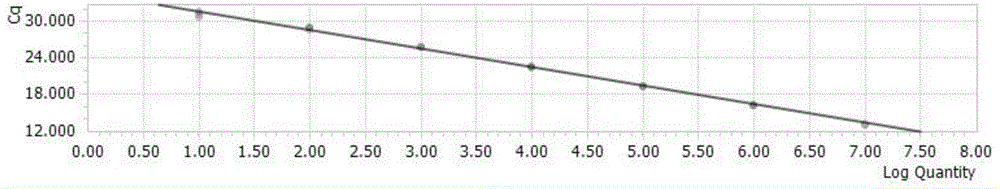
得到如圖1-4的標準曲線,其中圖1為H9亞型流感病毒熒光定量PCR的標準曲線方程為:y=-3.11×LOG(10X)+35.14;圖2的標準曲線方程為H5亞型流感病毒熒光定量PCR的標準曲線方程為y=-3.14×LOG(10X)+35.98;圖3為H7亞型流感病毒熒光定量PCR的標準曲線方程為y=-3.12×LOG(10X)+35.14;圖4為流感病毒M基因熒光定量PCR的標準曲線方程為y=-3.13×LOG(10X)+34.65。從四個標準曲線和線性方程來看,相關系數R2=0.999;擴增效率均是109%,說明有較好的線性關系。
實施例2
將通用載體重組質粒按照10倍梯度稀釋,得到1×100拷貝數/μl~1×107拷貝數/μl系列稀釋質粒分別進行檢測分析,以期獲得其檢測下限。獲得不同濃度標準品的Ct值判斷該方法所能檢測的模板最小拷貝數,同時,以上述不同濃度的模板做常規PCR方法的檢測,PCR產物用1%瓊脂糖凝膠電泳鑒定。各特異性目的片段的擴增曲線如圖5~8所示。
研究發現,當Ct值>35循環為陰性,Ct值≤35循環為陽性。所建立的熒光定量PCR方法檢測H5、H7、H9流感病毒和流感病毒M基因的檢測限度均為10拷貝數。
實施例3
為驗證SEQ ID No.1~SEQ ID No.12的多重熒光定量PCR引物對和探針的特異性,選擇同一病毒屬的H1、H2、H3、H4、H6、H8、H10、H11、H12、H13亞型流感病毒,以及有相同臨床癥狀的IBV、IBDV、NDV病毒為檢測對象,分別如實施例1所述的方法進行RNA提取,反轉錄和熒光定量PCR檢測,得到擴增曲線如圖9所示。
檢測結果表明同一病毒屬的其它亞型流感病毒除M基因為陽性外,其它所有檢測對象的結果均呈陰性,這表明新設計的SEQ ID No.1~SEQ ID No.12所述的引物探針具有特異性。
實施例4
選擇3個梯度1×103拷貝數/μl~1×105拷貝數/μl系列稀釋質粒為模板,批間試驗變異系數由單個濃度模板重復3次熒光定量PCR結果確定,批內試驗變異系數由單次實驗平行試驗結果確定。穩定性分析實驗結果是對4個不同濃度樣品重復檢測3次得到的Ct值進行匯總,并且通過計算Ct值的平均值以及標準差,進一步得到各檢測項目的變異系數。4個檢測樣品均能夠判定為陽性,并且Ct值變異系數在合理范圍內,最大為3.32%,均小于5%。可以得出結論:構建的多重熒光定量PCR檢測方法具有良好的穩定性,為定量分析奠定了基礎。
實施例5
初步應用建立的方法檢測臨床樣品100份:對2015年4月到2016年1月采自浙江余姚等地區的100份雞病變組織單獨進行研磨,利用熒光定量PCR檢測分析攜帶該病毒的狀況。
將100份病料研磨液分別接種SPF胚進行病毒分離;TaqManPCR檢測以Ct值≤35并且擴增曲線呈S形為陽性的判定原則熒光定量PCR檢測結果顯在100份病料中,鑒定到H9亞型病毒10株,H5亞型病毒3株、H7亞型病毒1株;與病毒分離結果鑒定到H9亞型病毒10株,H5亞型病毒3株、H7亞型病毒1株相同。
從上述結果可以看出,病毒的TaqMan PCR檢測方法與病毒分離方法比較具有用時短的特點,病毒分離的陽性結果在熒光定量PCR檢測均為陽性。通過本實驗初步證實了該方法在病毒的檢測方面具有可行性,靈敏度與病毒分離方法相同。
由以上實施例可知,本發明設計得到的H5、H7、H9亞型流感病毒特異性引物和探針具有較強的特異性,對檢測除H5、H7、H9亞型流感病毒以外的病毒都為陰性;建立的熒光定量PCR方法檢測H5、H7、H9流感病毒和流感病毒M基因,當Ct值>35循環為陰性,Ct值≤35循環為陽性,檢測限度為10~50拷貝數。批間批內實驗表明構建的多重熒光定量PCR檢測方法具有良好的穩定性。
以上所述僅是本發明的優選實施方式,應當指出,對于本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 兔中型艾美耳球蟲熒光定量pcr檢測引物和試劑盒的制作方法
- 基于dpo引物的實時熒光pcr檢測屎腸球菌的dpo引物、方法及試劑盒的制作方法
- 熒光定量pcr法檢測top2a基因表達的引物、探針及試劑盒的制作方法
- 對蝦tsv和imnv熒光定量檢測引物和探針及試劑盒的制作方法
- 牛乳中沙門氏菌的直接熒光定量pcr的檢測引物、探針及檢測方法
- 一種鑒定光慈菇的方法及其專用引物對的制作方法
- 基于dpo引物的實時熒光pcr檢測植物乳桿菌的方法、引物及試劑盒的制作方法
- 基于dpo引物的實時熒光pcr檢測鼠李糖乳桿菌的方法、引物及試劑盒的制作方法
- 一種貉的熒光pcr檢測方法及其擴增引物和探針的制作方法
- 鑒定白木香的熒光定量pcr方法、引物和探針及其應用
- 兔中型艾美耳球蟲熒光定量pcr檢測引物和試劑盒的制作方法
- 基于dpo引物的實時熒光pcr檢測屎腸球菌的dpo引物、方法及試劑盒的制作方法
- 熒光定量pcr法檢測top2a基因表達的引物、探針及試劑盒的制作方法
- 對蝦tsv和imnv熒光定量檢測引物和探針及試劑盒的制作方法
- 牛乳中沙門氏菌的直接熒光定量pcr的檢測引物、探針及檢測方法
- 一種鑒定光慈菇的方法及其專用引物對的制作方法
- 基于dpo引物的實時熒光pcr檢測植物乳桿菌的方法、引物及試劑盒的制作方法
- 基于dpo引物的實時熒光pcr檢測鼠李糖乳桿菌的方法、引物及試劑盒的制作方法
- 一種貉的熒光pcr檢測方法及其擴增引物和探針的制作方法
- 鑒定白木香的熒光定量pcr方法、引物和探針及其應用