一種酵母上游激活元件在絲狀真菌中的應用的制作方法
本發明屬于分子生物學領域,涉及一種酵母上游激活元件在絲狀真菌中的應用。
背景技術:
上游轉錄激活元件UAS在分子生物學中屬于一種順式作用元件,它是指DNA分子中具有轉錄調節功能的特異DNA序列,即具有特殊功能的轉錄因子DNA結合位點和其他調控基序。這些元件能夠被特異轉錄因子識別和結合,從而影響基因表達活性。通常只有特定的啟動子和順式作用元件結合后才能發揮相應的轉錄激活或轉錄抑制功能,由于不同物種之間轉錄因子的差異,跨種屬的交叉表達一般都會造成順式作用元件無效。
本發明描述的酵母UAS元件和特異蛋白結合后能隔絕常染色體和異染色體,從而阻斷上游異染色體的沉默信號,間接提升下游基因的表達水平。這種UAS元件對于調控異染色體周圍的基因表達具有十分重要的作用,從而避免的基因在染色體的位置效應。
釀酒酵母屬于盤菌目,而絲狀真菌屬于曲霉目。在分類學中屬于兩個不同的種屬。釀酒酵母屬于單細胞,單倍體或二倍體的真核模式微生物,而絲狀真菌通常一個細胞有多個細胞核,細胞和細胞間通常通過隔膜等細胞系緊密相連形成多細胞。目前對于釀酒酵母的功能基因研究已經十分細致,而對于絲狀真菌的基因分析尚停留在測序階段,因此在內源基因序列尚不清楚的情況下,轉入外源基因對于宿主的影響更加不可預測。
技術實現要素:
本發明的目的在于提供來源于釀酒酵母的上游激活元件UAS在提高絲狀真菌中目的蛋白表達量中的應用。
本發明的目的通過以下技術方案實現:
來源于釀酒酵母的SEQ ID NO.1所示的上游激活元件UAS在提高絲狀真菌中目的蛋白表達量中的應用。
所述的上游激活元件UAS優選克隆到啟動子的上游,或終止子的下游位置;但不限于這兩個位置。
所述的上游激活元件UAS優選距離啟動子或終止子的位置為0bp、50bp、100bp、200bp、300bp、400bp、500bp、1kb或距離啟動子或終止子更遠的距離。
所述的上游激活元件UAS優選為單拷貝、兩拷貝、三拷貝、四拷貝、五拷貝、六拷貝、七拷貝、八拷貝、九拷貝、十拷貝或更多拷貝的串聯重復。
所述的啟動子優選常用于真菌的啟動子或其突變的、截短的或雜合的啟動子。
所述的常用于真菌的啟動子進一步優選AOX1、cbh1、gpdA、pki、trpC、NA2、glaA、cbh1、cbhII、Alp、tef或amdS。
所述的目的蛋白優選糖化酶、葡萄糖氧化酶、酸性蛋白酶、酸性淀粉酶、中性蛋白酶、真菌淀粉酶、植酸酶或脂肪酶。
一種提高絲狀真菌中目的蛋白表達量的方法,其特征在于構建重組表達載體,將來源于釀酒酵母的SEQ ID NO.1所示的上游激活元件UAS克隆到絲狀真菌目的蛋白編碼基因的啟動子的上游,或終止子的下游位置;重組表達載體轉化絲狀真菌宿主細胞,培養轉化了重組表達載體的絲狀真菌表達目的蛋白。
作為本發明所述的方法的優選方式,所述的上游激活元件UAS距離啟動子或終止子的位置為0bp、50bp、100bp、200bp、300bp、400bp、500bp、1kb或距離啟動子或終止子更遠的距離;所述的上游激活元件UAS為單拷貝、兩拷貝、三拷貝、四拷貝、五拷貝、六拷貝、七拷貝、八拷貝、九拷貝、十拷貝或更多拷貝的串聯重復。
作為本發明所述的方法的優選方式,所述的啟動子選自常用于真菌的啟動子或其突變的、截斷的或雜合的啟動子;所述的常用于真菌的啟動子優選AOX1、cbh1、gpdA、pki、trpC、NA2、glaA、cbh1、cbhII、Alp、tef或amdS;所述的目的蛋白選自糖化酶、葡萄糖氧化酶、酸性蛋白酶、酸性淀粉酶、中性蛋白酶、真菌淀粉酶、植酸酶或脂肪酶。
有益效果:
本發明提供了一種來源于釀酒酵母的上游激活元件,將該元件與啟動子融合后可增強其相應的下游編碼蛋白序列的轉率水平,從而提高目的蛋白的表達產量。
附圖說明
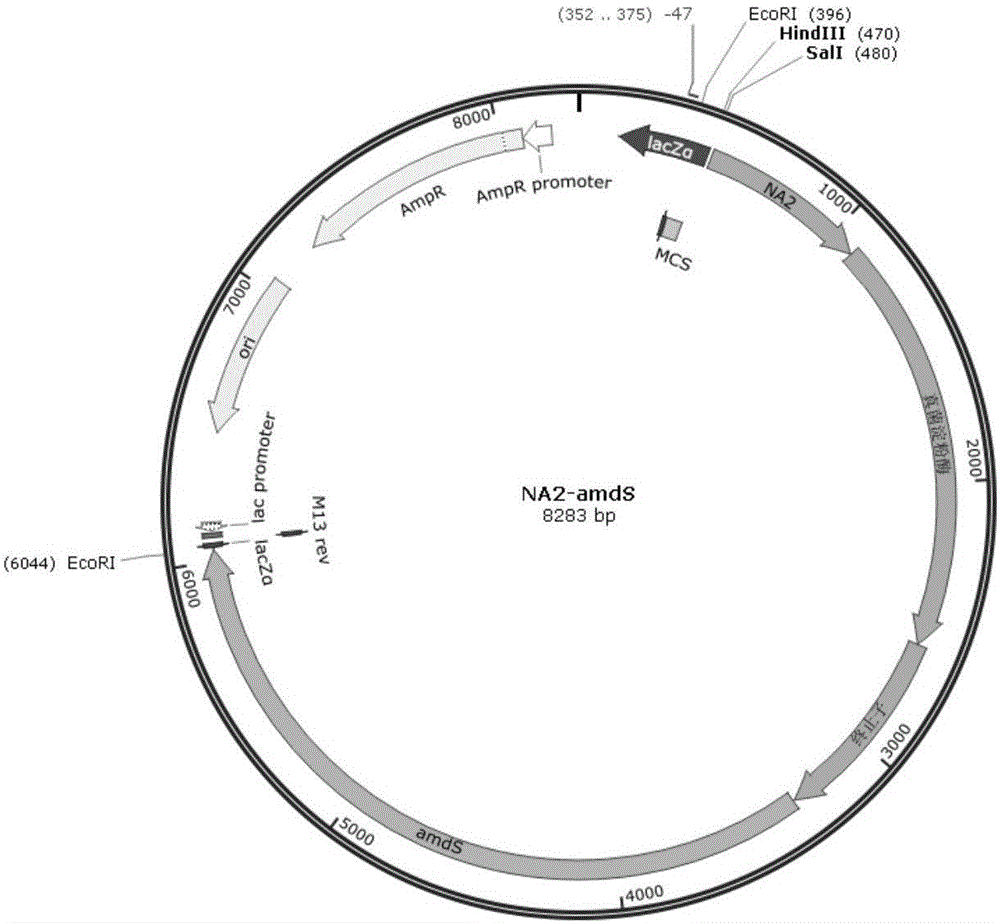
圖1 NA2-amdS質粒圖譜。
圖2 UAS-NA2-amdS質粒圖譜。
圖3 UAS2-NA2-amdS質粒圖譜。
圖4 UAS3-NA2-amdS質粒圖譜。
圖5不含UAS、含單拷貝UAS及含雙拷貝UAS的黑曲霉表達真菌淀粉酶酶活比較。
圖6比較串聯拷貝UAS真菌淀粉酶表達量差異。
圖7 NA2-UAS-amdS質粒圖譜。
圖8 NA2-UAS2-amdS質粒圖譜。
圖9 UAS克隆到終止子末端對表達量的影響
具體實施方式
以下僅以下述元件及基因來說明本發明的技術方案及技術效果,并不能作為限制本發明保護范圍的依據。
所述的酵母UAS元件來源于釀酒酵母YJM1389,NCBI sequence ID.CP004656.2
所述的啟動子NA2元件,來源于載體pMT1802,NCBI sequence ID.AF214480.1
所述的糖化酶終止子元件,來源于載體pMT1802,NCBI sequence ID.AF214480.1
所述真菌淀粉酶序列,來源于米曲霉,NCBI sequence ID.XM_001821384.2
實施例1
1.基因合成UAS元件
從NCBI上獲得UAS元件,分別合成單拷貝,兩拷貝及三拷貝UAS元件,序列的5’和3’末端分別添加HindIII和SalI位點,目的序列克隆到pUC57載體。兩端含HindIII和SalI位點的單拷貝USA元件序列如SEQ ID NO.1所示,兩端含HindIII和SalI位點的雙拷貝USA元件序列如SEQ ID NO.2所示,兩端含HindIII和SalI位點的三拷貝USA元件序列如SEQ ID NO.3所示。
2.構建表達載體
分別從NCBI上獲得NA2啟動子(SEQ ID NO.4),終止子(SEQ ID NO.5),真菌淀粉酶基因編碼序列(SEQ ID NO.6)后以pUC57為出發載體構建表達載體,命名為NA2-amdS(圖1),序列由金斯瑞合成。
上述載體NA2-amdS通過HindIII-SalI酶切,并將上述合成的單拷貝,兩拷貝及三拷貝UAS元件用同樣內切酶酶切后連入酶切后的表達載體NA2-amdS,含單拷貝UAS元件的表達載體命名為UAS-NA2-amdS(圖2),含兩拷貝UAS元件的表達載體命名為UAS2-NA2-amdS(圖3),含三拷貝UAS元件的表達載體命名為UAS3-NA2-amdS(圖4)。
3.表達載體轉化宿主細胞
表達載體UAS-NA2-amdS,UAS2-NA2-amdS、UAS3-NA2-amdS用HindIII線性化,通過原生質體轉化至黑曲霉。
轉化方法:
在TZ液體培養基(牛肉膏粉0.8%;酵母浸膏0.2%;蛋白胨0.5%;NaCl0.2%;蔗糖3%;pH5.8)中培養黑曲霉菌絲體(黑曲霉CBS513.88,購自荷蘭真菌菌種保藏中心CBS-KNAW Fungal Biodiversity Centre)。通過mira-cloth(Calbiochem公司)從培養液中過濾菌絲體并用0.7M NaCl(pH5.8)洗滌,菌絲體濾干后轉移至含纖維素酶1%(Sigma)、蝸牛酶1%(Sigma)和溶壁酶(Sigma)0.2%的酶解液中。30℃,65rpm酶解2.5-3h。然后將含有原生質體的酶解液置于冰上并用四層擦鏡紙過濾。得到的濾液3000rpm,4℃離心10min后,棄上清;附著在管壁上的原生質體用STC溶液(1M D-山梨醇、50mM CaCl2、10mM Tris-HCl,pH7.5)洗滌一次,最后把原生質體重懸于適量的STC溶液中。將30ug質粒EcoRI線性化DNA加入到300ul原生質體懸浮液中,混勻后室溫放置25min;然后分三次共加入2.7mL PEG溶液(60%PEG4000、10mM CaCl2、10mM TrisHCl,pH7.5),混勻后室溫放置25min;3000rpm,常溫離心,加入適量STC液體懸浮沉淀后鋪板。
4.搖瓶檢測真菌淀粉酶表達量
搖瓶配方及方法
上述所得陽性轉化子分離兩次,使用50mL發酵培養基(13%玉米淀粉,2%葡萄糖,3%豆餅粉,3%玉米漿,0.2%2萬U/g的高溫淀粉酶)的搖瓶在34℃下,220rpm的搖床中培養六天。按照國標法測試上清液的真菌淀粉酶活性,結果見表1和圖5。
表1
實施例2比較串聯拷貝UAS表達量差異
UAS2-NA2-amdS,UAS3-NA2-amdS載體轉化及酶活鑒定方法如實施例1所述。
各取20個轉化子,檢測搖瓶樣品酶活,結果如圖6所示,三個串聯UAS的表達量比兩個串聯UAS高20%左右。
實施例3UAS克隆到終止子末端對表達量的影響。
分別將UAS及兩拷貝UAS克隆到NA2-amdS載體的終止子的3’末端,載體分別命名為NA2-UAS-amdS(圖7),NA2-UAS2-amdS(圖8)。載體轉化及酶活鑒定方法如實施例1所述。
各取20個轉化子,檢測搖瓶樣品酶活,結果如表2及圖9所示,結果顯示UAS克隆到終止子下游仍能增強目的蛋白真菌淀粉酶的表達。
表2
實施例4UAS距離對增強表達的影響
在UAS-NA2-amdS載體的UAS元件和NA2之間隨機插入50bp,構建成載體UAS-random-NA2-amdS,隨機插入序列如SEQ ID NO.7所示。
載體轉化及酶活鑒定方法如實施例1所述。轉化子隨機挑取20個檢測酶活,并對這些樣品進行顯著性差異分析。結果表明,兩組數據沒有顯著性差異。
表3
表4
方差分析
F<F crit,且P-value>0.05,兩組數據間無顯著性差異。
- 還沒有人留言評論。精彩留言會獲得點贊!