一種用于檢測4/91型傳染性支氣管炎病毒的試劑盒的制作方法
本發明涉及分子生物學領域,特別是涉及一種用于檢測4/91型傳染性支氣管炎病毒的試劑盒及其應用。
背景技術:
傳染性支氣管炎病毒(Infectious bronchitis virus,IBV)屬于冠狀病毒科(Coronaviridae),冠狀病毒屬(Coronavirus),是有囊膜單股正鏈RNA病毒,其基因組長度約為27.6kb。IBV基因組編碼4種必需結構蛋白:纖突蛋白(S)、膜蛋白(M)、核衣殼蛋白(N)和小膜蛋白(E)。纖突蛋白、膜蛋白是主要表面蛋白,位于病毒粒子最表層的囊膜上,是構成冠狀病毒纖突的主要成分。IBV不同毒株間S基因的核苷酸序列變化幅度較大,有些可達50%以上,不同IBV毒株S蛋白的氨基酸變異多發生在S1上。Sl蛋白也是IBV血清型特異性抗原決定簇的主要蛋白,對IBV的組織嗜性及其毒力具有一定影響,能誘導機體產生特異性抗體。
由于IBV基因組RNA復制的不連續性以及RNA聚合酶的不完全校對機制,使得IBV基因組十分容易發生突變、缺失、插入和不同毒株基因組間的同源重組,造成IBV血清型眾多,IBV新的血清型也不斷出現,但QX-like型IBV是世界范圍內主要流行毒株,,4/91型IBV疫苗對該流行株具有較好的交叉保護效果,因此生產中常常需要對疫苗中4/91型IBV毒株進行鑒定,確定疫苗中是否含有4/91型IBV毒株,以保證疫苗的免疫效果。因此,對4/91型IBV進行特異性鑒定是預防和控制本病的關鍵一環。已經建立多種IBV的診斷方法,如中和試驗、ELISA、血凝和血凝抑制試驗等,這些方法雖已屬常規技術,但具體應用到IBV檢測中,或因IBV血清型間抗原差異大而敏感性降低,導致漏檢;或因常規血清學方法本身的缺陷而出現假陽性,造成誤檢。傳統的病毒分離方法,對采集病料的時機和病料的新鮮程度要求較高,需要接種9-11日齡雞胚進行傳代觀察胚變,以及用多種標準陽性血清進行雞胚中和試驗,且檢測周期往往要幾周以上,具有明顯的局限性。
RT-PCR技術是一種快速、敏感、特異的分子生物學檢測方法。80年代該技術的產生給病毒檢測提供了一種新的選擇,在檢測各種病毒中得到了廣泛應用。IBV眾多血清型中的序列同源性較高,不斷有新的變異株產生,為快速診斷IBV血清型帶來了困擾。
技術實現要素:
本發明的第一個目的在于提供用于檢測4/91型傳染性支氣管炎病毒的特異性引物對。
本發明的第二個目的在于提供檢測4/91型傳染性支氣管炎病毒的試劑盒。
考慮到IBV眾多血清型中序列同源性較高,尋找各血清型之間的差異并確定各差異的保守序列以及從S1基因高變區選擇靶區域是本領域的技術難點,本發明參照GenBank登錄的4/91型IBV-S1基因序列(GenBank登錄號為KF377577)的高變區設計并篩選特異性引物。IBV-S1蛋白為IBV變異程度最大的結構蛋白。在眾多備選的引物中,經過多次篩選,比對試驗,以排除引物與其他物種序列可能存在的非特異性匹配,最終獲得優化后的引物對。
本發明提供的優選的特異性引物對,其序列為:
上游引物5’-TCTGATTGCACTGCTGGTACT-3’(SEQ ID NO.1);以及下游引物5’-GCACCCGTAACGTGAGTTG-3’(SEQ ID NO.2)。
上游引物在GenBank登錄號為KF377577的20500nt-20520nt之間,下游引物在20858nt-20876nt之間。提取樣本總RNA并進行反轉錄(RT)合成cDNA后,利用上述引物進行聚合酶鏈式反應(PCR),采用下列反應程序:起始變性94℃5min,30個循環(94℃45s,58℃45s,72℃25s),最后經過72℃10min延伸,對PCR產物進行瓊脂糖凝膠電泳分析,利用紫外凝膠成像儀檢測目的條帶,如果擴增出目的條帶則證明為4/91型IBV檢測陽性,否則為陰性。
本發明提供了上述特異性引物對在制備鑒別傳染性支氣管炎病毒血清型試劑盒中的應用。
本發明提供了上述特異性引物對在制備檢測4/91型傳染性支氣管炎病毒試劑盒中的應用。
含有SEQ ID NO.1-2所示特異性引物對的檢測試劑屬于本發明的保護范圍。
含有SEQ ID NO.1-2所示特異性引物對的試劑盒屬于本發明的保護范圍。
進一步地,本發明的試劑盒其PCR階段的工作程序為:94℃5min;94℃45s,58℃45s,72℃25s,30個循環;72℃10min。
本發明的上述試劑盒是對待測樣本進行RT-PCR檢測后,擴增產物若有377bp大小的條帶,則待測樣本中含有4/91型傳染性支氣管炎病毒。
本發明還提供了一種檢測4/91型傳染性支氣管炎病毒的非診斷目的方法,包括以下步驟:
(1)提取待測樣本的總RNA,反轉錄,得到cDNA;
(2)利用SEQ ID NO.1-2所示特異性引物對對步驟(1)的cDNA進行PCR擴增,根據擴增結果判斷待測樣本中是否有4/91型傳染性支氣管炎病毒。
其中,步驟(2)中陽性樣本擴增的目的片段為377bp。
本發明的優點在于,1)擴增的目的片段位于4/91型IBV的S1蛋白的高變區,長度為377bp,敏感性好、操作方便;2)該方法對其它常見禽病病原,如禽流感病毒、新城疫病毒、傳染性法氏囊病毒、禽呼腸孤病毒、禽腺病毒和禽傳染性喉氣管炎病毒的檢測結果皆為陰性,沒有交叉反應,表明該方法亦具有良好的特異性;3)本發明方法適用于養禽生產中進行4/91型IBV的檢測,不能擴增常用疫苗株(H120、LDT3等)以及主要流行毒株(QX-like、TW-like等),僅能擴增4/91型毒株,具有高特異性、高靈敏度、高效率、低成本的特點,可在6h內對臨床病料進行快速鑒別診斷,克服了傳統檢測方法耗時較長的缺點。該方法適合大批量臨床樣本的檢測與分析,為4/91型IBV的早期快速診斷、監測以及分子流行病學調查研究提供了可靠的技術手段。
附圖說明
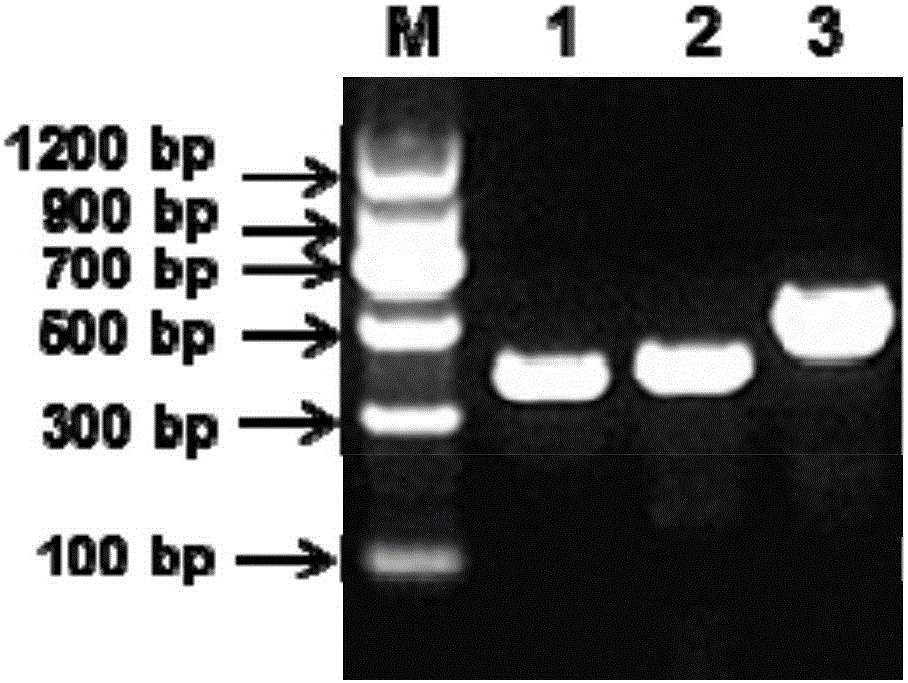
圖1是最佳擴增引物篩選電泳結果。點樣順序為M:MarkerII;1:引物1(377bp);2:引物2(401bp);3:引物3(518bp)。
圖2是引物2特異性試驗結果。點樣順序為M:MarkerII;1:4/91株;2:JS株;3:GD株;4:H52株;5:conn株;6:T株。
圖3是引物3特異性試驗結果。點樣順序為M:MarkerII;1:4/91株;2:JS株;3:GD株;4:H52株;5:conn株;6:T株。
圖4是RT-PCR反應最佳退火溫度篩選電泳結果。點樣順序為M:MarkerII;1:55℃;2:57℃;3:58℃;4:59℃;5:61℃。
圖5是RT-PCR反應最佳循環數篩選電泳結果。M:MarkerII;1:28循環;2:29循環;3:30循環;4:31循環;5:32循環;6:33循環。
圖6是根據IBV S1基因所繪制的遺傳進化樹,圖中●顯示用于本發明方法檢測的不同基因型的代表性IBV毒株。
圖7是對選擇的不同基因型傳染性支氣管炎病毒進行檢測的電泳結果。加樣順序為M:DNA Maker II;P:陽性對照(4/91型IBV);N:陰性對照;1:T株(腎型標準株);2:M41(M型標準株);3:YN株(YN-like);4:JS株(QX-like);5:GD株(TW-like)。
圖8是對其它常見禽病病原進行檢測的電泳結果。其中M:DNA Maker II;P:陽性對照(4/91型IBV);N:陰性對照;1:H5亞型禽流感病毒;2:H7亞型禽流感病毒;3:H9亞型禽流感病毒;4:新城疫病毒(NDV);5:傳染性法氏囊病毒(IBDV);6:禽呼腸孤病毒(REOV);7:禽腺病毒(FAdV);8:禽傳染性喉氣管炎病毒(ILTV)。
圖9為文獻公開的引物特異性檢測結果,樣品順序:M:Marker II;P:陽性對照;N:陰性對照;1:T株;2:conn株;3:H52;4:JS株;5:GD株。
具體實施方式
以下實施例進一步說明本發明的內容,但不應理解為對本發明的限制。在不背離本發明精神和實質的情況下,對本發明方法、步驟或條件所作的修改或替換,均屬于本發明的范圍。
若未特別指明,實施例中所用的技術手段為本領域技術人員所熟知的常規手段。
下列實施例中常規的實驗方法,參見Sambrook等編寫的分子克隆。儀器的使用參照儀器操作說明。LEGEND MICRO 17R低溫臺式離心機,為Thermo公司產品;VS-1渦旋振蕩器購自鼎昊源科技有限公司;TL-2010S組織研磨震蕩器購自鼎昊源科技有限公司。反轉錄酶(Reverse Transcriptase)200U/μl(Promega)、核酸酶抑制劑(Rnase Inhibitor)50U/μl(Takara)、5倍體積的反應緩沖液(5×Reaction Buffer)、dNTP混合物2.5mM和隨機引物(Random Primer)500μg/ml(Promega),購自北京愛普銳晟科技有限公司;DEPC處理水,購自北京明豪至遠有限公司。Marker II DNA Ladder購自中科瑞泰(北京)生物科技有限公司。Veriti 96-Well Thermal Cycler PCR擴增儀為Applied Biosystems公司產品,購自北京誠茂興業科技發展有限公司;MINI-Smart小型臺式離心機為HERO公司產品;HW·SYII-KP3型電熱恒溫水槽購自北京長風儀器儀表公司。
本發明實施例中選用的生物材料如下:禽流感病毒、新城疫病毒、傳染性法氏囊病毒、禽呼腸孤病毒、禽腺病毒和禽傳染性喉氣管炎病毒,傳染性支氣管炎病毒4/91型、T株(腎型標準株)、M41(M型標準株)、YN株(YN-like)、JS株(QX-like)、GD株(TW-like)、H52株(M型標準株)和conn株(M型標準株)均由中國農業大學動物醫學院保藏和提供。
實施例1用于檢測4/91型傳染性支氣管炎病毒的特異性引物的設計
參照GenBank登錄的4/91型IBV-S1基因序列(GenBank登錄號為KF377577)的高變區設計并篩選特異性引物。在眾多備選的引物中,經過多次篩選,比對試驗,以排除引物與其他物種序列可能存在的非特異性匹配,經反復篩選和驗證,最終獲得3組備選引物對,繼續對三組引物對進行實驗,選擇最優化的引物對。表1中的引物1、2、3均為針對同一個靶基因的引物,三者的位置鄰近。各引物擴增電泳結果如圖1、2和3所示。結果顯示,引物2和3能擴增出其它型IBV毒株,特異性較差,圖2中顯示引物2能夠擴增JS株、GD株、conn株、T株,圖3顯示能擴增出H52株、conn株的目的條帶,特異性差,故舍去引物2和3。引物1擴增目的條帶最亮,且無非特異性雜帶,故選擇引物1為最佳引物,上游引物在GenBank登錄號為KF377577的20500nt-20520nt之間,下游引物在20858nt-20876nt之間。
表1用于檢測4/91型IBV備選引物序列
本發明提供的優選的特異性引物對,即為表1中的第1組引物對,其序列為:上游引物5’-TCTGATTGCACTGCTGGTACT-3’(SEQ ID NO.1);以及下游引物5’-GCACCCGTAACGTGAGTTG-3’(SEQ ID NO.2)。
實施例2檢測4/91型傳染性支氣管炎病毒的RT-PCR檢測方法最佳退火溫度的摸索
1、檢測樣品的預處理
(1)組織樣品處理:取100mg臟器組織樣品加入0.5ml滅菌生理鹽水并用研磨器進行研磨混懸,組織懸液3000rpm離心30min后取上清用于檢測分析。
(2)尿囊液樣品處理:將樣品3000rpm離心30min后取上清用于檢測分析。
2、樣品總RNA的提取
參照Trizol RNA提取試劑盒(Invitrogen)說明書進行提取。
3、反轉錄為cDNA
在0.2ml離心管內加入下列成分:RNA溶液4μl,隨機引物1μl,輕輕混勻,70℃水浴5min,冰浴2min,然后依次加入下列成分:5×反應緩沖液4μl,dNTP混合物2μl,核酸酶抑制劑1μl,反轉錄酶0.5μl,DEPC處理水7.5μl,輕輕混勻,37℃作用1h,得到樣本cDNA。
4、PCR檢測
利用實施例1最終確定的引物對(第1組引物)進行PCR。
設計不同的退火溫度梯度(55℃、56℃、57℃、58℃和59℃)對4/91型IBV進行RT-PCR。
在0.2ml離心管中加入下列成分:
輕輕混勻后,以不同的退火溫度分別進行如下反應:94℃預變性5min,94℃45s,(55℃、57℃、58℃、59℃和61℃)45s,72℃25s,進行30個循環,循環結束72℃延伸10min。
PCR反應結束后,用1×TAE電泳緩沖液制備1.2%瓊脂糖凝膠并按照參考比例混入熒光染料Gelsafe,取7μl PCR產物加入凝膠孔中,選擇合適的電壓(4V/cm-10V/cm)進行電泳,電泳時間為25-35min,電泳結束后將凝膠塊置于紫外凝膠成像儀上觀察并拍照,根據電泳結果確定樣品中能否擴增出目的條帶,如果擴增出目的條帶長度為377bp則證明待測樣品為4/91型IBV檢測陽性,否則為檢測陰性。
電泳結果如圖4所示,58℃為擴增目的條帶最亮,結合退火溫度過高不利于引物與模板結合,所以選擇58℃為最佳退火溫度。
實施例3檢測4/91型IBV的RT-PCR檢測方法最佳循環數摸索
檢測樣品的預處理、樣品總RNA的提取、反轉錄為cDNA參見實施例2對應的方法。利用實施例1和2確定的條件,設計6個不同的循環數(28、29、30、31、32和33)對4/91型IBV進行RT-PCR。
在0.2ml離心管中加入成分同實施例2。輕輕混勻后,進行如下反應:94℃預變性5min,94℃45s,58℃45s,72℃25s,進行不同的循環數(28、29、30、31、32和33),循環結束72℃延伸10min。PCR產物電泳實驗參見實施例2,電泳結果如圖5所示,30個循環數擴增目的條帶條帶與更多循環數亮度相似,且沒有非特異性雜帶,能節省時間、提高檢測效率,因此選擇其為最佳循環數。
實施例4檢測4/91型傳染性支氣管炎病毒的RT-PCR檢測方法的建立
檢測樣品的預處理、樣品總RNA的提取、反轉錄為cDNA參見實施例2對應的方法。
在0.2ml離心管中加入,成分參見實施例2。
輕輕混勻后,采用下列反應程序:起始變性94℃5min,30個循環(94℃45s,58℃45s,72℃25s),最后經過72℃10min延伸,PCR反應結束后,用1×TAE電泳緩沖液制備1.2%瓊脂糖凝膠并按照參考比例混入熒光染料Gelsafe,取7μl PCR產物加入凝膠孔中,選擇合適的電壓(4V/cm-10V/cm)進行電泳,電泳時間為25-35min,電泳結束后將凝膠塊置于紫外凝膠成像儀上觀察并拍照,根據電泳結果確定樣品中能否擴增出目的條帶,如果擴增出目的條帶長度為377bp則證明待測樣品為4/91型IBV陽性,否則為陰性。
實施例5檢測4/91型傳染性支氣管炎病毒的RT-PCR檢測方法的特性評價
1、不同基因型傳染性支氣管炎病毒特異性檢測
按照實施例4建立的方法進行。
利用上述方法分別對不同基因型IBV(如圖6所示)進行檢測,電泳結果如圖7所示,結果說明,本發明實施例4建立的方法僅可檢出4/91型IBV而檢測不出其它血清型的IBV,因而可以對檢測樣品進行IBV基因型鑒定,表明本方法具有良好的敏感性和特異性。2、禽常見病病原的特異性檢測
利用實施例4建立方法對其它常見的禽病病原,禽流感病毒、新城疫病毒、傳染性法氏囊病毒、禽呼腸孤病毒、禽腺病毒和禽傳染性喉氣管炎病毒進行檢測,結果如圖8所示,結果顯示,除陽性對照外,其他實驗對象皆為陰性,表明本方法在檢測禽類常見的其他病原體過程中,實施例4建立的方法針對4/91型IBV具有良好的特異性。
3、與現有技術相比
現有技術記載了雞傳染性支氣管炎病毒793B RT-PCR檢測方法的建立及應用(于申業,刁有祥,等,中國獸醫學報,2007年7月),采用的引物序列如下:上游ACGAATTCATGTTGGGCAAACCGCT;下游ATGTCGACAAGTATCAACGCCACC,雞傳染性支氣管炎病毒793B也即IBV 4/91型。申請人采用上述引物進行特異性檢測實驗,發現上述引物除了能檢測到IBV 4/91型,還能夠檢測到IBV T株(腎型標準株),可見上述引物的特異性不如本發明引物特異性強。結果見圖9。
雖然,上文中已經用一般性說明及具體實施方案對本發明作了詳盡的描述,但在本發明基礎上,可以對之作一些修改或改進,這對本領域技術人員而言是顯而易見的。因此,在不偏離本發明精神的基礎上所做的這些修改或改進,均屬于本發明要求保護的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!