聯合制備CAR?Vγ9Vδ2T細胞和CAR?NKT細胞的方法與流程
本發明涉及生物技術領域,具體涉及一種聯合制備CAR-Vγ9Vδ2T細胞和CAR-NKT細胞的方法。
背景技術:
白血病是嚴重危害人類健康的最主要的血液系統惡性腫瘤,目前化療是治療白血病的主要手段,但化療缺乏特異性并且有嚴重的毒副作用,多數患者最終復發死亡;造血干細胞移植也是治療白血病的重要手段,但移植后腫瘤復發和移植物抗宿主病仍是目前難以克服的兩大難題。
CAR-T治療已在急性淋巴細胞白血病(B-ALL)和慢性淋巴細胞白血病(B-CLL)及B細胞淋巴瘤等的臨床試驗中顯示出良好的靶向性、殺傷性和持久性,為B細胞白血病和淋巴瘤的免疫細胞治療提供了新的解決方案,展示了巨大的發展潛力和應用前景。2013年ASH會議上Rosenberg團隊報道了CAR-T細胞在淋巴瘤治療中的應用,15例難治復發B細胞惡性腫瘤患者接受了CAR-T治療,其中9例彌漫大B細胞淋巴瘤,4例慢性淋巴白血病,2例惰性淋巴瘤,15例患者中8例完全緩解,4例部分緩解,1例淋巴瘤穩定。2014年的ASH會議上諾華公布了B細胞腫瘤CAR-T免疫療法CTL019治療的最新研究數據,39例復發難治急性淋巴細胞白血病兒童接受CTL019治療后有36例兒童(92%)達到了完全緩解,并且6個月后,70%的響應者仍處于緩解中,75%的兒童仍存活。
CAR-T技術全稱是嵌合抗原受體T細胞免疫療法,其中CAR表示Chimeric antigen receptor,即嵌合抗原受體。該技術是將抗原受體的高親和性和T淋巴細胞的殺傷作用相結合的技術,嵌合抗原受體基因轉導T細胞獲得的CAR-T細胞具有抗原特異性識別和激活效應性T細胞毒作用的雙重性質。在臨床應用中,CAR-T細胞的主要操作步驟是將含有CAR基因的載體在體外轉導到自體T細胞中,然后應用現有的T細胞擴增技術,在體外大量擴增T細胞,再將擴增的T細胞回輸給經預處理后的腫瘤患者,這個過程也叫做重新引導T細胞攻擊腫瘤細胞。CAR-T技術通過基因重組技術在體外將CAR基因轉入到自體T細胞內,使T細胞表面表達腫瘤相關抗原的受體,由于使用的是自體T淋巴細胞,因此不會引起移植物抗宿主病,對難治性和復發的B細胞惡性腫瘤治療效果顯著。嵌合抗原受體的結構包括胞外區、跨膜區和胞內區:胞外區主要是抗原特異性單克隆抗體單鏈可變區序列,包括重鏈可變區和輕鏈可變區,二者以鉸鏈區連接;跨膜區是CD3、CD4、CD8、CD28等蛋白分子;胞內區主要是T細胞受體TCR/CD3復合物中的CD3ζ鏈、免疫球蛋白Fc受體FcεRIγ鏈,通常具有免疫受體酪氨酸活化基序(ITAMs),負責信號轉導。CAR胞外區為配體,腫瘤相關抗原(TAA)本身則為受體,CAR一旦與TAA結合,即可通過由CD3ζ或高親和性受體FcεRIγ的胞內區使T細胞活化發揮效應功能。輸入體內的CAR-T細胞CARs與TAA結合后引起CAR-T細胞活化,表現為CAR依賴的殺傷、增殖及細胞因子釋放,輸注的CAR-T細胞在患者體內持續存在與潛在的療效相關。目前臨床研究中所輸注的CAR-T細胞多為第二代CAR-T細胞,在第二代CAR-T細胞中加入共刺激信號4-1BB可增強CAR-T細胞在體內的存活時間、以及抗腫瘤能力提高。
CD19的表達僅限于B細胞,并且持續表達在B系細胞分化的各個階段,超過95%B系淋巴細胞白血病和非霍奇金淋巴瘤等均有CD19表達,并且在大多數的正常組織表面不表達CD19,多能造血干細胞也不表達CD19,這就意味著CD19是一個引發自體免疫疾病風險小、不可逆和骨髓毒性低的安全靶標,因此構建識別CD19的嵌合抗原受體即CAR19-T通過特異性識別CD19抗原來殺傷靶細胞,可以達到治療絕大多數B系腫瘤的目的。目前開發的針對血液系統惡性腫瘤的CAR-T細胞即多以CD19為靶抗原。第二代CAR信號肽區由于添加了一個協同刺激分子,能夠更好的為CAR-T細胞提供活化信號,這樣CAR識別腫瘤細胞后能夠同時活化協同刺激分子和胞內信號,實現雙重活化,能明顯提高T細胞增殖分泌能力和抗腫瘤效應。但正是由于這種強的增殖能力,持續的體內存在和高效的靶向殺傷作用,也大大提高了這種CAR-T細胞治療的致死性毒副作用細胞因子風暴。另外,盡管CAR-T在當前的B細胞白血病及淋巴瘤的臨床試驗中顯示出了顯著的臨床效果,但由于當前CAR-T制備主要采集患者自身T細胞,這是一種“個性化定制”的細胞產品,僅適用于患者自身,對于CAR-T細胞產品的商業化來說,產品質量的“標準化”和產品生產的“批量化”是亟待解決的兩大瓶頸。并且CAR轉導前往往需要用免疫磁珠或其它手段從外周血單個核細胞中對特定T細胞亞群進行純化,不僅耗時費力且成本昂貴,如果不進行純化則轉導后目標CAR-T的純度很低,CD4+CAR-T和CD8+CAR-T比例也無法確定,嚴重影響其療效,甚至產生嚴重的副作用。
公開于該背景技術部分的信息僅僅旨在增加對本發明的總體背景的理解,而不應當被視為承認或以任何形式暗示該信息構成已為本領域一般技術人員所公知的現有技術。
技術實現要素:
為了克服現有技術中CAR-αβT細胞需要個性化定制、制備過程中需要預先純化獲得αβT細胞亞群以及CAR-αβT回輸體內后產生嚴重的細胞因子風暴的缺陷,本發明提供了一種新的聯合制備CAR-Vγ9Vδ2T細胞和CAR-NKT細胞的方法,該方法采用具有普適性的免疫細胞γδT作為待轉導的效應細胞,使用健康供者的γδT也可以進行“標準化”和“批量化”制備;另外該方法采用體外特異性活化技術使待轉導的外周血PBMC中的Vγ9Vδ2T細胞和NKT細胞得到最大程度的優勢擴增,不需要預先純化獲得特定的T細胞亞群,省時省力成本降低;并且使用該方法聯合制備的CAR-Vγ9Vδ2T細胞和CAR-NKT細胞在體內存在的時間可通過藥物來控制,不會像其他CAR-T那樣持續長時間的存在,因此作用溫和不會引起嚴重致死性的細胞因子風暴。使用該方法制備的CAR-NK/NKT細胞可用于B細胞白血病和淋巴瘤的靶向治療。
本發明的具體技術方案為:
一種聯合制備CAR-Vγ9Vδ2T細胞和CAR-NKT細胞的方法,包括以下步驟:
1)從患者的自體外周血、健康供者的外周血或嬰兒臍帶血中分離得到外周血單個核細胞(PBMC);將所得外周血單個核細胞加入可用于淋巴細胞、樹突狀細胞或DC細胞的無血清細胞培養基中,再加入抗γδTCR單克隆抗體、含氮二膦酸鹽類藥物或帕米磷酸鹽類藥物預活化PBMC中的Vγ9Vδ2T細胞和NKT細胞,之后再加入rhIL-2或rhIL-15進行Vγ9Vδ2T細胞和NKT細胞的選擇性體外活化擴增;
2)用攜帶有嵌合抗原受體的基因序列的慢病毒載體轉導步驟1)所得包含Vγ9Vδ2T細胞和NKT細胞的混合細胞(以下簡稱Vγ9Vδ2T/NKT細胞),即得包含CAR-Vγ9Vδ2T細胞和CAR-NKT細胞的混合細胞(以下簡稱CAR-Vγ9Vδ2T/NKT細胞),其中嵌合抗原受體與靶向表面抗原可特異性結合。
上述方法在另一種實現方式中,采用人淋巴細胞分離液從患者的自體外周血、健康供者的外周血或嬰兒臍帶血中分離得到外周血單個核細胞,人淋巴細胞分離液可采用GE公司的Ficoll paque plus或Ficoll paque premium。
上述方法在另一種實現方式中,所述無血清細胞培養基選自德國Cellgenix公司的cellgrowSCGM,日本TAKARA公司的GT-T551H3,日本KOHJIN公司的KBM581,美國GIBCO公司的AIM-V、瑞士LONZA公司的X-Vivo15中的一種或幾種。
上述方法在另一種實現方式中,將所得外周血單個核細胞加入可用于淋巴細胞、樹突狀細胞或DC細胞的無血清細胞培養基中,使外周血單個核細胞在無血清細胞培養基中的濃度為(1-9)×106個/ml。
上述方法在另一種實現方式中,預活化前所述無血清細胞培養基中還加入血漿,使血漿在無血清細胞培養基中的濃度為2-10%,且所述血漿與外周血單個核細胞來自于同一血液供體。即如果外周血單個核細胞來源于某一特定患者的外周血,血漿也來源于該特定患者的外周血;如果外周血單個核細胞來源于血庫中某一健康供者的外周血,血漿也來源該健康供者的外周血;如果外周血單個核細胞來源于血庫中某一嬰兒臍帶血,血漿也來源于該嬰兒臍帶血。本申請方法中使用的每份從血庫獲得的健康供者的外周血和從血庫獲得的嬰兒臍帶血都是采集單個供體的。
上述方法在另一種實現方式中,使用的抗γδTCR單克隆抗體、含氮二膦酸鹽類藥物或帕米磷酸鹽類藥物加入細胞培養基后的濃度為1-10μM。
上述方法在另一種實現方式中,所述含氮二膦酸鹽類藥物為唑來膦酸,即1-羥基-2-(咪唑-1-yl)-亞乙基-1,1-二磷酸一水化物,CAS號118072-93-8;所述帕米磷酸鹽類藥物為帕米膦酸二鈉。
上述方法在另一種實現方式中,預活化后加入rhIL-2使其在細胞培養基中的濃度為300-1000U/ml或加入rhIL-15使其在細胞培養基中的濃度為5-50ng/ml。
上述方法在另一種實現方式中,Vγ9Vδ2T細胞和NKT細胞的選擇性體外活化擴增中,每隔2-3天補充新鮮的所述無血清細胞培養基、血漿、rhIL-2和/或rhIL-15,以保證其在體系中的濃度。
上述方法在另一種實現方式中,所述預活化、選擇性體外活化擴增的條件均為在37℃、5%二氧化碳的培養箱中進行。
上述方法在另一種實現方式中,預活化12-36h后加入rhIL-2或rhIL-15,選擇性體外活化擴增Vγ9Vδ2T細胞和NKT細胞7天以上。當選擇性體外活化擴增7天后,CD3+TCR-gamma-delta+Vγ9Vδ2T細胞純度可達到60%以上,CD3+CD56+NKT細胞可達到30%以上。
上述方法在另一種實現方式中,所述攜帶有嵌合抗原受體的基因序列的慢病毒載體是通過以下步驟構建的:采用全基因合成的方法合成可與靶向表面抗原特異性結合的嵌合抗原受體的基因序列,將該嵌合抗原受體基因序列亞克隆到慢病毒表達載體中,載體經測序驗證序列準確無突變后,得到攜帶有嵌合抗原受體的基因序列的慢病毒載體,即重組慢病毒載體。
上述方法在另一種實現方式中,所述靶向表面抗原為CD19,與CD19特異性結合的嵌合抗原受體的基因序列如SEQ ID:1所示,與CD19特異性結合的嵌合抗原受體的氨基酸序列如SEQ ID:2所示,氨基酸序列SEQ ID:2是基因序列SEQ ID:1經轉錄翻譯所得。
上述方法在另一種實現方式中,所述慢病毒表達載體為美國SBI公司的pCDH載體,如:pCDH-CMV-MCS-EF1-Puro。
上述方法在另一種實現方式中,重組慢病毒載體在進行轉導前還需要進行擴增以方便轉導中的大規模使用,重組慢病毒載體的擴增方法為:
包被病毒顆粒:1)在HEK293T新鮮培養基中培養HEK293T細胞,24h細胞密度達到90%左右;2)在100mm平板中,向上述HEK293T細胞中加入10μg所得重組慢病毒、5μg PLP1、5μg PLP2,5μg PLP/VSVG,75μl轉染試劑Lipofectamine 2000,按照PLP1、PLP2和PLP/VSVG的說明書以及轉染試劑Lipofectamine 2000的說明書進行操作;3)4hr后除去含轉染試劑的HEK293T培養基,加入10ml HEK293T新鮮培養基;4)37℃孵育48h,收集含病毒顆粒的上清,并對上清進行4℃、2000×g的離心10min,除去細胞碎片,得到上清;
超速法濃縮病毒顆粒:1)超速離心“包被病毒顆粒”步驟所得上清,4℃、60000×g離心150min后棄上清,將離心管口倒置除去殘留培養基;2)用普通培養基重懸病毒顆粒;3)操作完成后,將含病毒的離心管冰上放置3h;4)病毒上清以0.1~1ml體積進行分裝,-80度凍存。
上述方法在另一種實現方式中,重組慢病毒載體轉導步驟1)所得Vγ9Vδ2T/NKT細胞的具體步驟為:收集Vγ9Vδ2T/NKT細胞,調整Vγ9Vδ2T/NKT細胞的濃度至5×106個/ml,重組慢病毒載體和Vγ9Vδ2T/NKT細胞以1:4的體積比混合靜置6-12h;收集細胞并用PBS緩沖液清洗,換可用于淋巴細胞、樹突狀細胞或DC細胞的新鮮無血清細胞培養基保持72小時。之后可以使用流式細胞免疫熒光染色,分析轉導效率。
上述方法在另一種實現方式中,該方法還包括對CAR19-Vγ9Vδ2T/NKT細胞的體外抗腫瘤活性進行試驗驗證的步驟:以轉導后所得CAR19-Vγ9Vδ2T/NKT細胞作為效應細胞,以表達CD19的Raji腫瘤細胞作為靶細胞進行毒殺傷試驗驗證,體外采用cytotox96試劑盒檢測細胞毒殺傷效果,按照不同的效靶比,建立CAR-Vγ9Vδ2T/NKT細胞與靶向腫瘤細胞的共培養體系,檢測培養基上清中由被裂解的腫瘤細胞釋放的LDH含量,以此反應CAR-Vγ9Vδ2T/NKT細胞在體外殺傷腫瘤細胞的能力。當效靶比E:T=3:1時,對CD19+Raji細胞殺傷效率>70%為合格。
上述方法在另一種實現方式中,CAR19-Vγ9Vδ2T/NKT細胞的體外抗腫瘤活性驗證合格后還包括將CAR19-Vγ9Vδ2T/NKT細胞在體外進一步擴增的步驟,當擴增到一定細胞數量時,即可回輸給患者發揮抗腫瘤作用,CAR19-Vγ9Vδ2T/NKT細胞在體外進一步擴增的方法與步驟1)中選擇性體外活化擴增的方法相同;如:加入到可用于淋巴細胞、樹突狀細胞或DC細胞的無血清細胞培養基中,調整細胞濃度為2×106個/ml,加入終濃度為1000U/ml的rhIL-2和終濃度為10%的血漿,于37℃和5%的二氧化碳培養箱中繼續培養,每隔2-3天補充新鮮的無血清細胞培養基、IL-2和血漿,以保持其各自的濃度。
上述方法在另一種實現方式中,CAR19-Vγ9Vδ2T/NKT細胞在體外進一步擴增至細胞數量達到(1-20)×107個/ml時還包括進行細胞質控檢測的步驟:細胞活力>90%且細菌、真菌、支原體和內毒素檢結果為陰性,視為合格。
上述方法在另一種實現方式中,細胞質控檢測合格后還包括以下步驟:開始收集細胞,用生理鹽水1500rpm×10min離心洗滌一次,棄掉上清,然后用100ml生理鹽水懸浮細胞并加入終濃度為1%的人血白蛋白。
之后交給醫護人員給患者回輸到體內,回輸到患者體內的CAR19-Vγ9Vδ2T/NKT細胞可以直接發揮抗腫瘤作用。CAR19-Vγ9Vδ2T/NKT細胞也可以在體外,在含氮二磷酸鹽類藥物、體內腫瘤裂解釋放的磷酸抗原等或體內IL-2、IL-15等細胞因子作用下繼續活化擴增持續具有抗腫瘤作用。
上述方法在另一種實現方式中,還包括使用流式細胞分析檢測重組CAR-Vγ9Vδ2T/NKT細胞表面的嵌合抗原受體表達水平的步驟。
與現有技術相比,本發明具有如下有益效果:
1、本發明可同時制備CAR-Vγ9Vδ2T細胞和CAR-NKT細胞,Vγ9Vδ2T細胞和NKT細胞是自身固有免疫細胞而且是非MHC限制性的識別和殺傷腫瘤,不管是轉導成功的CAR-Vγ9Vδ2T/NKT細胞還是小部分未轉導成功的Vγ9Vδ2T細胞和NKT細胞,都不會像αβT那樣因MHC限制性個體不同而產生免疫排斥反應,因此CAR-Vγ9Vδ2T/NKT細胞對不同個體的不同腫瘤類型均有普適性,可提前大規模制備并滿足不同個體的需求;當然針對CD19制備獲得的CAR19-Vγ9Vδ2T/NKT細胞還具有CAR-T對腫瘤殺傷的靶向性,對CD19+的惡性腫瘤殺傷更有效;
2、本發明不需要預先純化T細胞亞群,采用體外特異性活化的技術使得Vγ9Vδ2T/NKT細胞的純度可分別達到60%和30%以上;既簡單又可節約昂貴的純化成本,并且在此基礎上通過特殊轉導技術轉導重組慢病毒載體,可大大提高轉導效率;
3、針對CD19制備獲得的CAR19-Vγ9Vδ2T/NKT在體內受腫瘤釋放的抗原介導活化和增殖的能力很弱,可通過唑來膦酸和帕米膦酸二鈉等來延長其在體內的活化增殖程度及存續時間,與其他CAR19-T相比作用相對溫和,不會長期存在和大規模增殖,可大大降低細胞因子風暴的危險,安全有效。
附圖說明
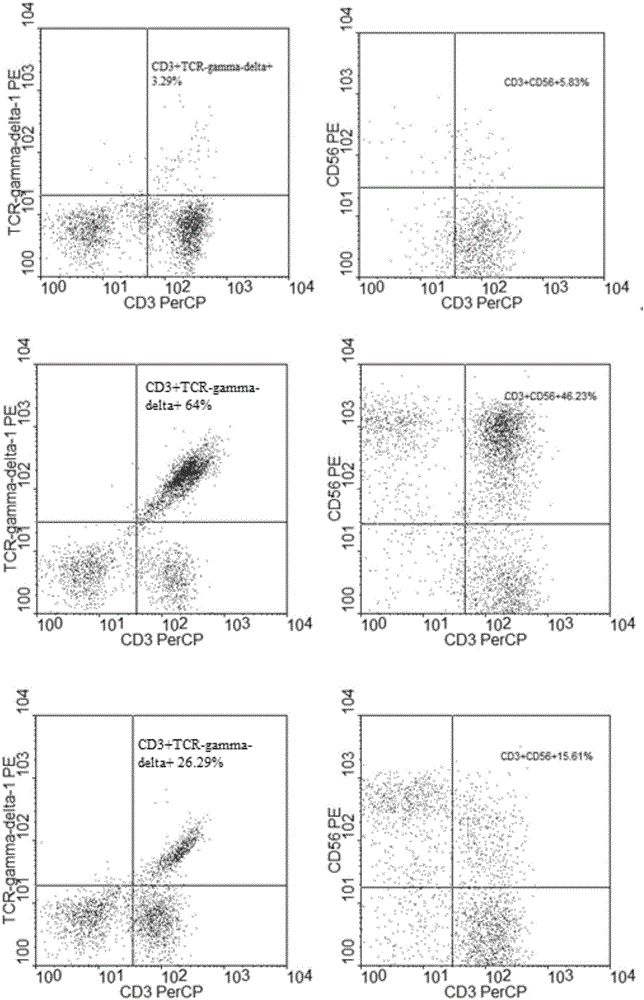
圖1從上到下分別是實施例1中PBMC預活化前Vγ9Vδ2T細胞和NKT細胞的免疫表型分析,選擇性體外活化擴增7天后Vγ9Vδ2T細胞和NKT細胞的免疫表型分析和重組慢病毒載體轉導后所得CAR19-Vγ9Vδ2T細胞和CAR19-NKT細胞的免疫表型分析,同時具備CD3+和TCR-gamma-delta+為Vγ9Vδ2T細胞或CAR19-Vγ9Vδ2T細胞,同時具備CD3+和CD56+為NKT細胞或CAR19-NKT細胞;
圖2從上到下分別是實施例2中PBMC預活化前Vγ9Vδ2T細胞和NKT細胞的免疫表型分析,選擇性體外活化擴增7天后Vγ9Vδ2T細胞和NKT細胞的免疫表型分析,重組慢病毒載體轉導后所得CAR19-Vγ9Vδ2T細胞和CAR19-NKT細胞的免疫表型分析,同時具備CD3+和TCR-gamma-delta+為Vγ9Vδ2T細胞或CAR19-Vγ9Vδ2T細胞,同時具備CD3+和CD56+為NKT細胞或CAR19-NKT細胞;
圖3從上到下分別是實施例3中PBMC預活化前Vγ9Vδ2T細胞和NKT細胞的免疫表型分析,選擇性體外活化擴增7天后Vγ9Vδ2T細胞和NKT細胞的免疫表型分析,重組慢病毒載體轉導后所得CAR19-Vγ9Vδ2T細胞和CAR19-NKT細胞的免疫表型分析,同時具備CD3+和TCR-gamma-delta+為Vγ9Vδ2T細胞或CAR19-Vγ9Vδ2T細胞,同時具備CD3+和CD56+為NKT細胞或CAR19-NKT細胞;
圖4是實施例1-3中所得CAR19-Vγ9Vδ2T/NKT細胞和Vγ9Vδ2T/NKT細胞對CD19+Raji細胞體外殺傷實驗的效果對比圖,圖中每個實施例左邊的柱狀代表CAR19-Vγ9Vδ2T/NKT細胞的殺傷效果,每個實施例右邊的柱狀代表Vγ9Vδ2T/NKT細胞的殺傷效果。
具體實施方式
下面結合附圖,對本發明的具體實施方式進行詳細描述,但應當理解本發明的保護范圍并不受具體實施方式的限制。
實施例1
在GMP實驗室的超凈工作臺內用人淋巴細胞分離液Ficoll paque plus(GE)從健康供者的80ml外周血中分離得到PBMC并進行計數,PBMC培養前取少量樣品進行免疫表型分析,參見圖1,將分離的PBMC懸浮后加入到含有10%血漿(血漿與外周血來自于同一健康供者)的無血清細胞培養基AIM-V(美國GIBCO公司)中,將細胞濃度用上述含有血漿的無血清細胞培養基調整至2×106個/ml,再加入注射用唑來膦酸(瑞士諾華),使其在無血清細胞培養基中的濃度為2.5μM,于37℃、5%二氧化碳的培養箱中預活化培養Vγ9Vδ2T/NKT;預活化24h后加入rhIL-2使其在無血清細胞培養基中的濃度為1000U/ml,繼續于37℃、5%二氧化碳的培養箱中選擇性體外活化擴增Vγ9Vδ2T/NKT細胞,以后每隔2-3天補充一次上述新鮮培養基、血漿和rhIL-2使其保持濃度,經過7天的選擇性體外活化擴增后Vγ9Vδ2T細胞比例達到64%,NKT細胞比例達到46.23%,參見圖1;攜帶有可與CD19特異性結合的嵌合抗原受體的基因序列的慢病毒載體轉導活化后的Vγ9Vδ2T/NKT細胞,Vγ9Vδ2T細胞和NKT細胞的轉導效率分別為26.29%和15.61%,參見圖1;CAR19-Vγ9Vδ2T/NKT細胞對CD19+靶細胞Raji細胞毒實驗,當效靶比E:T=3:1時,對靶細胞的殺傷為85%,如圖4所示;CAR19-Vγ9Vδ2T/NKT細胞體外進一步擴增,即:將CAR19-Vγ9Vδ2T/NKT細胞加入到含有10%血漿(血漿與外周血來自于同一健康供者)的無血清細胞培養基AIM-V(美國GIBCO公司)中,將細胞濃度調整至2×106個/ml,加入終濃度為1000U/ml的rhIL-2,于37℃和5%的二氧化碳培養箱中繼續培養,每隔2-3天補充新的無血清細胞培養基、rhIL-2及血漿使其保持濃度;當CAR19-Vγ9Vδ2T/NKT細胞數量達到一定數量(1-20)×107個/ml時;CAR19-Vγ9Vδ2T/NKT進行質控檢測,細胞活力>90%且細菌、真菌、支原體和內毒素檢測皆為陰性為合格,離心洗滌收集細胞,用50ml氯化鈉注射液和含有1%的人血白蛋白懸浮細胞裝于輸液袋中;CAR19-Vγ9Vδ2T/NKT細胞制品包裝貼標簽;回輸前患者預處理和回輸治療及療效監測和副作用處理。
實施例1:Vγ9Vδ2T/NKT活化擴增前后及重組慢病毒表達載體轉導后的流式檢測結果
實施例2
在GMP實驗室的超凈工作臺內用人淋巴細胞分離液Ficoll paque plus(GE)從健康供者的80ml外周血中分離PBMC并進行計數,PBMC培養前取少量樣品進行免疫表型分析,參見圖2,將分離的PBMCs懸浮后加入到含有10%血漿(血漿與外周血來自于同一健康供者)的無血清細胞培養基AIM-V(美國GIBCO公司)中,將細胞濃度用上述含有血漿的無血清細胞培養基調整至2×106個/ml,加入注射用帕米膦酸二鈉(深圳信立泰藥業),使其在無血清細胞培養基中的濃度為10μM,于37℃、5%二氧化碳的培養箱中預活化培養Vγ9Vδ2T/NKT細胞;預活化24h后加入rhIL-2使其在無血清細胞培養基中的濃度為1000U/ml的,繼續于37℃、5%二氧化碳的培養箱中選擇性體外活化擴增Vγ9Vδ2T/NKT細胞,以后每隔2-3天補充一次上述新鮮培養基、血漿和rhIL-2使其保持濃度,經過7天的選擇性體外活化擴增Vγ9Vδ2T細胞比例可達到69.7%,NKT細胞比例達到35.93%,參見圖2;攜帶有可與CD19特異性結合的嵌合抗原受體的基因序列的慢病毒載體轉導活化后的Vγ9Vδ2T/NKT,兩種細胞轉導效率分別為38.27%和11.82%,參見圖2;CAR19-Vγ9Vδ2T/NKT對CD19+靶細胞Raji細胞毒實驗,當效靶比E:T=3:1時,對靶細胞的殺傷為80%,如圖4所示;CAR19-Vγ9Vδ2T/NKT細胞體外進一步擴增,即:將CAR19-Vγ9Vδ2T/NKT細胞加入到含有10%血漿(血漿與外周血來自于同一健康供者)的無血清細胞培養基AIM-V(美國GIBCO公司)中,將細胞濃度調整至2×106個/ml,加入終濃度為1000U/ml的rhIL-2,于37℃和5%的二氧化碳培養箱中繼續培養,每隔2-3天補充新的無血清細胞培養基、rhIL-2及血漿使其保持濃度;當CAR19-Vγ9Vδ2T/NKT細胞數量達到一定數量(1-20)×107個/ml時;CAR19-Vγ9Vδ2T/NKT質控檢測,細胞活力>90%且細菌、真菌、支原體和內毒素皆為陰性為合格,離心洗滌收集細胞,用50ml氯化鈉注射液和含有1%的人血白蛋白懸浮細胞裝于輸液袋中;CAR19-Vγ9Vδ2T/NKT細胞制品包裝貼標簽;回輸前患者預處理和回輸治療及療效監測和副作用處理。
實施例2:Vγ9Vδ2T/NKT活化擴增前后及重組慢病毒表達載體轉導后的流式檢測結果
實施例3
在GMP實驗室的超凈工作臺內用人淋巴細胞分離液Ficoll paque premium(GE)從嬰兒臍帶血80ml中分離得到PBMC并進行計數,PBMCs培養前取少量樣品進行免疫表型分析,參見圖3,將分離的PBMC懸浮后加入到含有10%血漿(血漿與外周血來自于同一嬰兒臍帶血)的無血清細胞培養基AIM-V(美國GIBCO公司)中,將細胞濃度用上述含有血漿的無血清細胞培養基調整至2×106個/ml,然后轉移至被1μg/ml抗γδTCR抗體(美國Immunotech)包被的培養瓶中,于37℃、5%二氧化碳的培養箱中預活化培養Vγ9Vδ2T/NKT;預活化24h后加入rhIL-2使其在無血清細胞培養基中的濃度為1000U/ml的,于37℃、5%二氧化碳培養箱中選擇性體外活化擴增Vγ9Vδ2T/NKT細胞,每隔2-3天補充一次上述新鮮培養基、血漿和rhIL-2,經過7天的活化和擴增Vγ9Vδ2T細胞比例可達到59.27%,NKT細胞比例達到28.55%,參見圖3;攜帶有可與CD19特異性結合的嵌合抗原受體的基因序列的慢病毒載體轉導活化好的Vγ9Vδ2T/NKT細胞,兩種細胞轉導效率分別為34.06%和14.02%,參見圖3;CAR19-Vγ9Vδ2T/NKT對CD19+靶細胞Raji細胞毒實驗,當效靶比E:T=3:1時,對靶細胞的殺傷為78%,如圖4所示;CAR19-Vγ9Vδ2T/NKT體外進一步擴增,即:將CAR19-Vγ9Vδ2T/NKT細胞加入到含有10%血漿(血漿與外周血來自于同一嬰兒臍帶血)的無血清細胞培養基AIM-V(美國GIBCO公司)中,將細胞濃度調整至2×106個/ml,加入終濃度為1000U/ml的rhIL-2,于37℃和5%的二氧化碳培養箱中繼續培養,每隔2-3天補充新的無血清細胞培養基、rhIL-2及血漿使其保持濃度;當CAR19-Vγ9Vδ2T/NKT細胞數量達到一定數量(1-20)×107個/ml時;CAR19-Vγ9Vδ2T/NKT細胞制品質控檢測,細胞活力>90%且細菌、真菌、支原體和內毒素皆為陰性為合格,離心洗滌收集細胞,用50ml氯化鈉注射液和含有1%的人血白蛋白懸浮細胞裝于輸液袋中;CAR19-Vγ9Vδ2T/NKT細胞制品包裝貼標簽;回輸前患者預處理;回輸治療及療效監測和副作用處理。
實施例3:Vγ9Vδ2T/NKT活化擴增前后及重組慢病毒表達載體轉導后的流式檢測結果
實施例4
(1)實施例1-3中攜帶有可與CD19特異性結合的嵌合抗原受體的基因序列的慢病毒載體是通過以下步驟構建的:采用全基因合成的方法合成靶向表面抗原CD19對應的嵌合抗原受體基因,其基因序列如SEQ ID:1所示,其氨基酸序列如SEQ ID:2所示,將該嵌合抗原受體基因亞克隆到慢病毒表達載體pCDH-CMV-MCS-EF1-Puro(SBI公司)中,載體經測序驗證序列準確無突變后,得到攜帶有嵌合抗原受體基因的慢病毒表達載體,即重組慢病毒。
(2)實施例1-3中將上述所得重組慢病毒進行擴增以用于大量的轉導實驗,方法如下:
一、包被病毒顆粒:1)在HEK293T新鮮培養基中培養HEK293T細胞,24h細胞密度達到90%左右;2)在100mm平板中,向上述HEK293T細胞中加入10μg所得重組慢病毒、5μg PLP1、5μg PLP2,5μg PLP/VSVG,75μl轉染試劑Lipofectamine 2000,按照PLP1、PLP2和PLP/VSVG的說明書以及轉染試劑Lipofectamine 2000的說明書進行操作;3)4hr后除去含轉染試劑的HEK293T培養基,加入10ml HEK293T新鮮培養基;4)37℃孵育48h,收集含病毒顆粒的上清,并對上清進行4℃、2000×g的離心10min,除去細胞碎片,得到上清;
二、超速法濃縮病毒顆粒:1)超速離心步驟一所得上清,4℃、60000×g離心150min后棄上清,將離心管口倒置除去殘留培養基;2)用普通培養基重懸病毒顆粒;3)操作完成后,將含病毒的離心管冰上放置3h;4)病毒上清以0.5ml體積進行分裝,-80度凍存。
(3)實施例1-3中重組慢病毒轉導Vγ9Vδ2T/NKT細胞的方法為:收集Vγ9Vδ2T/NKT細胞,調整Vγ9Vδ2T/NKT細胞的濃度至5×106個/ml,擴增后的重組慢病毒和Vγ9Vδ2T/NKT細胞以1:4的體積比混合靜置8h;收集細胞并用PBS緩沖液清洗,換可用于淋巴細胞、樹突狀細胞或DC細胞的新鮮細胞培養液后保持72小時。之后可以使用流式細胞免疫熒光染色,分析轉導效率。
前述對本發明的具體示例性實施方案的描述是為了說明和例證的目的。這些描述并非想將本發明限定為所公開的精確形式,并且很顯然,根據上述教導,可以進行很多改變和變化。對示例性實施例進行選擇和描述的目的在于解釋本發明的特定原理及其實際應用,從而使得本領域的技術人員能夠實現并利用本發明的各種不同的示例性實施方案以及各種不同的選擇和改變。本發明的范圍意在由權利要求書及其等同形式所限定。
- 還沒有人留言評論。精彩留言會獲得點贊!