一種定量檢測血液中HBVDNA和RNA的雙通道實時熒光定量PCR檢測方法與流程
本發明一般涉及乙型病毒性肝炎的診斷和治療,以及感染病學、分子生物學、細胞生物學等領域。更具體地,本發明涉及一種血液中乙型肝炎病毒(HepatitisBvirus,HBV)DNA和RNA的雙通道實時熒光定量PCR檢測方法。
背景技術:
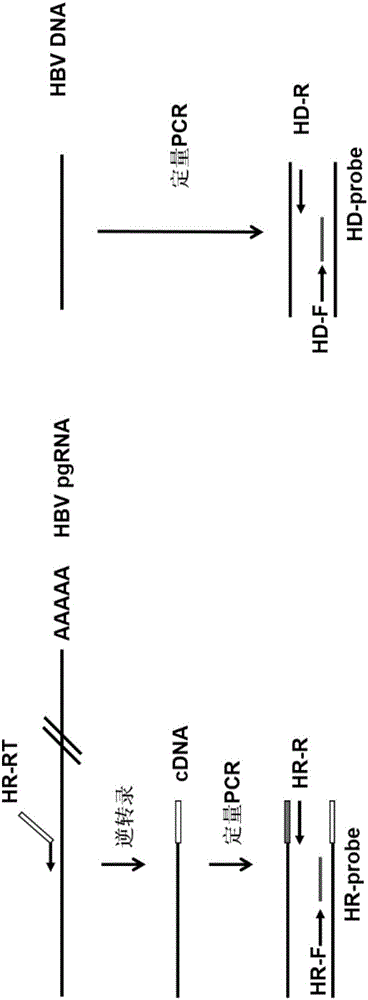
:乙型肝炎病毒(HepatitisBvirus,HBV)感染呈世界流行,但不同地區HBV感染的流行強度差異很大。我國屬于中高流行區。在2006年全國乙型肝炎血清流行病學調查中,我國1~59歲一般人群HBsAg攜帶率為7.18%。據此推算,我國慢性HBV感染者約為9300萬人,其中慢性乙型肝炎(慢性乙肝)患者約2000萬例。在我國,慢性HBV感染與肝硬化、肝癌等終末期肝病的發生密切相關。目前治療慢乙肝的藥物主要為干擾素和核苷(酸)類似物兩類。兩類藥物均可高效抑制HBV復制,但由于肝細胞內共價閉合環狀DNA(CovalentlyclosedcircularDNA,cccDNA)的持續存在,使得目前慢乙肝治療的臨床治愈率很低(<5%),停藥后慢乙肝復發率較高,因此慢乙肝患者需要長期甚至終身服藥。長期服藥會給患者甚至社會帶來極大的負擔,并且在治療過程中有可能會導致HBV耐藥株的出現。而且,目前臨床上檢測的HBV核酸只是HBVDNA。血清中HBVDNA水平能反映HBV的復制水平,可作為一個抗病毒療效的監測指標,且有較好的預后監測價值(Martinot-PeignouxM,MarcellinP.VirologicalandserologicaltoolstooptimizethemanagementofpatientswithchronichepatitisB[J].LiverInternational,2016,36Suppl1(SupplementS1):78–84.)。在《慢性乙型肝炎防治指南(2015更新版)》中提到,HBVDNA定量檢測主要用于判斷慢性HBV感染的病毒復制水平,可用于抗病毒治療適應癥的選擇及療效的判斷,并建議采用靈敏度和精確度高的實時熒光定量聚合酶鏈式反應。目前在臨床上,治療終點分為理想的終點,滿意的終點和基本的終點:理想的終點即為慢性乙肝患者停藥后獲得持久的HBsAg消失;滿意的終點根據慢性乙肝患者的HBeAg狀態有所區別,最終狀態是HBeAg陰性,有持續的病毒學應答和ALT復常;基本的終點是抗病毒期間長期維持病毒學應答。目前HBsAg轉陰做為臨床治愈的指標,當HBsAg轉陰時可安全停藥,但HBsAg轉陰率過低,使其臨床應用有著很大的限制。因此,基于此,目前迫切需要一種更加靈敏、精確、更加有效的血液學指標,用于監測慢乙肝治療的療效和監測安全停藥(中華醫學會肝病學分會,中華醫學會感染病學分會.慢性乙型肝炎防治指南(2015年版)[J].中華肝臟病雜志(電子版),2015,7(3):1-18.)。根據我們的前期研究結果并結合相關報道,已經證實血清中存在HBVRNA,并且其水平動態變化與慢性乙肝治療的療效和預后密切相關。我們在前期研究中明確了血清中HBVRNA的存在形式和產生機制,證實了血清中的HBVRNA為3.5kb長的HBVPregenomeRNA(pgRNA),存在于類似丹氏顆粒的病毒顆粒的核衣殼內,其來源為未經逆轉錄或不完全逆轉錄的情況下,獲得病毒外包膜并分泌至細胞外(JieW,TaoS,HuangX,etal.SerumhepatitisBvirusRNAisencapsidatedpregenomeRNAthatmaybeassociatedwithpersistenceofviralinfectionandrebound[J].JournalofHepatology,2016.)。由此可見,血清中的HBV病毒核酸既有存在于丹氏顆粒內的HBVDNA,也有存在于RNA病毒樣顆粒內的pgRNA。由于核苷(酸)類似物作用于乙肝病毒的逆轉錄和DNA合成過程,能夠抑制HBVDNA的產生,但對pgRNA病毒樣顆粒的產生則無直接抑制作用。因此HBVDNA和HBVRNA的動態變化能夠和好反映抗病毒治療的療效。乙肝病毒的基因組全長為3.2kb,而pgRNA是為病毒逆轉錄合成子代病毒DNA的模板,其大小則為3.5kb。其是以被感染肝細胞核內的HBVcccDNA為模板,部分重復轉錄形成的,而整合的HBV基因組則不能產生。因此,定量檢測血清HBVpgRNA的水平可更好地監測肝細胞內HBVcccDNA的水平和轉錄活性狀態,不失為一種良好的檢測慢性乙肝治療療效和安全停藥的預測指標。另外本室之前的研究表明HBVRNA的水平和停藥后患者的復發有關,因此,HBVRNA可做為一個潛在的判斷核苷(酸)類似物治療過程中安全停藥的監測指標(JieW,TaoS,HuangX,etal.SerumhepatitisBvirusRNAisencapsidatedpregenomeRNAthatmaybeassociatedwithpersistenceofviralinfectionandrebound[J].JournalofHepatology,2016.)。因此,本發明旨在建立一種高度靈敏和特異的可同時檢測血液中HBVDNA和HBVRNA的雙通道熒光定量PCR方法,用于臨床上評價慢性乙肝抗病毒治療的療效并指導其安全停藥。開發靈敏、精確、更加有效的定量檢測血液中RNA和DNA雙通道的診斷試劑或試劑盒對于臨床上慢乙肝的有效治療和安全停藥具有重要的指導意義。技術實現要素:一方面,本發明提供了一種用于同時檢測體液HBVDNA和RNA雙通道實時熒光PCR的寡核苷酸組,其特征在于,所述寡核苷酸組包括用于體液HBVDNA和RNA雙通道實時熒光PCR檢測的特異性地擴增的專用引物以及反向錨定引物。在一些實施例中,如前所述寡核苷酸組還包括與所述專用引物配合使用的特異性地擴增的專用探針。在一些具體實施例中,特異性地擴增體液HBVDNA的專用引物選自SEQIDNOs﹕1、2、3和4的上游引物與選自SEQIDNOs﹕5和6的下游引物組成的一對寡核苷酸;特異性地擴增體液HBVRNA的專用引物選自SEQIDNO﹕8的上游引物與選自SEQIDNOs﹕9、10和16的下游引物組成的一對寡核苷酸;反向錨定引物選自SEQIDNOs﹕11和12。在一些具體實施例中,特異性地擴增體液HBVDNA的專用引物選自SEQIDNO﹕1的上游引物與選自SEQIDNO﹕6的下游引物組成的一對寡核苷酸;特異性地擴增體液HBVRNA的專用引物選自SEQIDNO﹕8的上游引物與選自SEQIDNOs﹕9的下游引物組成的一對寡核苷酸;反向錨定引物選自SEQIDNO﹕11。在本發明的一些實施例中,擴增RNA正向引物SEQIDNO﹕8為AGACCACCAAATGCCCCT;反向引物SEQIDNO﹕16為(N)16-30。(N)16-30是指作為隨機錨定序列的核苷酸序列,N可為A、T、C或G,且下角標處16-30表示堿基數目。反向錨定引物SEQIDNO﹕17為(N)16-30-AGGCGAGGGAGTTCTTCTTCTA。SEQIDNO﹕16和SEQIDNO﹕17中的(N)16-30表示相同的隨機錨定序列。本領域技術人員知曉,雖然(N)16-30為隨機序列,但為了保證擴增的效率,其應避免設計成為與HR-F或Probe-HR形成引物二聚體。此外,為了增加擴增的效率,在引物兩端添加隨機堿基后形成的引物序列也涵蓋在本發明中。在一些具體實施例中,特異性地擴增體液HBVDNA的專用探針選自SEQIDNO﹕7所示的核苷酸序列;特異性地擴增體液HBVRNA的專用探針選自SEQIDNO﹕13所示的核苷酸序列。在一些具體實施例中,所述探針為TaqMan探針、MGB探針、雜交探針中的一種。在一些具體實施例中,連接所述探針5’端的是一種熒光報告基團,所述熒光報告基團選自FAM、VIC、TET、JOE、ROX、CY3、CY5、HEX中的任意一種,且擴增DNA的專用探針和擴增RNA的專用探針具有不同的熒光報告基團;并且,連接所述探針3’端的是一種熒光猝滅基團,所述熒光猝滅基團選自BHQ1、BHQ2、BHQ3、TAMRA、DABCYL、NFQ、Eclipse中的任意一種。另一方面,本發明還提供了一種同時檢測體液HBVDNA和RNA雙通道實時熒光定量PCR檢測體系,其特征在于,所述體系包括前述任一項中所述的寡核苷酸組。本發明還提供了如前任一項所述的寡核苷酸組或如前所述的檢測體系在制備HBV診斷試劑或試劑盒中的應用。本發明還提供了如前任一項所述的寡核苷酸組或如前所述的檢測體系在制備用于慢性乙肝抗病毒治療的療效評價和/或安全停藥、治療終點監測的HBV診斷試劑或試劑盒中的應用。血清中HBVDNA水平能反映HBV的復制水平,可作為一個抗病毒療效的監測指標,且有較好的預后監測價值。因此,本發明中所述的寡核苷酸組或所述檢測體系在制備HBV診斷試劑或試劑盒的應用中,用于慢性乙肝抗病毒治療的療效評價和/或安全停藥、治療終點監測的HBV診斷試劑或試劑盒也屬于本發明的保護范圍。另一方面,本發明還提供了一種同時檢測體液HBVDNA和RNA雙通道實時熒光定量PCR試劑盒,其特征在于,所述試劑盒包括如前任一項中所述的寡核苷酸組。本發明的一些實施例中,所述試劑盒還包括DNA標準品、RNA標準品。在本發明的一些具體實施例中,所述DNA標準品為包含SEQIDNO:14所示的核苷酸序列的pESAY-Blunt質粒;所述DNA標準品的擴增引物是由SEQIDNO﹕1所示的上游引物與SEQIDNO﹕6所示的下游引物組成的一對寡核苷酸;所述RNA標準品的擴增引物是由SEQIDNO﹕8所示的上游引物與SEQIDNO﹕9所示的下游引物組成的一對寡核苷酸。再一方面,本發明還提供了一種非診斷目的的同時檢測體液中HBVDNA和RNA雙通道實時熒光定量PCR檢測方法,其特征在于,所述雙通道實時熒光PCR檢測方法使用如前任一項所述的寡核苷酸組或如前所述的檢測體系或如前任一項所述的試劑盒。在一些具體實施例中,所述雙通道實時熒光PCR檢測方法的退火溫度為58-60℃。在一些具體實施例中,所述雙通道實時熒光PCR的反應條件為:50℃,5分鐘;95℃,10分鐘;94℃,15秒;50℃,45秒,共45個循環。在一些具體實施例中,所述檢測方法的步驟包括:步驟1.提取體液中HBV核酸(包括HBVDNA和RNA),其中用反向錨定引物將HBVRNA逆轉錄為cDNA;以及步驟2.以HBVDNA和逆轉錄產物為模板,用HBVDNA和RNA雙通道實時熒光PCR檢測的特異性地擴增的專用引物、專用探針擴增DNA和RNA;或者以HBVDNA和逆轉錄產物為模板,用HBVDNA和RNA雙通道實時熒光PCR檢測的特異性地擴增的專用引物擴增,并摻入熒光染料,以SYBRGreen法定量檢測體液中的HBVDNA和RNA。在本發明中,所述的體液包括血液、尿液和唾液。本發明的有益效果本發明首次在一個體系中通過雙通道同時檢測血液HBVDNA和RNA,在保持了良好的靈敏度和特異性重復性的基礎上,使得檢測時間大幅度減少,實際操作簡便、快捷。除此之外,本發明還在逆轉錄引物上加上了一段人工設計的錨定序列用來排除在檢測過程中HBVDNA帶來的可能干擾,確保了血液HBVRNA檢測的特異性。本發明的特異性引物和探針可檢測A-H所有基因型HBV,包括我國主要存在A-D型HBV。本發明的引物、探針和錨定序列是在最初設計的多條序列的基礎上,通過多輪篩選和優化后確定的特異性和靈敏度最優的序列。附圖說明圖1示出MegAlign軟件分析針對不同基因型HBVDNA檢測的上下游引物和探針序列的保守性。圖2示出利用本發明實施的血清HBVDNA和RNA雙通道實時熒光定量PCR檢測方法對血液HBVDNA和RNA進行檢測的流程圖。圖3示出利用SYBRGreen方法評價8對HBVDNA定量檢測引物(HD-F+HD-R、HD-F1+HD-R、HD-F2+HD-R、HD-F3+HD-R、HD-F+HD-R1、HD-F1+HD-R1、HD-F2+HD-R1、HD-F3+HD-R1)的擴增效率。圖4示出HBVRNA和HBVDNA引物的擴增效率。(A)和(B)是將HBVRNA樣品分別進行10,100,1000,10000倍梯度稀釋后的檢測結果,最終算得擴增效率為:0.88665;(C)和(D)是將HBVDNA樣品分別進行10,100,1000,10000倍梯度稀釋后的檢測結果,最終算得擴增效率為:0.88665。圖5示出雙通道體系中HBVDNA檢測探針的含量。雙通道體系中,在分別加入1.0μL濃度為10μM的HBVDNA和RNA檢測引物的情況下,分別加入0.4μL、0.6μL、0.8μL和1.0μL濃度為10μM的用于檢測HBVDNA的探針以及之前已確定的0.6μL濃度為10μM的用于檢測HBVRNA的探針時的擴增曲線。圖6示出雙通道體系中HBVDNA檢測引物的含量。雙通道體系中,在分別加入0.6μL濃度為10μM的HBVDNA和RNA檢測探針的情況下,分別加入0.5μL、1.0μL、1.5μL濃度為10μM的HBVDNA檢測引物(HD-F和HD-R1)以及之前已經確定的1.0μL濃度為10μM的HBVRNA檢測引物時的擴增曲線。。圖7示出雙通道定量擴增反應的退火溫度。(A)分別利用56、58、60、62℃的退火溫度進行定量PCR反應的擴增曲線;(B)分別利用54、56、58、60℃的溫度進行定量PCR反應得到的Ct值。圖8示出標準品測序結果。(A)DNA標準品的測序結果;(B)RNA標準品的測序結果。圖9示出雙通道熒光定量PCR法檢測HBVDNA標準品的靈敏度。(A)不同終濃度HBVDNA質粒經過檢測后的Ct值;(B)利用濃度和Ct值構建的標準曲線。(C)熒光定量PCR最終得到的擴增曲線。圖10示出雙通道熒光定量PCR法檢測HBVRNA標準品的靈敏度。(A)不同終濃度HBVRNA質粒經過檢測后的Ct值;(B)利用濃度和Ct值構建的標準曲線。(C)熒光定量PCR最終得到的擴增曲線。圖11示出單通道熒光定量PCR法檢測HBVDNA標準品的靈敏度。(A)不同終濃度HBVDNA質粒經過檢測后的Ct值;(B)利用濃度和Ct值構建的標準曲線。(C)熒光定量PCR最終得到的擴增曲線。圖12示出單通道熒光定量PCR法檢測HBVRNA標準品的靈敏度。(A)不同終濃度HBVRNA質粒經過檢測后的Ct值;(B)利用濃度和Ct值構建的標準曲線。(C)熒光定量PCR最終得到的擴增曲線。圖13示出利用雙通道檢測未經DnaseI處理的逆轉錄樣本。(A)同時顯示DNA和RNA的擴增曲線。(B)經VIC通道檢測的HBVDNA擴增曲線。(C)經FAM通道檢測的HBVRNA擴增曲線(*表示HBVDNA的擴增曲線▲表示HBVRNA的擴增曲線)。圖14示出利用雙通道檢測未經DnaseI處理的逆轉錄樣本的重復性檢測結果。具體實施方式除非特別說明,本發明的術語具有本領域通常使用的含義。術語“核苷酸”旨在包括那些不僅含有已知的嘌呤和嘧啶堿基還含有經修飾的其他雜環堿基的部分。此類修飾包括甲基化嘌呤或嘧啶、酰化嘌呤或嘧啶、烷基化核糖或其他雜環化合物。此外,術語“核苷酸”包括那些含有半抗原或熒光標記以及可以不僅含有常規核糖和脫氧核糖還含有其他糖的部分。修飾的核苷或核苷酸還可以在糖部分上包含修飾,例如,其中一個或多個羥基被鹵素原子或脂族基團取代,被官能化為醚、胺等等。術語“引物”是指長度通常為約20至30個堿基的、短的、化學合成的寡核苷酸。它們與靶DNA雜交,然后靶DNA通過DNA聚合酶復制產生互補的DNA鏈。“正向引物”和“反向引物”構成PCR中所用的“PCR引物組”,其中它們與互補的DNA鏈雜交,并指導向著彼此復制,分別產生上鏈和下鏈,導致靶DNA片段以指數增長。根據本發明的方法包含對RNA的(優選地3'聚腺苷酸)尾和用于反轉錄的(聚腺苷酸)尾上游的最近的1到10個核苷酸,優選地1到5個核苷酸,更優選地3到5個核苷酸特異的引物和/或一個對cDNA的相應的(5'聚胸苷酸)序列特異的擴增引物,該序列對RNA尾(3'聚腺苷酸)尾和cDNA的相應的(5'聚胸苷酸)序列下游的最近的的1到10個核苷酸,優選1到5個核苷酸,更優選3到5個核苷酸互補。相應地,除前述公開的引物外,可增加引物對的選擇能力并因而增加被最接近末端序列錨點的特定核苷酸所確定的cDNA群的數目。術語“錨定引物”是指在基因特異性引物的5’末端加入一段修飾序列(包括酶切位點、標簽序列和人工設計的隨機序列等),然后通過逆轉錄或PCR擴增將該修飾序列錨定在目的基因上,最終以該錨定序列作為引物進行后續檢測。在一定程度上可提高特定基因檢測的特異性。術語“探針”是指用捕獲標記或檢測標記來標記引物,檢測引物產物。探針序列用于與引物序列所產生的序列進行雜交,并且通常與不包括引物序列的序列雜交。與引物序列類似,探針序列也用捕獲標記或檢測標記來標記,需說明的是當引物用捕獲標記來標記時,用檢測標記來標記探針,反之亦然。在本發明中探針可以為TaqMan探針、MGB探針、雜交探針中的一種。比如,所述探針為TaqMan探針,標記探針5’端的為一種熒光發光基團,其是FAM、VIC、TET、JOE、ROX、CY3、CY5、HEX中的一種;標記探針3’端為一種熒光猝滅基團,其是BHQ1、BHQ2、BHQ3、TAMRA、DABCYL、NFQ中的一種。下面結合具體實施例,對本發明作進一步的闡述說明。應理解,這些實施例僅用于說明本發明而不在于限制本發明的范圍。下述實施例中的實驗方法,如無特殊說明,均為常規方法;所用的材料,如無特殊說明,均為自常規生化試劑公司購買得到的。實施例1、引物的設計目前,HBV分為至少10種基因型,在我國存在A~D4種基因型。根據我國存在的HBV基因型和國外常見基因型,發明人從GenBank中下載多條A~H基因型HBV參考序列,通過MegAlign軟件分析不同基因型HBV基因組的保守序列。遵循引物和探針的設計原則,在這些保守區域中通過PrimerPremier5軟件設計了針對HBVDNA檢測的多對引物(表1)。這些序列均為不同基因型HBV的保守序列(圖1)。同時,設計了針對HBVRNA檢測的特異性引物和探針序列(表2)。為排除HBVDNA的干擾,發明人在逆轉錄引物的5’端加入了一段隨機錨定序列。在上述引物、探針和隨機錨定序列設計過程中,盡量避免發卡結構、引物內部二聚體、引物間二聚體以及錯配的形成。此外,發明人通過NCBIBlast在線數據庫(http://blast.ncbi.nlm.nih.gov/Blast.cgi)對上述設計的HBV特異性引物和探針序列以及隨機錨定序列進行比對分析避免與其它病毒或人類基因發生非特異結合。通過多輪篩選和優化,最終確定一套靈敏度和特異度最優的引物、探針和隨機錨定序列,序列如表2所示。表1.針對HBVDNA檢測的引物和探針序列序列名稱SEQIDNO序列HD-F1CGGCGTTTTATCATMTTCCTCTHD-F12CGGCGTTTTATCATMTTCCTCHD-F23GCGGCGTTTTATCATMTTCCTHD-F34TGTCTGCGGCGTTTTATCATHD-R5GAGGACAAACGGGCAACATACHD-R16GACAAACGGGCAACATACCTTProbe-HD7CATCCTGCTGCTATGCCTCATCTTCTT其中,Probe-HD的5’端熒光探針為VIC,3’端熒光探針為BHQ1。表2.針對HBVRNA檢測的引物和探針序列其中,Probe-HR的5’端熒光探針為FAM,3’端熒光探針為BHQ1。HR-R1、HR-RT1序列的下劃線部分為相同的隨機錨定序列,HR-R2、HR-RT2序列的下劃線部分為相同的隨機錨定序列。如本領域技術人員所知,發明人通過實驗進一步證實,隨機錨定序列不影響檢測的效率,只要盡量不與HR-F或Probe-HR形成引物二聚體即可。實施例2、檢測方法的建立提取血液中HBV核酸(包括HBVDNA和RNA),其中利用特異性逆轉錄引物HR-RT將提取出的HBVRNA逆轉錄為cDNA,然后利用定量PCR的方法同時檢測HBVDNA和RNA的水平(圖2)。HBVRNA逆轉錄為cDNA的具體操作如下,通過RevertAidFirstStrandDNASynthesisKit(ThermoFisherScientific,Waltham,MA,USA)將血液中提出的HBVRNA逆轉錄成為cDNA。逆轉錄反應體系(20μL)為:反應條件為:25℃5分鐘,42℃60分鐘,70℃5分鐘。然后利用HBVDNA和RNA正向和反向引物以及探針序列進行定量PCR檢測擴增,利用SYBRGreen方法評價了針對HBVDNA檢測的不同引物組合的擴增效率,結果顯示,不同引物組合擴增效率無明顯差異(圖3)。隨后,我們比較分析了HBVDNA檢測引物(HD-F和HD-R1)與HBVRNA檢測引物的擴增效率,發現兩組引物擴增效率無明顯差異(圖4)。基于HBVRNA檢測體系為之前優化的體系,下面主要探索雙通道檢測方法中HBVDNA的檢測體系,確定了用于HBVDNA定量檢測的探針濃度和引物濃度,并確定了雙通道擴增反應的溫度。結果顯示,在確定探針濃度時,箭頭指示的曲線為加入0.6μL濃度為10μM的探針時的擴增曲線,表明體系中加入0.6μL濃度為10μM的探針時HBVDNA擴增效率最佳(圖5);在確定引物濃度時,箭頭指示的曲線為加入1μL濃度為10μM引物時的擴增曲線,表明體系中加入1.0μL濃度為10μM的引物時HBVDNA的擴增效率最佳(圖6);在確定雙通道擴增反應的退火溫度時,擴增反應溫度為58℃和60℃時的擴增效率優于其他溫度(圖7)。最終確定的反應體系和擴增條件如下:在ABIStepOnePlus熒光定量PCR儀中的擴增循環參數為50℃,5分鐘,94℃,10分鐘;然后94℃,15秒,58℃,45秒,45個循環;在每個循環的延伸階段(58℃)同步多次采集熒光(FAM和VIC信號均要采集)。實施例3、HBVDNA質粒標準品的構建提取HBV穩定復制細胞系HepAD38細胞培養上清中的HBVDNA,用HD-F和HD-R1引物進行PCR擴增,將擴增后的目的片段切膠回收后連接至pEASY-Blunt克隆載體上。經測序驗證為裝入的目的片段后,作為實驗室內部檢測血清HBVDNA的標準品使用。最終目的片段序列為:CGGCGTTTTATCATCTTCCTCTTCATCCTGCTGCTATGCCTCATCTTCTTGTTGGTTCTTCTGGACTACCAAGGTATGTTGCCCGTTTGTC(SEQIDNO﹕14)測序驗證的峰圖如圖8A所示。提取HBV穩定復制細胞系HepAD38細胞培養上清中的HBVRNA,利用HR-RT逆轉錄引物進行逆轉錄后,用HR-F和HR-R進行擴增,將擴增后的目的片段切膠回收后連接至pEASY-Blunt克隆載體上。經測序驗證為裝入的目的片段后,作為實驗室內部檢測血液HBVRNA的標準品使用。最終目的片段序列為:AGACCACCAAATGCCCCTATCCTATCAACACTTCCGGAAACTACTGTTGTTAGACGACGAGGCAGGTCCCCTAGAAGAAGAACTCCCTCGCCTGTGTCGTGTGTTACGGTGTGA(SEQIDNO﹕15)測序驗證的峰圖如圖8B所示。實施例4、靈敏度檢測將構建好的HBVDNA標準品和HBVRNA標準品進行10倍倍比稀釋,濃度分別為3.00E+09、3.00E+08、3.00E+07、3.00E+06、3.00E+05、3.00E+04、3.00E+03、3.00E+02copies/mL。用上述確定的檢測體系和循環參數分別對倍比稀釋的HBVDNA和HBVRNA標準品進行定量檢測。結果顯示,在檢測HBVDNA標準品時,線性范圍可低至3.00E+03copies/mL;標準曲線的線性回歸方程為:y=-3.3589x+50.371,相關系數的平方R2=0.9929(圖9)。在檢測HBVRNA標準品時,線性范圍可低至3.00E+02copies/mL;標準曲線的線性回歸方程為:y=-3.3431x+48.671,相關系數的平方R2=0.999(圖10)。除此之外,還利用單通道的檢測方法分別對倍比稀釋的HBVDNA和HBVRNA標準品進行了檢測。結果顯示,在檢測HBVDNA標準品時,線性范圍可低至3.00E+03copies/mL;標準曲線的線性回歸方程為:y=-3.0297x+47.853,相關系數的平方R2=0.9974(圖11)。在檢測HBVRNA標準品時,線性范圍可低至3.00E+03copies/mL;標準曲線的線性回歸方程為:y=-3.4843x+42.71,相關系數的平方R2=0.9992(圖12)。上述結果表明,在雙通道檢測過程中,其靈敏度與單通道檢測相比無明顯差異。上述結果表明,HBVDNA和RNA雙通道定量檢測方法具有較高的靈敏性。盡管雙通道檢測過程中,其靈敏度與單通道檢測相比無明顯差異,但由于在一個體系中經過一次檢測即可獲得與單通道檢測同樣的高靈敏度,使得檢測時間大為縮短,因此雙通道檢測具有明顯的優勢實施例5、特異性的檢測利用雙通道檢測未經DnaseI處理的逆轉錄樣本,此時樣本中含有HBVDNA和HBVRNA逆轉后形成的cDNA。當雙通道檢測后,經FAM通道只能檢測到HBVRNA的擴增曲線;經VIC通道只能檢測到HBVDNA的擴增曲線。由此可見,兩個通道之間無擴增信號干擾現象,具有較高的特異性。(圖13)實施例6、重復性的檢測選取未經DnaseI處理的逆轉錄樣本進行檢測,重復20次。結果顯示,20次重復檢測的曲線基本重合,重復檢測的ct值的標準差(SD值)為0.16466,重復性較好(圖14)。以上,基于本發明的實施方式進行了說明,但本發明不限定于此,本領域的技術人員應該明白,在本發明的主旨的范圍內能夠以進行變形和變更的方式實施,這樣的變形和變更的方式,理應屬于本發明的保護范圍。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1