原細纖維結合抗體及其治療和診斷帕金森氏癥、路易體癡呆和其他α?共核蛋白病的應用的制作方法
技術領域
本發明涉及具有對人類α-突觸核蛋白(α-synuclein)原細纖維(protofibrils)高的親和力和α-突觸核蛋白單體低的結合的抗體或其片段,其中抗體或片段具有特定的互補決定區(CDR)序列。本發明也涉及包含這樣的抗體或片段的組合物,并涉及利用這樣的抗體或片段檢測α-突觸核蛋白原細纖維的方法。在進一步的實施例中,本發明涉及通過給予這樣的抗體或片段預防、推遲具有α-突觸核蛋白病理的神經退化性疾病(neurodegenerative disorder)的發作或治療所述疾病的方法,并涉及在制備治療具有α-突觸核蛋白病理的神經退化性疾病的藥物組合物中應用這樣的抗體或片段。本發明也涉及在診斷或監測具有α-突觸核蛋白病理的神經退化性疾病的發展中應用這樣的抗體或片段,并涉及通過這樣的抗體或片段的給予減少或抑制α-突觸核蛋白聚集的方法。
背景技術:
帕金森氏癥(PD)和路易體癡呆(dementia with Lewy bodies)(DLB)是具有α-突觸核蛋白腦病理的神經退化性疾病的兩個最普遍的實例。PD是最普遍的運動紊亂,且PD的特點是僵化、運動功能減退、顫動和姿勢不穩定(postural instability)。認為大約四到六百萬的世界人口患PD。DLB代表所有癡呆的5-15%。除了健忘和經常波動的其他瘋狂的癥狀之外,DLB病人一般遭受反復出現的跌傷和視幻覺。
α-突觸核蛋白的神經元內(Intraneuronal)積聚導致路易體的形成,球形的嗜曙紅玻璃質10-20μm大的內含物,或路易神經突的形成,拉長的線狀的畸形的軸突和樹突。在PD腦中,路易體和路易神經突的沉積物通常限于連接紋狀體和黑質(substantia nigra)的神經細胞。這些細胞對于運動和姿勢功能的完成、說明PD癥狀的本性來說是至關重要的。在DLB腦中,在中腦和皮質區域中都發現路易體和路易神經突的廣泛分布的沉積物。
α-突觸核蛋白是主要地發現的神經內的蛋白質。在神經細胞內,α-突觸核蛋白主要地位于突觸前(presynaptically),且因此推測它在突觸的活性的調節中扮演的作用。識別了α-突觸核蛋白的三個主要的亞型,它的最長的和最普通的形式包含140個氨基酸。這種亞型已被應用,根據本發明的抗體的α-突觸核蛋白(α-突觸核蛋白)有關的特征涉及α-突觸核蛋白的這種亞型。
除了α-突觸核蛋白之外,路易體由多種分子組成,其中一個分子是4-羥基-2-壬烯醛(4-hydroxy-2-nonenal)(HNE)、α,β-不飽和的羥基烯烴(hydroxyalkenal)(Qin等人,2007)。在體外已經顯示HNE能修飾α-突觸核蛋白,且因此促進α-突觸核蛋白的寡聚化(oligomerization)。特別地是,已經顯示HNE增加和固定原細纖維的形成,例如,α-突觸核蛋白的可溶解的較大的寡聚形式(Qin等人,2007;WO 2009/133521,包括在此以供參考)。
在許多由錯誤折疊的α-突觸核蛋白的病理的積聚表征的神經退化性疾病中已經暗示了氧化應激(Oxidative stress)。各種活性氧組分能誘導脂質的過氧化,如細胞膜或脂蛋白,且也導致來自多不飽和脂肪酸的高度地活性醛的產生(yoritaka等人,1996)。
在具有DLB大約50%病例中可看到阿爾茨海默氏病(AD)的腦病理指征,例如,淀粉樣斑塊(amyloid plaques)和神經原纖維纏結(neurofibrillary tangles)。不清楚的是,平行的病理的存在是否暗示兩種不同的疾病或者僅僅代表每一個各自紊亂的變體。有時將共病理的病例描述為具有AD的路易體變體(Hansen等人,1990)。
近來的研究暗示了在AD和唐氏綜合征(Down's syndrome)中α-突觸核蛋白的作用,如已經證明了α-突觸核蛋白蛋白質在這些紊亂中的邊緣區中的積聚(Crews等人,2009)。
HNE對半光氨酸、組氨酸和賴氨酸的側鏈起反應并修飾所述側鏈,充分地改變這些側鏈的結構和物理性能。因此,HNE能與C-3碳或與醛基或其組合起反應。因此,HNE能作用于分子間地或作用于分子內共價地修飾蛋白質。
帕金森氏癥和路易體癡呆的遺傳學
能通過α-突觸核蛋白基因的點突變或重復形成PD和DLB的稀有的主要地遺傳的形式。已經描述了引起家族PD的致病突變A30P和A53T(Kruger等人,1998)(polymeropoulos等人,1998)和基因的重復(chartier-Harlin等人,2004),然而已經報道了引起PD或DLB的一個其他的α-突觸核蛋白突變,E46K(Zarranz等人,2004)和α-突觸核蛋白基因的三倍體(triplication)(Singleton等人,2003)。
僅部分地了解α-突觸核蛋白突變種的致病的結果。然而,體外數據已經顯示,A30P和A53T突變種增加聚集率(Conway等人,2000)。多種不同組成的α-突觸核蛋白種類(單體、二聚體、寡聚體,包括原細纖維)都涉及聚集過程,所有這些可具有不同的毒性。不清楚的是,哪一個分子種類在腦中有毒性作用。然而,最近的研究表明,α-突觸核蛋白的寡聚的形式是顯著地神經毒性的。通過引起遺傳的帕金森氏癥的某些α-突觸核蛋白突變種(A30P和A53T),導致寡聚化增加率的觀察給出關于寡聚物的作用的另外的證據。
還沒有完全地了解α-突觸核蛋白聚集級聯是如何開始的。可能,在這些中間大小種類在路易體中作為不可溶解的原纖維沉積之前,單體的α-突觸核蛋白的改變的構造開始二聚體和三聚體的形成,其繼續形成較大的可溶解的寡聚體,包括原細纖維。也應該理解,α-突觸核蛋白寡聚體,一旦它們形成,則能結合新的單體和/或α-突觸核蛋白較小的多聚體,因此加速原纖維(fibrils)形成過程。這樣的播種(seeding)作用可能也能在細胞外空間中發生,如最近的證據表明α-突觸核蛋白病理可在患病的腦中從神經細胞傳播到神經細胞。
除了在α-共核蛋白病(synucleinopathies)中的神經病理的改變之外,α-突觸蛋白的水平通常在受侵襲的腦區域中增加(Klucken等人,2006)。
α-共核蛋白病的主要的病理是細胞內的,其引起免疫治療途徑的挑戰。然而,可能,活躍誘導的片段或被動給予的抗體也能在神經元內結合它們的靶抗原。此外,血漿和腦脊髓液兩者中的α-突觸核蛋白的識別(El-Agnaf等人,2006)說明,不僅僅在神經細胞內發現所述蛋白質。減少的這樣的細胞外α-突觸核蛋白可改變細胞內和細胞外蛋白質集合之間的平衡,且也導致減少細胞內的α-突觸核蛋白。證據表明,在溶液中的α-突觸核蛋白能滲透細胞膜中的脂質雙分子層,并因此內在化或輸出細胞。最近的發現證明,α-突觸核蛋白在細胞外的空間中有毒性作用,因此,提供關于α-突觸核蛋白病理如何作為疾病發展傳遍腦的似乎真實的解釋。研究顯示,在移植的PD病人中路易病理傳播給移植的神經細胞(Li等人,2008)。此外,通過內吞作用(endocytosis)將α-突觸核蛋白傳播給鄰近的神經細胞,且α-突觸核蛋白聚集體的細胞到細胞的傳播已經與PD和其他α-共核蛋白病中的神經細胞死亡和病態發展聯系(Desplats等人,2009)。
PD和DLB的診斷
需要改進的診斷工具和方法,從而識別具有α-突觸核蛋白病理的神經退化性疾病的風險。現今,在對腦的真實的傷害已經發生之前,沒有生物化學的方法能幫助臨床醫生診斷在疾病的早期階段中的病人的臨床癥狀。
精確的診斷分析變得比新治療的可能性出現更加重要。截至今天,只有癥狀治療(通過取代腦中活性的多巴胺的損失)對PD病人可用。對于DLB,甚至更少的治療選擇是可用的。然而,臨床醫生經常地評價對于AD的標準治療對DLB病人的可能的有益的影響,例如,膽堿酯酶抑制劑。在任一方法中,對于α-共核蛋白病的現有的治療策略沒有一個可針對潛在的疾病過程。另外,也需要監測疾病發展和治療效果。對于改變帕金森氏癥的發展的不同的方法的評價,參見George等人,2009。
考慮到上述提及的參與幾種神經退化性疾病中的α-突觸核蛋白,需要能消除或減少有毒的α-突觸核蛋白種類的影響的新的治療,并需要好的生物標志物,以監測新的干涉并提供好的預測特異性。
技術實現要素:
本發明涉及具有對人類α-突觸核蛋白原細纖維高的親和力和α-突觸核蛋白單體的低的結合的改進的抗體和它的片段。本發明也涉及包含這樣的抗體或片段的組合物和涉及利用這樣的抗體或片段檢測α-突觸核蛋白原細纖維的方法。在進一步地實施例中,本發明涉及通過給予這樣的抗體或片段預防、推遲具有α-突觸核蛋白病理的神經退化性疾病的發作或治療所述疾病的方法,并涉及制備在具有α-突觸核蛋白病理的神經退化性疾病的治療的藥物組合物中使用的這樣的抗體或片段。本發明也涉及在具有α-突觸核蛋白病理的神經退化性疾病的發展的診斷或監測中這樣的抗體或片段的應用,并涉及通過這樣的抗體或片段的給予減少或抑制α-突觸核蛋白聚集的方法。
在一個實施例中,抗體或其片段具有對人類α-突觸核蛋白原細纖維高的親和力和α-突觸核蛋白單體的低的結合,和具有三個可變的重鏈(VH)CDR序列(VH-CDR-1、VH-CDR-2、和VH-CDR-3和三個可變的輕鏈(VL)CDR系列(VL-CDR-1、VL-CDR-2、和VL-CDR-3),其中抗體或其片段的六個CDR序列選自下列各組:
VH-CDR-1 SEQ ID NOS:22,23,24,25,26或者27
VH-CDR-2 SEQ ID NOS:28,29,30,31,32,33或者34
VH-CDR-3 SEQ ID NOS:35,36,37,38,39或者40
VL-CDR-1 SEQ ID NOS:41,42,43,44,45或者46
VL-CDR-2 SEQ ID NOS:47,48或者49
VL-CDR-3 SEQ ID NOS:50,51,52,53,54或者55
在另一個實施例中,抗體或其片段具有對人類α-突觸核蛋白原細纖維高的親和力和α-突觸核蛋白單體的低的結合,和具有三個可變的重鏈(VH)CDR序列(VH-CDR-1、VH-CDR-2、和VH-CDR-3和三個可變的輕鏈(VL)CDR系列(VL-CDR-1、VL-CDR-2、和VL-CDR-3),其中抗體或其片段的六個CDR序列選自下列各組,和與任何一個各自組的所述序列具有大于70、80、90、95或98%的相似性的序列:
VH-CDR-1 SEQ ID NOS:22,23,24,25,26或者27
VH-CDR-2 SEQ ID NOS:28,29,30,31,32,33或者34
VH-CDR-3 SEQ ID NOS:35,36,37,38,39或者40
VL-CDR-1 SEQ ID NOS:41,42,43,44,45或者46
VL-CDR-2 SEQ ID NOS:47,48或者49
VL-CDR-3 SEQ ID NOS:50,51,52,53,54或者55
其中抗體或其片段結合到模型系統中的固定的線性α-突觸核蛋白的氨基酸區域113-140內的表位上,例如,113-131,具體地,表位125-131、121-124、121-127、121-131、113-123或136-140上,其中所述模型系統中的固定的線性α-突觸核蛋白包含具有11個氨基酸重疊的15-merα-突觸核蛋白肽。
根據本發明的抗體、片段、組合物和方法在具有和/或在發展這樣的疾病的風險上的個體中,在診斷、監測、預防、推遲具有α-突觸核蛋白病理的神經退化性疾病的發作和/或治療中提供改進。
通過具體的說明,本發明的各種實施方式的另外的方面、實施例和優勢將更加明顯。
附圖說明
通過附圖,將更加充分地理解具體實施方式,其中:
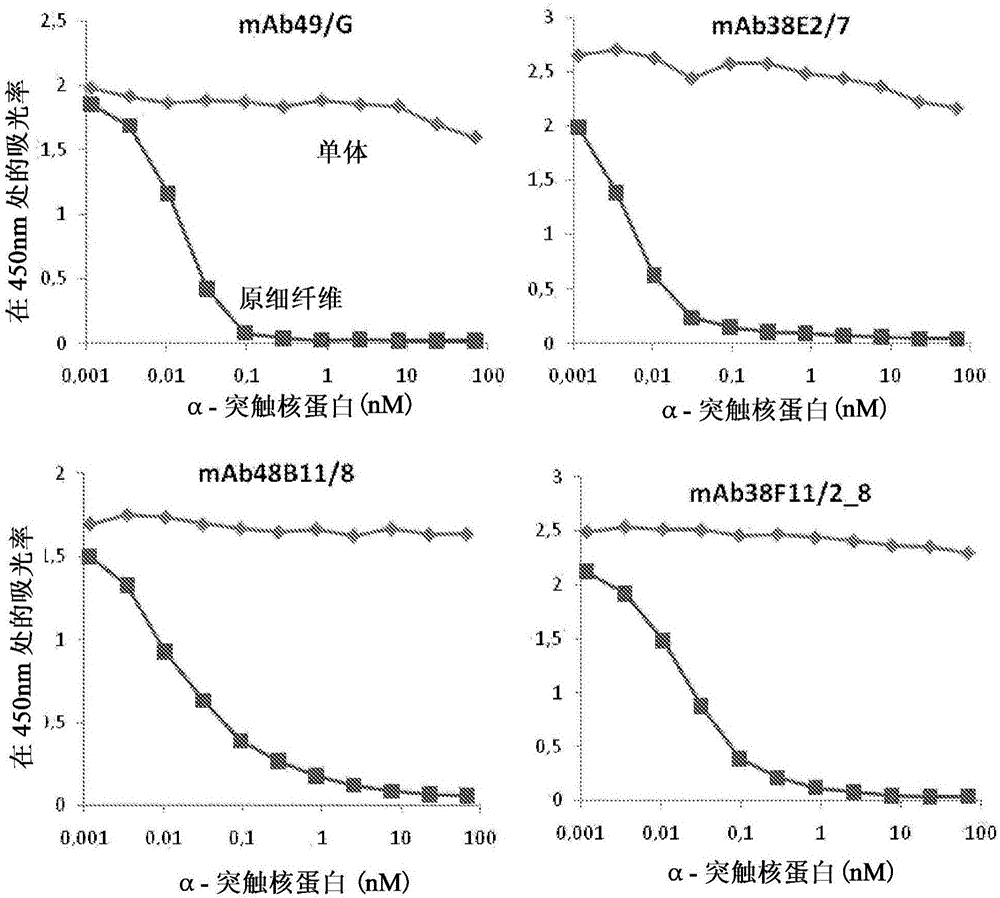
圖1顯示如通過競爭性ELISA測定的原細纖維特異性單克隆抗體的性能。如實例4中描述的利用HNE-固定(stabilized)的α-突觸核蛋白原細纖維進行試驗。
圖2A和圖2B顯示通過如實例4中描述的競爭性ELISA分析原細纖維特異性抗體mAb49/G的性能。圖2A顯示原細纖維特異性單克隆抗體mAb49/G以高親和力結合到通過HNE或ONE固定的人類α-突觸核蛋白原細纖維上。圖2B顯示單克隆抗體也以高親和力結合到α-突觸核蛋白的人類突變的形式的HNE-固定的原細纖維上,A30P和A53T。
圖3A-圖3C顯示通過如實例4中描述的競爭性ELISA分析的原細纖維特異性抗體的性能。原細纖維特異性單克隆抗體以高親和力結合到通過HNE(PF-HNE)或ONE(PF-ONE)固定的野生型人類α-突觸核蛋白原細纖維上。單克隆抗體也以高親和力結合到α-突觸核蛋白的人類突變的形式的HNE-固定的原細纖維上,A30P(A30P-HNE)和A53T(A30P-HNE)。
圖4A和圖4B涉及通過如實例5中描述的三明治式ELISA(夾心ELISA,sandwich ELISA),α-突觸核蛋白原細纖維的量化。圖4A顯示用作捕獲抗體和檢測抗體兩種作用的原細纖維特異性抗體mAb49/G的示意圖。圖4B顯示利用HNE-固定的α-突觸核蛋白原細纖維產生的標準的曲線。試驗性能達到LOQ=9pM的量化的限制。
圖5A和圖5B顯示利用如實例6中描述的α-突觸核蛋白原細纖維特異性三明治式ELISA,患病的(DLB)和對照的人類腦提取物的分析的結果。
圖6顯示如實例7中描述的對照組小鼠(ntg,非轉基因的)和來自Khale轉基因的(tg)小鼠PD模型的5月大的小鼠的腦提取物的分析。利用tris緩沖鹽(TBS)和含有Triton的TBS提取腦組織。利用如實例5中描述的α-突觸核蛋白原細纖維三明治式ELISA進行分析。原細纖維特異性抗體mAb49/G用作捕獲抗體和檢測抗體。在圖表中,y軸代表在OD450上的吸光率。
圖7A-圖7F顯示如實例8中描述的組織的免疫組織化學(IHC)分析。圖7A顯示路易體的38E2/7結合,且PD黑質中的神經突和陽性α-α-突觸核蛋白對照。圖7B顯示路易體的38E2/7結合和在DLB皮質和黑質中的神經突以及陽性α-α-突觸核蛋白對照。圖7C顯示多種抗體結合路易體和在DLB皮質和黑質中的神經突和陰性對照。圖7D顯示多種抗體結合路易體和在PD黑質中的神經突和陰性對照。圖7E顯示在非疾病相關的黑質中38E2/7沒有結合且陽性α-α-突觸核蛋白對照。圖7F顯示38E2/7結合和在阿爾茨海默氏癥病人的皮質中的陽性α-Aβ對照的比較。
圖8A和圖8B顯示利用如實例9中描述的腦提取方案,提取的具有原細纖維選擇性的單克隆抗體38E2/7的人類腦提取物的免疫沉淀反應。
圖9A和圖9B顯示利用如實例10中描述的裝備FITC落射熒光(epifluorescence)濾光器的Axiovert 200顯微鏡測量的熒光數據。圖9A顯示處理過的細胞,而圖9B顯示與抗體未處理的α-突觸核蛋白過表達的細胞相比較,將其設定為100%,以在熒光強度中相對%減少計算的數據。
考慮到下面列出的實施例,將更充分地理解各個圖。
具體實施方式
在第一個實施例中,本發明涉及具有對人類α-突觸核蛋白原細纖維高親和力和α-突觸核蛋白單體的低的結合的改進的抗體和它的片段。在具體的實施例中,抗體是一類IgG抗體或它的變體。在本公開內,對人類α-突觸核蛋白原細纖維的高的親和力意味著,抗體或片段對人類α-突觸核蛋白原細纖維表現小于10-7M的分離常數Kd。如本領域已知的,原細纖維是α-突觸核蛋白的可溶解的寡聚物。典型的原細纖維具有的分子量范圍從大約1000到大約5000kDa,以球狀蛋白為參考,利用尺寸排阻色譜適當地測量,但是本發明不限于這樣的典型的原細纖維。另外,在本公開內,α-突觸核蛋白單體的低的結合意味著,根據本發明的抗體或片段對α-突觸核蛋白單體的結合至少小于對α-突觸核蛋白原細纖維的結合的100倍。在具體的實施例中,根據競爭性ELISA,例如,如實例4中描述的,測量這些結合親和力。
本發明進一步涉及在預防、推遲具有α-突觸核蛋白病理的神經退化性疾病的發作、所述疾病的治療、監測和/或診斷中用于改進的這樣的抗體和片段的方法和應用,所述疾病包括,但不限于,帕金森氏疾病(PD)、路易體癡呆(DLB)、阿爾茨海默氏癥的路易體變體(the Lewy body variant of Alzheimer’s disease)、多發性系統萎縮癥、精神病、精神分裂癥和克雅二氏病(Creutzfeldt-Jakob disease)。在α-共核蛋白病中,作為路易體和路易神經突的聚集的α-突觸核蛋白在腦中,在某些指征中,也在其他器官中積聚。
已經通過經典的雜交瘤細胞技術揭露了根據本發明的抗體的實例。抗體可以是多克隆抗體或單克隆抗體。在具體的實施例中,抗體是單克隆抗體。在很多場合中本公開涉及抗體和它的片段時,為了方便的目的,在本公開中的術語“抗體”包括它的片段,意味著它的活性片段,例如,片段具有根據本發明的抗體定義的相同的特征,即對α-突觸核蛋白寡聚體/原細纖維具有高親和力和α-突觸核蛋白單體低的結合。在病理形式的α-突觸核蛋白的清除中,抗體和它的片段表現出高效率。
發明的抗體結合聚集的形式,具體地是原細纖維,包括未修飾的或結合的α-突觸核蛋白,例如,結合到4-羥基-2-壬烯醛(HNE)或4-氧-壬烯醛(4-oxo-2-nonenal)(ONE)、或其他α,β-不飽和的羥基烯烴、或多-不飽和脂肪酸,這種結合固定致病的原細纖維/寡聚α-突觸核蛋白表位。所述表位在構象改變的或修飾的α-突觸核蛋白上出現,例如,在患有α-共核蛋白病的病人的腦中出現的α-突觸核蛋白原細纖維和寡聚體,如,但不限于,帕金森氏癥、DLB,等等。發明的抗體也結合到通過α-突觸核蛋白突變種形成的致病的原細纖維/寡聚結構上,例如,已經描述了引起家族PD的A30P和A53T(Kruger等人,1998)(Polymeropoulos等人,1997)。本發明的抗體的這種靶目標的另一個實例是通過引起PD或DLB的突變種α-突觸核蛋白E46K形成的原細纖維。
在本發明的一個具體的實施例中,提供用于區分、診斷、識別與α-突觸核蛋白病理有關的疾病的發展的風險、和/或治療所述疾病的單克隆抗體,包括,但不限于,例如,帕金森氏癥、路易體癡呆、阿爾茨海默氏病的路易體變體、阿爾茨海默氏病、唐氏綜合征、多發性系統萎縮癥、精神錯亂、精神分裂癥、克雅二氏病(Creutzfeldt-Jakob disease)和其他神經退化性疾病。
本發明的抗體或片段包括在抗體的可變的輕鏈(VL)和可變的重鏈(VH)鏈上的CDR1-3區域限定的氨基酸序列,其中所述抗體對含有“PD和/或DLB疾病的表位”的可溶解的α-突觸核蛋白原細纖維具有高的親和力。在具體的實施例中,CDR區域與Fc區域的變型結合,以便調節效應器功能,如,但不限于,Fc受體結合(Fc receptor binding)、補體因子C1q結合(complement factor Clq binding)、有效的半衰期(effecting half-life)、補體的激活(complement activation)和炎癥過程。抗體的恒定區具有許多重要的功能,顯著地結合Fc-受體和補體因子C1q。能阻止后面的功能激活,以便避免炎癥反應。
如與其他已知的免疫治療的治療藥比較,具有對α-突觸核蛋白原細纖維高的親和力和對α-突觸核蛋白單體低的結合的本發明的抗體和片段具有下列獨特的優勢:
1)本發明的抗體和片段例如,通過抑制寡聚化(參見實例10)或通過其他機制,靶向和滅活或至少減少疾病引起的α-突觸核蛋白原細纖維。
2)通過本發明的抗體和片段表現的對α-突觸核蛋白原細纖維的高的親和力減少治療需要的有效的臨床劑量。
3)與活性的免疫方法例如疫苗比較,本發明的抗體和片段提供在老年病人中精確劑量的模式。
4)在邊緣區/全身中對α-突觸核蛋白單體的低的結合,因此允許更多的抗體/片段可用于腦中α-突觸核蛋白寡聚形式的結合和清除。
5)抗體和片段通過對補體因子C1q低的或沒有的結合減少炎癥副作用的風險,例如,腦膜腦炎(meningioencephalitis)。
本發明的一個方面是CDR區域的抗體氨基酸序列的發現,其中所述CDR區域對于人類野生型和突變體α-突觸核蛋白原細纖維的結合扮演重要的作用。通過對野生型人類α-突觸核蛋白寡聚體/原細纖維的高的親和力表征具有根據本發明的結合位點(CDR區域)的抗體,以便用作治療或診斷。
免疫球蛋白(IgG)分子的基礎結構包括通過二硫橋連接在一起的兩個同樣的輕鏈和兩個同樣的重鏈。輕鏈,其是λ或κ,具有每一個大約110個氨基酸殘基的可變區域(VL)和恒定區域(CL)。重鏈具有大約110個氨基酸殘基的可變區域(VH),但是具有300-400個氨基酸殘基的更大的恒定區域(CH),包括CHγ1、CHγ2和CHγ3區域或結構域。
恒定區(Fc)激活補體系統并結合到巨噬細胞、小神經膠質細胞和嗜中性細胞上的Fc受體上,其吸收和破壞感染的微生物或外源的/非自身的抗原。這種功能是重要的,因為它是抗體的治療原則的部分,例如,Fc受體介導小神經膠質細胞的吞噬作用和α-突觸核蛋白原細纖維的清除。已經證明了通過溶酶體降解途徑調節的α-突觸核蛋白寡聚體的清除(Lee等人,2004)。這個過程涉及,在其中降解α-突觸核蛋白原細纖維的溶酶體的融合之后,受體依賴的或非受體依賴的抗體/原細纖維復合物的內吞作用(Masliah等人,2005)。已經表明了控制這個過程的受體包括Thy1.1受體和與脂蛋白受體有關的蛋白質(LPR)。
也可能操作其他的抗α-突觸核蛋白的清除機制。可溶解的α-突觸核蛋白原細纖維的清除是根據本發明的治療的重要的機制,認為α-突觸核蛋白原細纖維是高度地毒害神經的,啟動和加快了疾病過程。腦中α-突觸核蛋白原細纖維的清除是重要的臨床評價的機制。除了α-突觸核蛋白原細纖維的清除之外,將通過α-突觸核蛋白原細纖維如,α-突觸核蛋白原細纖維、二聚體、三聚體、四聚體和更高的寡聚形式的前體形式的清除間接地簡化包括α-突觸核蛋白原纖維的其他α-突觸核蛋白聚集的形式。包括原細纖維和原纖維的不同的α-突觸核蛋白形式保持平衡狀態。利用高的親和力的原細纖維結合抗體的治療并通過所述抗體對α-突觸核蛋白原細纖維的清除也具有間接地簡化其他α-突觸核蛋白聚集的或寡聚的形式的優勢。還有另一個抗體的作用機制是通過結合到毒性的α-突觸核蛋白種類和阻止它們的與神經細胞的相互作用阻斷或抑制α-突觸核蛋白的毒性。
重鏈和輕鏈的各自的可變區含有稱作互補決定區或CDR的三個高變區(hyper variable regions)。CDR區域是位于VL和VH區域中的,大約7-23個,例如,13-23個氨基酸的短的延伸。抗體的一個“臂”上的六個CDR區域形成結合抗原的“口袋”。在文獻中使用CDR-序列的幾個定義。SEQ ID NOS:1-21利用第一識別系統定義發明的CDR-序列,因而在表格1中(參見實例2)通過下劃線區域在人類野生型和突變體α-突觸核蛋白原細纖維特異性單克隆抗體中的VL和VH中顯示識別的CDR序列。SEQ ID NOS:22-55利用已知的Kabat系統識別發明的CDR-序列,因而在表格2中(參見實例2)通過下劃線區域在人類野生型和突變種α-突觸核蛋白原細纖維特異性單克隆抗體中的VL和VH中顯示識別的Kabat CDR序列。在本公開中使用根據Kabat(SEQ ID NOS:22-55)發明的CDR-序列的識別。
因而,一個實施例中,通過具有六個CDR序列(VH-CDR-1、VH-CDR-2、VH-CDR-3、VL-CDR-1、VL-CDR-2、和VL-CDR-3)表征根據本發明的抗體,其中所述CDR序列選自以任意組合的方式的CDR序列的每個下列各自組。
VH CDR-1
VH CDR-2
VH CDR-3
VL CDR-1
VL CDR-2
KVSNRFS SEQ ID NO:17(SEQ ID NO:47)
RTSNLAS SEQ ID NO:18(SEQ ID NO:48)
WASTRES SEQ ID NO:49
VL CDR-3
排除了為了某些感興趣的特征最初選擇的一個抗體,因為它不能滿足根據本發明的標準的定義的抗體。這種排除的重要的參數是具有由這種抗體暴露的五個氨基酸的相當短的VH CDR-3序列。因此,推斷,VH CDR-3序列需要超過5個氨基酸。在具體的實施例中,VH CDR-3序列是9、10、11或12個氨基酸。
在具體的實施例中,根據本發明的抗體和片段具有選自下列組合的六個CDR序列:
SEQ ID NOS:22,28,35,41,47和50,
SEQ ID NOS:23,29,36,42,47和50,
SEQ ID NOS:24,30,37,43,48和51,
SEQ ID NOS:25,31,38,44,47和52,
SEQ ID NOS:26,32,39,45,47和53,
SEQ ID NOS:23,33,37,43,48和54,和
SEQ ID NOS:27,34,40,46,49和55。
在另外的具體的實施例中,在滿足此處定義的其他重要的特征時,提供關于α-突觸核蛋白原細纖維的期望的特異性的抗體具有選自下列下列各組的抗體或片段的六個CDR序列:
VH CDR-1 SEQ ID NOS:23,24,25或者26
VH CDR-2 SEQ ID NOS:29,30,31或者32
VH CDR-3 SEQ ID NO:36
VL CDR-1 SEQ ID NOS:42,43,44或者45
VL CDR-2 SEQ ID NOS:47或者48
VL CDR-3 SEQ ID NOS:50,51,52或者53
或選自下列各組:
VH CDR-1 SEQ ID NOS:23,24,25或者26
VH CDR-2 SEQ ID NOS:29,30,31或者32
VH CDR-3 SEQ ID NO:37
VL CDR-1 SEQ ID NOS:42,43,44或者45
VL CDR-2 SEQ ID NOS:47或者48
VL CDR-3 SEQ ID NOS:50,51,52或者53
或選自下列各組:
VH CDR-1 SEQ ID NOS:23,24,25或者26
VH CDR-2 SEQ ID NOS:29,30,31或者32
VH CDR-3 SEQ ID NO:38
VL CDR-1 SEQ ID NOS:42,43,44或者45
VL CDR-2 SEQ ID NOS:47或者48
VL CDR-3 SEQ ID NOS:50,51,52或者53
或選自下列各組:
VH CDR-1 SEQ ID NOS:23,24,25或者26
VH CDR-2 SEQ ID NOS:29,30,31或者32
VH CDR-3 SEQ ID NO:39
VL CDR-1 SEQ ID NOS:42,43,44或者45
VL CDR-2 SEQ ID NOS:47或者48
VL CDR-3 SEQ ID NOS:50,51,52或者53。
如先前提到的,通過對靶目標的高的親和力表征α-突觸核蛋白原細纖維結合的根據本發明的抗體和片段。高親和力,以分離常數Kd表示,小于10-7M。在另外的實施例中,對于人類α-突觸核蛋白原細纖維的分離常數Kd小于10-8M、小于10-9M、小于10-10M、或甚至小于10-11M。與具有10-6M周圍或更高的親和力的抗體比較,這些抗體和片段具有它們能夠以較低的劑量給予的優勢。如這些能通過注射給予的高親和力抗體,能皮下給予,因為為了達到功效只需要低量的抗體,這具有重要的臨床優勢。給予方式不限于皮下的或靜脈注射。此外,功效需要較低的劑量將減少用于抗體生產的物質的成本。
除了抗體對α-突觸核蛋白原細纖維的高的親和力之外,抗體和片段對α-突觸核蛋白單體表現低的結合,和可選地對α-突觸核蛋白原纖維表現低的結合。如上述提到的,對α-突觸核蛋白單體的低的結合意味著,根據本發明的抗體或片段對α-突觸核蛋白單體的結合小于對α-突觸核蛋白原細纖維的結合的至少100倍。在更具體的實施例中,根據本發明的抗體或片段對α-突觸核蛋白原細纖維的結合超過對α-突觸核蛋白單體的結合的500倍或甚至超過1000倍。
在另一個實施例中,抗體和片段對α-突觸核蛋白原纖維表現低的結合。在更具體的實施例中,根據本發明的抗體或片段對α-突觸核蛋白原細纖維的結合超過對α-突觸核蛋白原纖維的結合的100倍、500倍、或甚至超過1000倍。
在本發明的還有的另一個實施例中,抗體和片段對β淀粉樣(Aβ)原細纖維表現低的結合(例如,Kd>10-5M)且對β淀粉體單體表現低的結合(例如,Kd>10-5M)。
在本發明的還有的另一個實施例中,抗體和片段對β-突觸核蛋白單體、γ-突觸核蛋白單體、IAPP(胰島淀粉樣多肽(islet amyloid polypeptide))、和/或Medin多肽表現低的結合,例如,抗體和片段對一個或更多這些肽/蛋白質的結合至少小于對人類α-突觸核蛋白原細纖維的結合的100倍。
根據本發明的另一個實施例,能通過在模型系統中對氨基酸(aa)區域113-140內的α-突觸核蛋白中的線性表位的結合限定為根據本發明的抗體或片段,例如,aa區域113-131,具有aa 125-131、121-124、121-127、121-131、113-123和136-140作為特定的表位的實例。在這種模型系統中,使用具有11個氨基酸序列重疊的15-merα-突觸核蛋白肽(參見下列實例3)。
根據本發明的另外的實施例,提供抗體或片段,所述抗體或片段具有對人類α-突觸核蛋白原細纖維高的親和力和α-突觸核蛋白單體低的結合,且包含選自SEQ ID NO:22-27、28-34、35-40、41-46、47-49和50-52的每一個六個CDR序列組的一個CDR-序列的組合,且序列與每一個各自組中的所述序列的任何一個具有大于70、80、90、95或98%的相似性。抗體或片段結合到氨基酸(aa)區域113-140內的表位上,例如,aa區域113-131,和具體地模型系統中的固定的線性α-突觸核蛋白的表位aa125-131、121-124、121-127、121-131、113-123或136-140,其中所述系統包含具有11個氨基酸重疊的15-merα-突觸核蛋白。
根據本發明的另一個具體的實施例,高親和力α-突觸核蛋白原細纖維結合的抗體能減少或抑制α-突觸核蛋白聚集,因此減少腦中可溶解的寡聚α-突觸核蛋白形式的水平。
根據本發明的另一個具體的實施例,高親和力α-突觸核蛋白原細纖維結合的抗體也能結合CNS外面的α-突觸核蛋白寡聚體/原細纖維,因此以這樣的方式改變血腦屏障上的所述α-突觸核蛋白形式的平衡,以便降低所述α-突觸核蛋白形式的CNS水平(排除)。
根據本發明的另一個具體的實施例,抗體是IgG類型的抗體,適于能經過血腦屏障的治療應用。可設計高親和力α-突觸核蛋白原細纖維結合的IgG抗體,以便減少結合到IgG1的CH2結構域上的補體因子C1q,并減少補體激活和炎癥的風險。能以幾種不同的方式完成這種修飾。一種方式是制造嵌合抗體,其中刪除了IgG1恒定區的CHγ2結構域并換成IgG4的相應的結構域或賦予C1q結合的部分結構域。很確定,IgG4不結合C1q,因此不激活補體級聯反應。為了完成這個,以這樣的方式設計重鏈(CH)的恒定區,以使IgG1上的高親和力Fc-受體結構域(CHγ3)與IgG4對補體因子C1q不具有結合的結構域(CHγ2)結合。含有嵌合的恒定的重鏈(IgG1:CHγ1、CHγ2:IgG4、CHγ3:IgG1)的這種新的抗體具有通過Fc-受體介導的吞噬作用使α-突觸核蛋白原細纖維有效的清除的重要的性能并減少副作用的風險,例如炎癥如腦膜腦炎的副作用的風險。
減少炎癥的風險的還有的另一個方式是改變抗體的寡聚糖結構,其將減少補體因子C1q結合和補體激活作用。已經描述了人類IgG1中Asn-297上的合成的雜合的寡聚糖的三十個不同的結構。認為CH2關聯的糖類的缺失引起抗體的“鉸鏈”區中的構象的改變,減少與效應器分子的相互作用的功效和補體激活功能和C1q結合的損失。
高親和力人類α-突觸核蛋白原細纖維結合抗體通過Asn-297的位置定點突變成任意其他的氨基酸的修飾將產生具有較少的C1q結合的保留Fc-受體結合的抗體,因此減少炎癥的風險,具體地是在血腦屏障上的炎癥的風險。抗體上可替換地修飾糖基化是在其中已經抑制了N-乙酰葡糖胺(acteylglucosaminyl)轉移酶的細胞類型中表達抗體。這將產生在Asn-297上具有改變的碳水化合物結構的抗體。形成Man5GlcNAc2的結構,但不限于這個結構。這種碳水化合物修飾將減少補體因子C1q結合和抑制炎癥(Wright等人,1998)。可替換地,能通過在含有衣霉素的情況下培養表達抗體的細胞獲得無糖基化的(aglycosylated)原細纖維結合抗體,其中所述衣霉素抑制糖基化。這些抗體已經改變了補體激活活性和改變Fc-受體功能(Leatherbarrow等人,1985)。具有低的補體激活和高的Fc-受體結合的表達抗體的克隆表達的篩選將產生原細纖維結合抗體,其表現α-突觸核蛋白原細纖維的高的Fc-介導的清除和低的C1q結合。
在另一個實施例中,高親和力人類α-突觸核蛋白原細纖維結合抗體是IgG亞型,例如,IgG1或IgG4,其中以這樣的方式已經修飾了補體因子C1q結合位點,例如,Pro331>Ser331(Xu等人,1994),以便減少或抑制補體因子C1q的結合。這樣的抗體特別地適合于,例如,用于治療、預防或推遲具有α-突觸核蛋白病理的神經退化性疾病的發作,對患有這樣的疾病或在發展這樣的疾病的風險上的個體給予這樣的抗體,例如,但不限于,患有或具有發展成PD的風險的個體。也能將人類IgG1中的位置331上的脯氨酸殘基改變成蘇氨酸或甘氨酸或任何其他極性氨基酸。能通過標準的分子生物學技術如定點突變或DNA缺失完成這種修飾。
本發明的還有的另一個方面是關于具體地測定人類或動物組織中的原細纖維水平的高親和力人類α-突觸核蛋白原細纖維結合抗體的應用,例如,腦脊髓液(CSF)、血、尿、唾液、腦組織中,作為診斷工具或生物標志用于,或用于監測,患有α-突觸核蛋白病理的神經退化性疾病。帕金森氏癥(PD)、路易體癡呆(DLB0、阿爾茨海默氏病的路易體變體、多發性系統萎縮癥、精神錯亂、精神分裂癥、和克雅二氏癥僅僅是患有α-突觸核蛋白病理的這樣的神經退化性疾病的例證。例如,如與不具有帕金森氏癥或任何其他α-共核蛋白病的匹配的老年的對照組相比,PD病人的CSF或血中的人類α-突觸核蛋白原細纖維的水平可能是不同的。與對照的受試者相比,發展帕金森氏癥或任何其他α-共核蛋白病的人可能改變了CSF或血液中的α-突觸核蛋白原細纖維的水平。因此,CSF或血液中α-突觸核蛋白原細纖維水平的測定能提供所述疾病的早期診斷。對于以根據本發明的新的高親和力的α-突觸核蛋白原細纖維結合抗體完成所述測定是可能的,且,在具體的實施例中,可結合三明治氏ELISA方法完成所述測定(參見實例5),其中已經測定了降至9pM水平的α-突觸核蛋白原細纖維。可以忽略其他α-突觸核蛋白形式的干擾,具體地α-突觸核蛋白單體,和可選地α-突觸核蛋白原纖維和試驗中的α-突觸核蛋白片段的干擾。
利用抗-α-突觸核蛋白原細纖維抗體分析這些組織和細胞培養基中的α-突觸核蛋白原細纖維的適當的方法的實例包含免疫分析如ELSA、RIA、蛋白質印跡或斑點印跡(dot blotting)。這些方法適合于如通過臨床試驗中原細纖維減少測量和/或如診斷檢驗的下列治療功效。因為CSF和血中的α-突觸核蛋白原細纖維水平是非常低的,本發明的高親和力α-突觸核蛋白原細纖維結合抗體用于診斷檢驗是有利的,例如,基于ELISA方法的診斷檢驗,以允許低水平的α-突觸核蛋白原細纖維的測量。
根據這樣的方法,將根據本發明的抗體或片段加入到包含或懷疑包含α-突觸核蛋白原細纖維的生物樣品上,且檢測在α-突觸核蛋白原細纖維和抗體或片段之間形成的復合物(complex)的存在。可定性地檢測復合物,例如,檢測復合物的存在,或定性地,例如,如期望的,可檢測復合物的濃度或復合物的閾值濃度。
在另外的實施例中,本發明包括在用于人類和動物組織中的α-突觸核蛋白原細纖維的檢測、定位和定量的成像中高親和力原細纖維特異性抗體和片段的應用。可利用可檢測的標簽標記抗體或片段,例如,放射性的配體如I131、C14、H3或鎵68,但不限于這些放射性同位元素,且與樣品接觸或為了檢測目的給予。這樣的方法適于用作具有α-突觸核蛋白病理的神經退化性疾病的診斷工具,所述疾病包括,但不限于,帕金森氏癥、路易體癡呆和其他α-突觸核蛋白有關的神經退化性疾病。在具體的實施例中,這樣的方法可指導監測沒有或在藥物治療或其他可能的治療下的受試者中的α-突觸核蛋白有關的疾病的發展。
因此,在本發明的一個方面中,將抗體加入到包含或懷疑包含α-突觸核蛋白原細纖維的生物樣品中,測量所述原細纖維和所述抗體之間形成的復合物的濃度,用于樣品中原細纖維的檢測和/或定量化。在具體的實施例中,檢測方法包含免疫分析和鄰位連接技術(proximity ligation assay)。生物樣品可以是從受試者獲得的體外樣品和體內液體。
本發明的還有的另一個方面是制造在獸醫中應用的特定的抗體種類。列出的診斷方法也適合于獸醫應用。
本發明的另一個方面是所述抗體的人源化,以便避免副作用,例如,以避免當用作治療或診斷試劑時對抗人類中的抗體的免疫響應。這樣的人源化技術在本領域的一個普通技術人員的能力內。
根據本發明的藥物組合物包含此處描述的抗體或片段,和藥物學上可接受的載體。在治療應用的具體的實施例中,組合物是生理學上可接受的配制劑,其包含在適于人類和/或動物給予的生理學上的緩沖液中根據本發明的抗體或片段的治療上的活性量,所述緩沖液例如,但不限于,PBS。為了更好的固定性,能凍干抗體或片段。凍干的配制劑可含有任何適當的傳統的賦形劑,包括固定劑、凍干支持劑(lyoprotectants)、緩沖液等等,如,但不限于,甘露醇,用于在凍干和/或后來的存儲期間和/或之后,保護和/或固定產品。
可選擇地,抗體配制劑可含有抗菌試劑或其他防腐劑或不干擾原細纖維結合抗體或片段的功能或功效的添加劑。
實施例
下列實施例用于說明,并不應理解為限制本發明的這些具體的實施例。
實施例1
α-突觸核蛋白原細纖維抗體
免疫/多克隆抗體
在免疫方案中,利用Balb/C小鼠。如抗原,使用HNE固定的α-突觸核蛋白原細纖維。如上面描述的生產這些,除了使用HNE和α-突觸核蛋白之間60:1的比率(WO 2009/133521,包括在此以供參考)。對于免疫,用HNE固定的α-突觸核蛋白原細纖維和佐劑(例如,3-6倍)注射小鼠。在處死小鼠之前,進行含有HNE-修飾的α-突觸核蛋白原細纖維的一個加強注射(booster injection)。分析對α-突觸核蛋白原細纖維和α-突觸核蛋白單體反應性的免疫的小鼠的血液。通過直接的ELISA分析多克隆抗體響應的特異性。在典型的實驗中,利用單體的α-突觸核蛋白(未修飾的或利用HNE或其他醛修飾的)、原細纖維/寡聚α-突觸核蛋白(未修飾的或利用HNE或其他醛修飾的)或纖維狀的α-突觸核蛋白,以400ng/孔的最終濃度包被在平底高度結合的96-孔聚苯乙烯微滴定板上。利用2%BSA封閉所述板,利用0.05%Tween-20/PBS洗滌板,并將來自研究的多克隆抗體的細胞培養基上清液(未稀釋的或利用磷酸鹽緩沖的鹽1:1稀釋的)作為初級抗體加入到孔中。將1/1000的稀釋的堿性的磷酸酶-結合的山羊-抗鼠鼠IgG/IgM抗體(Pierce Biotechnology,Rockford,IL,USA)用作第二抗體。利用p-硝基苯磷酸鹽(p-nitrophenyl-phosphate)(Sigma-Aldrich,MO,USA)可視化顯示免疫反應性。
在血清中,檢測特異性地識別α-突觸核蛋白原細纖維/寡聚體的抗體。另外,能發現識別α-突觸核蛋白單體的抗體。陰性對照代表未免疫的小鼠。
雜交瘤細胞/單克隆抗體
鼠B-細胞雜交瘤細胞用于生產單克隆α-突觸核蛋白原細纖維結合抗體。分離脾細胞且將其放置在消過毒的磷酸鹽-緩沖的鹽(PBS)中,以及在1200×g上離心10min,以便收集細胞富集的顆粒狀物。進一步利用PBS洗滌細胞,且在1200×g上離心10min。在以1%抗生素補充的達爾伯克氏改良伊格爾培養基(DMEM,Invitrogen,La Jolla,CA,USA)中重懸細胞顆粒狀物。在DMEM中將脾細胞與Sp2/0細胞(鼠骨髓瘤細胞系)以1:1比率混合。為了促進細胞融合,將1ml聚乙二醇(Sigma-Aldrich,St.Louis,MO,USA)加入到細胞混合物中,且添加DMEM終止反應。收集細胞,且在以10%(v/v)胎牛血清(Cambrex,Charles City,IA,USA)補充的和也含有1%(v/v)丙酮酸鈉(Cambrex,Charles City,IA,USA)、1%(v/v)抗生素(Sigma-Aldrich,St.Louis,MO,USA)和1%(v/v)L-谷氨酸(Cambrex,Charles City,IA,USA)、5%(v/v)BM條件介質(BM condition media)(Roche Diagnostics Scandinavia,Bromma,Sweden)和2%(v/v)HAT介質補充物(Sigma-Aldrich,St.Louis,MO,USA)的DMEM中重懸顆粒狀物。將細胞平鋪在96孔細胞培養板上,且允許保留并生長2周。
在直接的ELISA中分析雜交瘤細胞細胞上清液。在典型的實驗中,利用單體的α-突觸核蛋白(未修飾的或利用HNE或其他醛修飾的)、寡聚/原細纖維α-突觸核蛋白(未修飾的或利用HNE或其他醛修飾的)或纖維狀的α-突觸核蛋白包被在平底高度結合96-孔聚苯乙烯微滴定板上。利用1%BSA封閉所述板,利用PBS-Tween 20(0.05%)洗滌板,并將來自研究的雜交瘤細胞的細胞培養基上清液(未稀釋的或利用PBS-Tween 20(0.05%)1:2或1:5稀釋的)作為初級抗體加入到孔中。將1/5000稀釋的辣根過氧化物酶-結合的HRP-連接結合的山羊抗鼠Ig(Southern Biotechnology,prod.No.1010-05)用作第二抗體。利用K-藍色水性TMB基底液(K-Blue Aqueous TMB substrate)(Neogen Corp.prod.No.331177)可視化顯示免疫反應性。
實施例2
α-突觸核蛋白原細纖維特異性單克隆抗體重鏈(VH)和輕鏈(VL/Vkappa)的可變區的氨基酸序列
通過mRNA模板的RT PCR,隨后通過DNA測序測定抗體的重鏈(VH)和輕鏈(VL)的可變區的氨基酸序列,包括抗體的CDR區域的氨基酸序列。在表格1中顯示選擇性的抗體的可變重鏈區域(VH)和可變輕鏈區域(VL)的氨基酸序列。在CDR區域1-3的位置下劃線并顯示。CDR區域的氨基酸序列形成結合人類野生型和組成α-突觸核蛋白的“致病的表位”的突變的α-突觸核蛋白原細纖維的結構基礎。
在表格1中顯示根據本發明的原細纖維特異性抗體的各自的VL和VH鏈的CDR區域1-3的氨基酸序列。在表格2中,包括根據本發明的一系列另外的抗體的CDR-序列。
VH和VL鏈的CDR1-3區域的組合的氨基酸序列形成以高親和力和特異性結合人類α-突觸核蛋白野生型原細纖維的分子“口袋”。這種“口袋”形成“PD/DLB表位”的結構基礎。在VH鏈和VL鏈兩種鏈中都觀察到CDR氨基酸序列長度中的變化,且所述變化與對人類α-突觸核蛋白原細纖維的結合一致。較短的CDR區域提供更加有限的三維結構的抗體結合口袋,然而較長的CDR區域更靈活。
如在表格1和2中示出的CDR序列是本發明的實施例,因為它們是VH和VL鏈的“鼠框架”區域中的氨基酸序列,例如,CDR區域外面的,和原細纖維特異性抗體的人類VL和VH框架區域,但不限于那些。
與在表格1和2中示出的相比較,CDR區域中的其他氨基酸置換與高親和力和高特異性結合人類α-突觸核蛋白原細纖維相同。其中極性氨基酸在能通過一個極性氨基酸置換的具體的氨基酸的CDR區域中的具體的位置中出現,對α-突觸核蛋白原細纖維具有保留的或改進的高親和力和特異性結合。同樣地,如果非極性或負或正帶電荷的氨基酸在某些位置中出現,能通過來自相同的極性組的相似的氨基酸置換某些位置上的氨基酸。
如通過功能等效物在CDR區域中的任何位置中交換具體的氨基酸,其中功能的等效物賦予關于α-突觸核蛋白原細纖維親和力的抗體充分地相同的功能和結構,這樣的構造當然在本發明的范疇內。在這點上,與一個先前指示的各自組的VH CDR和VL CDR序列具有大于70、80、90、95或98%的相似性的抗體和片段,具有在本文中描述的維持的表位結合,都在本發明的范疇內。
表格1.來自人類野生型和突變α-突觸核蛋白原細纖維特異性的四個不同單克隆抗體的重鏈(VH)和輕鏈(VL/Vκ)的可變區的氨基酸序列。在VL和VH中的各種CDR區域(1-3)的位置有下劃線。抗體BA1-BA4是根據本發明的高親和力原細纖維特異性抗體的實例。
表格2.來自人類野生型和突變α-突觸核蛋白原細纖維特異性的八個不同抗體的重鏈和輕鏈的可變區的氨基酸序列。標記根據Kabat系統的各種CDR-區域的位置。抗體是根據本發明的高親和力原細纖維特異性抗體的實例。重鏈分別是SEQ ID NO:64-71和輕鏈分別是SEQ ID NO:72-79。
重鏈
輕鏈
突出CDR1-3。
實施例3
α-突觸核蛋白原細纖維特異性單克隆抗體的表位測定(Epitope mapping)
通過在Pepspots膜上的蛋白質印跡進行抗體的表位測定。通常通過JPT Peptide Technologies(Sigma Aldrich,UK的子公司)合成生成人類α-突觸核蛋白的全部序列(氨基酸1-140)的合成的多肽,且固定在Pepspots膜上。以11個氨基酸序列重疊設計33合成的15-mer肽。所述肽通過C-末端共價地連接到Whatman 50纖維素膜上(Whatman,England),且由于對于降解的更高的穩定性通常乙酰化N-末端。未改變的N-ac較好的代表天然的抗原中的區域,然后使NH3+-集團帶電荷。在表格3中列出結果。
表格3
人類α-突觸核蛋白(SEQ ID NO:80)
可替換地,通過在Pepspots膜(Sigma Aldrich)上的蛋白質印跡進行抗體的表位測定,如下:習慣合成生成從氨基酸100到140的人類α-突觸核蛋白的C-末端序列的合成的肽,且在Pepspots膜(Sigma Aldrich)上固定。以9個氨基酸重疊設計30合成的10-mer多肽。在表格4中顯示結果。
表格4:
因此,表位的長度和精確位置依賴用于測定的方法。
實施例4
通過競爭性ELISA顯示高親和力人類α-突觸核蛋白原細纖維結合的單克隆單體的特征
這個實施例顯示四個抗體(mAb49/G、mAb38E2/7、mAb38Fl l/2_8和mAb48Bll/8)。如依靠下面描述的競爭性ELISA分析測量的,這些抗體對α-突觸核蛋白原細纖維顯示高的親和力,且對α-突觸核蛋白單體顯示低的交叉反應性(結合)。簡要地,允許要檢驗的抗-α-突觸核蛋白抗體在溶液中與α-突觸核蛋白單體或原細纖維相互作用,其后,將混合物加入到預包被有α-突觸核蛋白原細纖維的微滴定板中。如果抗體結合到預孵育步驟中的抗原上,較少的抗體將結合到微滴定板上的固定的抗原上。通過堿性磷酸酶(APL)結合的第二抗體檢測結合到固定的抗原上的抗體。利用產生黃色的ALP基質(pNPP)孵育結合物,所述黃色能在微滴定板讀取器中在405nm上檢測。因此,低OD值反應溶液中抗體對抗原的高親和力。
具體地,以100μl/孔的在1×PBS中稀釋的1μg/ml的α-突觸核蛋白原細纖維包被在高度結合的ELISA微滴定板上,利用帶粘性的密封層密封且在+4℃孵育過夜。然后,丟棄包被溶液,且通過添加200μl/孔的PBS-Tween 20(0.05%)封閉板的殘余的結合能力。將密封板在室溫下(R.T.)通過900rpm的搖動孵育60min。
同時,在1×PBS-Tween 20(0.05%)中,通過將α-突觸核蛋白單體或原細纖維稀釋成140nM的濃度制備多肽溶液。在圓底的、低蛋白結合的微滴定板中,在50μl的體積中進行α-突觸核蛋白單體和原細纖維的10步的3×稀釋系列。關于這種溶液,加入在PBS-Tween 20(0.05%)中稀釋成100ng/ml的50μl的檢驗的抗體,且允許其在R.T.下通過在900rpm上搖動60min相互作用。隨后,將這些預孵育的樣品加入到洗滌過的(3×洗滌)包被的高結合的板上,且允許在R.T.下,而沒有搖動的情況下孵育15min。然后洗滌ELISA板,以便清除未結合的抗體。利用在PBS-Tween20(0.05%)中以1/1000稀釋的100μl ALP-連接結合的抗-鼠-IgG檢測結合的抗體,且在R.T.下通過在900rpm上搖動孵育60min。
最終,洗滌ELISA板,以便清除未結合的抗體并將100μl ALP-基質加入到每孔中。在R.T.孵育期間將板保持黑暗,直到形成黃色。每隔15min到120min,在405nm的波長上在連續的模式上測量吸光值。如果時間和吸光率之間存在線性關系,測量結果可用于IC 50測定。
以需要達到ELISA中的一半的信號的單體或原細纖維的濃度計算IC50值。通過方法UV-SEC,利用作為參考的商業的α-突觸核蛋白標準(cat.S-1001-1,rPeptide,USA,0.5mg作為利用BCA的檢測)檢測這種方法中使用的α-突觸核蛋白單體或原細纖維的濃度。圖1顯示如通過描述的競爭性ELISA檢測的四個原細纖維特異性單克隆抗體在450nm上的吸光率。利用HNE-固定的α-突觸核蛋白原細纖維進行試驗。
進一步的ELISA實驗顯示,候選的抗體對通過HNE或ONE固定的人類α-突觸核蛋白原細纖維顯現相同的親和力。如依靠競爭性ELISA證明的,抗體也結合通過HNE固定的A30P或A53Tα-突觸核蛋白突變種組成的α-突觸核蛋白原細纖維/聚集體。
特異性地,圖2A和2B顯示通過競爭性ELISA分析的原細纖維特異性抗體mAb49/G的結果。原細纖維特異性單克隆抗體mAb49/G以高親和力結合到通過HNE或ONE固定的人類α-突觸核蛋白原細纖維上(圖2A)。單克隆抗體也以高親和力結合到α-突觸核蛋白的人類突變的形式的HNE-固定的原細纖維,A30P和A53T上(圖2B)。如通過尺寸排阻色譜定義的,利用ONE的α-突觸核蛋白單體的聚集產生兩個截然不同的復合物種群。分別地洗脫這兩個截然不同的峰并標記為FP-ONE_大和FP-ONE_小。
另外,圖3A-3C顯示通過競爭性ELISA分析的另外的原細纖維特異性抗體38E2/7、38F11/2_8和48B11/8的結果。原細纖維特異性單克隆抗體以高親和力結合到通過HNE(PF-HNE)或ONE(PF-ONE)固定的野生型人類α-突觸核蛋白原細纖維上。單克隆抗體也以高親和力結合到α-突觸核蛋白的人類突變的形式的HNE-固定的原細纖維A30P(A30P-HNE)和A53T(A30P-HNE)上。
實施例5
α-突觸核蛋白原細纖維特異性三明治氏ELISA的建立
為了能夠測量生物樣品中的α-突觸核蛋白原細纖維,建立作為捕獲抗體和檢測抗體的具有mAb49/G的三明治式ELISA。這個試驗測量具有量化LOQ=9pM的限制的α-突觸核蛋白原細纖維(參見圖4B)。由于關于在標準的曲線中使用的α-突觸核蛋白原細纖維的大小的不確定,pM中的濃度基于一個α-突觸核蛋白單體的分子量(14000g/mol)。因為通過尺寸排阻色譜,已經評價了至少1,000,000g/mol的原細纖維的分子量,如摩爾α-突觸核蛋白原細纖維計算的檢測的限制能低至0.13pM。
通過HNE固定的α-突觸核蛋白原細纖維和單體的α-突觸核蛋白用于驗證ELISA的構造特異性。
由兩個同一的抗體組成的ELISA需要蛋白質的至少二聚體,以便產生信號。然而,大量過量的單體的α-突觸核蛋白,其可在生物樣品中自然地出現,能通過占據捕獲抗體包被的結合位點干擾α-突觸核蛋白原細纖維結合,因此抑制原細纖維結合。通過將增加的過量的α-突觸核蛋白單體加入到固定濃度的α-突觸核蛋白原細纖維(500pM,表示成單體單元)中研究這種問題,且利用mAb49/G ELISA分析。如期望的,因為α-突觸核蛋白單體很少結合到捕獲抗體上,如與α-突觸核蛋白原細纖維(500pM)比較,30000-倍摩爾過量的α-突觸核蛋白單體(15μM)不擾亂利用mAb49/G三明治式ELISA的測量。
圖4A顯示通過三明治式ELISA關于α-突觸核蛋白原細纖維量化的ELISA結合的示意圖。圖4B顯示利用HNE-固定的α-突觸核蛋白原細纖維產生的標準的曲線。試驗性能達到量化LOQ=9pM的限制。
實施例6
利用α-突觸核蛋白原細纖維特異性三明治式ELISA進行患病的和對照組人類腦提取物的分析
利用不同的洗劑進行腦提取方案,產生三個不同的提取物:TBS提取物(圖5A,白色柱),包含細胞外和細胞質α-突觸核蛋白種類;Triton提取物(圖5A,條紋柱),包含膜-關聯的α-突觸核蛋白種類;和SDS提取物(圖5B,黑色柱),包含SDS-可溶解的α-突觸核蛋白種類。分析診斷的患有α-共核蛋白病路易體癡呆(DLB)的病人的腦提取物。分析皮質和黑質的腦組織。作為對照,也分析沒有可檢測的免疫組織化學的路易體病理的受試者的腦組織。三明治式ELISA基于作為捕獲抗體和檢測抗體的α-突觸核蛋白原細纖維特異性mAb49/G。圖5A和5B顯示利用α-突觸核蛋白原細纖維特異性三明治式ELISA,患病的和對照的人類腦組織提取物的分析的結果。試驗允許在大于9pM的水平上的原細纖維的量化(量化限制;LOQ=9pM)。
實施例7
PD轉基因的小鼠模型的腦提取物中的α-突觸核蛋白原細纖維的測量
盡管迄今為止不存在關于生物樣品中的α-突觸核蛋白原細纖維的直接的分析方法,但已經表明了細胞和小鼠模型中的α-突觸核蛋白原細纖維的存在。mAb49/G三明治式ELISA因此提供測量α-共核蛋白病的生物樣品和小鼠模型中的α-突觸核蛋白原細纖維的首次機會,所述α-共核蛋白病由聚集的α-突觸核蛋白的積聚表征。
將過表達人類α-突觸核蛋白A53T突變體的轉基因的小鼠的腦提取物樣品與來自野生型小鼠的樣品比較。在TBS或TBS+tween中使腦組織均勻,且在分析之前離心,以便重新獲得可溶解的α-突觸核蛋白片段。非轉基因的小鼠腦勻漿的TBS-可溶解的片段中的α-突觸核蛋白原細纖維水平的測量與轉基因的小鼠中的比較(Kahle模型)(圖6)。為了確保這個試驗中測量的所有的α-突觸核蛋白原細纖維是在可溶解的狀態中,在分析之前,將所有的樣品在16000×g上離心5min。測量具有α-突觸核蛋白病理的5個月大的轉基因的小鼠的腦中的α-突觸核蛋白原細纖維的水平。
圖6顯示對照組小鼠(ntg,非轉基因的)和5個月大的Kahle轉基因的(tg)小鼠PD模型的腦提取物的分析的結果,其中,y軸代表在OD450上的吸光率。
實施例8
人類腦組織的免疫組織化學(IHC)分析
如描述的,來自PD和DLB病人的皮質和黑質用于進行免疫組織化學(IHC)分析(Oinas等人,2010)。作為對照,使用來自年齡匹配的非患病的病人的皮質和黑質。α-突觸核蛋白的陽性抗體對照是鼠抗-α-突觸核蛋白mAb(BD 610787)。
如下評價Aβ噬菌斑的結合:處理來自AD病人的皮質的兩個連續的載玻片,以便顯示抗原,且利用陽性抗-AβmAb(mAbl58,BioArctic)或利用每一個候選的抗體孵育。通過連接到辣根過氧化酶(HRP)上的第二抗-種類特定的抗體檢測結合的抗體。然后利用HRP基質DAB孵育結合物,產生有色的沉淀物,其可通過光顯微鏡方法檢測。在利用候選的抗體處理的載玻片中的共分別的區域分析通過陽性對照中的有色的沉淀檢測Aβ噬菌斑的區域。視覺上評價有色的沉淀的缺失,且解釋為通過候選的抗體對于Aβ噬菌斑的結合的缺失。
圖7A顯示路易體的38E2/7結合和PD黑質中的神經突和陽性α-α-突觸核蛋白對照。圖7B顯示路易體的38E2/7結合和DLB皮質和黑質中的神經突和陽性α-α-突觸核蛋白對照。圖7C顯示各種抗體結合的路易體和DLB皮質和黑質中的神經突和陰性對照。圖7D顯示各種抗體結合的路易體和PD黑質中的神經突和陰性對照。圖7E顯示在非疾病有關的黑質中沒有38E2/7的結合和陽性α-α-突觸核蛋白對照。圖7F顯示阿爾茨海默氏癥病人的皮質中的38E2/7結合和陽性α-Aβ對照的比較。
實施例9
利用免疫沉淀反應(IP)和蛋白質印跡進行人類腦提取物的分析
利用蛋白質印跡指導人類腦提取物和原細纖維結合的單克隆抗體38E2/7的免疫沉淀反應。利用四個不同的洗劑進行腦提取實驗,產生四個不同的提取物:TBS提取物,包含細胞外和細胞質α-突觸核蛋白種類;Triton提取物,包含膜-相關的α-突觸核蛋白種類;和SDS提取物,包含SDS-可溶解的α-突觸核蛋白種類和FA提取物,包含不可溶解的α-突觸核蛋白。利用抗體38E2/7或對照抗體15P能連接到其上的磁性珠使這些提取物免疫反應。抗體15P能同樣地結合到α-突觸核蛋白原細纖維和單體上,且期望結合(pull down)出現的所有的種類。圖8A顯示DLB病人的黑質的SDS提取物,而圖8B顯示DLB病人的黑質的Triton提取物。如看到的,在圖8A和8B中,mAb38E2/7只捕獲來自DLB黑質的α-突觸核蛋白原細纖維,兩者都在Triton和SDS提取物中,然而mAb 15捕獲所有提取物中的α-突觸核蛋白單體。
實施例10
α-突觸核蛋白寡聚化抑制的分析
這個實施例顯示抗體mAb49/G利用以2個載體轉染神經細胞的體外方法抑制α-突觸核蛋白單體的寡聚化,兩者都含有與GFP的N-末端或C-末端片段融合的α-突觸核蛋白的一個拷貝(aa 1-140)。只有那些細胞中,α-突觸核蛋白在其中寡聚,引起兩個GFP片段連接在一起,將產生能利用熒光顯微鏡檢測的綠色熒光。與沒有抗體添加的對照組比較,能通過比較這些培養基中的熒光評價能抑制和/或破壞寡聚化的抗體的存在。
具體地,利用FuGENE6轉染試劑(Roche Diagnostics,Basel,Switzerland)將含有利用GFP(aa1-155)的N-末端片段融合的α-突觸核蛋白(aa1-140)或利用GFP(aa 156-238)的C-末端片段融合的α-突觸核蛋白(aa 1-140)的等摩爾比率的DNA-構造,轉染H4神經膠質瘤細胞。同時地,對照抗-α-突觸核蛋白單克隆抗體(mAb5C2,Santa Cruz Bio)和mAb49/G以1μg/ml的終濃度細胞外地加入到細胞中。將細胞在37℃5%CO2中孵育24小時。在24小時之后,將細胞移動到30℃,以便GFP-熒光的完全的重組,且孵育另外的24小時的時間。利用裝備FITC落射熒光濾光器的Axiovert 200顯微鏡測量熒光。如與將其設為100%的抗體未處理的α-突觸核蛋白過表達的細胞相比較,相對%熒光強度計算所有的數據。
如圖9A中看到的,利用mAb49/G處理在α-突觸核蛋白寡聚化中顯示顯著的(*p<0.05)減少(與未處理的細胞比較在熒光強度中42%減少)。圖9B顯示與設為100%的未處理的α-突觸核蛋白過表達的細胞相比較,百分比熒光強度的用圖表表示的結果。
此處描述的特定的實例和實施例在本質上僅作為例證,并不意在限制由權利要求限定的本發明。考慮到這個說明書,進一步的實施例和實例及其優勢對于本領域的一個技術人員來說是顯而易見的,且它們都在所要求保護的發明的范疇內。
參考文獻
Chartier-Harlin,MC,et al.2004.Alpha-synuclein locus duplication as a cause of familial Parkinson's disease.Lancet 1,364,1167-1169.
Conway,K.,et al.,2000.Acceleration of oligomerization,not fibrillization,is a shared property of both a-synuclein mutations linked to early-onset Parkinson's disease:Implications for pathogenesis and therapy.Proc Natl Acad Sci USA 97,571-576.
Crews,L.,et al.,2009.Role of synucleins in Alzheimer's disease.Neurotox Res.16,306-317.
Desplats,P.,et al.,2009.Inclusion formation and neuronal cell death through neuron-to-neuron transmission of alpha-synuclein.Proc Natl Acad Sci U S A.4,106,13010-13015.Erratum in:Proc Natl Acad Sci USA.2009,106,17606.Comment in:Proc Natl Acad Sci U S A.2009,106,12571-12572.
El-Agnaf,O.M.,et al.,2006.Detection of oligomeric forms of a-synuclein protein in human plasma as a potential biomarker for Parkinson's disease.Faseb J 20,419-425.
George,J.L.,et al.2009.Targeting the progression of Parkinson's disease.Curr Neuropharmacol.7,9-36.
Hansen,L,et al.,1990.The Lewy body variant of Alzheimer's disease.A clinical and pathologic entity.Neurology 40,1-8.
Klucken,J.,et al.,2006.Clinical and biochemical correlates of insoluble a-synuclein in dementia with Lewy bodies.Acta Neuropathol(Berl)111,101-108.
Kruger,R.,et al.,1998.Ala30Pro mutation in the gene encoding a-synuclein in Parkinson's disease.Nat Genet 18,106-108.
Leatherbarrow,R.J.,et al.1985.Effector functions of a monoclonal aglycosylated mouse IgG2a:binding and activation of complement component CI and interaction with human monocyte Fc receptor.Mol Immunol 22,407-415.
Lee,H-J.,et al.2004.Clearance of a-synuclein oligomeric intermediates via the lysosomal degradation pathway.Journal of Neuroscience 24,1888-1896.
LiJ.Y.,et al Li et al.2008.Lewy bodies in grafted neurons in subjects with Parkinson's disease suggest host-to-graft disease propagationNature Med.,14,501-503.
Masliah,E.,et al.2005.Effects of alpha-synuclein immunization in a mouse model of Parkinson's disease.Neuron.46,857-868.
Oinas,M.,et al.2010.alpha-Synuclein pathology in the spinal cord autonomic nuclei associates with alpha-synuclein pathology in the brain:a population-based Vantaa 85+study.Acta Neuropathol.119,715-722.
Polymeropoulos,M.H.,et al.,1997.Mutation in the oc-Synuclein Gene Identified inFamilies with Parkinson's Disease.Science 276,2045-2047.
Qin,Z.,et al.,2007.Effect of 4-hydroxy-2-nonenal modification on a-synuclein aggregation.J Biol Chem 282,5862-5870.
Singleton,AB.,et al.,2003.alpha-Synuclein locus triplication causes Parkinson's disease.Science 302:841.
Wrigth,A.,1998.Effect of C2-associated carbohydrate structure on Ig effector function:studies with chimeric mouse-human IgGl antibodies in glycosylation mutants of Chinese hamster ovary cells.J Immunol 160,3393-3402.
Xu,Y.,et al.1994.Residue at position 331 in the IgGl and IgG4 CH2 domains contributes to their differential ability to bind and activate complement.J Biol Chem.269,3469-3474.
Yoritaka,A.,et al.,1996.Immunohistochemical detection of 4-hydroxynonenal protein adducts in Parkinson disease.Proc Natl Acad Sci USA 93,2696-2701.
Zarranz,J.,et al.,2004.The new mutation,E46K,of a-synuclein causes Parkinson and Lewy body dementia.Ann Neurol.55,164-173。
- 還沒有人留言評論。精彩留言會獲得點贊!