用于多重PCR檢測致腹瀉寄生蟲的引物組及試劑盒的制作方法
本發明涉及生物
技術領域:
,具體地,涉及多重PCR檢測致腹瀉寄生蟲的引物組和試劑盒及其檢測方法。
背景技術:
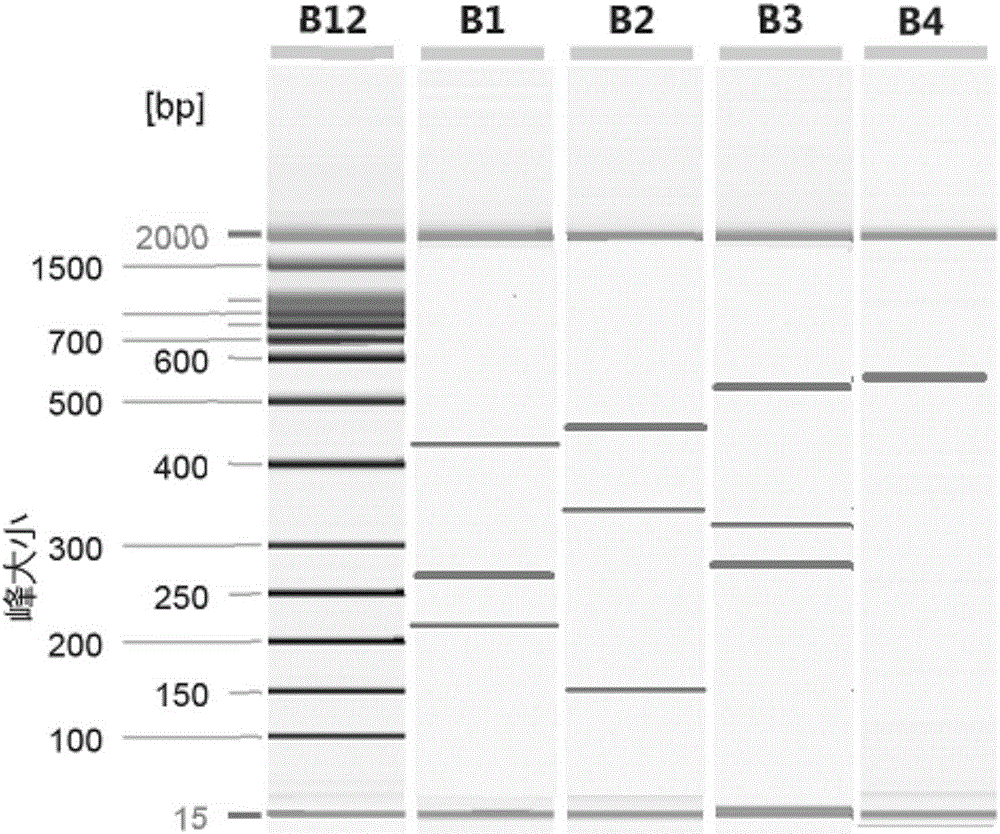
:感染性腹瀉是我國傳染病中發病率最多、流行面最廣、影響嚴重的一組疾病。目前對寄生蟲感染引起腹瀉的相關研究相對薄弱。寄生蟲引起的腹瀉臨床上有急性腹瀉和慢性腹瀉,但絕大多數表現為慢性腹瀉,或在急性發作后經常再發。我國可引起腹瀉的寄生蟲種類多、分布廣、感染高、危害大、各地流行程度不一。目前,在寄生蟲病診斷中,病原學檢查是寄生蟲感染確診的主要依據。臨床診斷仍然主要以方便快捷的糞便病原學檢查作為最直接和可靠的確診依據。多年來,顯微鏡檢查糞便樣本一直被認為是診斷寄生蟲的“黃金標準”,其中病原學和免疫學檢測方法仍被廣泛應用,但是特異性和敏感性不高,不能鑒別蟲種和基因型。糞便病原學檢測的隨機性很大,不能正確反映感染情況。尤其當感染度較低時,糞便檢測方法的敏感性較低,不適用于低度流行病區寄生蟲感染的檢測以及療效考核,而且,在成蟲未產卵以前,即處于潛伏期時,糞便檢測法則無法檢測到早期感染。免疫學診斷較病原體檢測敏感性高,但由于經藥物治療后病人體內的抗體仍將持續較長時間,所以抗體檢測法的療效考核效果不理想,尤其在疫區反復感染人群中無法區別是現行感染還是既往感染。循環抗原檢測相對特異性高,能反映感染蟲荷,而且經治療后,感染的宿主體內循環抗原消失快,可用于確定診斷和(或)療效考核。但由于成蟲外膜具有不斷更新的特點,使得血中抗原的量不夠穩定,檢測結果有時難以反映真實情況,所以循環抗原檢測敏感性較低,并受多種因素干擾,尤其對慢性病的檢出率較低。分子生物學技術核酸檢測診斷為病原生物的檢測提供了快速、高效、靈敏的診斷新方法。聚合酶鏈反應(PCR)技術以其高敏感性、高特異性等特點,被廣泛應用于生命科學的各個領域。現已有應用于多種腹瀉寄生蟲的核酸檢測報道,并顯示出較高的敏感性和較強的特異性。在我國,不僅有可以檢測單個寄生蟲的報道,也有可以同時檢測兩種或兩種以上腹瀉寄生蟲的試劑盒及檢測方法,國外專利中多見使用PCR技術檢測單個寄生蟲,如日本專利2003-033184(kitandmethodforcryptosporidiumdetection)建立了一對引物檢測隱孢子蟲的試劑盒;美國專利8114976(Cryptosporidiumhominisgenesandgeneproductsforchemotherapeutic,immunoprophylacticanddiagnosticapplications)建立了多對引物用于檢測隱孢子蟲的多個基因位點,用于疾病診斷和治療。現有的分子生物學技術的缺陷在于難以對多種致腹瀉寄生蟲進行全面篩檢,漏檢率較高。因此有必要對現有的致腹瀉寄生蟲的檢測方式進行改進,建立一種快速、特異且敏感地判定致腹瀉寄生蟲及鑒別致腹瀉寄生蟲的檢測技術。技術實現要素:本發明的目的在于解決現有致腹瀉寄生蟲檢測技術中存在的難以全面篩檢和漏檢率較高的問題,提供一種新的致腹瀉寄生蟲檢測引物和方法。為達到以上目的本發明提供了一種多重PCR檢測腹瀉寄生蟲用引物組,其中,該引物組包括SEQIDNO.1和3-18所示的引物;所述腹瀉寄生蟲包括溶組織內阿米巴(EntamoebahistolyticaSchaudinn)、賈第鞭毛蟲(GiardialambliaStiles)、隱孢子蟲(CryptosporidiumTyzzer)、日本血吸蟲(SchistosomajaponicumKatsurada)、華支睪吸蟲(Clonorchissinensis)、糞類圓線蟲(strongyloidiasis)、人芽囊原蟲(Blastocystishominis)和衛氏并殖吸蟲(Paragonimuswestermani)。本發明的還提供了腹瀉寄生蟲的檢測方法,該方法包括如下步驟:(1)提取待測樣本的總DNA;(2)以所述總DNA為模板,并使用本發明所述的引物組,進行多重PCR反應,獲得多重PCR擴增后的物料;(3)對所述多重PCR擴增后的物料進行核酸電泳檢測,得到核酸電泳檢測的結果;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有215bp的擴增產物,則指示所述待測樣本中含有溶組織內阿米巴;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有423bp的擴增產物,則指示所述待測樣本中含有賈第鞭毛蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有256bp的擴增產物,則指示所述待測樣本中含有隱孢子蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有453bp的擴增產物,則指示所述待測樣本中含有日本血吸蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有362bp的擴增產物,則指示所述待測樣本中含有華支睪吸蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有334bp的擴增產物,則指示所述待測樣本中含有糞類圓線蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有149bp的擴增產物,則指示所述待測樣本中含有人芽囊原蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有282bp的擴增產物,則指示所述待測樣本中含有衛氏并殖吸蟲。本發明還提供了一種多重PCR檢測腹瀉寄生蟲的試劑盒,所述試劑盒包括本發明所述的引物組和DNA聚合酶。另一方面,本發明還提供了如上所述的引物組在制備檢測腹瀉寄生蟲的試劑盒中的用途;其中,所述腹瀉寄生蟲包括溶組織內阿米巴、賈第鞭毛蟲、隱孢子蟲、日本血吸蟲、華支睪吸蟲、糞類圓線蟲、人芽囊原蟲和衛氏并殖吸蟲。通過上述技術方案,本發明建立了八種腹瀉性寄生蟲多重PCR檢測方法,能夠克服其他技術手段的不足之處,達到以下的檢測效果:(一)多重檢測覆蓋全面本發明所建立的檢測方法能夠在一個PCR反應中同時篩查包括溶組織內阿米巴、賈第鞭毛蟲、隱孢子蟲、日本血吸蟲、華支睪吸蟲、糞類圓線蟲、人芽囊原蟲和衛氏并殖吸蟲的八種常見腹瀉性寄生蟲,全面涵蓋了以腹瀉為主要臨床癥狀的寄生蟲和食品安全篩查常見的腹瀉寄生蟲,快速獲得檢測結果,節省時間、人力和物力成本。(二)特異性高本發明所建立的檢測方法特異性主要體現在一整套引物的特異性,所有引物都經過Blast比對分析,具有高度的保守性和特異性;同時經過特異性驗證,能夠很好的區分與檢測目標種屬相近、生存環境相同的細菌,包括沙門氏菌、志賀氏菌、副溶血性弧菌、空腸彎曲菌、結腸彎曲菌、金黃色葡萄球菌、蠟樣芽孢桿菌、單核細胞增生性李斯特氏菌、小腸結腸炎耶爾森氏菌、阪崎腸桿菌、大腸埃希氏菌、霍亂弧菌等,證明檢測方法具有高度的特異性,能夠將非目標細菌準確分辨出來。(三)靈敏度高本發明所建立的檢測方法能夠實現八個目標寄生蟲核酸的同時篩檢,在每一個反應體系中每個目標寄生蟲的檢測靈敏度可達到0.002ng/ul。本發明靈敏度提高的主要原因是本發明針對所有目標基因的特異性引物對序列設計了特定的LHP序列,LHP序列中的同源通用引物能夠在第二階段PCR中提高多重PCR反應的擴增效率,降低多重PCR反應的非特異性擴增和引物二聚體的產生,而LHP中的6個堿基連接序列能夠保證同源通用引物擴增不同毒力基因時具有相同的擴增效率,避免多重PCR擴增過程中不同目標基因產量的失衡,從而在總體上提高多重PCR檢測的靈敏度。(四)成本較低本發明所建立的多重PCR檢測方法在操作性上降低了人力成本和時間成本,原來單重檢測需要八次人工和八倍時間,現在使用此方法只需要一次人工和一次反應的時間;該多重檢測方法同時節省了重復檢測同一個樣本的試劑消耗,最大可節省50%以上的試劑成本。(五)預防假陰性結果體系中添加的陽性內對照引物和對應的模板,可以有效的提示假陰性檢測結果。本發明為八種常見腹瀉性寄生蟲的快速檢測提供了完備的解決方案,能實現臨床腹瀉寄生蟲源的快速檢測,為盡快處置疫情和建立臨床治療節省寶貴的時間。綜上所述,本發明提供一種多重PCR檢測八種常見腹瀉性寄生蟲的引物組,并建立一種基于普通PCR平臺的多重PCR檢測方法。本發明采用高靈敏度和特異性的引物序列,保證檢測結果的質量;該檢測方法操作簡單,省時省力;檢測通量高,試劑耗材成本低;可以直接對糞便樣本進行檢測,相比較于傳統檢測方法,將能夠提前24-72小時鎖定可疑寄生蟲;對檢測平臺和檢測人員的要求低,能夠在檢驗檢疫第一線廣泛推廣。本發明的其他特征和優點將在隨后的具體實施方式部分予以詳細說明。附圖說明附圖是用來提供對本發明的進一步理解,并且構成說明書的一部分,與下面的具體實施方式一起用于解釋本發明,但并不構成對本發明的限制。在附圖中:圖1是本發明試劑盒檢測八種致腹瀉寄生蟲實驗結果;B1:賈第鞭毛蟲、隱孢子蟲、溶組織內阿米巴的檢測;B2:日本血吸蟲、華支睪吸蟲、人芽囊原蟲的檢測;B3:陽性內對照、糞類圓線蟲、衛氏并殖吸蟲的檢測;B4:空白對照。圖2是本發明試劑盒敏感性實驗結果;B12:Marker;B1:檢測濃度為0.2ng/μl的八種致腹瀉寄生蟲擴增效果;B2:檢測濃度為0.02ng/μl的八種致腹瀉寄生蟲擴增效果;B3:檢測濃度為0.002ng/μl的八種致腹瀉寄生蟲擴增效果;B4:空白對照。具體實施方式以下對本發明的具體實施方式進行詳細說明。應當理解的是,此處所描述的具體實施方式僅用于說明和解釋本發明,并不用于限制本發明。本發明提供了一種多重PCR檢測腹瀉寄生蟲用引物組,其中,該引物組包括SEQIDNO.1和3-18所示的引物;所述腹瀉寄生蟲包括溶組織內阿米巴、賈第鞭毛蟲、隱孢子蟲、日本血吸蟲、華支睪吸蟲、糞類圓線蟲、人芽囊原蟲和衛氏并殖吸蟲。其中,所述引物組還包括SEQIDNO.19-20所示的引物。SEQIDNO.19-20所示的引物是以pET28a為模板設計的一對引物,作為陽性內對照引物對。本發明的PCR引物組檢測目標基因包括溶組織內阿米巴18S核糖體RNA基因、賈第鞭毛蟲磷酸丙糖異構酶基因、隱孢子蟲DNAJ-like蛋白基因、日本血吸蟲28S核糖體RNA基因、華支睪吸蟲線粒體NAD2基因、糞類圓線蟲18S核糖體RNA基因、人芽囊原蟲18S核糖體RNA基因和衛氏并殖吸蟲線粒體環氧化酶亞單位Ⅰ基因,(如表1所示)。表1八種腹瀉寄生蟲多重PCR檢測目標基因目標寄生蟲檢測目標基因檢測目標基因代碼溶組織內阿米巴18S核糖體RNAEn.18S賈第鞭毛蟲磷酸丙糖異構酶基因tim隱孢子蟲DNAJ-like蛋白基因J-like日本血吸蟲28S核糖體RNASJ.28S華支睪吸蟲線粒體NAD2基因NAD糞類圓線蟲18S核糖體RNASS.18S人芽囊原蟲18S核糖體RNABh.18S衛氏并殖吸蟲線粒體環氧化酶亞單位Ⅰ基因COISEQIDNO.3-18所示的8對引物序列中均含有與之匹配的LHP序列(基于連接序列的同源通用引物basedonligation-sequencehomogenousPrimer,LHP)。LHP序列與每條特異性引物連接后使用,同源通用引物單獨使用,序列詳見表2。表2八種腹瀉性寄生蟲多重PCR引物匯總表在本發明的一種實施方式中,涉及多重PCR檢測腹瀉寄生蟲的檢測方法,(1)提取待測樣本的總DNA;(2)以所述總DNA為模板,并使用本發明所提供的引物組,進行多重PCR反應,獲得多重PCR擴增后的物料;(3)對所述多重PCR擴增后的物料進行核酸電泳檢測,得到核酸電泳檢測的結果;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有215bp的擴增產物,則指示所述待測樣本中含有溶組織內阿米巴;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有423bp的擴增產物,則指示所述待測樣本中含有賈第鞭毛蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有256bp的擴增產物,則指示所述待測樣本中含有隱孢子蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有453bp的擴增產物,則指示所述待測樣本中含有日本血吸蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有362bp的擴增產物,則指示所述待測樣本中含有華支睪吸蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有334bp的擴增產物,則指示所述待測樣本中含有糞類圓線蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有149bp的擴增產物,則指示所述待測樣本中含有人芽囊原蟲;如果核酸電泳檢測的結果顯示所述多重PCR擴增后的物料中含有282bp的擴增產物,則指示所述待測樣本中含有衛氏并殖吸蟲。其中,優選地,SEQIDNO.3-20所示的引物的最終使用濃度各自為0.1-0.8μM,SEQIDNO.1所示的引物的最終使用濃度為0.4-0.8μM。其中,優選地,多重PCR反應的條件包括如下a-h的步驟:a:94-96℃,3-6min;b:94-96℃,15-60s,c:50-60℃,15-60s,d:71-73℃,60-120s,進行10-15個b-d的循環;e:94-96℃,15-60s,f:55-65℃,15-60s,g:71-73℃,30-60s,進行30-35個e-g的循環;h:71-73℃,5-10min。其中,所述待測樣本可以包括但不限于食品、藥品、排泄物、嘔吐物和體液中的至少一種。本發明的多重PCR檢測方法不用于診斷。或者說,檢測結果與疾病是否發生沒有一一對應的相關性,不屬于診斷結果,但是檢測結果能夠作為中間信息,供臨床醫生參考。其中,優選地,所述核酸電泳檢測包括核酸凝膠電泳和/或核酸毛細管電泳。在本發明的一種實施方式中,采用QIaxcel全自動毛細管電泳分析儀作為結果分析的平臺。基于QIaxcel的全自動操作和設定的智能化結果分析程序,從而實現結果的自動判定分析。本發明的一個方面還提供了一種多重PCR檢測腹瀉寄生蟲的試劑盒,所述試劑盒包括本發明所述的引物組和DNA聚合酶;所述腹瀉寄生蟲包括溶組織內阿米巴、賈第鞭毛蟲、隱孢子蟲、日本血吸蟲、華支睪吸蟲、糞類圓線蟲、人芽囊原蟲和衛氏并殖吸蟲。優選的,所述試劑盒還包括PCR反應所需的PCR反應試劑,所述反應試劑可以為PCR反應緩沖液和dNTP。另一方面,本發明還提供了如上所述的引物組在制備檢測腹瀉寄生蟲的試劑盒中的用途;其中,所述腹瀉寄生蟲包括溶組織內阿米巴、賈第鞭毛蟲、隱孢子蟲、日本血吸蟲、華支睪吸蟲、糞類圓線蟲、人芽囊原蟲和衛氏并殖吸蟲。下面結合實施例對本發明進行進一步說明。實施例11、引物合成:進行SEQIDNO.1和3-20的引物合成。以物質的量為單位,將SEQIDNO.3-20的引物各取1份,與4份的SEQIDNO.1的引物混合,構成本實施例的引物組。引物匯總表見表3。表3多重PCR引物序列匯總表2、特異性驗證:選擇12種無關病原體作為模擬干擾樣本:沙門氏菌(購自中國醫學菌種保藏中心,編號為50001)、志賀氏菌(購自中國醫學菌種保藏中心,編號為51054)、副溶血性弧菌(購自中國醫學菌種保藏中心,編號為21617)、空腸彎曲菌(購自中國醫學菌種保藏中心,186089)金黃色葡萄球菌(購自中國醫學菌種保藏中心,編號為26003)、蠟樣芽孢桿菌(購自中國醫學菌種保藏中心,編號為63303)、單核細胞增生性李斯特氏菌(購自中國醫學菌種保藏中心,編號為54002)、小腸結腸炎耶爾森氏菌(購自中國醫學菌種保藏中心,編號為52201)、阪崎腸桿菌(購自中國醫學菌種保藏中心,編號為21665)、大腸桿菌埃希氏菌(購自中國醫學菌種保藏中心,編號為43317)、霍亂弧菌(購自中國醫學菌種保藏中心,編號為1109)。上述模擬干擾樣本用于特異性評估,分別進行總核酸的提取,每種樣本提取得到的總核酸溶解于TE緩沖液中,濃度為1ng/μL。使用上述得到的每種樣本的總核酸與質粒pET28a(1:1)混合,作為模板,用上述得到的引物組多重PCR擴增。按照如下操作配制25μL的反應體系,其配置如下:2×PCRBuffer12.5μL;DNA聚合酶1μL;10×引物混合物2.5μL;模板2μL,超純水7μL。引物濃度如表4所示。表4引物濃度表引物編號10×引物混合物SEQIDNO.18μMSEQIDNO.3-203μM/每條引物反應的條件包括如下a-h的步驟:a:95℃5min;b:95℃15s,c:50℃30s,d:72℃90s,b-d循環10個反應;e:95℃15s,f:60℃30s,g:72℃30s,e-g循環35個反應;h:72℃5min。多重PCR產物置于QIAxcel全自動毛細管電泳分析儀中進行分析,結果顯示,12種無關病原體樣本的總核酸與等量的陽性內對照混合作為模板所進行的多重PCR全部擴增到了532bp的陽性內對照條帶,但除532bp的陽性內對照條帶外,均沒有擴增出其它條帶。由此證明,本實施例的引物組難以被無關病原體所干擾,具有較高的特異性。實施例21、多重PCR檢測試劑盒的組建該試劑盒由2×反應體系緩沖液、DNA聚合酶、10×引物混合液、陽性對照、超純水構成,其具體組分如下:2×PCRBuffer(Tris-HCl40Mm(pH8.3),KCl100mM,tween-200.08%,0.0006ng/μLPET28a,1mMdNTP、8mMMgCl2);25×DNA聚合酶(2U/μL);10×引物混合液(包括IAC在內的長引物對濃度各2μM,同源通用引物SEQIDNO.1濃度為8μm);陽性對照(含有8個寄生蟲的混合模板,每種均為0.2ng/μL)。2、基因組的提取選擇溶組織內阿米巴、賈第鞭毛蟲、隱孢子蟲、日本血吸蟲、華支睪吸蟲、糞類圓線蟲、人芽囊原蟲和衛氏并殖吸蟲作為建立檢測方法的目標寄生蟲,分別按照國標或者行業標準方法對八種寄生蟲進行蟲體的收集,采用DNA提取試劑盒提取DNA模板。寄生蟲采集方法如下:收集糞便標本用特制的糞便盒或油紙,如果使用便盆則必須洗滌干凈,不要用消毒劑洗滌,不要使尿或水混入糞便或容器內,以免殺死滋養體。采取糞便務求新鮮。標本收集后,及時處理,以免滋養體死亡變形。室溫低於15℃時應注意保溫,以便涂制標本觀察蟲體活動,若當時不能立即進行涂片觀察,可將糞便暫放置4℃冰箱中,待進行觀察或制片時再加溫(37℃)使蟲體活動,但放置于冰箱的時間不宜超過4h。3、反應體系的配制取200μL的PCR管配置25μL的反應體系,其配置如下:2×PCRBuffer12.5μL;DNA聚合酶1μL;10×引物混合物2.5μL;模板5μL,超純水4μL。4、PCR反應將PCR管放入Bio-RadC1000型PCR儀中,開啟熱蓋后,按照如下程序進行PCR反應:a:95℃5min;b:95℃15s,c:50℃30s,d:72℃90s,b-d循環10個反應;e:95℃15s,f:60℃30s,g:72℃30s,e-g循環35個反應;h:72℃5min。5、全自動毛細管電泳分析PCR產物將PCR反應管放入全自動毛細管電泳儀QiaxcelAdvanced(凱捷公司),使用DNAHighResolutionKit卡夾,選擇15bp-2000bp的Alignmentmarker,100-2000bp的sizemarker,自動分析目標條帶的大小。6、結果判斷根據溶組織內阿米巴215bp、賈第鞭毛蟲423bp、隱孢子蟲256bp、日本血吸蟲453bp、華支睪吸蟲362bp、糞類圓線蟲334bp、人芽囊原蟲149bp、衛氏并殖吸蟲282bp。判定糞便樣本中是否含有寄生蟲及寄生蟲種類。包括空白對照在內的所有泳道均至少有一個條帶擴增,空白對照泳道有陽性內對照(532bp)的擴增,其他檢測有目標條帶和(或)陽性內對照的擴增,表明所有PCR反應均成立,排除假陰性的結果。否則視實驗無效,需要重復。結果如圖1所示。實施例3試劑盒的最低檢出限試驗評估用檢測樣本:選擇8種寄生蟲,樣本1(模板1)為溶組織內阿米巴,樣本2(模板2)為賈第鞭毛蟲,樣本3(模板3)為隱孢子蟲,樣本4(模板4)為日本血吸蟲,樣本5(模板5)為華支睪吸蟲,樣本6(模板6)為糞類圓線蟲,樣本7(模板7)為人芽囊原蟲,樣本8(模板8)為衛氏并殖吸蟲,樣本9(模板9)為上述八種寄生蟲的混合模板。將9個模板的菌懸液分別調整至20ng/ul,將9個樣本梯度稀釋成2ng/ul,0.2ng/ul,0.02ng/ul,0.002ng/ul及0.0002ng/ul的檢測樣品。使用本發明試劑盒分別檢測不同稀釋度的模板。根據實施例2進行操作和結果判斷,試劑盒檢測8個目標基因的最低檢出限試驗結果如表5和圖2所示:表5試劑盒檢測寄生蟲目標基因最低檢出限試驗結果模板編號所含檢測目標0.2ng/ul0.02ng/ul0.002ng/ul0.0002ng/ul0.00002ng/ul1溶組織內阿米巴是是是是否2賈第鞭毛蟲是是是是否3隱孢子蟲是是是是否4日本血吸蟲是是是是否5華支睪吸蟲是是是是否6糞類圓線蟲是是是是否7人芽囊原蟲是是是是否8衛氏并殖吸蟲是是是是否9八種混合是是是是否從表5看出,試劑盒檢測八種寄生蟲核酸的最低檢出限均為0.0002ng/ul,試劑盒總體的最低檢出限為每個反應0.0002ng/ul。對比例1制備對比引物21-36,見表6。表6對比引物序列表按照實施例1的方法進行檢測,區別僅在于,將實施例1的引物組中SEQIDNO.3-4所示的引物替換為SEQIDNO.21-22所示的引物獲得對比引物組1。將實施例1的引物組中SEQIDNO.5-6所示的引物替換為SEQIDNO.23-24所示的引物獲得對比引物組2。將實施例1的引物組中SEQIDNO.7-8所示的引物替換為SEQIDNO.25-26所示的引物獲得對比引物組3。將實施例1的引物組中SEQIDNO.9-10所示的引物替換為SEQIDNO.27-28所示的引物獲得對比引物組4。將實施例1的引物組中SEQIDNO.11-12所示的引物替換為SEQIDNO.29-30所示的引物獲得對比引物組5。將實施例1的引物組中SEQIDNO.13-14所示的引物替換為SEQIDNO.31-32所示的引物獲得對比引物組6。將實施例1的引物組中SEQIDNO.15-16所示的引物替換為SEQIDNO.33-34所示的引物獲得對比引物組7。將實施例1的引物組中SEQIDNO.17-18所示的引物替換為SEQIDNO.35-36所示的引物獲得對比引物組8。實施例1的引物組中SEQIDNO.3-18所示的引物替換為SEQIDNO.21-36所示的引物獲得對比引物組9。其中,用對比引物組1擴增溶組織內阿米巴標準品質粒樣品;用對比引物組2擴增賈第鞭毛蟲標準品質粒樣品;用對比引物組3擴增隱孢子蟲標準品質粒樣品;用對比引物組4擴增日本血吸蟲標準品質粒樣品;用對比引物組5擴增華支睪吸蟲標準品質粒樣品;用對比引物組6擴增糞類圓線蟲標準品質粒樣品;用對比引物組7擴增人芽囊原蟲標準品質粒樣品;用對比引物組8擴增衛氏并殖吸蟲標準品質粒樣品;用對比引物組9擴增8種寄生蟲標準品質粒與陽性內對照混合物樣品。用對比引物組9擴增12種無關病原體樣本的總核酸與等量的陽性內對照的混合樣本。分別按照與實施例1和2相同的方法進行特異性和敏感性試驗,結果顯示本對比例的引物21-36的特異性、敏感性均差于實施例1-3的引物。在對目標標準化質粒的擴增中,對比組2和6沒有檢出目標,最低檢出限低于0.0002ng/ul,較本試劑盒較差;在對12種無關病原體樣本的總核酸與等量的陽性內對照的混合樣本的特異性展示中,除了陽性內對照外還有其余的雜帶,說明其特異性較差。以上結合附圖詳細描述了本公開的優選實施方式,但是,本公開并不限于上述實施方式中的具體細節,在本公開的技術構思范圍內,可以對本公開的技術方案進行多種簡單變型,這些簡單變型均屬于本公開的保護范圍。另外需要說明的是,在上述具體實施方式中所描述的各個具體技術特征,在不矛盾的情況下,可以通過任何合適的方式進行組合,為了避免不必要的重復,本公開對各種可能的組合方式不再另行說明。此外,本公開的各種不同的實施方式之間也可以進行任意組合,只要其不違背本公開的思想,其同樣應當視為本公開所公開的內容。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 用于檢測AEDs引起的SJS/TEN的引物、試劑盒及方法與制造工藝
- 檢測植原體的LAMP引物組及其試劑盒和應用的制造方法與工藝
- 用于多重PCR檢測致腹瀉寄生蟲的引物組及試劑盒的制造方法與工藝
- 使用重疊非等位基因特異性引物和等位基因特異性阻斷劑寡核苷酸的組合物進行等位基因特異性擴增的制造方法與工藝
- 一種基于特異性SS-COI引物的麗草蛉PCR快速檢測方法與制造工藝
- 一種利用線粒體D-loop區特異區域鑒定黿的標記引物及方法
- 一種用于檢測大豆擬莖點種腐病菌的特異性lamp引物組合物及其應用
- 一種針對膨脹污泥中Eikelboom Type 0092型絲狀菌群特異性引物和方法
- 紫苑石斛的分子特異性標記引物及檢測方法
- 一種檢測牛hcd攜帶者的特異性pcr引物、試劑盒及檢測方法
- 檢測植原體的LAMP引物組及其試劑盒和應用的制造方法與工藝
- 用于多重PCR檢測致腹瀉寄生蟲的引物組及試劑盒的制造方法與工藝
- 使用重疊非等位基因特異性引物和等位基因特異性阻斷劑寡核苷酸的組合物進行等位基因特異性擴增的制造方法與工藝
- 一種利用線粒體D-loop區特異區域鑒定黿的標記引物及方法
- 一種用于檢測大豆擬莖點種腐病菌的特異性lamp引物組合物及其應用
- 一種針對膨脹污泥中Eikelboom Type 0092型絲狀菌群特異性引物和方法
- 紫苑石斛的分子特異性標記引物及檢測方法
- 一種檢測牛hcd攜帶者的特異性pcr引物、試劑盒及檢測方法
- 用于檢測牛源性成分的lamp引物及其設計方法
- 七種不同種屬來源細胞的pcr檢測引物和檢測方法與應用
- 檢測植原體的LAMP引物組及其試劑盒和應用的制造方法與工藝
- 用于多重PCR檢測致腹瀉寄生蟲的引物組及試劑盒的制造方法與工藝
- 使用重疊非等位基因特異性引物和等位基因特異性阻斷劑寡核苷酸的組合物進行等位基因特異性擴增的制造方法與工藝
- 一種利用線粒體D-loop區特異區域鑒定黿的標記引物及方法
- 一種用于檢測大豆擬莖點種腐病菌的特異性lamp引物組合物及其應用
- 一種針對膨脹污泥中Eikelboom Type 0092型絲狀菌群特異性引物和方法
- 紫苑石斛的分子特異性標記引物及檢測方法
- 一種檢測牛hcd攜帶者的特異性pcr引物、試劑盒及檢測方法
- 用于檢測牛源性成分的lamp引物及其設計方法
- 七種不同種屬來源細胞的pcr檢測引物和檢測方法與應用