磁性納米粒子和產生自由基的酶的介孔催化劑及其使用方法與流程
本申請是申請號為201280022702.9、申請日為2012年3月9日、發明名稱為“磁性納米粒子和產生自由基的酶的介孔催化劑及其使用方法”的中國申請的分案申請,原申請要求2011年12月9日提交的美國臨時申請號61/568,966,和2011年3月10日提交的美國臨時申請號61/451,360的優先權,其全部內容通過引用并入本申請。
關于聯邦政府資助研究的聲明
本發明在康奈爾大學東北贈日計劃(Northeast Sun Grant Initiative)的合同中規定的政府資助下進行的,該合同號為美國運輸部資助#DTOS59-07-G-00052。政府享有本發明的某些權利。
發明背景
過氧化物酶(EC 1.11.1)廣泛存在于生物系統中,并形成氧化還原酶亞類,所述氧化還原酶亞類將過氧化氫(H2O2)還原成水,從而氧化多種類型的芳香化合物,范圍從酚到芳香胺。過氧化物酶反應循環十分復雜,其始于H2O2對亞鐵血紅素的活化以形成雙電子活化的化合物I(N.C.Veitch,Phytochemistry,2004,65,249)。然后化合物I的一個電子被有機底物的氧化反應所還原導致形成化合物II,該化合物的一個電子處于靜息狀態。第二個還原將酶恢復至靜息狀態以開始一個新循環。總的來說,對于所消耗的每個過氧化氫分子而言,產生兩個芳香自由基并且其能夠易于在次級反應中反應。
過氧化物酶對主要由H2O2引起的底物抑制高度敏感,其能夠導致可逆的酶滅活形式(化合物III)的形成。其活性還被產物的抑制所阻止。因此,與過氧化物酶活性相關的復合動力學能夠限制其在多種工藝和生物過程中的應用。增加這一酶家族的活性及其對不同工藝條件的耐受性能夠改進其目前的用途,以及為其在新應用中的用途創造條件。
發明概述
本申請發現了由產生自由基(FRP)的酶,例如辣根過氧化物酶(HRP),和自組裝磁性納米粒子(MNP)組成的生物納米催化劑(BNC)增強了酶活性。特別地,本申請令人驚訝地發現,與游離酶和不含酶的磁性納米粒子簇相比,FRP酶和磁性納米粒子的自組裝簇一般具有更加迅速的翻轉和對酶更低的抑制。而且本申請還發現MNP的粒徑和磁化強度影響BNC的形成和最終結構,其均對所包封酶的活性具有顯著影響。特別地憑借在不同反應條件下令人驚訝的適應性,本申請所述的BNC能夠在其它此類試劑目前可以使用的地方用作改進的FRP劑,而且其能夠用于FRP酶尚未被考慮或發現適用的其它應用。
本申請所描述的方法非常不同于依賴通過復合生化方法將蛋白偶聯于表面修飾粒子的經典方法,經典方法通常情況下是以消耗酶活性和反應效率為代價的。通過本方法,僅當酶與MNP緊密結合時HRP的動力學被根本改良,例如初級MNP微晶和過氧化物酶的自組裝簇(聚集)。在生物相關底物濃度下,所得的BNC的總活性能夠有利地高于游離酶或MNP若干數量級。
在一個方面,本發明涉及一種組合物,在所述組合物中FRP酶被包埋(即,包封)在磁性納米粒子或其簇中。在特定實施方式中,所述組合物是由磁性納米粒子和一種FRP酶或FRP酶組合組裝成的介孔簇。所述介孔簇的簇狀組裝件具有包埋了FRP酶的介孔。在其它實施方式中,前述簇組合物包括表面涂覆了金的磁性納米粒子。在又一個實施方式中,前述簇組合物進一步包括微米或亞微米粒徑的磁性微粒,上有包埋了FRP的磁性納米粒子。
在其它方面,本發明涉及一種工藝,上文所述的包埋了FRP的磁性納米粒子的組合物可用于所述工藝中。在特定實施方式中,所述包埋了FRP的磁性納米粒子組合物參與了用于解聚木質素的工藝、用于從水中除去芳香族污染物的工藝和用于通過自由基反應使單體聚合生產聚合物的工藝。
在另一個方面,本發明涉及用于生產上文所述的包埋了FRP的磁性納米粒子組合物的工藝。在某些實施方式中,首先制備磁性納米粒子或其聚合物,隨后將FRP酶吸附于其中或與其連接。在其它實施方式中,在存在FRP酶的條件下,通過進行磁性納米粒子的合成生產包埋了FRP的磁性納米粒子組合物,從而通過自組裝機制在MNP簇中包埋所述FRP酶。
附圖說明
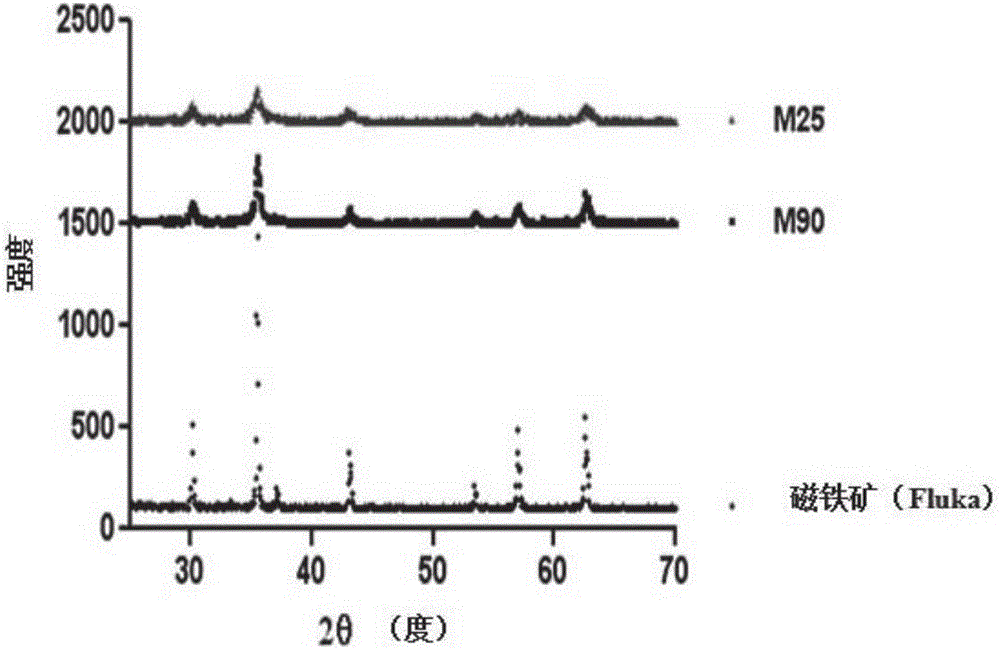
圖1:在25℃和90℃下合成的磁性納米粒子的X-射線衍射圖。合成的納米粒子顯示了磁鐵特征性的X-射線衍射圖。在25℃(較小粒徑)和90℃(較大粒徑)下形成的納米粒子之間的微晶衍射峰強度存在差異。
圖2A,2B:在25℃和90℃下合成的磁性納米粒子的粒徑分布圖。在25℃和90℃下合成的納米粒子具有不同的粒徑分布。M25納米粒子(圖2A)的平均粒徑為8nm,而M90納米粒子(圖2B)的平均粒徑為約10nm。
圖3:在25℃和90℃下合成的磁性納米粒子的磁化強度圖。在25℃和90℃下合成的納米粒子具有的飽和磁化強度(Ms)分別為約20和50emu g-1。其均具有可以忽略不計的剩余磁化強度(Mr),這使其具有超順磁性。超順磁性的性質使其超聲后在溶液中形成充分的單分散磁性納米粒子。
圖4A-4C:M25和M25-BNC的粒徑分布圖(圖4A)以及M25(圖4B)和M25-BNC(圖4C)的顯微照片。當將酶(HRP)加入初始的單分散磁性納米粒子后,M25納米粒子聚集物的粒徑增加。酶的存在增加了所述簇的總直徑。
圖5A-5G:M90納米粒子簇的顯微照片(圖5A)和相應的粒徑圖(圖5B、5C),M90-BNC納米粒子簇的顯微照片(圖5D)和相應的粒徑圖(圖5E、5F),以及對M90和M90-BNC簇進行比較的粒徑分布圖(圖5G)。
圖6:在溶液中單位酶量的情況下,單位有效MNP表面積捕獲的酶量的等溫線圖。測定M90和M25簇中捕獲的酶量(利用MNP的表面積進行標準化)。對于在溶液中的初始酶量而言,M90MNP形成的聚集物與M25MNP形成的聚集物相比含有更多的酶。溶液中的酶低于10nmol.m-2,100%的酶被包封在M90形成的簇中,而約有50%包封在M25簇中。
圖7:M25磁性納米粒子和M25-BNC酶簇的孔徑分布圖。M25-BNC是具有直徑低于50nm的孔的介孔。較小的磁性納米粒子形成具有較小孔徑的聚集物。孔徑分布受酶存在情況的影響,所述的總孔體積低于M25MNP簇的總孔體積,這表明酶占據了介孔的空間。
圖8:M90磁性納米粒子和M90-BNC酶簇的孔徑分布圖。M90NMP聚集形成的簇是介孔的,其具有孔的直徑低于50nm。較大的納米粒子形成具有較大孔徑的較大聚集物。孔徑分布受酶存在情況的影響,所述的總孔體積低于M90MNP簇的總孔體積,這表明酶占據了介孔的空間。
圖9A,9B:在4μg/mL和8μg/mL濃度下,針對M25-BNC(圖9A)和M90-BNC(圖9B),將活性(酚AAP檢測,以U.mmole-1計)作為孵育時間的函數的圖,以確定孵育時間對BNC活性的影響。
圖10:歸一化的活性作為檢測中使用的磁性納米粒子(HRP-BNC)濃度(以μg/mL計)的函數的圖,用于確定孵育時間對HRP-BNC活性的影響。P5方案:來自稀釋的HRP+納米粒子(M90)1∶1溶液(體積/體積)的3%(體積/體積)預混物;P1方案:來自高濃度的HRP和M90儲備溶液的3%(體積/體積)預混物;P3方案:HRP+納米粒子1∶1(體積/體積)混懸物的14%(體積/體積)預混物;P4方案:未預混,在檢測混合物中分別加入酶和粒子。方案P5和P1是比較將酶和粒子(M90)混合以形成BNC的方法。P3和P5表示BNC的濃度在檢測中的影響。為了進行比較,P4顯示出未孵育的影響。自組裝依賴于在預混物(酶+MNP)中MNP的濃度。高濃度的MNP因過度聚集而導致活性降低。
圖11A,11B:96孔板用于酚/AAP檢測并用于測定PBS緩沖液對BNC形成和活性的影響(圖11A),圖表中顯示了在H2O和不同濃度磷酸鹽緩沖液(PBS)中M90-BNC增加的活性數據(對游離酶的活性進行歸一化處理)(圖11B)。利用固定濃度為1mM的H2O2(即,過氧化物)進行的酚/AAP檢測研究形成BNC的條件。在不同離子強度(最高200mM)的PBS緩沖液中形成了BNC。當緩沖液的離子強度增加時增加的活性降低。在水中形成的BNC中觀察到了活性的最大增加(無離子補償電荷)。在水中形成的BNC活性增加達26倍,可以用于在檢測時更高濃度的PBS中。
圖12A,12B:96孔板用于酚/AAP檢測并用于測定丙二酸鹽緩沖液對BNC形成和活性的影響(圖12A),圖表中顯示了在H2O和不同濃度丙二酸鈉緩沖液(SMB)中M90-BNC增加的活性數據(對游離酶的活性進行歸一化處理)(圖12B)。利用固定濃度的過氧化物(1mM)進行的酚/AAP檢測研究形成BNC的條件。在不同離子強度(最高200mM)的有機緩沖液(丙二酸鈉:SMB)中形成了BNC。當緩沖液的離子強度增加時增加的活性降低,但是比在PBS中形成的BNC高一個數量級。在水中形成的BNC中觀察到了活性的最大增加(無離子補償電荷)。在SMB中形成的BNC活性增加達26倍,可以用于在檢測時更高濃度的SMB中。
圖13A,13B:96孔板用于酚/AAP檢測并用于測定酒石酸鹽緩沖液對BNC形成和活性的影響(圖13A),圖表中顯示了在H2O和不同濃度酒石酸鈉緩沖液(STB)中M90-BNC增加的活性數據(對游離酶的活性進行歸一化處理)(圖13B)。利用固定濃度的過氧化物(1mM)進行的酚/AAP檢測研究形成BNC的條件。在不同離子強度(最高200mM)的有機緩沖液(酒石酸鈉:STB)中形成了BNC。當緩沖液的離子強度增加時增加的活性降低,但是比在PBS中形成的BNC高一個數量級。在水中形成的BNC中觀察到了活性的最大增加(無離子補償電荷)。在STB中形成的BNC活性增加達24倍,可以用于檢測時更高濃度的STB中。
圖14:分子活性(酚/AAP檢測,以U.mmole-1計)作為HRP-BNC納米粒子聚集物過氧化物濃度的函數的圖,以確定介孔空間的酶飽和度的影響。令人驚訝的是,被酶所飽和的MNP聚集物沒有增加酶活性,反而是具有非飽和量酶的BNC顯示出了增加的活性。
圖15:Km動力學常數作為游離HRP、M25BNC和M90BNC納米粒子濃度的函數的圖,用于確定游離HRP同M25和M90形成的BNC的底物親和常數。通過擬合HRP-BNC的速率圖估算Km動力學常數。在M25形成的BNC中親和常數增加,這表明過氧化物酶得到了更好的利用。在M90形成的BNC的介孔空間所捕獲的酶中未觀察到Km的差異。
圖16:Vmax作為游離HRP、M25BNC和M90BNC納米粒子濃度的函數的圖,用于確定游離HRP同M25和M90形成的BNC的最大速率常數。通過擬合HRP-BNC的速率曲線估算Vmax的動力學常數。與游離酶的Vmax相比,在M25形成的BNC中最大速率增加,這表明過氧化物酶得到了更好的利用。在M90形成的BNC的介孔空間所捕獲的酶及其游離形式中未觀察到Vmax的差異。
圖17:Ki動力學常數作為游離HRP、M25BNC和M90BNC納米粒子濃度的函數的圖,用于確定游離HRP同M25和M90形成的BNC的抑制常數。通過用HRP擬合BNC的速率曲線估算Ki的動力學常數。在M90形成的BNC中底物抑制常數顯著增加,這表明當被BNC的介孔空間捕獲后對酶產生了更好的抑制保護。與游離酶相比,如果不是更低,則M25-BNC的抑制在相同范圍。
圖18:Kcat動力學常數作為游離HRP、M25BNC和M90BNC納米粒子濃度的函數的圖,用于確定游離HRP同M25和M90形成的BNC的翻轉常數。通過用HRP擬合BNC的速率曲線估算Kcat的動力學常數。與游離酶相比,在M25形成的BNC中翻轉常數顯著增加,這表明底物得到了更好的利用。在更低的酶濃度下,M90-BNC的kcat也增加。
圖19A,19B:歸一化活性(酚/AAP檢測)作為檢測緩沖液和pH的函數的圖(圖19A),以及速率作為檢測緩沖液pH的函數的圖(圖19B)。在水中HRP(1nM)和M90MNP(4μg/ml)形成BNC,并在不同pH條件下,在5mM過氧化物和5mM緩沖液的酚/AAP檢測中對BNC進行檢測。在所有緩沖液和所有pH下均觀察到了活性增加。
圖20A,20B:歸一化活性作為檢測緩沖液和pH的函數作圖(圖20A)和速率作為酚/AAP檢測的檢測緩沖液pH的函數的圖(圖20B)。在水中HRP(1nM)和M90MNP(4μg/ml)形成BNC,并在不同溫度條件下,在5mM過氧化物和3mM緩沖液的酚/AAP檢測中對BNC進行檢測。在所有緩沖液和所有溫度下均觀察到了活性增加,最高在25℃。與游離酶相比所觀察到的增加是游離酶速率更低所致,這表明BNC在較低的溫度下更有效。
圖21:分子活性(酚/AAP檢測,以U.mmole-1計)作為BNC的過氧化物濃度(M)的函數的圖,其中BNC由萬能過氧化物酶和M90和功能化的M90形成。用萬能過氧化物酶(Vep:商品化形式,未進一步純化)形成BNC并使用酚/AAP(無錳)檢測。使用有機聚合物將M90-MNP功能化以修飾其表面的電荷。與游離VeP相比,所有BNC均顯示出增加的活性。在未經修飾的BNC中觀察到最大活性。
圖22:與M90-MNP相比,錳過氧化物酶和金涂覆的MNP形成的BNC的速率曲線。用M90或金涂覆的M90和錳過氧化物酶(FLPC陰離子交換純化后形式,5nM)形成BNC。在這項檢測中,錳過氧化物酶產生了Mn3+反應性陽離子,其與有機酸和氧化二甲氧基酚(顯色劑)形成復合物。在用M90形成的BNC中反應的初始速率為游離酶的兩倍。與游離酶相比,金涂覆BNC的反應速率增加四倍。
圖23:增加的漆酶BNC的活性(Lac-BNC,歸一化的活性)作為緩沖液濃度和pH的函數的圖。該檢測(無過氧化物酶的酚/AAP)在不同緩沖液和不同pH下進行。漆酶的最佳pH約為5。僅在較低和較高pH下觀察到了活性的增加(高至60%),其在較高摩爾濃度的緩沖液中更高。
圖24A-24D:高香草酸熒光二聚體形成的動力學圖,用于確定使用混合酶BNC增加的過氧化酶速率,即中心(核)為辣根過氧化物酶(HRP)和外層(殼)為葡萄糖氧化酶(Gox)的簇、中心為Gox和外層為HRP的簇、或隨機分布。BNC由金涂覆MNP形成,Gox和HRP的比例為1。HVA檢測使用增加的葡萄糖濃度。在這個系統中,葡萄糖氧化酶將葡萄糖轉化為過氧化物和葡糖酸內酯,HRP使用過氧化物將高香草酸聚合為其熒光二聚體。該動力學顯示了酶在介孔空間中的分布情況。
圖25:混合酶、金包覆BNC的速率圖(HVA檢測,葡萄糖氧化酶:HRP的比例為1∶1)。在這種配置中,在較低的葡萄糖范圍的條件下,與游離酶相比Gox/HRP BNC的速率更高(反應的初始速率)。在較高的葡萄糖范圍的條件下,BNC與游離酶的活性相似。在該Gox/HRP比例和葡萄糖濃度范圍下未觀察到底物抑制。具有HRP核的BNC的初始反應速率為隨機分布的兩倍。這些結果表明可以使用聚酶系統,并且可以控制酶的分布以便有利地影響該系統的活性。
圖26A,26B:商品化磁性微粒(圖26A)和使用金包覆BNC(葡萄糖氧化酶和HRP)將表面功能化的微粒的SEM顯微照片。可以利用殘余磁化強度將預制成的BNC固定在鐵磁性微粒上。這種新材料具有將酶捕獲于磁性簇的介孔空間中的優點,并且還具有將其固定在穩定和高磁性材料上的優點。
圖27:利用葡萄糖氧化酶/HRP μBNC產生的高香草酸熒光二聚體形成的動力學的圖。μBNC使用金包覆Gox/HRP BNC制備,其具有中心為HRP和外層為Gox的簇、中心為Gox和外層為HRP的簇、或隨機分布。核/殼μBNC的速率高于游離酶或隨機分布的BNC。這些結果表明BNC能夠固定在微粒上,并且保持了僅存在BNC時觀察到的增加的活性。Gox∶HRP=1∶1。酶∶MNP=1∶2。MNP∶微球=1∶100(W/W)。
圖28A-28C:照片顯示了μBNC在被外部磁體捕獲方面具有優越的性能。圖28A中比較了在1mM葡萄糖溶液中的HRP/Gox(左圖)和HRP/Gox BNC(右圖)溶液。圖28B中比較了暴露于外部磁體后的相同溶液。圖28C為經外部旋轉磁體攪拌后的μBNC。如圖所示,反應后即使在較低磁場下僅需要幾秒中就能夠將μBNC從溶液中回收,也能夠使用外部磁場容易地對其進行攪拌。10小時后,固定在微粒上的HRP/Gox-BNC系統的顏色較深(右管)還表明與游離酶(左管)相比其反應程度較高。
圖29:使用M90磁性納米粒子的HRP-BNC、LiP-BNC、VeP-BNC(不含Mn)、和MnP-BNC的波長吸收光譜。扣除相同濃度下游離酶的光譜。在M90-BNC介孔空間中捕獲的真菌過氧化物酶與其游離形式相比顯示了更高的活性(即,增加了木質素解聚反應釋放的芳香族化合物)。
圖30:游離木質素過氧化物酶(純LiP)、和LiP+M8(由2nM LiP和8μg/ml M90形成的BNC)、和LiP+M16(由2nM LiP+16μg/ml M90形成的BNC)與硫酸鹽木質素作用后可溶性芳香族分子增加情況的圖表。在特征性吸收波長下觀察用BNC使硫酸鹽木質素釋放的可溶性芳香族化合物。BNC由2nM木質素過氧化物酶(商品形式,未經純化)形成。扣除上清液在T0下(初始條件)和納米粒子本底的OD值。
圖31:游離通用過氧化物酶(純VP)、VP+M8(由2nM VP和8μg/ml M90形成的BNC)、和VP+M16(由2nM VP+16μg/ml M90形成的BNC)與硫酸鹽木質素作用后可溶性芳香族分子增加情況的圖表。在特征性吸收波長下觀察用BNC使硫酸鹽木質素釋放的可溶性芳香族化合物。BNC由2nM通用過氧化物酶(商品形式,未經純化)形成。扣除上清液在T0下(初始條件)和納米粒子本底的OD值。
圖32:存在Mn的游離通用過氧化物酶(純VP)、VP+M8(由2nM VP和8μg/ml M90形成的BNC)、和VP+M16(由2nM VP+16μg/ml M90形成的BNC)與硫酸鹽木質素作用后可溶性芳香族分子增加情況的圖表。在特征性吸收波長下觀察用BNC使硫酸鹽木質素釋放的可溶性芳香族化合物。BNC由2nM通用過氧化物酶(商品形式,未經純化)形成。扣除上清液在T0下(初始條件)和納米粒子本底的OD值。
圖33:游離錳過氧化物酶(純MnP)、MnP+M8(由1nM MnP和8μg/ml M90形成的BNC)、和MnP+M16(由1nM MnP+16μg/ml M90形成的BNC)與硫酸鹽木質素作用后可溶性芳香族分子增加情況的圖表。在特征性吸收波長下觀察用BNC使硫酸鹽木質素釋放的可溶性芳香族化合物。BNC由1nM錳過氧化物酶(商品形式,未經純化)形成。扣除上清液在T0下(初始條件)和納米粒子本底的OD值。
圖34:照片顯示了HRP和M90形成的BNC的酚聚合作用和多酚的沉淀。利用NaCl將濃縮的多酚沉淀并離心,用吸光度測定溶液中殘余酚。在存在MNP的情況下校正吸光度。
圖35:平均酚消除(%)作為MnP/HRP比率的函數的圖,用于確定納米粒子與酶的比率對酚消除百分率的影響。固定總酶(辣根過氧化物酶)量以及過氧化物和酚的濃度(各1mM)。增加形成BNC的MNP的比例。當酶被磁性M90簇的介孔空間捕獲時,從溶液中消除的酚量增加。酚消除的效率接近95%。
圖36:酚消除%作為過氧化物與酚比率的函數的圖,用于確定過氧化氫與酚的比率對HRP和BNC的酚消除百分率的影響。將酚的終濃度固定為1mM。改變過氧化物的量。當過氧化物與酚的比率為1.1時,酚消除效率增至100%,而游離酶的效率僅為約30%。當過氧化物的濃度增加導致底物抑制時,游離酶的效率降低。而與此相反,在依賴于MNP/HRP比率的檢測范圍內BNC很少或未被抑制。
發明詳述
在一方面,本發明涉及一種產生自由基(FRP)的組合物,所述組合物包括與FRP酶結合的磁性納米粒子。與FRP酶結合的磁性納米粒子在本申請中也稱為“生物納米催化劑”或“BNC”。如本文所使用的,術語“結合”旨在包括使FRP酶能夠附著于磁性納米粒子之上,且在其使用或供后續使用的儲存條件下不會使FRP酶從磁性納米粒子上釋放的任何方法。FRP酶能夠通過,例如共價鍵、離子鍵、氫鍵、親和力、或范德華相互作用,結合。可以將FRP酶定位于磁性納米粒子的任意位置,例如在其表面和/或包埋于磁性納米粒子內部,例如如果磁性納米粒子是多孔的,可以在磁性納米粒子的介孔中。如本文所使用的,術語“磁性”包括所有的有效磁性特性類型,包括永磁性、超順磁性、順磁性、鐵磁性和亞鐵磁性狀態。
所述磁性納米粒子或BNC具有納米級粒徑,即一般不超過500nm。如本文所使用的,當磁性納米粒子近似或基本上為球形時,術語“粒徑”可以指磁性納米粒子的直徑。在磁性納米粒子不是近似或基本上為球形的情況下(例如,基本上是橢圓形或不規則的),術語“粒徑”可以指磁性納米粒子的最長維度或三維的平均值。術語“粒徑”還可以指磁性納米粒子群的平均粒徑(即,“平均粒徑”)。在不同實施方式中,磁性納米粒子具有的粒徑不超過,例如500nm、400nm、300nm、200nm、100nm、50nm、40nm、30nm、25nm、20nm、15nm、10nm、5nm、4nm、3nm、2nm或1nm,或者以任意兩個前述示例性粒徑為邊界的范圍內的粒徑。
上文所述的磁性納米粒子或其BNC可以是成簇的,即作為聚集物或聚集,在這種情況下,將上文所述的磁性納米粒子認為是原始納米粒子(即,原始微晶),并且可以將上文提供的磁性納米粒子粒徑認為是原始納米粒子粒徑。聚集物通常具有的粒徑(即,二級粒徑)為至少5nm。在不同實施方式中,聚集物具有的粒徑精確地、約為或至少,例如5nm、8nm、10nm、12nm、15nm、20nm、25nm、30nm、35nm、40nm、45nm、50nm、60nm、70nm、80nm、90nm、100nm、150nm、200nm、300nm、400nm、500nm、600nm、700nm或800nm,或者以任意兩個前述示例性粒徑為邊界的范圍內的粒徑。
典型地,原始的和/或聚集的磁性納米粒子或其BNC具有粒徑分布,即其通常分布的粒徑,可以是較窄的或較寬的分布。在不同實施方式中,原始或聚集物粒徑的任意范圍構成原始或聚集物粒徑總體范圍的主要或次要部分。例如,在一些實施方式中,原始粒徑的特定范圍(例如,至少1、2、3、5或10nm和至多15、20、25、30、35、40、45或50nm)或者聚集粒徑的特定范圍(例如,至少5、10、15或20nm和至多50、100、150、200、250或300nm)構成原始粒徑總體范圍的至少或高于50%、60%、70%、80%、90%、95%、98%、99%或100%。在其它實施方式中,原始粒徑的特定范圍(例如,低于1、2、3、5或10nm,或高于15、20、25、30、35、40、45或50nm)或者聚集粒徑的特定范圍(例如,低于20、10或5nm,或高于25、50、100、150、200、250或300nm)構成原始粒徑總體范圍的不超過或低于50%、40%、30%、20%、10%、5%、2%、1%、0.5%或0.1%。
磁性納米粒子的聚集物(即“聚集物”)或其BNC可以具有任意的多孔程度,其中包括基本上缺乏多孔性,這取決于制備其的各原始微晶的量。在特定實施方式中,聚合物通過含有間隙介孔(即,位于原始磁性納米粒子之間的介孔,通過堆積排布形成)從而是介孔性的。介孔的孔徑通常為至少2nm和至多50nm。在不同實施方式中,介孔具有的孔徑精確地或約為,例如2、3、4、5、10、12、15、20、25、30、35、40、45或50nm,或者以任意兩個前述示例性孔徑為邊界的范圍內的孔徑。與粒徑類似,介孔通常具有孔徑分布,即其通常分布的孔徑,可以是較窄的或較寬的分布。在不同實施方式中,介孔孔徑的任意范圍構成介孔孔徑總體范圍或其總孔體積的主要或次要部分。例如,在一些實施方式中,介孔孔徑的特定范圍(例如,至少2、3、或5,和至多8、10、15、20、25、或30nm)構成介孔孔徑總體范圍或其總孔體積的至少或高于50%、60%、70%、80%、90%、95%、98%、99%或100%。在其它實施方式中,介孔孔徑的特定范圍(例如,低于2、3、4或5nm,或者高于10、15、20、25、30、35、40、45或50nm)構成介孔孔徑總體范圍或其總孔體積的不超過或低于50%、40%、30%、20%、10%、5%、2%、1%、0.5%或0.1%。
磁性納米粒子能夠具有本領域公知的任意組分。在一些實施方式中,磁性納米粒子是或者包括磁性的零價金屬部分。一些這種零價金屬的例子包括鈷、鎳和鐵,及其混合物和合金。在其它實施方式中,磁性納米粒子是或者包括磁性金屬的氧化物,如鈷、鎳或鐵的氧化物或其混合物。在一些實施方式中,磁性納米粒子具有區分開的核和表面部分。例如,磁性納米粒子可以具有由鐵、鈷或鎳元素組成的核部分和鈍化層組成的表面部分,鈍化層如金屬氧化物或稀有金屬涂層,如金、鉑、鈀或銀層。在其它實施方式中,金屬氧化物磁性納米粒子或其聚集物上涂覆一層稀有金屬涂層。稀有金屬涂層可以,例如減少磁性納米粒子表面的電荷數,這可以有益地增加在溶液中的分散性和更好地控制BNC的粒徑。稀有金屬涂層保護粒子防止其氧化,因溶出或螯合造成的溶解,例如在生物反應或工藝中使用螯合有機酸,如檸檬酸、丙二酸、酒石酸時。鈍化層可以是任意適宜厚度,和特別地,至少、至多或者低于,例如0.1nm、0.2nm、0.3nm、0.4nm、0.5nm、0.6nm、0.7nm、0.8nm、0.9nm、1nm、2nm、3nm、4nm、5nm、6nm、7nm、8nm、9nm或10nm,或者在以這些值中的任意兩個為邊界的范圍內的厚度。
在特定實施方式中,磁性納米粒子具有氧化鐵組分。氧化鐵組分可以是本領域公知的任意磁性或超順磁性氧化鐵組分,例如磁鐵礦(Fe3O4)、赤鐵礦(α-Fe2O3)、磁赤鐵礦(γ-Fe2O3)、或者如式AB2O4所示的尖晶石型鐵酸鹽,其中A是二價金屬(例如Zn2+、Ni2+、Mn2+、Co2+、Ba2+、Sr2+或其組合),并且B是三價金屬(例如Fe3+、Cr3+或其組合)。
在一些實施方式中,磁性納米粒子或其聚集物或其BNC位于鐵磁性亞微米粒子表面。通過位于鐵磁性微粒表面,磁性納米粒子或聚集物或BNC通過任意適宜的締合、吸附或結合相互作用附著在鐵磁性微粒表面。鐵磁性微粒可以或可以不涂覆金屬氧化物或稀有金屬涂層。而且,鐵磁性微粒可以具有任意適宜的表面基團,根據本領域所公知的,該表面基團可以促進向磁性納米粒子的附著。在不同實施方式中,鐵磁性微粒子具有的粒徑大約、精確地、或至少為20、30、40或50、60、70、80、90、100、100、200、300、400、500、600、700、800、900、1000nm,或者在以任意兩個前述示例性粒徑為邊界的范圍內的粒徑。由于具有更大的粒徑(超微結構),因而附著于鐵磁性粒子表面的BNC能夠更容易地被外部磁場捕獲。更大的粒徑還有助于保護酶活性。這些更大的磁性粒子能夠容易地被外部磁場捕獲。當處于磁場中時,附著于鐵磁性亞微米粒子表面上的BNC不會產生過度聚集的傾向。
磁性納米粒子或其聚集物或其BNC具有任意適宜的磁度。例如,磁性納米粒子或其聚集物或其BNC能夠具有至少或至多為5、10、15、20、25、30、40、45、50、60、70、80、90或100emu/g的飽和磁化強度(Ms)。磁性納米粒子或其聚集物優選具有不超過(即,至多)或低于5emu/g的剩余磁化強度(Mr),更優選地,至多或低于4emu/g、3emu/g、2emu/g、1emu/g、0.5emu/g或0.1emu/g。磁性納米粒子或其聚集物的表面磁場可以是大約或至少,例如5、10、50、100、200、300、400、500、600、700、800、900或1000高斯(G),或在以任意兩個前述值為邊界的范圍內的磁場。
可以使磁性納米粒子或其聚集物吸附適量的FRP酶以產生產物BNC,酶量根據用途達到或低于飽和水平。在不同實施方式中,磁性納米粒子或其聚集物可以吸附大約、至少、至多、或少于,例如1、5、10、15、20、25或30pmol/m2的FRP酶。或者,磁性納米粒子或其聚集物可以吸附的FRP酶量是大約、至少、至多、或少于,例如飽和水平的10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
磁性納米粒子或其聚集物或其BNC具有任意適宜的孔體積。例如,磁性納米粒子或其聚集物可以具有的孔體積大約、至少、至多、或少于,例如0.01、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、0.95或1cm3/g,或者在以任意兩個前述值為邊界的范圍內的孔體積。
磁性納米粒子或其聚集物或其BNC具有任意適宜的比表面積。例如,磁性納米粒子或其聚集物可以具有的比表面積大約、至少、至多、或少于,例如50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200m2/g。
FRP酶可以是產生自由基的任意酶。而且,FRP酶可以是任意來源的,例如真菌、微生物、動物或植物。在特定實施方式中,FRP酶是屬于EC 1酶家族的氧化還原酶。EC 1氧化還原酶可以是,例如作用于供體CH-OH基團的EC 1.1氧化還原酶、作用于供體醛基或氧代基團的EC 1.2氧化還原酶、作用于供體CH-CH基團的EC 1.3氧化還原酶、作用于供體CH-NH2基團的EC 1.4氧化還原酶、作用于供體CH-NH基團的EC 1.5氧化還原酶、作用于NADH或NADPH的EC 1.6氧化還原酶、作用于供體各種氮化合物的EC1.7氧化還原酶、作用于供體硫基團的EC 1.8氧化還原酶、作用于供體亞鐵血紅素基團的EC 1.9氧化還原酶、作用于供體二酚及其相關物質的EC 1.10氧化還原酶、作用于受體過氧化物的EC 1.11氧化還原酶、作用于供體氫的EC 1.12氧化還原酶、通過摻入分子氧(加氧酶)作用于單一供體的EC 1.13氧化還原酶、通過摻入或還原分子氧作用于成對供體的EC 1.14氧化還原酶、作用于受體超氧化物的EC 1.15氧化還原酶、氧化金屬離子的EC 1.16氧化還原酶、作用于CH或CH2基團的EC 1.17氧化還原酶、作用于供體鐵-硫蛋白的EC 1.18氧化還原酶、作用于供體還原型黃素氧化還原蛋白的EC 1.19氧化還原酶、作用于供體磷或砷的EC 1.20氧化還原酶、作用于X-H和Y-H以形成X-Y鍵的EC 1.21氧化還原酶、EC 1.97氧化還原酶、使用氫作為還原劑的EC 1.98氧化還原酶和使用氧作為氧化劑的EC 1.99氧化還原酶。還可以更特別地將氧化還原酶鑒定為屬于上文所述的任意EC 1.1群組的亞型。
在第一個特定實施方式的集合中,FRP酶選自EC 1.1型的氧化還原酶。可以進一步將EC 1.1酶鑒定為屬于任意下述亞型:NAD或NADP作為受體的EC 1.1.1、細胞色素作為受體的EC 1.1.2、氧作為受體的EC 1.1.3、二硫化物作為受體的EC 1.1.4、醌或類似化合物作為受體的EC 1.1.5和作用于其它受體的EC 1.1.99。在更特定的實施方式中,將FRP酶鑒定為屬于上文所述的任意EC 1.1亞型的亞型。例如,可以將FRP酶鑒定為屬于任意EC 1.1.3亞型,如EC 1.1.3.3(蘋果酸氧化酶)、EC 1.1.3.4(葡萄糖氧化酶)、EC 1.1.3.5(己糖氧化酶)、EC 1.1.3.6(膽固醇氧化酶)、EC 1.1.3.7(芳基-醇氧化酶)、EC 1.1.3.8(L-古洛糖酸內酯氧化酶)、EC 1.1.3.9(半乳糖氧化酶)EC 1.1.3.10(吡喃糖氧化酶)、EC 1.1.3.11(L-山梨糖氧化酶)EC 1.1.3.12(吡哆醇4-氧化酶)、EC 1.1.3.13(醇氧化酶)、EC 1.1.3.14(兒茶酚氧化酶)、EC 1.1.3.15(2-羥基酸氧化酶)、EC 1.1.3.16(蛻皮素氧化酶)、EC 1.1.3.17(膽堿氧化酶)、EC 1.1.3.18(仲醇氧化酶)、EC 1.1.3.19(4-羥基扁桃酸氧化酶)、EC 1.1.3.20(長鏈醇氧化酶)、EC 1.1.3.21(甘油-3-磷酸氧化酶)、EC 1.1.3.22、EC 1.1.3.23(硫胺素氧化酶)、EC 1.1.3.24(L-半乳糖內酯氧化酶)、EC 1.1.3.25、EC 1.1.3.26、EC 1.1.3.27(羥基植烷酸氧化酶)、EC 1.1.3.28(核苷酶)、EC 1.1.3.29(N-酰基己糖胺氧化酶)、EC 1.1.3.30(聚乙烯醇氧化酶)、EC 1.1.3.31、EC 1.1.3.32、EC 1.1.3.33、EC 1.1.3.34、EC 1.1.3.35、EC 1.1.3.36、EC 1.1.3.37(D-阿拉伯糖-1,4-內酯氧化酶)、EC 1.1.3.38(香草醇氧化酶)、EC 1.1.3.39(核苷氧化酶,H2O2形成)、EC 1.1.3.40(D-甘露醇氧化酶)和EC 1.1.3.41(木糖醇氧化酶)。
在第二個特定實施方式集合中,FRP酶選自EC 1.10型的氧化還原酶。可以進一步將EC 1.10酶鑒定為屬于任意下述亞型:NAD或NADP作為受體的EC 1.10.1、細胞色素作為受體的EC 1.10.2、氧作為受體的EC 1.10.3和具有其它受體的EC 1.10.99。更特別地,EC 1.10.1酶可以是,例如EC 1.10.1.1,即反式-苊-1,2-二醇脫氫酶。更特別地,EC 1.10.2酶可以是,例如EC 1.10.2.1(細胞色素-b5還原酶)或EC 1.10.2.2(細胞色素-c還原酶)。更特別地,EC 1.10.3酶可以是,例如EC 1.10.3.1(兒茶酚氧化酶)、EC 1.10.3.2(漆酶)、EC 1.10.3.3(L-抗壞血酸氧化酶)、EC 1.10.3.4(o-氨基苯酚氧化酶)、EC 1.10.3.5(3-羥氨苯甲酸氧化酶)、EC 1.10.3.6(利福霉素-B氧化酶)、EC 1.10.3.7或EC 1.10.3.8。更特別地,EC 1.10.99酶可以是,例如EC 1.10.99.1(塑醌-質體藍素還原酶)、EC 1.10.99.2(核糖二氫煙酰胺脫氫酶,醌)或EC1.10.99.3(紫黃質去環氧酶)。
在第三個特定實施方式集合中,FRP酶選自EC 1.11型的氧化還原酶。可以將EC 1.11酶進一步鑒定為屬于EC 1.11.1亞型(過氧化物酶)。更特別地,EC 1.11.1酶可以是例如EC 1.11.1.1(NADH過氧化物酶)、EC 1.11.1.2(NADPH過氧化物酶)、EC 1.11.1.3(脂肪酸過氧化物酶)、EC 1.11.1.4、EC 1.11.1.5(細胞色素-c過氧化物酶)、EC 1.11.1.6(過氧化氫酶)、EC 1.11.1.7(過氧化物酶)、EC 1.11.1.8(碘過氧化物酶)、EC 1.11.1.9(谷胱甘肽過氧化物酶)、EC 1.11.1.10(氯過氧化物酶)、EC 1.11.1.11(L-抗壞血酸過氧化物酶)、EC 1.11.1.12(磷脂-過氧化氫谷胱甘肽過氧化物酶)、EC 1.11.1.13(錳過氧化物酶)、EC 1.11.1.14(二芳基丙烷過氧化物酶)或EC 1.11.1.15(過氧化物氧化還原酶)。
在特定實施方式中,FRP酶是過氧化物酶。過氧化物酶還可以進一步按照功能分類,例如木質素過氧化物酶、錳過氧化物酶或通用過氧化物酶。還可以將過氧化物酶分為真菌、細菌、動物或植物過氧化物酶。還可以將過氧化物酶分為I類、II類或III類過氧化物酶。還可以將過氧化物酶分為髓過氧化物酶(MPO)、嗜曙紅細胞過氧化物酶(EPO)、乳酸過氧化物酶(LPO)、甲狀腺過氧化物酶(TPO)、前列腺素H合成酶(PGHS)、谷胱甘肽過氧化物酶、鹵化過氧化物酶、過氧化氫酶、細胞色素c過氧化物酶、辣根過氧化物酶、花生過氧化物酶、大豆過氧化物酶、蕪菁過氧化物酶、煙草過氧化物酶、番茄過氧化物酶、大麥過氧化物酶或者過氧蛋白。在特定實施方式中,過氧化物酶是辣根過氧化物酶。
在一些實施方式中,使用單一的FRP酶。在其它實施方式中,使用FRP酶的組合,如任意兩種或三種選自任意上述類型或亞類的氧化還原酶。在一些實施方式中,使用FRP酶(例如,EC1酶)的組合。在特定實施方式中,使用EC 1.1酶的組合。在其它特定實施方式中,使用EC 1.10酶的組合。在其它特定實施方式中,使用EC 1.11酶的組合。在其它實施方式中,使用上文所述的任意特定FRP酶和過氧化物酶的組合(例如,EC 1.1或EC 1.1.3酶和過氧化物酶的組合)。當使用FRP酶的組合時,可以將兩種或更多酶排布在核-殼類型的排布中,即第一種FRP酶在磁性納米粒子或其聚集物的核部分或表面部分,并且第二種(不同的)FRP酶覆蓋存在第一種FRP酶的區域。第二種FRP酶可以是磁性納米粒子的聚集物或者在其表面上,覆蓋在第一種酶的上面。在多酶系統中,控制不同酶在介孔聚集物內分布的情況為不同反應的解偶聯以及允許反應底物和產物從一層向另一層或向BNC的核擴散提供了益處。因而,當在BNC的狹窄孔結構內進行酶反應時,核/殼分布為更好地控制所捕獲的不同FRP酶的動力學提供了可能性。將進行類似反應(例如,兩種或多種過氧化物酶或者一種過氧化物酶和一種漆酶)但具有不同反應要求(底物、底物濃度等)的酶進行組合能夠有利地增加BNC的通用性以便在廣泛和多變的反應條件下進行高效率的反應。將酶與所偶聯的反應組合能夠確保在酶附近產生底物,并且避免需要有害的和不穩定的化學底物,如過氧化氫。例如,葡萄糖氧化酶能夠從葡萄糖中產生過氧化氫,葡萄糖是一種便宜和無害的化合物。
本發明還涉及一種制備引入酶的(例如,結合酶、捕獲酶、或包埋酶)磁性納米粒子及其聚集物的方法。在特定實施方式中,通過在用于制備磁性納米粒子或聚集物的反應條件下引入FRP酶制備引入酶的磁性納米粒子或其聚集物。例如,可以在產生金屬納米粒子(例如,鈷、鎳或鐵)或金屬氧化物磁性納米粒子(例如,鈷、鎳或鐵的氧化物)的工藝中引入FRP酶。產生金屬和金屬氧化物磁性納米粒子的合成方法是本領域所公知的。一種用于生產金屬納米粒子的公知方法包括在溶液中還原金屬離子(例如,作為金屬的鹽)。還原反應可以通過,例如還原化學方法(例如,通過與還原劑反應,如氫、硼烷、肼、連二磷酸鹽或檸檬酸)或者還原或分解物理方法(例如,在溶液中超聲或熱處理)。或者,所述方法可以是通過,例如超聲、熱處理或暴露于放射源如紫外線,分解零價金屬復合物(例如,Ni0羰基或膦復合物)。生產金屬氧化物磁性納米粒子的一種特別的公知的方法包含在使金屬氧化物納米粒子沉淀的條件下與金屬鹽(例如,金屬鹵化物)發生堿性反應。例如,使用已建立的方法,可以通過在溶液中與堿如NaOH反應將鐵(II)和鐵(III)離子(例如,在FeCl2和FeCl3中的)共沉淀生產鐵氧化物納米粒子。可以在任意的此類方法中引入FRP酶,只要所述方法不會實質上不利于FRP酶的活性即可。
在其它實施方式中,首先制備磁性納米粒子或其聚集物,然后將FRP酶引入磁性納米粒子或其聚集物上或內部。特別地,在磁性納米粒子或聚集物是多孔的情況下,可以在水性溶液中通過簡單擴散、吸附或自組裝將FRP酶包埋于磁性納米粒子或聚集物的孔中。在其它實施方式中,使用結合劑將磁性納米粒子或其聚集物的表面和/或孔衍生化,這引起或促進FRP酶與磁性納米粒子或其聚集物的結合。結合劑可以是,例如具有與磁性納米粒子結合的一個反應性末端和與FRP酶結合的另一個反應性末端的雙功能連接子。對于金屬納米粒子,與磁性納米粒子結合的反應性末端可以是,例如氨基、巰基、巰醚基或膦基。對于金屬氧化物納米粒子,與磁性納米粒子結合的反應性末端可以是,例如磷酸基、膦酸基、硫酸基或磺酸基。在這兩種情況下,與FRP酶結合的反應性末端可以是,例如本領域公知的任意胺反應性基團(例如N-羥基琥珀酰亞胺基),或者本領域公知的將酶或其它蛋白與另外一部分偶聯的任意其它基團。或者,結合劑可以是,例如基于親和偶聯的,例如分別產生磁性納米粒子-生物素或-親和素偶聯物并將其與FRP-親和素或-生物素偶聯物反應。
磁性納米粒子或其聚集物或其BNC還可以涂覆稀有金屬如金、鉑或鈀。可以使用涂覆磁性納米粒子的任意適宜方法。例如,在特定實施方式中,將磁性納米粒子分散于含有稀有金屬鹽的溶液中,并稀有金屬鹽處于還原條件。在稀有金屬鹽被還原前,通過在磁性納米粒子的表面上結合雙功能分子能夠使上述方法易于進行。用于這一目的的雙功能分子應含有用于與磁性納米粒子結合的部分(如上文所述)和用于與稀有金屬離子結合的稀有金屬結合部分(例如,胺、巰基、膦或螯合部分)。任選地,一旦金屬離子與納米粒子表面結合,則可以對磁性納米粒子進行洗滌以除去過量的稀有金屬鹽(例如,通過過濾或傾析)。由于稀有金屬粒子附著于所述表面,因而上述方法提供了用于生產稀有金屬涂層的具有更高選擇性的方法(即,不會伴隨著稀有金屬納米粒子的產生),并且涂層更加均一。在一些實施方式中,在將FRP酶引入磁性納米粒子前進行稀有金屬涂層,在這種情況下FRP酶隨后與稀有金屬涂層結合。FRP酶能夠通過,例如使用與稀有金屬涂層結合并具有另一個與FRP酶結合的反應性基團的雙功能性分子將稀有金屬涂層功能化,從而與稀有金屬涂層結合。
含有酶的磁性納米粒子或其聚集物或其稀有金屬涂覆的形式還可以結合或附著于(即,定位于)鐵磁性微粒的表面。在一個實施方式中,將含有酶的磁性納米粒子或其聚集物或其稀有金屬涂覆的形式通過將其在水溶液中接觸以使得納米粒子附著于微粒的表面上,從而將其附著于鐵磁性微粒的表面。在其它實施方式中,將納米粒子和微粒適宜地使用界面劑進行功能化以利于結合相互作用,其可以基于,例如共價鍵、離子鍵、親和力、氫鍵或范德華(分散)相互作用。
在另一個方面,本發明涉及一種解聚木質素的工藝,即木質素解聚工藝,其中將上文所述的任意結合酶的磁性納米粒子或其聚集物(即,BNC)用于解聚或促進木質素解聚。被解聚的木質素可以是任意含有木質素的材料。前體木質素可以是自然界中存在的或本領域公知的多種多樣木質素成分中的任意一種。
如本領域所公知的,在自然界中沒有統一的木質素成分。木質素是在不同種屬的植物之間呈現出顯著組分差異的隨機聚合物。多種其它條件如環境條件、壽命和處理方法均影響木質素的成分。木質素的差異主要是三種醇單元的比率,即p-香豆醇、愈創木醇和芥子醇。p-香豆醇、愈創木醇和芥子醇的聚合作用分別形成木質素聚合物的p-羥苯基(H)、愈創木基(G)和紫丁香基(S)組分。前體木質素可以具有多種多樣的H、G和S組分相對重量百分百(wt%)中的任意一種。除了木質素的天然差異之外,其可能還進一步存在由于對木質素處理方法不同造成的成分差異。例如,前體木質素可能是硫酸鹽木質素、亞硫酸鹽木質素(即,木質素磺酸鹽)或無硫木質素。
木質素是地球上最豐富的芳香生物聚合物,但是由于其化學成分和物理結構存在明顯的隨機性,因而其對轉化和生物轉化具有化學抗性。可以將木質素認為是多糖纖維之間的“膠”或“環氧樹脂”,其為脈管植物的細胞壁提供了強度、剛性和保護。從化學的角度看,木質素是由類苯基丙烷分子包括松柏醇、芥子醇和香豆醇通過芳基鍵、醚鍵和碳碳鍵聚合形成的高度異質性的聚合物。
基于1噸生物質生產100加侖乙醇且所述生物質(例如木材和草)含有平均約20%的木質素的假設,能夠迅速估算出生物提煉處理1億加侖的年生產能力能夠產生約200,000噸木質素材料。僅就美國而言,為達到2020年時替代20%汽油的目標,相當于約350億加侖乙醇,每年將產生共計約7億噸木質素。在世界范圍內木質素的實際產生情況約為每年9千萬噸,其主要為造紙的副產物硫酸鹽木質素。換言之,在世界范圍內木質素的產生將以高于一個數量級的方式增長。
根據用途和化學純度,可以將木質素用于生產低價和高價產品。直到最近,與回收來自其燃燒的能量相比,木質素產品的市場并沒有足夠龐大、具有競爭力和吸引力,從而抵償分離和純化木質素的成本。這主要是因為油料的成本仍較低且供應較高,其足以為化學和材料工業提供基礎材料。然而,在基于生物燃料和生物產物共同生產的碳水化合物經濟框架下,預計用于轉化的高純度的分離木質素將為每kg原始材料$1.10,相比之下用于混燒時為$0.04。低端應用主要用作分散劑、用于碳固定的土壤改良劑、肥料和殺蟲劑的吸附劑、以及燃料,這些應用在提取后很少或不需要進一步的轉化。高端應用需要將木質素解聚,包括產生酚前體(DMSO、香草醛、酚和芳香化合物)和聚合物組分(例如環氧樹脂、聚氨酯泡沫、酚醛樹脂粉末、碳纖維以及膠和粘合劑)。
在自然界中,木質素的轉化通過特定微生物進行,特別是真菌和細菌。木質纖維細菌和真菌具有降解木質素以獲得生物質纖維素成分的能力。為實現這一目標,木質纖維細菌和真菌分泌一系列氧化還原酶,包括漆酶、氧化酶和過氧化物酶,以及產生有機酸和H2O2的過氧化氫酶。最強的氧化還原酶由被稱為白腐真菌的特定類型的真菌產生,其專門用于木質纖維的降解。不同類型真菌過氧化物酶底物的性質不同。
木質素過氧化物酶(LiP,E.C.1.11.1.14)催化大量模型化合物的C-C鍵氧化裂解,并將芐基醇氧化為醛或酮。木質素過氧化物酶催化的典型反應為Cα-Cα裂解、Cα氧化、烷基芳基裂解、芳環裂解、脫甲基化、羥基化和聚合。白腐擔子真菌中,木質素過氧化物酶參與了木質素的氧化分解。木質素過氧化物酶利用H2O2催化非酚芳環成為芳基陽離子自由基的氧化反應。典型的例子是藜蘆醇(3,4-二甲氧基芐基醇)通過中間形成藜蘆基陽離子和芐基自由基成為藜蘆醛(3,4-二甲氧基芐基醛)的氧化反應:藜蘆醇+H2O2→藜蘆醛+2H2O。錳過氧化物酶(MnP;E.C.1.11.1.13)與LiP(至多1.5V)相比具有更低的氧化還原電位(至多1.1V),其催化木質素和酚化合物由Mn介導的氧化反應。這種酶利用H2O2催化Mn(II)成為Mn(III)的氧化反應。在存在二羧基酸的條件下,高反應性Mn(III)通過螯合作用穩定化:2Mn(II)+2H++H2O2→2Mn(III)+2H2O。MnP的目的為產生小而高效的氧化劑,其擴散進入木質化細胞壁中,并從內部實現對木質素的解聚。通用過氧化物酶(合成的混合過氧化物酶,錳-木質素過氧化物酶:VeP EC 1.11.1.16)是一種相當新穎的木質素分解酶,其具有錳過氧化物酶(Mn(II)的氧化反應)、木質素過氧化物酶(非酚芳香化合物不依賴于Mn的氧化反應)和植物過氧化物酶(氫醌和取代酚的氧化反應)的組合催化性質。在本文所述的木質素解聚工藝中可以使用上文所述過氧化物酶中的任意一種或其組合。
在第一個實施方式中,含有木質素的材料是部分地或基本上與木材的其它成分(例如,纖維素和半纖維素成分)分離的形式,因為其通常經過木質纖維素材料的預處理工藝,上述工藝的細節是木質纖維素處理和轉化領域所公知的。預處理工藝用于將木質素與含木質素的來源中的其它成分分離,或者用于削弱木質素與其它成分之間的結合。可以通過例如提取對木質素進行進一步分離,這也是本領域所公知的。在第二個實施方式中,含有木質素的材料是含有木質素的消耗品如紙張或紙板,其可以或可以不經過預處理。在第三個實施方式中,含有木質素的材料是含有木質素的天然原料(即,粗木質纖維材料)如木屑、草(例如,柳枝稷和混合草)、玉米秸稈(例如,玉米植物的葉、外皮、莖或穗軸)、甘蔗、鋸末、麻或其組合,其通常均經過預處理以使得木質素能夠用于解聚反應。
在木質素解聚工藝中,在利用酶結合磁性納米粒子或其聚集物的自由基活性使木質素部分或完全解聚的條件下,將上文所述的任意與酶結合的磁性納米粒子或其聚集物與含有木質素的材料接觸。通常通過將酶結合磁性納米粒子或其聚集物與含有木質素的材料一同加入水溶液中使其接觸,該水溶液如對含有木質素的材料進行預處理工藝使用的水溶液。在一些實施方式中,在解聚工藝中使用室溫條件(例如,至少15、18、20或22℃和至多25℃或30℃)。在其它實施方式中,在解聚工藝中使用升高的溫度條件(例如,高于30℃,或者至少或高于35、40、45、50或60℃,或者達到FRP酶降解或活基本上失去活性的溫度)。在其它實施方式中,在解聚工藝中使用降低的溫度條件(例如,低于15℃,或者至多或低于10、5或0℃)。與其原有形式相比,解聚時木質素斷裂為更短的片段。完全解聚后全部或絕大部分木質素(例如,至少80、90或95%)轉化為至少一個或多個木質素的基本結構單元,即松柏醇、芥子醇和香豆醇及其衍生物。一般而言,部分解聚使得少于80%或者至多70、60、50、40、30、20、10、5或1%的木質素轉化為原始的結構單元,其余的木質素轉化為含有兩個、三個、四個或更多的(甚至至多10、20、50、100、200、500或1000)結構單元重復(例如,分別為來自松柏醇、芥子醇和香豆醇的p-羥苯基、愈創木基和紫丁香基單元)。由于不同的木質素解聚度可以優選用于不同的應用,因而可以對解聚條件進行適當調整以提供適宜的解聚度或與其它相比偏向于產生一種或多種類型的解聚產物。
由于每種含有木質素材料的各自結構單元具有不同的分布情況和相對量,因而解聚產生的各種產物的相對量非常依賴于含有木質素材料的類型。在解聚工藝中通常還產生其它的解聚產物,例如芳香醛、酮、醇和酸,一般量較少。在不需要此類其它產物的實施方式中,通過調整反應條件可以方便地將其有益的減少或消除,上述反應條件包括對FRP結合磁性納米粒子或其聚集物進行適當的選擇。
可以將上文所述的任意酶結合磁性納米粒子和聚集組合物用于木質素解聚工藝。在特定實施方式中,用于木質素解聚工藝的FRP酶是過氧化物酶,特別地,是降解木質素的過氧化物酶如木質素過氧化物酶、通用過氧化物酶、錳過氧化物酶或其組合(包括其核-殼組合)。更特別地,FRP酶還可以是真菌、細菌或植物過氧化物酶。在特定實施方式中,FRP酶是兩個FRP酶的系統,如真菌過氧化物酶和葡萄糖氧化酶的組合,或者過氧化物酶和/或氧化酶與漆酶的組合。
在一些實施方式中,木質素解聚工藝與下游工藝是偶聯的(即,整合的),在所述下游工藝中將木質素解聚工藝生產的解聚產物用于生產其它產品。下游工藝可以將木質素解聚產物轉化為,例如生物燃料或工業化學產品,例如聚合物、塑料、聚合物前體(單體)、溶劑、粘合劑、涂料、洗滌劑、潤滑劑、食品、藥品、或香料或其前體。或者,下游工藝可以將木質素解聚產物摻入任意此類最終產品。
在一些實施方式中,木質素解聚工藝與上游工藝是偶聯的,在所述上游工藝中提供用于本申請所述的木質素解聚工藝的含有木質素的材料。上游工藝可以是,例如紙或紙漿生產工藝、生物質轉化為生物燃料的工藝(即,主要是將纖維素材料水解并轉化為生物燃料)或者生物質轉化為乙醇的發酵工藝(即,主要是將纖維素材料水解并轉化為乙醇)。
在另一個方面,本發明涉及一種從水中除去芳香族污染物的工藝(即,水體修復工藝)。在所述工藝中,將受到一種或多種芳香族物質污染的水與任意上文所述的酶結合磁性納米粒子或其聚集物接觸,以使得芳香族物質沉淀,即形成不溶性物質。然后優選對沉淀的(即,沉積)材料如通過離心或沉降進行進一步分離,并通過例如過濾或傾晰將其從水中除去。不囿于任何理論,可以相信芳香族物質與酶結合磁性納米粒子產生的自由基反應產生了來源于芳香族物質的聚合物質。芳香族污染物可以是任意芳香族物質,包括較常見于受污染水中的那些。在一些實施方式中,芳香族污染物是苯或苯的衍生物,如鹵代苯(例如,氯苯、二氯苯、溴苯或多氯聯苯即PCB)、烷基苯(例如,甲苯、乙苯或二甲苯)、酚類物質(例如,苯酚、間苯二酚、兒茶酚或甲酚)、醚化苯(例如,茴香醚)、稠環化合物(例如,萘或聚芳烴)、苯胺類物質(例如,苯胺和N-烷基或N,N-二烷基取代苯胺)或者苯甲酸化合物(例如,苯甲酸及其酯和苯甲酸的羥基取代衍生物)。在其它實施方式中,芳香族污染物是雜芳香族物質如呋喃、吡喃、二惡英、噻吩、吡啶、吡嗪、嘧啶、吡咯、咪唑、吲哚及其衍生物。
可以將任意上文所述的酶結合磁性納米粒子和聚集組合物用于水體修復工藝。在特定實施方式中,在水體修復工藝中使用的FRP酶是辣根過氧化物酶或者辣根過氧化物酶與氧化酶的組合。
在另一個方面,本發明涉及一種通過自由基反應使可聚合的單體聚合的工藝。在所述工藝中,將一種或多種類型的單體與任意上文所述的酶結合磁性納米粒子或其聚集物反應以使得單體聚合。所述單體可以是,例如上文所述的水體修復工藝中的任意物質。在特定實施方式中,所述單體是或者包括乙烯基加成單體。在聚合中,產生乙烯基加成聚合物。此類單體的一些例子包括乙烯、丙烯、丁二烯、丙烯酸及其酯、異丁烯酸及其酯、丙烯腈、乙酸乙烯酯、苯乙烯、二乙烯基苯、氟化乙烯和氯化乙烯。在其它實施方式中,所述單體是酚類化合物。在聚合中,產生酚樹脂或聚合物。聚合工藝可以采用本領域公知的用于實施聚合反應的任意條件和裝置,特別是用于自由基引發的聚合反應的那些。
對于上文所述的任意工藝而言,酶結合磁性納米粒子及其聚集物能夠方便地通過磁分離進行捕獲以防止污染最終產品。而且,本文所述的酶結合磁性納米粒子或其聚集物進一步的優點是在多種情況下保持活性并在被捕獲后再生的能力,這允許其在被捕獲后重新使用。有益的是,在經過若干個循環后,失活的BNC能夠被容易地提取和濃縮成其固體形式以減少浪費和提供更有效的工藝。通過酶的變性、超聲和純化處理以使其重新儲存和重新使用新鮮的功能性酶可以將金屬涂覆的BNC用于其它用途。由在表面上磁性捕獲自組裝BNC制備的微-生物納米催化劑(微-BNC)在使用較低強度磁場的工藝應用中具有吸引力。與介孔和低密度的MNP聚集物相比,更大和密度更高的鐵磁性粒子具有更高的質量磁化率。微BNC是穩定的、納米化的和具有介孔結構的,其有助于保持酶的活性同時增加磁性催化劑的整體密度和質量磁化率。這些超微結構使其本身更易于被由小永磁體和弱場電磁體產生的外部磁場所控制。在將微-BNC磁性捕獲時,可以清除和更換反應溶液,因此只要酶保持其工藝水平的活性,微-BNC就可以連續使用。
在一些實施方式中,本申請提供了如下1-47項所述的實施方案:
1.一種組合物,所述組合物包括磁性納米粒子的介孔聚集物和產生自由基的酶,其中所述磁性納米粒子的介孔聚集物具有介孔,在所述介孔中嵌入所述產生自由基的酶。
2.根據第1項所述的組合物,其中所述磁性納米粒子的介孔聚集物具有氧化鐵組分。
3.根據第1項所述的組合物,其中所述磁性納米粒子的介孔聚集物具有的磁性納米粒子的粒徑分布為其中至少90%的磁性納米粒子具有至少3nm和至多30nm的粒徑,以及聚集粒子的粒徑分布為其中至少90%的所述磁性納米粒子的介孔聚集物具有至少10nm和至多500nm的粒徑。
4.根據第1項所述的組合物,其中所述磁性納米粒子的介孔聚集物具有至少10emu/g的飽和磁化強度。
5.根據第1項所述的組合物,其中所述磁性納米粒子的介孔聚集物具有至多5emu/g的剩余磁化強度。
6.根據第1項所述的組合物,其中所述產生自由基的酶以至多100%的飽和容量包含在所述磁性納米粒子的介孔聚集物中。
7.根據第1項所述的組合物,其中所述產生自由基的酶選自與作為受體的過氧化物作用的EC 1.11氧化還原酶和與作為供體的聯苯酚及其相關物質作用的EC 1.10氧化還原酶及其組合。
8.根據第7項所述的組合物,其中所述產生自由基的酶包括過氧化物酶。
9.根據第8項所述的組合物,其中所述過氧化物酶是II類過氧化物酶。
10.根據第9項所述的組合物,其中所述II類過氧化物酶是II類微生物過氧化物酶。
11.根據第10項所述的組合物,其中所述II類微生物過氧化物酶選自木質素過氧化物酶、錳過氧化物酶、和通用過氧化物酶。
12.根據第8項所述的組合物,其中所述過氧化物酶是III類過氧化物酶。
13.根據第12項所述的組合物,其中所述III類過氧化物酶選自辣根過氧化物酶、花生過氧化物酶、大豆過氧化物酶、蕪菁過氧化物酶、煙草過氧化物酶、番茄過氧化物酶、和大麥過氧化物酶。
14.根據第7項所述的組合物,其中所述產生自由基的酶是漆酶。
15.根據第1項所述的組合物,其中所述介孔的特征為孔徑分布為其中具有孔徑至少2nm和至多20nm的孔形成了至少90%的孔體積。
16.根據第1項所述的組合物,其中所述產生自由基的酶包括EC 1.1.3酶和過氧化物酶。
17.根據第16項所述的組合物,其中所述EC 1.1.3酶是葡萄糖氧化酶EC 1.1.3.4。
18.根據第16項所述的組合物,其中所述過氧化物酶是辣根過氧化物酶。
19.根據第1項所述的組合物,其中所述磁性納米粒子的介孔聚集物和產生自由基的酶的表面涂覆金。
20.根據第1項所述的組合物,其中位于鐵磁性亞微粒子表面的、所述磁性納米粒子的介孔聚集物和產生自由基的酶具有至少20納米的粒徑。
21.一種組合物,所述組合物包括與產生自由基的酶結合的磁性納米粒子,其中與產生自由基的酶結合的所述磁性粒子的表面涂覆金。
22.一種組合物,所述組合物包括與產生自由基的酶結合的磁性納米粒子,其中位于鐵磁性亞微粒子表面的、與產生自由基的酶結合的所述磁性納米粒子具有至少20納米的粒徑。
23.一種用于解聚木質素的工藝,所述方法包括將含有木質素的材料與包括磁性納米粒子的組合物反應以用所述木質素生產解聚產物,所述磁性納米粒子與產生自由基的酶結合。
24.根據第23項所述的工藝,其中所述解聚產物選自松柏醇、芥子醇、和香豆醇,及其衍生物。
25.根據第23項所述的工藝,其中所述產生自由基的酶包括過氧化物酶。
26.根據第25項所述的工藝,其中所述過氧化物酶是降解木質素的過氧化物酶。
27.根據第26項所述的工藝,其中所述降解木質素的過氧化物酶選自木質素過氧化物酶、通用過氧化物酶、錳過氧化物酶、及其組合。
28.根據第23項所述的工藝,其中所述工藝與木質纖維素轉化工藝連接,通過所述木質纖維素材料轉化工藝生產將被解聚的所述木質素。
29.根據第23項所述的工藝,其中所述磁性納米粒子包括磁性納米粒子的介孔聚集物,其中所述磁性納米粒子的介孔聚集物具有介孔,在所述介孔中嵌入所述產生自由基的酶。
30.根據第23項所述的工藝,其中與產生自由基的酶結合的所述磁性粒子的表面涂覆金。
31.根據第23項所述的工藝,其中位于鐵磁性亞微粒子表面的、與產生自由基的酶結合的磁性納米粒子具有至少20納米的粒徑。
32.根據第23項所述的工藝,其中在所述工藝結束后通過磁性分離捕獲與產生自由基的酶結合的所述磁性納米粒子并在捕獲后重新使用所述磁性納米粒子,其中在被捕獲和重新使用后,與產生自由基的酶結合的所述磁性納米粒子基本上保持了其活性。
33.一種從水中除去芳香族污染物的工藝,所述方法包括將受到芳香族物質污染的水與包括磁性納米粒子的組合物接觸以便從所述水中除去所述芳香族污染物,所述磁性納米粒子與產生自由基的酶結合。
34.根據第33項所述的工藝,其中將所述水與所述磁性納米粒子接觸導致來自所述芳香族污染物的不溶性材料沉淀,所述磁性納米粒子與產生自由基的酶結合。
35.根據第34項所述的工藝,其進一步包括從所述水中除去所述不溶性材料。
36.根據第33項所述的工藝,其中所述芳香族污染物包括酚類物質。
37.根據第33項所述的工藝,其中所述產生自由基的酶包括過氧化物酶。
38.根據第33項所述的工藝,其中所述磁性納米粒子包括磁性納米粒子的介孔聚集物,其中所述磁性納米粒子的介孔聚集物具有介孔,在所述介孔中嵌入所述產生自由基的酶。
39.根據第33項所述的工藝,其中與產生自由基的酶結合的所述磁性粒子的表面涂覆金。
40.根據第33項所述的工藝,其中位于鐵磁性亞微粒子表面的、與產生自由基的酶結合的磁性納米粒子具有至少20納米的粒徑。
41.根據第33項所述的工藝,其中在所述工藝結束后通過磁性分離捕獲與產生自由基的酶結合的所述磁性納米粒子并在捕獲后重新使用所述磁性納米粒子,其中在被捕獲和重新使用后,與產生自由基的酶結合的所述磁性納米粒子基本上保持了其活性。
42.一種通過自由基反應使可聚合的單體聚合的工藝,所述方法包括將所述單體與包括磁性納米粒子的組合物反應以產生衍生自所述單體的聚合物,所述磁性納米粒子與產生自由基的酶結合。
43.根據第42項所述的工藝,其中所述單體包括乙烯基-加成單體。
44.根據第42項所述的工藝,其中所述磁性納米粒子包括磁性納米粒子的介孔聚集物,其中所述磁性納米粒子的介孔聚集物具有介孔,在所述介孔中嵌入所述產生自由基的酶。
45.根據第42項所述的工藝,其中與產生自由基的酶結合的所述磁性粒子的表面涂覆金。
46.根據第42項所述的工藝,其中位于鐵磁性亞微粒子表面的、與產生自由基的酶結合的磁性納米粒子具有至少20納米的粒徑。
47.據第42項所述的工藝,其中在所述工藝結束后通過磁性分離捕獲與產生自由基的酶結合的所述磁性納米粒子并在捕獲后重新使用所述磁性納米粒子,其中在被捕獲和重新使用后,與產生自由基的酶結合的所述磁性納米粒子基本上保持了其活性。
下文中列出的實施例用于解釋和描述本發明的最佳方式。然而,本發明的范圍不應以任何方式受到本文所述實施例的限制。
實施例
試劑和儀器
本研究中使用的酶是辣根過氧化物酶(HRP,E.C.1.11.1.7,VI-A型)、木質素過氧化物酶(LiP,E.C.1.11.1.14)、錳過氧化物酶(MnP;E.C.1.11.1.13)、通用過氧化物酶(合成的混合過氧化物酶,錳-木質素過氧化物酶:VeP EC 1.11.1.16)和漆酶。本文中使用的所有酶均是從商業來源獲得。辣根過氧化物酶(HRP,E.C.1.11.1.7,VI-A型)的純度值指數(OD A403/A280)為約2.9。高活性形式通過使用陰離子交換柱(Resource Q,GE Bioscience)的FPLC(AKTA Explorer,GE Bioscience)進一步純化獲得。使用的漆酶沒有經過進一步純化。在280處監測蛋白信號,在405nm處監測亞鐵血紅素信號。對于各酶而言,將RZ高于1的成分合并在一起、濃縮和分裝。苯酚、高香草酸、藜蘆醇、甲氧基苯酚、4-氨基安替比林(AAP)、葡萄糖(上述的純度為98%)、pH 7.4和67mM的磷酸鈉緩沖液(PBS)、磁鐵礦微粒粉末、硫酸錳、過氧化氫、FeCl3·6H2O和FeCl2·4H2O、O-乙基磷酸二胺、四氯化金,以及丙二酸和酒石酸二鈉鹽均是從商業來源獲得。
合成氧化鐵磁性納米粒子
在堿性條件下,通入氮氣于25℃(M25)或90℃(M90)通過Fe2+和Fe3+的共沉淀合成磁性納米粒子。在持續攪拌條件下,將鐵鹽(2g FeCl2·4H2O和5.2g FeCl3·6H2O)的酸性溶液(25ml)滴加至NaOH(250ml,1.5M)中。反應前在所有溶液中通入氮氣15分鐘以實現非氧化條件。使用銣磁鐵捕獲Fe3O4的瞬時黑色沉淀、洗滌、中和并保持在蒸餾水中直至進一步使用。
使用金包覆氧化鐵磁性納米粒子
通過在超聲條件下將四氯化金離子在O-乙基磷酸二胺(OPEA)功能化的MNP上溫和地還原以實現磁性納米粒子的包覆。在氮氣下使用改良的與聲波浴偶聯的旋轉蒸發裝置進行涂覆操作。簡言之,將20mg MNP(1mg/ml)超聲處理30min。加入OPEA(2g)并使其在超聲和旋轉條件下與MNP(終體積為40mL)反應2小時。使用稀土磁體捕獲OPEA功能化的MNP,并洗滌3次以除去過量的OPEA。將OPEA功能化的MNP重懸于含100μL硝酸(1N)的milliQ水中,并超聲1小時。將四氯化金(10至30mg)加入OPEA功能化的MNP中,并使其反應30分鐘。將聲波浴的溫度升高至85℃,并在該溫度注入檸檬酸/檸檬酸鹽(50∶50,總計50mM,pH5.5)。在超聲和快速旋轉條件下以不同體積(至多100mL)和不同包覆時間(至多60min)進行金包覆。將反應容器至于冰上,加入5g CaCO3終止反應。磁性捕獲MNP-OPEA-Au納米粒子,洗滌四次以除去過量試劑,并儲存直至進一步使用。
合成生物納米催化劑(BNC)
所有的BNC均由涂覆金或不涂覆的M90或M25磁性納米粒子形成。BNC由辣根過氧化物酶、木質素過氧化物酶、錳過氧化物酶或通用過氧化物酶形成。典型的BNC合成要求MNP在初始是單分散的(即,個體化的和非聚集的MNP)。在室溫條件下將MNP在超聲浴中超聲20分鐘,并立即用于形成BNC。在預實驗中,研究緩沖液組分、緩沖液強度和孵育時間以測定其對BNC的形成和酶活性的影響。由于無離子補償電荷,因而認為在水中BNC的形成超過一小時最有效;在研究的其余部分使用該方案。檢測使用的過氧化物酶終濃度的范圍為0.1至10nM。還發現BNC具有50%或更低的飽和度(單位表面積)時增加的活性更高,因而相應地調整加入酶中的MNP的量。典型地,檢測中MNP的終濃度在0.5至50μg.ml-1之間。典型的比率為1nM酶(HRP)對2μg.ml-1MNP(檢測中的終濃度)。將酶和MNP同時加入,并在4℃下持續攪拌孵育至少12小時。典型地,在儲備溶液中形成BNC以進行生化反應需要的5或10倍濃度存在。在臨檢測前,將BNC最終稀釋成檢測所需的終濃度。對于核/殼聚-酶系統BNC的合成而言,首先通過將第一種酶(過氧化物酶或葡萄糖氧化酶,核心的酶)反應形成核BNC,超聲MNP 7小時,然后將第二種酶(過氧化物酶或葡萄糖氧化酶=外殼的酶)加入適當比率的經超聲的MNP,并孵育至少7小時。對于隨機的葡萄糖氧化酶和過氧化物酶的BNC而言,將經超聲的MNP和酶同時加入,并孵育14小時。
合成微-生物納米粒子(微-BNC)
通過形成的BNC和商品化的亞微米磁性粒子反應合成微-BNC(μBNC)。將亞微米粒子在水中重懸,并且在超聲浴中超聲20分鐘。在4℃將形成的BNC和經超聲的微粒在水中于持續攪拌下孵育6小時。以重量計亞微米商品粒子的量至少要比形成BNC的MPN的量高一個數量級。當在經小磁體磁性捕獲后的上清液中檢測不到納米粒子時,認為BNC捕獲完全。
表征磁性納米粒子和介孔聚集物
使用(Quantum Design)磁強計利用超導量子干涉儀(SQUID)技術對磁特性進行檢測。在300K外部磁場范圍40Oe至50kOe下確定磁滯曲線。使用透射電子顯微鏡(TEM)圖像處理測定平均粒徑、粒徑分布和簇粒徑。使用UHV-STEM顯微鏡(VG,UK)進行TEM檢測。使用Image Analysis Image J軟件(NIH,Washington DC)和JmicroVision(V1.27)對圖像進行處理。由最少1000個粒子計算納米粒子和簇的粒徑分布。使用Micrometrics ASAP 2020物理吸附儀獲得氮吸附-解吸附等溫線。使用Barrett-Joyner-Halenda(BJH)法利用N2吸附等溫線計算孔徑分布。
解析磁性納米粒子
圖1中的X-射線衍射圖確證了MNP由磁鐵礦制備。上文所述的合成使用廉價試劑并且能夠容易地定制粒徑(圖2A,2B)和磁場(圖3)。如圖2A和2B所示,M90具有更加均一的粒徑分布,其平均粒徑為10nm(±1),而M25具有更寬的粒徑范圍,其平均粒徑為8nm,粒子最小為5nm。如圖3所示,兩種MNP均具有總體上可以忽略不計的剩余磁化強度(MR),這是表示超順磁性。如圖4A-4C和5A所示,在檢測使用的磁鐵礦濃度下,M25MNP大部分是單分散的小簇和游離的納米粒子,而M90形成了平均直徑為100nm的大簇。如圖7和8所示,M90和M25的總孔體積分別為0.39cm3.g-1和0.14cm3.g-1。當對孔隙度進行校正時,發現簇的平均密度為pM253.03g.cm-3和ρM901.72g.cm-3。
使用辣根過氧化物酶(HRP)定量所捕獲的酶
通過使用高通量FTIR光譜儀(HTS-XT-Vertex70,Bruker,德國)對具有變性HRP的磁性納米粒子進行定量。在60℃的真空條件下將50微升BNC漿體在透射硅96孔板上干燥一小時,并在真空條件下室溫繼續干燥過夜。記錄4,000和400cm-1之間的光譜,掃描32次,在測定各樣品前記錄本底。設置三復孔對樣品進行分析;在板上使用磁鐵礦和磁鐵礦加HRP作為標準品以檢測各樣品中蛋白和納米粒子的濃度。使用Matlab軟件的最小二乘擬合法通過擬合Langmuir方程的二次型獲得吸附等溫線參數:
在上述式(1)中,Q是表面上所吸附的酶(nmol·m-2),C*是初始酶濃度(nmol.m-2),Qm是結合酶的最大量(nmol.m-2),以及Ka是吸附常數(m2.mol-1)。在動力學實驗中使用這些參數以直接從HRP的初始濃度計算平衡時HRP的結合部分。
表征過氧化物酶活性
酚/AAP檢測:使用顯色酚/AAP檢測監測原本HRP和BNC的過氧化物酶活性,所述檢測產生易于與氨基芘反應形成粉色醌亞胺染料的苯氧基自由基。使用具有進樣能力和溫度控制室的自動酶標儀(Synergy4,Biotek)記錄30分鐘96孔板(四復孔)中的溶液在510nm的吸光度。檢測中酚和AAP標準試劑(200ul)的濃度分別為80mM和13mM。檢測不同的緩沖液和緩沖液強度。注入過氧化氫以引發反應,其濃度范圍為10-7M至1M。扣除納米粒子和底物產生的本底。對于HRP而言,利用使用Langmuir吸附參數估算結合量的差以計算游離酶的量,因為HRP的濃度較低和MNP的本底較高使得無法直接估算游離酶的量。對于各批次而言,建立游離酶的速率標準曲線,并用于校正當不是全部酶分子均結合時游離酶對總活性的貢獻。根據初始反應率計算速率(V)和比活度(A)(mmol產物.s-1.mmol酶-1)。
使用模型底物的真菌過氧化物酶活性:在96孔UV透明微孔板(Falcon)中使用標準比色法方案在酒石酸鈉或丙二酸鈉中進行比色法檢測(LiP:藜蘆醇,pH 3,310nm;MnP:2,6二甲氧基酚,pH 4.5,468nm和針對形成的Mn3+-有機酸復合物為270nm;VeP:藜蘆醇或2,6二甲氧基酚,pH 4.5,310nm、468nm、270nm)。
采用高香草酸(HVA)熒光檢測過氧化物酶活性:開發一種熒光檢測以測定過氧化物酶動力學的初始速率。HVA自由基能夠聚合形成熒光二聚體(λex310nm,λem405nm)。在具有注射器混合能力以進行反應引發劑(H2O2或葡萄糖)稀釋的Biotek酶標儀上執行自動序列程序。通過將HVA(10mM)與亞鐵氰化鈉(15mM)和氫氧化銨(15mM)反應合成用于化學反應的熒光二聚體原料,并在用于酶反應的緩沖液中將其用作定量標準品。所有的反應均設三復孔,數據以相對熒光單位(mRFU)表示。
木質素解聚檢測:使用HRP、LiP、VeP和MnP,及其BNC進行硫酸鹽木質素解聚檢測。在存在錳的條件下進行MnP和VeP檢測。檢測設為三復孔,在pH5.5的酒石酸鈉或丙二酸鈉緩沖液中進行。將硫酸鹽木質素漿體(10mg/ml)孵育1或4小時,然后通過0.2μm孔的膜濾器過濾以除去粒子。使用Biotek酶標儀獲得溶液的UV-Vis光譜。在280和310nm處監測木質素解聚釋放的芳香分子。對光譜進行背景校正。
酚聚合檢測:酚消除檢測為兩步法。第一步為在1mM的PBS緩沖液中用辣根過氧化物酶形成多酚。反應體積固定為2mL或10mL。將酚終濃度固定為1mM,HRP的終濃度固定為30nM。M90形成的BNC的酶與納米粒子的比率是變化的。第二步為通過加入氯化鈉(500mM)沉淀這些多酚。將樣品12,000g離心20分鐘,并收集上清液。使用Biotek酶標儀在280nm處檢測溶液中的可溶性酚。
動力學參數
使用在監測波長下形成的各產物消耗的V/mmolHRP的比率計算比活度A(mmol產物.s-1.mmolHRP-1)。使用衍生自乒乓雙向(ping-pongbi-bi)2底物抑制模型的H2O2底物抑制模型通過GraphPad Prism(La Jolla,CA,USA)的最小二乘擬合法得到反應的動力學參數。經修訂的模型方程為:
在式(2)中,Vmax是最大酶速率(mmol.s-1),酶反應能夠達到的最大速率,單位與V相同,Km是Michaelis-Menten常數(mM),Ki是H2O2的抑制常數(mM)。kcat(s-1)由Vmax和結合HRP的總量計算得到。
與HRP形成的磁性BNC的形成、鑒定和活性
通過BNC簇粒徑的總體增加確證了在MNP簇中捕獲了酶分子(圖4A和5G)。盡管M25-BNC的粒徑略有增加且簇更大,但是M25MNP(圖4B)和M25-BCN(圖4C)均具有較小的簇粒徑。M90NMP(圖5A)和M90-BNC(圖5D)的比較表明M90納米粒子聚集物的粒徑增加比M25更大。而且,與M90本身的聚集物(圖5B和5C)相比,M90BNC的聚集物(圖5E和5F)具有更高的密度,即由更多的MNP和更緊密的MNP制成。通過M25和M90在HRP吸附性能之間的差異進一步確證了MNP簇內捕獲了酶分子(圖6)。這兩種BNC均具有孔小于50nm的介孔(圖7和8)。與M25-BNC相比,M90-BNC具有更大的總孔體積和更大的平均孔徑。復合物形成的差異結果導致了MNP簇超微結構不同,結果使得納米粒子的磁化強度和所得到的簇介孔孔隙度不同。特別地,M90-BNC的自組裝似乎是在介孔聚集物中的表面吸附和分子捕獲的雙重機制導致的。
M90具有較高的Ka,這表明與其對酶具有比M25更高的親和性(圖6)。在對所捕獲的酶進行的定量時,發現當使用1nM HRP和4μg.ml-1磁性粒子時,少于50%的總HRP負載能夠與M25結合形成M25-BNC復合物,而在M90中捕獲的酶為100%。如圖11A、11B、12A、12B和13所示,增加的活性隨BNC形成的不同條件而改變。在pH 6.5的超純水中形成具有最高活性的BNC,這表明在納米粒子的表面上存在Fe-OH2+陽離子物質。在這一pH和不存在任何其它補償電荷的條件下,HRP分子巨大的表面上均帶有負電,這使得其能夠與磁鐵礦通過靜電相互作用形成復合物。當對在PBS中形成的BNC進行檢測時(圖11A),增加的活性低于在水中形成的BNC(圖11B)。在PBS中形成的BNC在全體中增加的活性最低。當對在丙二酸鹽中形成的BNC進行檢測時(圖12A),其增加的活性與在水中形成的BNC具有相同的范圍或更低(圖11B)。當對在酒石酸鹽中形成的BNC進行檢測時(圖13A),其增加的活性低于在水中形成的BNC(圖13B)。亦如圖11B、12B和13B所示,與在其它離子緩沖液中形成的BNC相比,僅在水中形成的BNC持續顯示出具有更高的增加的活性,即使當在檢測中使用其它緩沖液時鹽的濃度更高。
使用酚/APP檢測測定瞬時自由基濃度,使用這些測定結果來計算歸一化的BNC活性。根據BNC的活性除以相同濃度下游離酶的活性得到的比率計算歸一化的活性。對于M90-BNC而言,在預孵育1小時后達到與游離酶相比的最大活性。歸一化活性的增加可以穩定超過24小時。如圖9A和9B所示,在孵育10分鐘后M25-BNC增加的活性達到最大。這些結果清楚地表明增加的活性僅僅是由固定化的酶引起,而不僅僅因在溶液中存在MNP。而且,如圖10所示,該結果還表明HRP與不同粒徑、磁性和比率磁性納米粒子的結合產生具有不同比活度的復合物。如圖14所示,具有最大量捕獲酶的BNC的飽和狀態會一致地降低活性。
使用初始反應速率估算Km、Vmax、Ki和kcat,分別進一步在如圖15-18所示的曲線中顯示。M25或M90MNP的Vmax低于游離HRP和BNC若干數量級。轉換率kcat與游離HRP、M25-BNC和M90-BNC的數據集非常一致。由M25和M90形成的BNC均具有更高的Km。M25-BNC的Vmax和kcat比相同濃度的游離酶高兩至三倍。而且,M25-BNC的kcat隨結合酶組分增加,而Ki與游離HRP在相同范圍內。在結合酶為0.5nM時,M25-BNC和M90-BNC根據kcat/Km估算的MNP效率分別為6.75x 103和5.5x 103s-1mM-1。這些動力學結果與所觀察到的反應速率的趨勢一致。M90-BNC的Ki比游離HRP高約10倍,而其Vmax類似。M90具有更高的Ki表明與游離酶和M25-BNC相比來自H2O2的底物抑制程度更低。
對不同緩沖液、pH和溫度下M90-BNC的活性進行了進一步研究(圖19A、19B、20A和20B)。在所檢測的無機和有機緩沖液和溫度范圍內也觀察到了M90-BNC的活性具有類似的增加。與單獨的HRP相比,發現在較低溫度下BNC更有效率,因為游離酶在較高溫度下具有更高的速率。發現M90-BNC對pH敏感,其速率隨pH的升高而增加,且在無機緩沖液中歸一化的活性具有pH依賴性。在有機酸緩沖液中未觀察到pH的顯著影響。
其它酶系統中BNC的活性
通用過氧化物酶-BNC的活性:BNC由通用過氧化物酶形成(圖21)。如圖21中的活性曲線所示,在由M90形成的BNC中觀察到了最大活性。使用有機聚合物的表面修飾僅使得活性適度增加但過氧化氫的抑制降低。
錳過氧化物酶-BNC的活性:BNC由錳過氧化物酶形成(圖22)。如圖22中的速率曲線所示,與未涂覆的磁性納米粒子相比,金涂覆MNP的反應速率進一步增加。在不同涂覆條件(和納米粒徑)之間觀察到的差異造成速率增加不同。
漆酶-BNC的活性:BNC由漆酶形成(圖23)。如圖23中的檢測曲線所示,當在非最佳條件下(較低或較高的pH)使用酶時,觀察到了漆酶活性的增加。活性的增加雖然不像過氧化物酶一樣高,但是與游離的漆酶相比仍具有顯著性。值得注意的是,漆酶實現其功能不需要過氧化物,因而不會受到強的底物抑制。如上文所觀察到的,BNC針對底物抑制和更嚴苛的反應條件(例如,pH、溫度和離子強度)提供了較強的保護作用。
葡萄糖氧化酶和過氧化物酶系統的活性:BNC由葡萄糖氧化酶/過氧化物酶二元系統形成(圖24A-24D和25)。在這種配置中,葡萄糖氧化酶的活性提供過氧化物以便將過氧化物酶活化。使用高度單分散的金涂覆MNP對不同配置進行檢測。如圖24A-24D和25所示,在所使用的Gox和HRP的比率下,未觀察到酶系統的抑制。采用HRP在簇核心,Gox在外層及與之相反的或者隨機分布的核/殼設計。在葡萄糖濃度較低時,與游離酶和隨機分布的BNC相比,核/殼BNC顯示出增加的活性。值得注意的是,該系統允許使用葡萄糖替代過氧化氫,與過氧化氫相比,葡萄糖的成本低得多、更豐富且危害更低。
將這些新型的BNC進一步固化在更大的鐵磁性亞微米粒子上。商品化的磁性粒子及使用BNC對其表面功能化后的掃描電子顯微鏡(SEM)的顯微照片如圖26A和26B所示。盡管這些鐵磁性粒子聚集物的粒徑為微米級,但是單個微晶均是亞微米級的。鐵磁性微粒易于捕獲在其表面形成小簇的較小的BNC。盡管MNP具有一定的磁性,但是需要強磁場才能將其捕獲。而且,MNP越小和單分散性越高,外部磁場捕獲其所需的時間越長。BNC-微粒簇基本上克服了該缺陷。而且,如圖27和28A-28C所示,BNC-微粒簇的酶活性與BNC的活性相似(圖27),并且能夠被非常小的磁性所捕獲以再利用或攪拌(圖28A-28C)。這種μBNC配置使得該催化劑工藝能夠在現實世界中應用。
由真菌過氧化物酶形成的磁性BNC對木質素的解聚
展示了使用BNC進行的木質素解聚。進行木質素解聚檢測以測定可溶性芳香族化合物(例如,松柏醇、芥子醇和香豆醇及其衍生物)的產生。如圖29中的吸收曲線所示,在真菌過氧化物酶系統的特征波長下觀察到了增加的信號。亦如圖29所示,由辣根過氧化物酶(植物過氧化物酶)形成的BNC不會使木質素釋放任何芳香族分子。如圖30-33所示,使用真菌過氧化物酶BNC時觀察到了木質素的解聚。
由HRP形成的BNC對酚的聚合
展示了使用辣根過氧化物酶的BNC的酚消除作用。如圖34中的圖片所示,采用兩步法進行酚聚合檢測:(i)酶促聚合成多酚,和(ii)利用氯化鈉將多酚聚合物濃縮。如圖35中的活性曲線所示,與游離酶相比在,由HRP和M90MNP形成的BNC具有更高的酚消除效率。上述結果表明當使用BNC而不是游離HRP系統時,酚消除作用得到顯著改善。如圖36所示,除了增加酚消除的程度以外,在BNC系統中的H2O2濃度改變以達到最大的消除作用(或聚合作用)。這表明與游離酶相比BNC具有較低的H2O2抑制。而且,BNC系統提供了更加寬泛的H2O2濃度范圍。這些特性表明與其游離形式相比BNC能夠在不穩定的和更加嚴苛的工藝條件下使用。
盡管已對本發明的優選實施方式進行了顯示和描述,但是本領域技術人員仍可以在由所附權利要求所定義的本發明的保護范圍內,對本申請進行多種改變和修改。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 具吡啶二硫功能基的磁性納米粒子Fe3O4@SiO2@S-S-Py的制備及生物醫藥中的應用的制造方法與工藝
- 聚乙二醇化包裹聚多巴胺載藥磁性納米顆粒的制備方法與流程
- 一種PQQ?DA印跡磁性納米粒子的制備方法及其應用與制造工藝
- 一種可降解聚合物磁性納米粒子及其制備方法與制造工藝
- 一種山梨酸-茶多酚復合納米粒子及其應用的制造方法與工藝
- 一種實現納米線生物傳感器表面修飾的方法與制造工藝
- 磁性納米粒子和產生自由基的酶的介孔催化劑及其使用方法與制造工藝
- 一種靶向性超順磁性納米探針的制備方法和應用方法與制造工藝
- 油酸包裹的超順磁性納米Fe3O4及其制備方法與制造工藝
- 一種貴金屬納米粒子間距可控的SERS襯底制備方法與制造工藝
- 一種磁性納米粒子與超濾膜結合處理廢棄乳化液的方法與流程
- 一種多肽修飾納米粒子在制備治療急性肺損傷的藥物中的應用的制作方法與工藝
- 一種金納米花修飾的離子液體功能化石墨烯紙電極、其制備方法和應用與流程
- 一種新型的透明質酸修飾的多級納米顆粒及其制備與應用的制作方法與工藝
- 一種核殼結構的磁性納米粒子及其制備與應用的制作方法與工藝
- 一種室溫固相反應制備的納米鐵修飾的鐵基氨合成催化劑及其制備方法和應用與流程
- 一種丁氧基修飾的TiO2單晶空心四方納米錐材料、制備方法及其應用與流程
- 一種改性粒子修飾的有機無機雜化聚合物涂料的制作方法與工藝
- 一種表面修飾片狀納米銅及含有該納米銅的復合潤滑油的制備方法與流程
- 一種用于簡便修飾磁性納米粒子的手性拆分添加劑的制備和應用的制作方法與工藝