綠盲蝽ApEps15基因及其在RNAi介導的害蟲防治方面的應用的制作方法
本發明涉及昆蟲基因工程技術領域,具體涉及一種綠盲蝽ApEps15基因及其在RNAi介導的害蟲防治方面的應用。
背景技術:
昆蟲害蟲和人類戰爭常常伴隨著難以預測的新趨勢。2000年以前,綠盲蝽并非是我國棉產區農業生產的主要害蟲,原因是為了防止棉鈴蟲所使用的農藥把綠盲蝽的數量保持低水平。然而1997年開始,Bt棉花的商業化種植有效控制了棉鈴蟲等鱗翅目害蟲的危害,綠盲蝽逐漸成為危害棉花的主要害蟲。目前對綠盲蝽的防治主要依靠化學防治,該方法不僅容易導致其產生抗藥性,而且對環境造成污染。因此,發展一種經濟有效、環境友好的方法控制綠盲蝽具有重要意義。利用轉基因作物進行抗蟲可以有效抵抗蟲害,并且安全環保,這些優點使轉基因作物成為抗蟲策略的首選。基于目前以RNAi為基礎發展抗蟲轉基因作物是當前的研究熱點,且該技術在害蟲防治領域已經取得一些進展。
RNAi指的是內源或外源RNA被RNase III內切酶DICER切成大小20–25bp,小dsRNA片段,然后這些小片段進一步被進入RNAi誘導的沉默復合體內并被解開雙鏈,把反義鏈作為識別同源性mRNA的引導者,最后降解同源性mRNA的過程。表皮生長因子是一種小肽,由53個氨基酸殘基組成,是類EGF大家族的一個成員,是一種多功能的生長因子,在體內體外都對多種組織細胞有強烈的促分裂作用。表皮生長因子通過與細胞表面的受體,表皮生長因子受體(EGFR)結合而起作用。EGF一旦同應答細胞表面的特異受體結合,便促進受體二聚化并使細胞質位點磷酸化。被激活的受體至少可與5種具有不同信號序列的蛋白結合,進行信號轉導。EGF能夠廣泛促進細胞的增殖。
Eps15起初被鑒定為與表皮生長因子受體(EGFR)激酶活性有關。其由三個部分組成的。研究表明Eps15的干擾影響表皮生長因子受體(EGFR)對生長因子(EGF)的內吞作用。所以對昆蟲生長發育中起著重要的作用。由此可見,該基因很有可能將成為一種新的靶標來設計研發RNAi介導的害蟲防治策略方面能夠應用。然而至今在昆蟲中RNAi介導Eps15沉默研究幾乎沒有。
技術實現要素:
本發明的目的提供一種綠盲蝽表皮生長因子途徑底物15命名為ApEps15基因,在綠盲蝽生長發育和生理過程中起著非常重要的作用,沉默該基因后,對綠盲蝽個體發育造成的影響。
本發明的另一個目的提供一種綠盲蝽ApEps15基因在RNAi介導的害蟲防治方面的應用。
綠盲蝽ApEps15基因,其核苷酸序列如序列表SEQ ID NO:1所示。
綠盲蝽ApEps15基因在RNAi介導的害蟲防治方面的應用。
所述RNAi介導中,合成的dsRNA通過注射或飼喂進入綠盲蝽體內。
所述合成dsRNA所對應的靶標片段的核苷酸序列如SEQ ID NO:2所示。
所述注射體積為41.6nl,注射dsRNA濃度為10μg/μl,注射部位為綠盲蝽的后胸與腹部節間膜的最外側。
所述飼喂的飼料總體積200ul,dsRNA濃度0.5ug/ul。
所述綠盲蝽為三齡綠盲蝽。
本發明中利用生物信息學技術,分析了綠盲蝽成蟲和幼蟲轉錄組,并獲得了ApEps15基因,然后按下面循序進項(1)取綠盲蝽總RNA,通過RT-PCR得到cDNA;(2)設計帶有T7序列的特異性引物;(3)通過PCR技術擴增目的基因片段:以第一步得到的cDNA為模板,第二步設計的特異引物擴增,得到帶有T7序列和目的基因片段的PCR產物;(4)構建含有選定目的基因片段的載體并轉入宿主大腸桿菌中,培養,提取含有目的基因片段的質粒;
(5)以上一步所提取含有目的基因片段的質粒為模板,第二步設計的特異性引物擴增,得到大量含有T7序列和目的基因片段的PCR產物;(6)利用T7RNA聚合酶將上一步得到的PCR產物合成為目的基因片段dsRNA;(7)進行顯微注射實驗把靶標dsRNA傳遞到體內
(8)人工飼料的配制(9)將dsRNA混合到人工飼料中通過封口膜包裝飼喂3齡幼蟲24小時后用正常飼料繼續飼養(9)統計死亡率,觀察表型。在此基因內重新設計一對引物,提取綠盲蝽不同組織RNA并反轉錄成cDNA,以這些cDNA為模板進行RT-PCR反應。
附圖說明
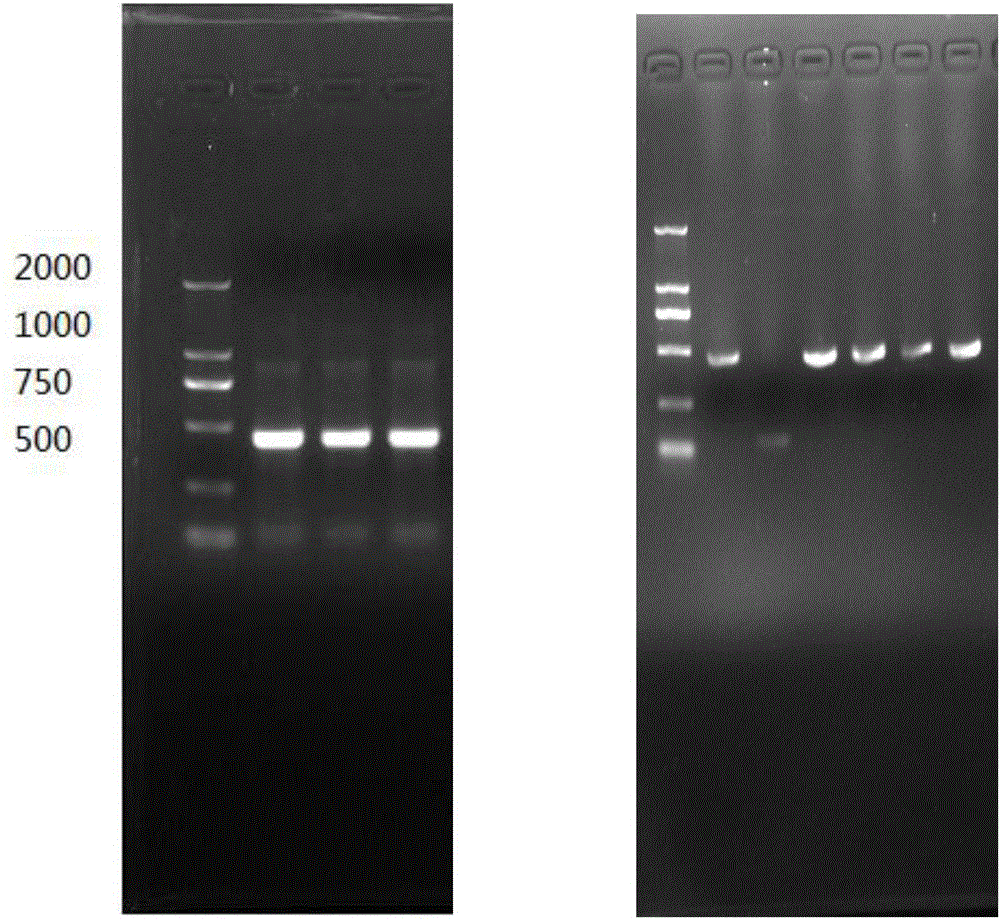
圖1實驗所用dsRNA瓊脂糖凝膠電泳結果圖。
其中A為ESP-15的dsRNA,B為GFP的dsRNA瓊脂糖凝膠電泳結果。
圖2 ESP-15dsRNA顯微注射后存活率。
圖3 ESP-15dsRNA顯微注射后Qpcr結果。
圖4 ESP-15dsRNA顯微注射誘導的異常表型,其中左圖為空白對照,右圖為實驗組。
圖5綠盲蝽ApEps15的dsRNA飼喂傳遞7天后存活率。
圖6綠盲蝽ApEps15的dsRNA飼喂后表型,其中左圖為空白對照,右圖(2張)為實驗組。
具體實施方式
下面通過具體實施例進一步說明本發明。以下實施例用于說明本發明,但不用來限制本發明的范圍。在不背離本發明精神和實質的情況下,對本發明方法、步驟或條件所作的修改或替換,均屬于本發明的范圍。下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的實驗材料,如無特殊說明,均為市售常規生化試劑。
實施例1ApEps15基因克隆、dsApEps15的具備,注射和飼喂實驗
1、ApEps15基因的生物信息學分析
本實驗室事前對綠盲蝽進行轉綠組測序,成功得到綠盲蝽63029條基因序列,并注釋了其中25760條基因序列。利用生物信息學技術及相關在線軟件對綠盲蝽轉錄組數據進行初步的分析,通過在線程序NCBI Blast等程序的幫助下確定了到綠盲蝽ApEps15基因,見序列表SEQ ID NO1。
2、供試昆蟲及組織收集
綠盲蝽為中國農業科學院植物保護研究所使用新鮮玉米(ZeamaysL)及四季豆(Phaseolusvulgaris L.)飼養,飼養溫度為25-28℃,相對濕度為60%-70%,光照為16:8(L:D)。
3、RNA的提取
昆蟲總RNA提取的全部過程在無RNase條件下進行。整個提取步驟如下所示:
1)取-70℃保存的昆蟲組織,加入已經用液氮預冷的玻璃勻漿器中,立即向勻漿器內加入1mL Trizol試劑,將組織充分研磨磨碎;將研磨好的組織溶液用無RNA酶的槍頭轉移到無RNA酶的1.5mL離心管中,暫時置于冰上。
2)4℃,12000g離心15min,將上清轉移到新的無RNA酶的1.5mL離心管中。
3)將上清在室溫下放置5min后,向離心管中加入0.2mL氯仿,用手劇烈震蕩15s,再室溫靜置2-3min。
4)4℃,12000g離心15min,混合物在此后分層,下層為有機相,上層為水相(RNA就在水相中),用無RNA酶的槍頭將上層水相轉移到新的無RNA酶的1.5mL離心管中,注意盡量不要吸到中間層,以免造成蛋白質或DNA污染。
5)加入0.5mL異丙醇,混勻后,室溫靜置10min來沉淀RNA。
6)4℃,12000g離心10min后,觀察到的沉淀即為RNA,棄上清(盡量吸凈),加入1mL 75%的乙醇(用DEPC水配置,現用現配),輕輕震蕩離心管懸浮沉淀,洗滌沉淀。
7)4℃,7500g離心10min后,棄上清(盡量吸凈),超凈臺中干燥沉淀5-10min。
8)加入10-20μL RNA-free水(根據RNA量而定),輕彈離心,使沉淀充分溶解。
9)55-60℃溫育后,取1μL樣品稀釋至5μL,其中2.5μL進行電泳檢測,2.5μL用NanoDrop儀器檢測;剩余的樣品用于cDNA合成或者保存于-70℃冰箱。
4、第一鏈cDNA的合成
整個反轉錄過程在無RNA酶污染的條件下進行,操作步驟按Revert Aid First Strand cDNA Synthesis Kit進行,具體如下:
1)在無RNA酶的PCR管中依次加入:2μg RNA(根據NanoDrop定量的結果計算應該加入RNA的體積數),DNaseⅠ1μL,1μL Ribolock RNase Inhibitor,1μL 10×Reaction Buffer with MgCl2,用RNA-free水將體系補足到10μL;輕微震蕩后離心;
2)37℃溫育30min后,向體系內加入1μL 50mM EDTA,震蕩后離心,然后65℃溫育10min,以去除DNA酶I;
3)加入1μLoligo-dT,用RNA-free水補至12μL;
4)65℃溫育5min后,立即置于冰上;
5)依次加入下列試劑,使體系達到20μL:4μL的5×Reaction buffer;2μL的dNTP Mix(10mM);1μL的Revert Aid Reverse Transcriptase和1μL的Ribolock RNase Inhibitor;簡單混勻離心;
6)42℃溫育1h,然后再70℃溫育5min;
7)合成后存于-20℃或者-70℃冰箱,使用前按情況稀釋若干倍。
5、靶標基因的克隆
本發明選取了持家基因、能量代謝相關基因和細胞凋亡相關基因上的基因片段,通過注射法研究其對昆蟲的影響,GFP基因上的片段作為對照。持家基因又稱管家基因,是指所有細胞中均要表達的一類基因,其產物是對維持細胞基本生命活動所必需的;而能量代謝相關基因和細胞凋亡相關基因也在綠盲蝽生長發育和生理過程中起著非常重要的作用。本發明選取此類基因上的片段,利用注射法進行RNAi將其沉默,研究觀察沉默該基因后,對綠盲蝽個體發育造成的影響。GFP即綠色熒光蛋白,在昆蟲體內并不存在,故大量研究中將其作為對照基因合成dsRNA。
1.靶標基因引物的設計:
(1)利用BLAST檢索數據庫,搜索綠盲蝽的相近物種同一靶標基因的蛋白或者cDNA編碼的氨基酸序列,用綠盲蝽成蟲若蟲轉錄組組建的本地BLAST庫進行比對查詢,確定所選基因的序列。
(2)根據靶標基因的片段,用Primer Premier 5.0軟件設計帶T7啟動子的引物,引物設計原則如下:
a.引物設計的區間要在靶標基因的編碼區,中間片段大小在400~500bp左右。
b.中間片段盡量選在靶標基因的特異區域。
c.引物之間不能形成引物二聚體,交叉二聚體。
2.根據以上引物設計原則設計引物后,送至華大基因進行引物合成。
3.相關靶標基因的引物序列見表1。
表1.實驗所用引物
4.目的片段的PCR擴增、測序及序列分析
1).以綠盲蝽cDNA為模板,用ExTaq酶擴增表1-1中基因。反應體系為25μl:17μl重蒸水,2.5μl 10×反應緩沖液,2μl dNTPs(2.5mM),1μl cDNA,1μl F引物(10mM),1μl R引物(10mM)和0.5μl DNA聚合酶。反應條件為:94℃預變性3min;94℃變性30s,60-65℃退火30s,72℃延伸30s,35個循環;最后72℃延伸10min。
2).PCR產物用溶解在1×TAE緩沖液的1%瓊脂糖凝膠電泳進行檢測。檢測正確的PCR產物,用瓊脂糖凝膠回收試劑盒進行回收(操作步驟按試劑盒內附帶的說明書進行),回收的片段連接到pGME-T載體上(體系為8μl膠回收產物、1μl 10×T4鏈接反應緩沖液、0.5μl pGME-T載體和0.5μl T4連接酶,16℃條件下連接過夜),連接體系轉化Top10感受態細胞(轉化步驟按感受態細胞附帶的說明書進行),培養過夜后,挑取8個陽性克隆進行PCR驗證(體系和條件同上),將檢測正確的克隆用液體LB培養基(含氨芐抗生素)培養過夜檢驗目的片段序列。
3).根據測序結果,將正確的菌株加入含有氨芐抗生素的新鮮LB培養基重新搖菌,獲得新鮮的菌液,將1ml菌液和百分之八十的甘油按照9:1比例混合,存于-80℃低溫冰箱保存。將剩余的菌液進行質粒提取。序列結果見序列表SEQ ID NO2。
5.dsRNA模板的制備
以帶有靶標基因片段的質粒為模板,用聚合酶擴增。反應體系為25μl:17μl重蒸水,2.5μl 10×反應緩沖液,2μl dNTPs(2.5mM),1μl載有靶標基因片段的質粒,1μl正向(F)引物(10mM),1μl反向(R)引物(10mM)和0.5μl DNA聚合酶。反應條件為:94℃預變性3min;94℃變性30s,55-60℃退火45s,72℃延伸1min,35個循環;最后72℃延伸10min。
將1μl PCR產物用溶解在1×TAE緩沖液的1%瓊脂糖凝膠電泳進行檢測。如果所得條帶長度與目的片段長度一致,并且結果顯示為單一明亮的條帶,則將剩余的PCR產物進行酚氯仿抽提與純化。
PCR產物的酚氯仿抽提的步驟:
1).將需要純化的PCR產物用無RNA酶的H2O定容至200μl
2).加入等體積(200μl)的酚氯仿試劑(一定取酚氯仿試劑的下層,并且拿試劑瓶時要平穩,不能晃動)。
3).溫和混勻,在4℃離心機下離心(12000rpm,4℃)15min.
4).4.取上清,加入1/10體積(20μl)的3M乙酸鈉(pH5.2)和2倍體積(400μl)的100%乙醇(-20℃貯存),溫和混勻后放于-20℃靜置沉淀至少3小時或者過夜。
5).在4℃離心機下離心(12000rpm,4℃)30min.
6).白色沉淀積于離心管底部,棄上清液(為防止沉淀一起被吸出,可保留些許上清液),加入75%乙醇(-20℃貯存)輕輕混勻,洗滌沉淀
7).在4℃離心機下離心(7500rpm,4℃)5min.
8).將乙醇慢慢吸出(注意不要吸出沉淀),接近沉淀的殘留液體用10μl移液槍慢慢吸出。將離心管開蓋放入37℃恒溫培養箱干燥,10min左右,待乙醇全部揮發。
9).加入5μl RNase–free H2O輕彈管底,讓沉淀充分均勻溶解于無RNA酶的H2O。
10).取1μl溶液溶于4μl無RNA酶的H2O中,用濃度測量儀器檢測濃度和OD值。用凝膠電泳檢測產物單一性,如果檢測條帶是單一明亮的條帶,并且其OD值為:
260/280:1.8-2.0
260/230:1.8-2.0
則說明PCR產物質量良好,可以作為下一步合成dsRNA的模板使用。
6、dsRNA的合成
1.將ATP,CTP,GTP,UTP(100mM)放于冰上慢慢融化,5×反轉錄緩沖液室溫融化,T7RNA聚合酶放于-20℃貯存,隨用隨拿,用完立即放入-20℃環境下貯存。溶解以后輕彈管底,瞬時離心,將試劑離心到管底。
2.按以下比例將試劑混合:
試劑 50μl體系
反轉錄緩沖液 10μl
ATP,CTP,GTP,UTP(100mM) 各1μl
RNA酶抑制劑 1.25μl
模板 1.5μg
無RNA酶的H2O定容至 49μl
T7RNA聚合酶 1μl
輕彈混勻,瞬時離心。放入37℃金屬浴中4小時。
3.從金屬浴中取出離心管,放入75℃金屬浴中5min,然后放置室溫冷卻(切勿放在冰上)。吸出1μl,稀釋5倍,凝膠電泳檢測產物條帶。
4.去除DNA和dsRNA.按照比例加入下列試劑:
試劑 60μl體系
10×反應緩沖液 6μl
DNA酶Ⅰ 2μl
RNA酶 0.5μl
無RNA酶的H2O 2.5μl
dsRNA產物49μl
充分混勻,輕彈管底,瞬時離心后,放入金屬浴37℃30min,加入EDTA試劑1μl,65℃金屬浴中放置5min終止反應。取1μl產物,稀釋5倍,凝膠電泳檢測產物單一性,濃度檢測儀器檢測濃度和OD值。如果檢測條帶是單一明亮的條帶,并且其OD值為:
260/280:1.8-2.0
260/230:1.8-2.0
則說明dsRNA質量良好,可以進行下一步dsRNA酚氯仿抽提。
7、dsRNA的酚氯仿抽提
1.將需要純化的dsRNA(~60μl)用無RNA酶的H2O定容至200μl(可根據實際需要等比例擴大體系)。
2.加入1/2體積(100μl)的水飽和酚試劑(一定取水飽和酚試劑的下層,并且拿試劑瓶時要平穩,不能晃動)和1/2體積的氯仿(100μl)。
3.輕輕混勻,在4℃離心機下離心(12000rpm,4℃)15min。
4.取上層水相,加入的等體積氯仿(200μl),輕輕混勻,在4℃離心機下離心(12000rpm,4℃)15min。
5.取上層水相,加入1/10體積(20μl)的3M乙酸鈉(pH5.2)和2.5倍體積(500μl)的100%乙醇(-20℃貯存),溫和混勻后放于-20℃靜置沉淀至少3小時或者過夜。
6.在4℃離心機下離心(12000rpm,4℃)30min。
7.白色沉淀積于離心管底部,棄上清液(為防止沉淀一起被吸出,可保留些許上清液),加入80%乙醇(-20℃貯存)輕輕混勻,洗滌沉淀。
8.在4℃離心機下離心(7500rpm,4℃)5min。
9.將乙醇慢慢吸出(注意不要吸出沉淀),接近沉淀的殘留液體用10μl移液槍慢慢吸出。將離心管開蓋放入37℃恒溫培養箱干燥,10min左右,待乙醇全部揮發。
10.加入5μl無RNA酶的H2O輕彈管底,讓沉淀充分均勻的溶解于無RNA酶的H2O中。
11.取1μl溶解的dsRNA產物稀釋于4μl DEPC H2O中,用凝膠電泳檢測產物單一性,并用濃度檢測儀器檢測濃度和OD值。如果檢測的條帶是單一明亮的條帶,并且其OD值為:
260/280:1.8-2.0
260/230:1.8-2.0
則證明dsRNA質量良好,可以進行綠盲蝽體內注射RNAi實驗。
8、事實熒光定量PCR與分析
實驗采用的是2-ΔΔCT法進行相對定量,即通過內參基因校準不同樣品的模板加入總量的差異。ΔΔCT=(CT目的基因-CT內參基因)實驗組-(CT目的基因-CT內參基因)對照組,2-ΔΔCT的意義即為:實驗組的目的基因相對于對照組的目的基因的倍數,由此即可得到相對表達量。本實驗所用的引物如表2所示
表2實時熒光PCR實驗所用引物
本實驗中,以α-tubulin,GADPH為內參基因,按照TakaRa公司的SYBR PRemix Ex TaqTM試劑盒說明書對綠盲蝽對照組和實驗組進行Real Time PCR反應,以實驗的三組基因的第1d、2d、3d、4d、5d樣品的cDNA模板。反應體系以及反應條件如下:
反應體系為20μL
9、綠盲蝽RNAi飼喂方法的具體實施
9.1齡(3L)綠盲蝽的準備
本發明中所選綠盲蝽為3L若蟲,現以3L若蟲的收集方法如下:收集1L初孵若蟲(200~300頭),放入養蟲盒中,盒中放入干凈濾紙和一根去皮的新鮮玉米,約4天后所有1L若蟲成長為3L若蟲,準備鋪好濾紙和7~8粒新鮮玉米粒的塑料培養皿,每個培養皿里放15只3L若蟲,放若蟲時,用軟毛刷輕輕挑取,以免對若蟲造成不必要的機械損傷。饑餓處理兩個小時
人工飼料的配制
人工飼料是按照中國農業科學院植物保護研究所棉花害蟲研究組所提供的配方來配制的(棉蟲組已經在人工飼料的配制和實際應用方面通過了實驗驗證)。
9.2注射篩選Eps15基因片段的dsRNA對綠盲蝽生長發育的影響
合成完dsRNA以后先用注射法傳遞dsRNA,dsGFP和dsβ-actin分別作為對照。注射法使用3L綠盲蝽,注射參數如下:注射體積為41.6nl,注射dsRNA濃度為10μg/μl,注射部位為綠盲蝽的后胸與腹部節間膜的最外側。結果表3所示。
表3盲蝽Eps15dsRNA注射7天存活率
9.3飼喂傳遞Eps15dsRNA基因對綠盲蝽生長發育的影響
三齡綠盲蝽的準備和人工飼料的配制
為飼喂實驗所準備的綠盲蝽前期準備階段與注射實驗一樣然而最后開始做實驗前饑餓處理兩個小時。
人工飼料是按照中國農業科學院植物保護研究所棉花害蟲研究組所提供的配方來配制的(棉蟲組已經在人工飼料的配制和實際應用方面通過了實驗驗證)
飼料總體積200ul,dsRNA濃度0.5ug/ul。結果如表3所示。
表4綠盲蝽Eps15的dsRNA飼喂7天存活率
- 還沒有人留言評論。精彩留言會獲得點贊!