一種優化的從幼稚T細胞誘導擴增調節性T細胞的方法與流程
本發明屬于生物工程領域,涉及一種細胞體外擴增方法,具體地涉及一種優化的從幼稚T細胞誘導擴增調節性T細胞的方法。
背景技術:
免疫耐受是指免疫活性細胞接觸抗原性物質時所表現出的一種主動的不應答狀態,是一種有別于免疫缺陷和免疫抑制生物學現象。免疫耐受不良與多種疾病相關,如自身免疫性疾病、移植物抗宿主病(graft versus host disease,GVHD)和母胎免疫排斥等。在器官或組織移植中,傳統的免疫抑制藥物雖能顯著延長移植物的存活時間,但其伴隨的副作用是患者整體免疫功能下降、感染機會增加,并可能誘發腫瘤等,極大地限制了臨床器官移植的進一步發展;在母胎免疫排斥所導致的復發性流產等疾病中,使用免疫抑制藥物治療可能對胎兒生長發育造成潛在的不良影響。因此細胞靶向性誘導免疫耐受日益受到重視。通過體外誘導的方式,擴增一種安全有效、半衰期長、甚至注入體內后具有再生能力的,能誘導特異性免疫耐受的細胞具有廣闊的應用前景。
調節性T細胞(regulatory T cells,Treg)是一大類具有免疫調節和抑制功能的T細胞亞群,它參與并維持機體的免疫自穩,其數量和功能的穩定與腫瘤逃逸、自身免疫性疾病、X連鎖隱性遺傳病IPEX(免疫調節異常,多內分泌腺病,腸病,X連鎖綜合征)、移植物抗宿主病(GVHD)和妊娠免疫耐受等密切相關。根據來源不同,Treg可分為兩大類:(1)天然型調節性T細胞(natural Treg,nTreg):成熟于胸腺,表達CD25分子和Foxp3,約占外周CD4+T細胞的5%‐10%;(2)誘導型調節性T細胞(induced Treg,iTreg):在不完全暴露抗原刺激和/或聯合刺激的特定條件下,由幼稚T細胞(T cells)在體內周圍組織中激活擴增而來。nTreg和iTreg雖然來源不同,但其表型和免疫學功能相似,均以表達核轉錄因子Foxp3為最主要特征,表達CTLA‐4、ICOS及OX‐40等表面分子,分泌IL‐10、TGF‐β等細胞因子,通過多種途徑抑制效應T細胞的免疫應答并促進抑制型細胞因子分泌,維持機體內環境的免疫自穩、誘導宿主對移植物的免疫耐受,是機體以主動方式獲得并維持自身免疫耐受的重要方式。
近來,過繼轉移實驗研究顯示,CD4+、CD25+Treg可以推遲甚至治療同種異體移植物排斥反應。在動物模型中,IgG介導擴增調節性T細胞表位組合物可預防、治療甚至治愈自身免疫疾病的小鼠。對Treg的基礎和臨床研究,尤其是臨床應用潛能的研究是基礎醫學和免疫學的研究熱點。然而,nTreg僅占正常人周圍血CD4+T細胞的5‐15%,大大地限制了其臨床應用。在已報道的Treg擴增方法中,iTreg多存在以下問題:使用anti‐CD3/CD28‐磁珠作為誘導劑,擴增成本高;使用異種或異體血清,具有潛在生物安全問題;需要多次分選,操作復雜且增加成本;此外,還存在擴增誘導周期較長、穩定性欠佳等其他問題。
技術實現要素:
本發明的目的是針對以上要解決的技術問題,提供一種從幼稚T細胞誘導擴增調節性T細胞的方法,該方法操作簡便、安全有效、擴增誘導周期較短、穩定性較好、成本經濟。
為實現以上目的,本發明提供了一種優化的從幼稚T細胞誘導擴增調節性T細胞的方法,該方法的步驟包括:
(1)anti‐CD3抗體包被:細胞培養,在24孔培養板中每孔加入含0.1‐2μg/ml anti‐CD3抗體的PBS 1mL置于4℃孵育1h至24h備用,其他孔板根據體積或底面積換算;
(2)外周血單個核細胞的分離:抽取肝素抗凝靜脈血20ml,取3支15ml管離心管,每管加入淋巴細胞分離液4ml,將6‐7mL外周血沿管壁緩慢置于淋巴細胞分離液層面之上,800g離心17min,分別收集血漿和外周血單個核細胞,血漿56℃水浴滅活補體,外周血單個核細胞加入足量的生理鹽水洗滌1‐2次;
(3)磁珠分選幼稚T細胞:將所述步驟(2)中獲得的外周血單個核細胞進行計數,加PBS洗滌,用美天旎磁珠陰性分選幼稚T細胞;每107細胞以40μl buffer重懸,加入10μl CD4+T Cell Biotin‐Antibody Cocktail II抗體,混勻后4℃孵育5min;加入30μl buffer、20μl的Naive CD4+T Cell Micro Bead Cocktail II磁珠,混勻后4℃孵育10min,得到細胞混合液;用3‐5ml buffer平衡LD型細胞分選柱,將所得的細胞混合液加入平衡后的LD型細胞分選柱,用3‐5ml buffer洗滌裝有細胞混合物的離心管后加入細胞分選柱,收集過柱后的細胞懸液,得到陰選的未被抗體結合的細胞,即幼稚T細胞;
(4)誘導擴增培養:將包被anti‐CD3的培養板從4℃取出于置于37℃培養箱平衡;吸去PBS;將幼稚T細胞重懸于Treg誘導培養基,調整至0.2‐2×106/孔接種于包被anti‐CD3的培養板。
作為一種優選的實施方式,所述Treg誘導培養基的配方比例為:已添加2.06mM Glutamax‐I和25mM HEPES buffer的RPMI 1640培養基,向所述RPMI 1640培養基中加入10%v/v自體血清,并加入終濃度為200U/ml重組人IL‐2、1‐5ng/ml重組人TGF‐β1、0.1‐10μg/ml anti‐CD28、10‐200nM雷帕霉素。
作為一種優選的實施方式,所述方法還包括Treg細胞傳代步驟,在該步驟中,根據細胞情況,離心計數細胞數,將其重懸于所述Treg誘導培養基中,調整至0.2‐2×106/孔,接種于另一個包被anti‐CD3的24孔板。
作為一種優選的實施方式,所述方法還包括Treg細胞凍存步驟,在該步驟中,所述凍存液的配方如下:向已添加2.06mM Glutamax‐I和25mM HEPES buffer的RPMI 1640培養基中,按體積百分比(v:v)加入10%DMSO和20%自體血清。
作為一種優選的實施方式,所述方法還包括Treg細胞復蘇步驟,在該步驟中,于37℃水浴復蘇細胞,使用5ml的所述Treg誘導培養基洗滌細胞后,重懸于所述Treg誘導培養基中,調整至0.2‐2×106/孔接種于包被anti‐CD3的24孔板中。
本發明的方法采用預包被的anti‐CD3抗體的培養板作為擴增誘導劑;在使用淋巴細胞分離液分離外周血單個核細胞(PBMC)的同時,吸取上層自體血清作為Treg培養血清,從而避免了同種異體血清和異種血清潛在的生物安全問題及免疫排異反應,并且節約了商品血清成本;此外,本發明僅在培養開始階段用磁珠陰性分選幼稚T細胞,培養過程不需要進行多次分選,從而降低成本,減少污染機會和對細胞的損傷和消耗,節省操作時間;本發明還進一步標準化了每個培養孔的細胞數、培養基量和刺激劑濃度、治療時間和治療的細胞總數、細胞濃度,使擴增和治療效果更為穩定。利用表型和功能實驗驗證體外擴增Treg的擴增效率和純度,實驗結果表明,本發明方法的擴增誘導周期是12‐21天,Treg細胞純度達到85%以上。
附圖說明
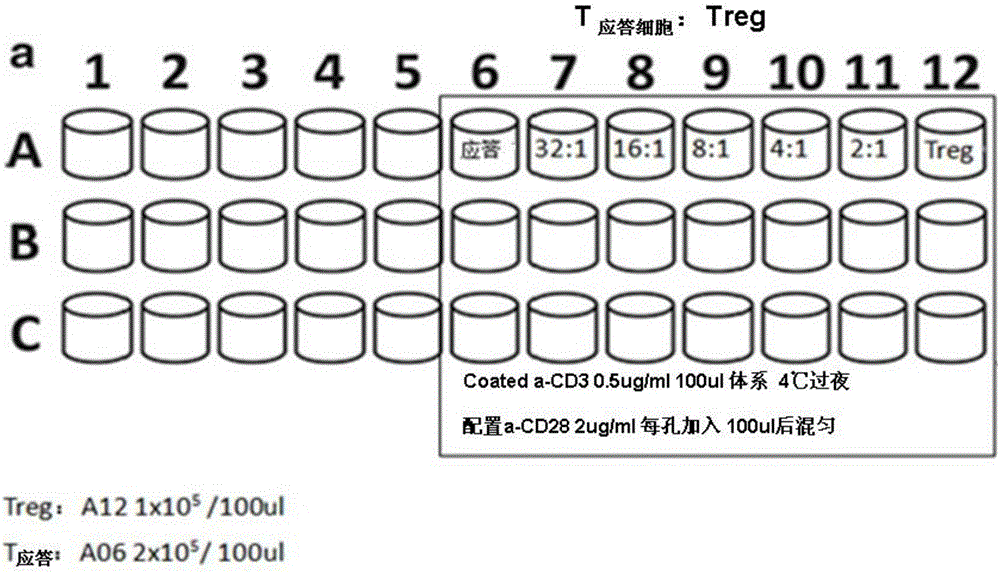
圖1示出了Treg抑制功能實驗的操作示意圖。
圖2示出了使用根據本發明的方法誘導增殖后的調節性T細胞的生長情況。
圖3示出了Treg表型和CD25、CD127、Foxp3表達的流式分析結果。
圖4示出了Treg表型和IL‐10、TGF‐β、IFN‐γ表達的流式分析結果。
圖5示出了Treg抑制功能實驗的實驗結果。
具體實施方式
下面結合附圖和具體實施例,對本發明的技術方案作進一步的詳述,但本發明并不限于以下實施例。如未特別指出,本發明的實施例中所使用試劑、儀器均為本領域已知并可獲得的。
實施例1
根據本發明的優化的從幼稚T細胞誘導擴增調節性T細胞的方法,其具體步驟如下:
步驟1. anti‐CD3抗體包被
細胞培養前24h至1h,在U型或平底培養板中每孔加入含0.1‐2μg/ml(優選為1μg/ml)的anti‐CD3(OKT3,eBioscience)抗體的PBS(磷酸鹽緩沖鹽水),24孔板加1ml,其他孔板根據體積或底面積換算。置于4℃直至使用。
步驟2.外周血單個核細胞(PBMC)的分離
抽取肝素抗凝靜脈血20ml,取3支15ml管離心管,每管加入淋巴細胞分離液4ml,將6‐7mL外周血沿管壁緩慢置于淋巴細胞分離液層面之上,800g離心17min,分別收集血漿和PBMC,血漿56℃水浴滅活補體,PBMC加入足量的生理鹽水洗滌1‐2次。
步驟3.磁珠分選Naive T細胞(幼稚T細胞)
1)將步驟2中獲得的PBMC進行計數,加PBS洗滌一遍,用美天旎磁珠(CD4+T Cell Isolation Kit II,human,cat 130‐094‐131)陰性分選幼稚T細胞;
2)每107細胞以40μl buffer重懸(以下所加buffer及抗體均按107細胞計算),加入10μl CD4+T Cell Biotin‐Antibody Cocktail II抗體。混勻后置于冰箱4℃孵育5min;
3)加入30μl buffer、20μl的Naive CD4+T Cell Micro Bead Cocktail II磁珠。混勻后于冰箱孵育10min;
4)用3‐5ml buffer平衡LD型細胞分選柱,將步驟3)所得的細胞混合液加入平衡后的柱子,用3‐5ml buffer洗滌裝細胞混合物的離心管后加入柱子,收集過柱后的細胞懸液即為陰選的未被抗體結合的細胞,此為幼稚T細胞(T細胞);
5)將柱子從磁鐵上取下,加入5ml buffer將液體打出后收集,此為其他細胞(即非幼稚T細胞)。
步驟4.誘導擴增培養
1)提前至少20min將包被anti‐CD3的培養板從4℃冰箱取出,置于37℃培養箱預熱平衡。
2)吸去PBS,不可吹打已包被抗體的區域。
3)將幼稚T細胞重懸于Treg誘導培養基,調整至0.2‐2×106/孔接種于包被anti‐CD3的培養板。Treg誘導培養基配方:RPMI 1640培養基(已添加2.06mM Glutamax‐I和25mM HEPES buffer)加10%v/v自體血清,并加入終濃度為200U/ml rh IL‐2,1‐5ng/ml rh TGF‐β1,0.1‐10μg/ml anti‐CD28,10‐200nM Rapamycin(雷帕霉素)。
4)未使用的孔加滿PBS以降低邊緣蒸發效應,37℃培養箱培養3‐5天。
步驟5.Treg細胞傳代
3‐5天后根據細胞情況,離心計數細胞數,重懸于Treg誘導培養基,調整至0.2×106‐2×106/ml,接種于另一個包被anti‐CD3的24孔板,其他孔板根據體積或底面積換算。
步驟6.每2‐3天重復步驟5,直至細胞凍存,或者從抽血培養開始算第12‐15天,取部分細胞流式分析Treg細胞比例及表型,并進行Treg抑制功能實驗。
步驟7. Treg細胞凍存
配制凍存液:RPMI 1640Medium(已添加2.06mM Glutamax‐I和25mM HEPES buffer)按體積百分比加10%DMSO、20%自體血清,置于4℃冰箱直至使用。根據需要調整Treg細胞數重懸于凍存液中,‐80℃冰箱過夜,置于液氮中保存。
步驟8. Treg細胞復蘇
37℃水浴復蘇細胞,5ml Treg誘導培養基洗滌細胞后,重懸于Treg誘導培養基,調整至0.2×106‐2×106/ml接種于包被anti‐CD3的24孔板,其他孔板根據體積或底面積換算。重復步驟6。
步驟9. Treg效能評價
在培養過程中,每天鏡下觀察細胞增殖情況,拍照存檔;每3天取2×105細胞流式分析Treg純度和各種細胞因子表達:包括CD4、CD25、CD45‐RA、CD127、Foxp3、IL‐10、TGF‐β、IFN‐γ等;于第10‐15天,進行Treg抑制功能實驗:CFSE(羧基熒光素雙乙酸鹽琥珀酰亞胺酯)是一種熒光探針,可穿透細胞膜后與胞內蛋白共價結合,定位于細胞膜、細胞質和細胞核,水解后釋放出綠色熒光。細胞核中熒光染色最強。CFSE不影響細胞的增殖能力,在細胞增殖過程中,其熒光強度隨細胞分裂而逐級遞減,熒光平均分配至兩個子代細胞中,因此其熒光強度是親代細胞的一半,根據這一特性,它可被用于檢測細胞增殖,細胞周期的估算及細胞分裂等方面。本發明采用CFSE染色的PBMC與梯度稀釋的Treg共培養,流式檢測CFSE,CFSE熒光強度的衰減程度與效應細胞PBMC的增殖程度正相關,與Treg抑制能力負相關,對比不加Treg與添加Treg,效應細胞CFSE熒光強度的衰減程度的變化即可知道Treg的抑制功能,具體操作方法如下。
9.1包被孔板:
用冷的PBS稀釋α‐CD3(0.1‐0.5μg/ml),混勻后在96孔板每孔加入100μl包被抗體,置于4℃冰箱過夜。從6‐12孔全部包被抗體。
9.2應答細胞CFSE染色:
(1)取出一管CFSE(A)溶解于18μl DMSO,配制成5mM的CFSE儲液;
(2)用PBS或RPMI(無血清,血清可終止染色)將CFSE儲液稀釋成10μM(2X)工作液備用;
(3)用15ml離心管收集細胞并計數,用預熱好的PBS洗滌2次以去除血清殘留,將細胞重懸于PBS,調整濃度至2×106/ml;加入等體積CFSE(2×),混勻,置于37℃培養箱孵育10分鐘,期間顛倒混勻數次;
(4)加入含10%血清的培養基至15ml,充分混勻以終止反應;300×g離心5min,去上清;
(5)用10%血清培養基再洗滌一次;
(6)用完全培養基重懸,調整濃度至2×106/ml(即2×105/100μ1)。
9.3 Treg與應答細胞混合培養:
用CD127磁珠陰選Treg,調整細胞數至1×106/ml(即1×105/100μ1)(可先用127磁珠陰選,再用CD25+磁珠陽選富集Treg)。
如圖1所示,在96孔板中第5‐11列加入50μl RPMI完全培養基,第12列加入100μl Treg(僅有Treg的對照)。從第12列中吸取50μl細胞于第11列(2:1),混勻,再從第11列吸50μl于第10列,以此類推直至第7列。最后從第7列吸取50μl細胞丟棄(32:1)。從第6‐11列,每孔加入CFSE染色的T細胞50μl(1×105/孔),第6列為只有T細胞的對照,在第5列加入50μl T細胞(1×105/孔,不刺激的對照)。在第12列加入50μl RPMI完全培養基使各孔終體積保持一致。置于37℃培養箱培養3‐4天。A、B、C為復孔。
實驗結果
使用根據本發明的方法誘導增殖后的調節性T細胞的生長情況如圖2所示。其中,圖2中的A、B、C、D分別為day2(第2天)、day4(第4天)、day6(第6天)、day12(第12天)的細胞生長情況。由圖2可見,細胞生長狀態良好,刺激后細胞較刺激前大,胞膜較光滑,碎片較少,背景干凈。
圖3和圖4分別示出了Treg表型和轉錄因子標志以及細胞因子表達的流式分析結果。結果顯示,培養細胞向CD127lo/‐CD25+Foxp3+Treg方向分化。
圖5示出了Treg抑制功能實驗的實驗結果,結果顯示,加入培養后,Treg能明顯抑制效應細胞的增殖。
實驗結果表明,本發明方法的擴增誘導周期是12‐21天,CD25+Foxp3+Treg細胞純度達到85%以上。
- 還沒有人留言評論。精彩留言會獲得點贊!