靶向VEGF與mucin1的抗腫瘤疫苗、編碼基因、表達載體、表達工程菌及應用的制作方法
本發明涉及一種靶向VEGF與mucin1的抗腫瘤疫苗,同時還涉及編碼該抗腫瘤疫苗的基因、抗腫瘤疫苗表達載體、表達工程菌及應用,屬于生物技術領域。
背景技術:
目前,惡性腫瘤已成為國民健康的最大威脅。而腫瘤常規治療方法如手術、放化療等均有其各自的局限,這也使得免疫治療成為繼常規療法之后的一種補充療法。在免疫療法中,各種針對腫瘤相關抗原或免疫檢驗點的單抗在腫瘤治療中起著至關重要的作用。但其代價高昂,需要長期給藥,且存在腫瘤細胞易產生抗性等問題。理論上,腫瘤疫苗具有高度特異性,其利用患者自身的免疫系統產生抗腫瘤反應,可產生長期的免疫記憶以阻止腫瘤復發。另外,腫瘤疫苗相對容易制備,與常規療法相比具有副作用小、特異性高、作用持續時間長等優點。在臨床實驗中已證實能夠有效預防腫瘤復發。
腫瘤的發生與發展過程極為復雜,僅依靠對單一靶點的作用抑制腫瘤生長與轉移是極為不現實的。所以腫瘤疫苗靶向的多靶標已成為目前疫苗研究的一個共識。Kaumaya等研究認為同時靶向VEGF和HER2的腫瘤疫苗能夠為癌癥的免疫治療提供一種新范式(Future Oncol,2012)。
Mucin1(MUC1)是一種黏蛋白,在正常組織中均有表達,但在前列腺癌、胃癌、子宮頸癌、乳腺癌等的上皮惡性腫瘤中過表達,且其N端胞外域變低或者異常糖基化,且隨著碳水化合物側鏈的縮短,核心肽上覆蓋的表位暴露出來。由于不完全糖基化,核心肽骨架上數目可變的串聯重復區域也暴露出來,成為一個潛在的細胞與體液免疫反應的靶標。其中,位于mucin1蛋白串聯重復區的一個肽段由B細胞(弱)及T細胞聯合表位(STAPPAHGVTSAPDTRPAPGSTAPP)組成,在臨床實驗中已顯示在某種程度上可對抗早期發現的小腫瘤或者防治已接受手術等常規療法的過表達mucin1患者的腫瘤復發與擴散(Pol J,2015)。但是,由肽段組成的表位疫苗往往存在分子量小、免疫原性弱等問題,易于降解,因此需要與載體蛋白連接以增強其免疫原性,延長半衰期。
在過去十年中,針對VEGF-A的抗血管治療已經普遍用于各種腫瘤治療中(Crit Rev Oncol Hematol,2014)。研究認為,阻斷VEGF不僅能夠抑制血管生成,還有助于打破腫瘤誘導的免疫抑制(Voron T,2014)。所以,同時靶向VEGF和腫瘤相關抗原mucin1,從理論上講既可以通過抑制血管生成干擾腫瘤細胞的營養供應,又可以誘導出靶向過表達mucin1的T細胞,直接靶向腫瘤細胞對其進行殺傷,達到協同抗腫瘤的效果。
目前,國內外多數研究集中在將腫瘤相關抗原作為靶標,尤其是多表位抗原,用牛血清蛋白或者銅藍蛋白作為載體增強免疫反應。然而卻未有將VEGF蛋白作為腫瘤表位載體的研究。
技術實現要素:
本發明的目的是提供一種靶向VEGF與mucin1的抗腫瘤疫苗融合蛋白,其中VEGF既作為表位載體增強與之連接的mucin1表位的抗原性,殺傷過表達mucin1的腫瘤細胞,其自身又作為抗原,產生針對VEGF的抗體,抑制腫瘤血管生成,切斷腫瘤營養供應,具有雙靶向作用。
同時,本發明還提供一種編碼上述融合蛋白的基因。
再者,本發明提供一種靶向VEGF與mucin1的抗腫瘤疫苗表達載體和表達工程菌。
最后,本發明再提供一種抗腫瘤組合物及相關應用。
為了實現以上目的,本發明所采用的技術方案是:
靶向VEGF與mucin1的抗腫瘤疫苗融合蛋白,具體為:在VEGF165、VEGF165b或其相應改構的VEGF突變體的N端或C端融合有至少一段腫瘤相關抗原mucin1的表位肽段。其中,VEGF165、VEGF165b或其相應改構的VEGF突變體作為腫瘤相關抗原mucin1的表位肽段的載體。
所述VEGF突變體的氨基酸序列至少有與天然的VEGF165或VEGF165b序列60%的相似性,其突變區域不包含外顯子6a。
所述腫瘤相關抗原mucin1的表位肽段的氨基酸序列如SEQ ID NO.3所示。優選的,腫瘤相關抗原mucin1的表位肽段融合在載體的C端,并以連接肽GGSAAY與載體連接。當腫瘤相關抗原mucin1的表位肽段的數目多于一段時,表位肽段之間以AAY連接。
更具體的,抗腫瘤疫苗融合蛋白以突變的VEGF165b(也即mVEGF165b)作為載體,在mVEGF165b的C端融合有一段腫瘤相關抗原mucin1的表位肽段,其氨基酸序列如SEQ ID NO.1所示,簡寫為mVEGF165b-muc1。編碼該融合蛋白的核苷酸序列如SEQ ID NO.2所示。
靶向VEGF與mucin1的抗腫瘤疫苗表達載體,其上連接有如SEQ ID NO.2所示的核苷酸序列。
靶向VEGF與mucin1的抗腫瘤疫苗表達工程菌,包含上述抗腫瘤疫苗表達載體。
表達載體、表達工程菌的構建均可采用常規技術。
抗腫瘤組合物,包含上述融合蛋白或表達載體,以及藥用賦形劑和/或載體。
一種細胞,包含上述抗腫瘤疫苗表達載體。
上述抗腫瘤疫苗融合蛋白、表達載體、表達工程菌、細胞或抗腫瘤組合物在制備腫瘤免疫預防和/或治療的藥物中的應用。
本發明的有益效果:
本發明中靶向VEGF與mucin1的抗腫瘤疫苗融合蛋白以VEGF165、VEGF165b或其相應改構的VEGF突變體為表位載體,通過在載體的N端或C端連接一段或數段腫瘤相關抗原mucin1的表位肽段,構成具有雙靶向作用的抗腫瘤疫苗,該疫苗中VEGF既能作為表位載體增強與之連接的mucin1表位的抗原性,殺傷過表達mucin1的腫瘤細胞,其自身又能作為抗原,產生針對VEGF的抗體,也即誘導出機體對血管生成的抑制,從而抑制腫瘤血管生成,切斷腫瘤的營養供給。同時,VEGF165、VEGF165b及其突變體具有肝素結合域,可以與肝素瓊脂糖凝膠結合,有利于后續的蛋白純化操作,融合蛋白的親和層析更加方便、快捷。
本發明以突變的VEGF165b為表位載體,在C端串聯上一段腫瘤相關抗原mucin1的表位肽段,載體與肽段之間以GGSAAY連接,構成mVEGF165b-muc1抗腫瘤疫苗。相較單獨的VEGF165b或mucin1表位免疫,mVEGF165b-muc1能夠刺激機體同時產生靶向mVEGF165b和過表達mucin1的免疫反應,二者具有協同抑制腫瘤生長的作用。ELISA與Western blot試驗證實,該疫苗免疫動物后免疫血清不僅能產生針對mVEGF165b的抗體,還能抑制臍帶靜脈內皮細胞的增殖,同時動物試驗證實mVEGF165b-muc1能夠抑制過表達mucin1腫瘤在體內生長。試驗證明,VEGF165b-muc1抗腫瘤疫苗具有雙靶向性,既能通過抑制血管生成阻礙腫瘤生長,又能直接殺傷腫瘤細胞,可用于制備腫瘤的免疫預防和/或治療的藥物。
附圖說明
圖1為mVEGF165b-muc1融合蛋白純化結果;
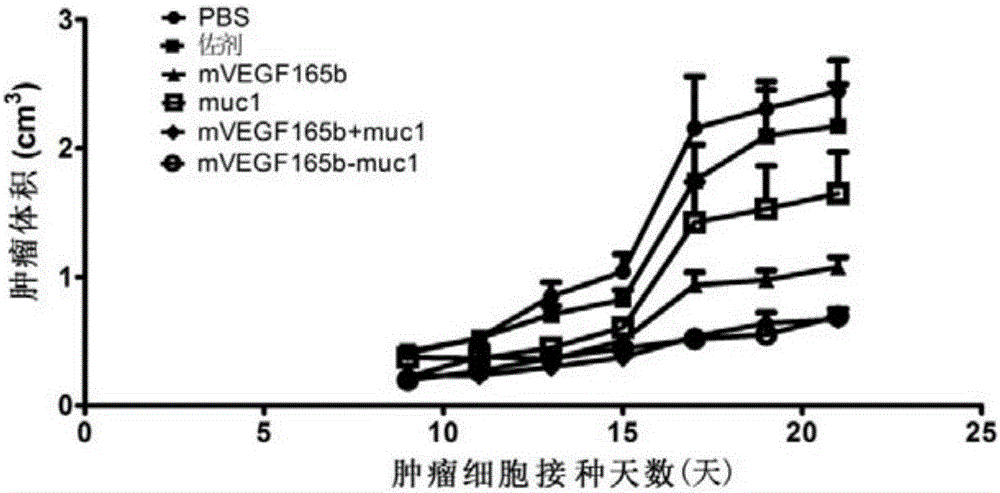
圖2為預防背景下VEGF165b-muc1對過表達mucin1的乳腺癌體內抑制效果;
圖3為治療背景下VEGF165b-muc1對過表達mucin1的乳腺癌體內抑制效果;
圖4為疫苗免疫誘導的針對VEGF165免疫血清的滴度檢測結果;
圖5為免疫血清結合VEGF165的western blot檢測結果;
圖6為疫苗免疫誘導的針對小肽muc免疫血清的滴度檢測結果;
圖7為補體介導的抗血清對HUVEC殺傷的檢測結果。
具體實施方式
下述實施例僅對本發明作進一步詳細說明,但不構成對本發明的任何限制。
實施例1
靶向VEGF與mucin1的抗腫瘤疫苗融合蛋白mVEGF165b-muc1,以突變的VEGF165b作為腫瘤相關抗原mucin1的表位肽段的載體,在其C端融合有一段mucin1的表位肽段,mVEGF165b與mucin1之間以GGSAAY連接,其氨基酸序列如下:
其中,正體部分為mVEGF165b的氨基酸序列,下劃線部分為連接肽GGSAAY的氨基酸序列,斜體部分為腫瘤相關抗原mucin1的表位肽段的氨基酸序列。
編碼上述氨基酸序列的核苷酸序列如下:
其中,正體部分為mVEGF165b的核苷酸序列,下劃線部分為連接肽GGSAAY的核苷酸序列,斜體部分為腫瘤相關抗原mucin1的表位肽段的核苷酸序列。
實施例2
靶向VEGF與mucin1的抗腫瘤疫苗表達載體,其構建步驟為:
1)使用限制性內切酶Not I、EcoR I分別雙酶切pPIC9K載體和mVEGF165b-muc1基因序列(如SEQ ID NO.4所示,其兩端包含Not I、EcoR I酶切識別序列和相應的保護堿基,由蘇州金唯智生物技術有限公司合成),酶切反應體系及反應條件如下:
pPIC9K載體的酶切反應體系(100μl):pPIC9K載體(75ng/μl)26.7μl,內切酶Not I(10U/μl)2μl,內切酶EcoR I(10U/μl)2μl,10×H Buffer(酶切緩沖液)10μl,0.1%BSA(牛血清白蛋白)10μl,滅菌蒸餾水49.3μl;酶切反應條件:在37℃下反應3小時;
mVEGF165b-muc1基因序列的酶切反應體系(100μl):mVEGF165b-muc1基因片段(149ng/μl)13.4μl,內切酶Not I(10U/μl)2μl,內切酶EcoR I(10U/μl)2μl,10×H Buffer(酶切緩沖液)10μl,0.1%BSA(牛血清白蛋白)10μl,滅菌蒸餾水62.6μl;酶切反應條件:在37℃下反應3小時。
兩端包含Not I、EcoR I酶切識別序列及相應保護堿基的mVEGF165b-muc1基因序列:
其中,下劃線部分為Not I、EcoR I酶切識別序列。
2)取酶切后線性化的pPIC9K載體和酶切后的mVEGF165b-muc1基因片段,采用T4DNA連接酶體系,在16℃下孵育過夜,連接反應體系如下:
pPIC9K載體與mVEGF165b-muc1基因片段的連接反應體系(10μl):線性pPIC9K載體(0.15μg/μl)3μl,mVEGF165b-muc1基因片段(0.015μg/μl)1.6μl,T4DNA連接酶(350U/μl)1.0μl,10×T4DNA連接酶緩沖液1.0μl,滅菌蒸餾水3.4μl。
3)取連接產物轉化感受態細胞,篩選陽性菌落,提取陽性菌落的質粒,得到pPIC9K-mVEGF165b-muc1表達載體,具體操作為:
轉化感受態細胞:在100μl細胞濃度為1.5×109個/ml的大腸桿菌TOP10感受態細胞中,加入10μl上述連接體系,充分混勻,置于冰浴中冷卻30分鐘后,立即置于42℃水浴中熱休克90秒,再置于冰浴中冷卻2分鐘;然后加入800μl的LB液體培養基(先置于37℃水浴中預熱),在37℃、100rpm條件下振蕩培養45分鐘;然后以4000rmp的轉速離心1分鐘后,棄去750μl的上清液,余下菌液充分混懸;
重組載體的鑒定:將上述菌液均勻涂布于含50μg/ml氨芐青霉素的LB平板培養基上,于37℃倒置培養14小時(12~16小時均可),挑取陽性菌落接種在5ml含有50μg/ml氨芐青霉素的LB液體培養基中,于37℃培養過夜;然后對菌液部分進行保存,同時取菌液進行PCR反應鑒定,反應產物經凝膠電泳檢測和基因測序(由蘇州金唯智生物科技有限公司提供)鑒定,結果顯示與目標產物一致;
重組載體的提取:吸取保存的經測序驗證正確的克隆菌液10μl,接種于5ml含50μg/ml氨芐的LB培養液中培養過夜,然后轉接于50ml氨芐LB培養液中,于37℃培養12小時,7000rpm離心10分鐘,收集菌體;采用OMEGA-midi質粒提取試劑盒(美國Omega Bio-Tek公司,產品貨號為D6904-01)進行質粒提取,得到pPIC9K-mVEGF165b-muc1表達載體,載體用Nanodrop超微量分光光度計(購自美國熱電(上海)科技儀器有限公司,型號NanoDrop 2000)測濃度,為264ng/μl。
實施例3
靶向VEGF與mucin1的抗腫瘤疫苗表達工程菌,其構建流程為:使用限制性內切酶Sal I酶切上述pPIC9K-mVEGF165b-muc1表達載體,得到線性化的pPIC9K-mVEGF165b-muc1表達載體,然后轉化畢赤酵母GS115感受態細胞,篩選陽性菌落,并培養高拷貝陽性克隆菌落,具體操作為:
1)pPIC9K-mVEGF165b-muc1表達載體的線性化
采用限制性內切酶Sal I對pPIC9K-mVEGF165b-muc1表達載體進行酶切,酶切產物加入20μl 3mol/L的NaAc溶液(pH=5.2)和400μl的無水乙醇進行沉淀,在4℃下以12000rpm的轉速離心10分鐘,沉淀物用70%(v/v)的酒精洗滌,再以12000rpm的轉速離心10分鐘,沉淀物晾干后溶于20μl的無菌去離子水中,取1μl作瓊脂糖凝膠電泳鑒定,以判斷pPIC9K-mVEGF165b-muc1表達載體是否完全線性化,其余置于-20℃保存備用;
酶切反應體系如下(200μl):pPIC9K-mVEGF165b-muc1表達載體(264ng/μl)75.7μl,Sal I內切酶(10U/μl)4μl,酶切緩沖液(10×H buffer)20μl,無菌去離子水100.3μl;酶切反應條件:37℃下酶切反應3小時,65℃下滅活20分鐘;
2)畢赤酵母GS115感受態細胞的制備
取單個畢赤酵母GS115菌落,接種于3ml YPD培養液中,于30℃振蕩培養過夜,次日轉接于100ml YPD培養液中,培養至OD值為1.3;菌液分裝于兩個50ml的離心管中,分別以4500rmp的轉速離心5分鐘,棄上清,分別加入100ml無菌預冷去離子水,吹打重懸;離心棄上清,加入50ml無菌去離子水,吹打重懸,再離心棄上清,加入20ml 1M山梨醇溶液,吹打重懸,然后再次離心棄上清,將畢赤酵母細胞重懸于500μl 1M山梨醇溶液中,置于冰上待用;
3)線性化pPIC9K-mVEGF165b-muc1表達載體轉化畢赤酵母GS115感受態細胞
將BIO-RAD電轉儀的參數設置為:電壓1500v,電阻200Ω,電容25uF;并將電轉杯烘干,置于冰上預冷;將15μl線性化的pPIC9K-mVEGF165b-muc1表達載體加入100μl畢赤酵母GS115感受態細胞(His氨基酸缺陷型酵母菌)溶液中混勻,置于冰上預冷5分鐘,然后加到電轉杯中,啟動電轉儀,脈沖為4.35ms,并迅速加入1ml預冷的1M山梨醇溶液混勻,吸取200μl細胞溶液涂布于MD平板培養基(His營養缺陷型培養基)上,于30℃培養2天,長出His陽性克隆菌落,His陽性克隆菌落的總數在4000以上;
4)高拷貝G418抗性克隆菌落的篩選
用YPD培養液將MD平板培養基上長出的全部陽性菌落沖洗下來,測定酵母菌懸液的OD值;按照1OD約等于5×107cell/ml的量,將其稀釋至每200μl中含有的細胞數量為2×106個;然后涂布于濃度為4mg/ml的G418-YPD平板培養基上,于30℃培養2天,挑選長出的高拷貝陽性克隆菌落。
研究發現,多個重組基因拷貝整合到畢赤酵母中已被證實可以增加目的基因的表達產量。pPIC9K載體可以在酵母中整合多個拷貝,載體上含有卡那霉素基因,卡那霉素基因賦予酵母對遺傳霉素(Geneticin,G418)的抗性。并且,G418的抗性水平依賴于卡那霉素基因整合在酵母中的數目。單個拷貝的pPIC9K整合在酵母基因組上僅對濃度約為0.25mg/ml的G418有抗性。多拷貝的pPIC9K整合在酵母基因組上可使酵母對G418的抗性由0.5mg/ml(1~2拷貝)提高到4mg/ml(7~12個拷貝)。因此,采用濃度為4mg/ml的G418-YPD平板培養基即能夠篩選出高拷貝的G418抗性克隆菌落。
實施例4
靶向VEGF與mucin1的抗腫瘤疫苗表達工程菌的應用,表現為mVEGF165b-muc1抗腫瘤疫苗融合蛋白的誘導表達和分離純化,具體操作為:
1)mVEGF165b-muc1的誘導表達
取上述高拷貝酵母菌株單克隆接種于5ml YPD培養液中,于30℃振蕩培養過夜,次日吸取100μl培養物接種于25ml BMGY培養液中,于29℃(28~30℃均可)繼續振蕩培養至OD值為3.6,以4500rmp的轉速離心,收集菌體,重懸于200ml BMMY培養液中,加入2ml甲醇,繼續于29℃振蕩培養,誘導表達mVEGF165b-muc1,連續4天在固定時間補加2ml甲醇,發酵4天后,于8000rpm的轉速離心10分鐘,取上清液;
2)mVEGF165b-muc1的分離純化
將離心后得到的上清液加入含有0.1M NaCl、濃度20mmol/L的Tris-HCl溶液(PH=8.0)中,于4℃透析平衡過夜,經0.45μm濾器過濾后,上樣于肝素瓊脂糖親和柱(Heparin-Sepharose CL6B親和柱),用含有0.5M NaCl、濃度20mmol/L的Tris-HCl溶液(PH=8.0)進行洗脫,流速為1ml/min,OD280nm檢測出峰情況,收集最后一個出峰的組分,并采用SDS-PAGE電泳分別對變性(打開二硫鍵,即上樣緩沖液中含β-巰基乙醇)與非變性融合蛋白(即上樣緩沖液中不含β-巰基乙醇)進行檢測,檢測結果見圖1,圖1中M為marker,1為目標產物mVEGF165b-muc1抗腫瘤疫苗融合蛋白(非變性狀態,即以二聚體形式存在),2為目標產物mVEGF165b-muc1抗腫瘤疫苗融合蛋白(變性狀態)。
試驗例
一、動物免疫檢測抗腫瘤疫苗在預防背景與治療背景下對過表達mucin1腫瘤生長影響
預防背景下,mVEGF165b-muc1免疫對小鼠過表達mucin1乳腺癌的生長抑制能力測試:取50μg mVEGF165b-muc1溶于100μl PBS中與100μl佐劑混合,總體積200μl,免疫BAL B/c小鼠,初次采用完全弗氏佐劑與cpG混合物為佐劑,加強免疫采用不完全佐劑與cpG混合物為佐劑,5點皮下注射(四肢腋下及背部1點),每間隔1周免疫1次,共4次;對照組分別為200μl PBS(PBS組),100μl佐劑混合100μl PBS(佐劑組),50μg mVEGF165b溶于100μl PBS與100μl佐劑混合(mVEGF165b組),50μg muc1小肽溶于100μl PBS與100μl佐劑混合(muc1組),混合100μl佐劑43.5μg mVEGF165b與溶于100μl PBS的6.5μg muc1小肽混合(mVEGF165b+muc1組)。距最后一次免疫1周,小鼠前肢下接種過表達人mucin1的小鼠乳腺癌細胞株EMT6(1×106),待腫瘤可見時,用游標卡尺每天測量腫瘤的長寬,腫瘤大小用下式計算:腫瘤體積=0.5×長×寬2。當測到22天后,停止測量,結果如圖2所示。結果顯示,抗腫瘤疫苗組mVEGF165b-muc1與突變VEGF165b混合mucin1小肽組一樣,可以顯著抑制過表達mucin1腫瘤在小鼠體內的生長,但mVEGF165b-muc1的抑制作用最強。
治療背景下,mVEGF165b-muc1免疫對小鼠過表達人mucin1乳腺癌的生長抑制能力測試:在小鼠前肢腋下接種100μl(1×106/ml)過表達人mucin1的小鼠乳腺癌細胞株EMT6,當腫瘤可見時(可以摸到但無法測量,約7天時),取50μg mVEGF165b-muc1溶于100μl PBS中與100μl佐劑混合,總體積200μl,免疫BAL B/c小鼠,初次采用完全弗氏佐劑與cpG混合物為佐劑,加強免疫采用不完全佐劑與cpG混合物為佐劑,5點皮下注射(四肢腋下及背部1點),每間隔1周免疫1次,共3次;對照組分別為200μl PBS(PBS組),100μl佐劑混合100μl PBS(佐劑組),50μg mVEGF165b溶于100μl PBS與100μl佐劑混合(mVEGF165b組),50μg muc1小肽溶于100μl PBS與100μl佐劑混合(muc1組),混合100μl佐劑43.5μg mVEGF165b與溶于100μl PBS的6.5μg muc1小肽混合(mVEGF165b+muc組)。待腫瘤可見時,用游標卡尺每天測量腫瘤的長寬,腫瘤大小用下式計算:腫瘤體積=0.5×長×寬2。當測到26天后,停止測量,結果如圖3所示。結果顯示,抗腫瘤疫苗組mVEGF165b-muc1可以在治療背景下顯著抑制過表達mucin1腫瘤在小鼠體內的生長。
二、腫瘤免疫效果的檢測
1)體液免疫效果檢測
檢測步驟為:1)在免疫過程中,每周1次眼底靜脈叢取血,室溫3000rpm離心5min得到血清;取VEGFm165蛋白用碳酸鹽緩沖溶液(0.05mol/L pH9.6的碳酸鹽緩沖液,4℃保存;其中Na2CO3 0.15g,NaHCO3 0.293g,蒸餾水稀釋至100mL)稀釋成濃度為10μg/mL的包被液,每孔加入100μL抗原包被液,并以不加標準抗原的三孔為對照,為反應的0%值,同時設置三孔加100μL封閉液(5%脫脂奶粉溶于PBS中)作為對照;將反應板置于4℃下過夜;2)封閉板:將包被好的酶標板孔內的液體傾去,每孔加200μL洗滌液(0.01mol/L pH7.4PBS+0.5%Tween20)后室溫下放置1min,倒掉,如此重復4次后,在吸水紙上拍干,加封閉液進行封閉,在37℃放置45min(注意:空白孔也要加封閉液);封閉后,如前述洗滌;3)加梯度稀釋的小鼠血清,37℃放置1h,洗滌;4)加入HRP標記的山羊抗小鼠IgG:洗滌后每孔加100μL稀釋好的HRP-羊抗兔IgG,37℃放置1h,洗滌;5)加入TMB底物:洗板4次后,每孔加入100μL底物溶液,于37℃暗處振蕩反應20min后,每孔加入50μL結束反應液以終止反應;6)吸收測定:用酶聯免疫檢測儀測定波長為450nm下的吸光值;7)數據處理:抗體滴度,就是將抗體稀釋成不同濃度,如果在某一濃度下抗體測定OD與陰性對照OD比值剛好呈陽性(比值大于等于2.1),此時的稀釋度就看作抗體滴度。結果如圖4所示,mVEGF165b-muc1組4次免疫后的抗體滴度可達到60萬倍。
將免疫血清分別稀釋100倍、500倍、1000倍,分別用western blot驗證,檢測血清是否誘導出針對native VEGF165b蛋白的抗體。結果如圖5所示,免疫血清誘導出可以與VEGF165結合的抗體。圖5中M代表marker,1為mVEGF165b與來源于PBS組免疫血清的結合結果;2為mVEGF165b與稀釋1000倍小鼠血清孵育的western Blot結果;3為mVEGF165b與稀釋500倍小鼠血清孵育的western Blot結果;4為mVEGF165b與稀釋100倍小鼠血清孵育的western Blot結果。
將mucin1小肽偶聯到牛血清白蛋白BSA上,然后用上述方法包被到ELISA包被板上,ELISA檢測免疫血清中針對mucin1小肽的抗體滴度,如圖6所示,4次免疫后的抗體滴度可達到8000倍左右。
2)補體依賴的抗體中和VEGF165刺激HUVEC細胞增殖試驗
將亞融合的HUVECs細胞(1×104個,100μL/孔)接種于96孔板中,孔板中盛裝有含5%胎牛血清與50ng/ml VEGF165的ECM培養基,培養過夜。然后加1μL(1%)、5μL(5%)與10μL(10%)免疫血清和相應量的正常小鼠血清作為對照,加入10μL豚鼠血清做為補體來源,孵育24h。孵育結束,加入20μL 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT,5mg/mL),細胞于37℃繼續培養4h。最后在培養液中加入100μL DMSO裂解細胞,測其在570nm的吸光度。結果如圖7所示,5%、10%的來自于mVEGF165b-muc1組的免疫血清可以抑制HUVEC的增殖。
以上所述實施例僅表達了本發明的幾種實施方式,其描述較為具體和詳細,但并不能因此而理解為對發明專利范圍的限制。應當指出的是,對于本領域的普通技術人員來說,在不脫離本發明構思的前提下,還可以做出若干變形和改進,這些都屬于本發明的保護范圍。因此,本發明專利的保護范圍應以所附權利要求為準。
- 還沒有人留言評論。精彩留言會獲得點贊!