一種表達載體及表達豬氨肽酶N的Vero細胞系的制作方法
本發明涉及生物工程技術領域,尤其涉及一種表達載體及表達豬氨肽酶N的Vero細胞系。
背景技術:
豬流行性腹瀉(porcine epidemic diarrhea,PED)是由豬流行性腹瀉病毒(porcine epidemic diarrhea virus,PEDV)引起的一種嚴重的病毒性傳染病,它會導致哺乳期仔豬發生嚴重的腹瀉、嘔吐、脫水等癥狀,并且致死率極高。該疾病在歐洲和亞洲傳播非常廣泛,每年都會對一些國家和地區造成嚴重的經濟損失,給養豬業帶來了巨大的危害,所以對于豬流行性腹瀉的防治是當務之急。
對于大多數的病毒性腹瀉疾病來說,防治措施一般都會選擇接種疫苗免疫。雖然現在市場上已經有多種針對豬流行性腹瀉病毒的疫苗產品,但其免疫效果并不理想,該病毒仍然可以在已免疫豬群中被發現,豬流行性腹瀉病毒所造成的損害仍然在持續加重。近年來,有關豬流行性腹瀉病毒疫苗的研究和生產雖然已經取得了一定的進展,但目前仍面臨著在種毒制備的過程中培養條件復雜、病毒生長速度較慢、獲得的病毒滴度較低等問題,這些都嚴重阻礙了豬流行性腹瀉疫苗的生產和研制。因此構建一種能夠促進PEDV復制、可用于高效生產PEDV疫苗的工程細胞系十分必要。
由于冠狀病毒都是利用自身的S蛋白和相應宿主細胞表面受體結合隨后進入宿主細胞的,冠狀病毒對受體的依賴性以及受體本身的特異性也決定了冠狀病毒對感染宿主的范圍的局限性,以及感染宿主器官部位的靶向性。豬氨肽酶N(porcine Aminopeptidase N,pAPN)是PEDV侵染宿主細胞時的天然受體。有研究表明,PEDV入侵宿主細胞與該細胞膜上pAPN的含量多少有關,而與pAPN作為酶的活性無關。在不能被PEDV侵染的真核細胞系如ST細胞系、293T細胞系中過表達pAPN能夠使該細胞變成PEDV的易感細胞。
Vero細胞系是世界衛生組織(WHO)允許用于疫苗生產的細胞株,它對多種病毒敏感,其中也包括豬流行性腹瀉病毒。Vero生長需要培養條件簡單, 生長速度快,被廣泛的用于多種病毒疫苗的生產,包括流感疫苗,狂犬疫苗,登革熱疫苗等。
當前用于工業生產PEDV疫苗的細胞系就是Vero細胞系,但PEDV的天然宿主是豬,而其天然宿主細胞是豬的小腸上皮細胞。Vero細胞系是非洲綠猴的腎細胞系,不是PEDV的天然宿主細胞,不能真實的反映PEDV自然侵染宿主細胞的過程。而且Vero細胞系上沒有PEDV的天然受體豬氨肽酶N,其入侵Vero細胞的效率與入侵天然宿主細胞相比的必然受到影響。
另有發明構建了一種能穩定傳代的豬腸道上皮細胞系。該細胞系對PEDV高度敏感、PEDV感染的毒價可以達到104.9TCID50/mL以上,在流行毒株培養方面優于Vero細胞。該細胞系可用于PEDV的分離和培養,也能用于PEDV細胞受體和致病機制的研究。PEDV易感的豬腸道上皮細胞系的建立,避免了原代豬腸道上皮細胞制備繁瑣、穩定性差、難于培養的一系列缺點,為PEDV的培養提供了一個備選細胞系,為PEDV的深入研究提供了靶細胞,對PEDV疫苗生產具有重要意義。但是該細胞系自身的增殖能力與Vero細胞系相比仍有差別,生長較緩慢;且其培養條件較為復雜,需要添加生長因子等,成本較大;并且上皮細胞系也不是疫苗生產常用的細胞系,實際應用不太現實,且生物安全性還有待評估。
因此,構建表面存在pAPN受體的Vero細胞,必定會促進PEDV的入侵天然宿主的過程的研究。
技術實現要素:
有鑒于此,本發明要解決的技術問題在于提供一種表達載體及表達豬氨肽酶N的vero細胞系,本發明提供的vero細胞系能夠表達豬氨肽酶N,且表達量較高,且能夠有效促進PEDV在vero細胞中的增殖。
本發明提供了一種表達載體,在pcDNA3.1(+)載體中插入puro抗性基因和pAPN序列。
本發明提供的表達載體的圖譜如圖1所示,其中,所述pAPN序列為pAPN的CDS序列,為了便于后期在蛋白水平上檢測pAPN的過表達,通過引物在其N端添加flag-tag標簽。本發明中,pAPN序列如SEQ ID NO:1所示。pAPN序列的插入位點為Hind III和BamH I酶切位點之間。
pAPN的CDS序列的獲得方法采用分段擴增法,擴增共分為3步。
第一步擴增以小腸組織cDNA為模板,擴增共分為3段;擴增第一段的引物序列如SEQ ID NO:3~4所示;擴增第二段的引物序列如SEQ ID NO:5~6所示;擴增第三段的引物序列如SEQ ID NO:7~8所示。
第二步擴增以第一步擴增產物(選自3個片段中的2個)為模板。
第三步擴增以第二步擴增產物和剩余的1個擴增產物為模板。
flag-tag標簽的添加采用PCR法,所述PCR采用pAPN的CDS序列為模板,擴增引物如SEQ ID NO:9~10所示。
puro抗性指嘌呤霉素(Puromycin)抗性,本發明中puro抗性基因的序列如SEQ ID NO:2所示。
在本發明的實施例中,puro抗性基因的插入位點為Sma I和Sal I酶切位點之間;
采用脂質體轉染法將本發明提供的表達載體=瞬時轉染293T細胞系,培養48h后,分別進行western blot和細胞免疫熒光試驗鑒定結果表明,該細胞能在蛋白水平上檢測到pAPN的顯著過表達。因此,將本發明提供的表達載體轉染vero細胞系,能夠使vero細胞系表達pAPN。
本發明提供的表達載體在制備表達豬氨肽酶N的Vero細胞系中的應用。
本發明還提供了一種表達豬氨肽酶N的Vero細胞系其保藏編號為CGMCC NO.12675。
本發明提供的表達豬氨肽酶N的vero細胞系的制備方法,為以本發明提供的表達載體轉染vero細胞系。
轉染前需將表達載體線性化,本發明中,表達載體經pvu I酶切線性化。
本發明中,轉染為脂質體轉染。
轉染后,置于37℃,5%CO2培養48h。
轉染后,還包括以puromycin篩選的步驟。
所述puromycin的濃度為2.0μg/mL。
所述篩選具體為,轉然后培養48h后分板,分板24h后以含有2.0μg/mLpuromycin的10%DMEM培養液,培養8~10天,每天更換培養液及時清除死亡的細胞。
將篩選獲得的細胞裂解后,以PCR法鑒定所獲得細胞是否含有pAPN。
所述PCR鑒定的引物序列如SEQ ID NO:11~12。
鑒定為陽性的細胞,擴大培養,以western blot法用anti-Flag一抗鑒定每個克隆中pAPN蛋白水平的表達情況,將能夠穩定表達pAPN蛋白的細胞株保藏至中國微生物菌種保藏管理委員會普通微生物中心(CGMCC),保藏編號為CGMCC NO.12675。
擴大培養采用的培養基為10%DMEM培養液;
擴大培養的培養條件為37℃,5%CO2。
保藏編號為CGMCC NO.12675的表達豬氨肽酶N的vero細胞系在促進PEDV增殖中的應用。
以PEDV病毒對本發明提供的細胞系進行攻毒試驗,結果表明,PEDV病毒在本發明提供的細胞系中具有更高的拷貝數,約為未經改造的vero細胞系拷貝數的十倍。說明保藏編號為CGMCC NO.12675的表達豬氨肽酶N的vero細胞系能夠有效地促進PEDV在Vero細胞中的增殖。
本發明提供的細胞系易于被PEDV侵染,因此,本發明提供的細胞系能夠用于實驗室PEDV病毒的培養、致病機理的研究或PEDV疫苗的生產。由于本發明提供的細胞系能夠促進PEDV的復制、增殖作用,故而,以其制備PEDV疫苗,能夠具有更高的效率。
保藏編號為CGMCC NO.12675的表達豬氨肽酶N的vero細胞系在制備PEDV疫苗中的應用。
本發明檢測PEDV的拷貝數采用real-time PCR法。
用于熒光定量檢測的為PEDV基因組中保守性較高的M基因;引物如SEQ ID NO:13~14。
本發明提供了一種表達載體,并提供了以該載體制備用于表達豬氨肽酶N的Vero細胞系,同時提供了該細胞系制備的方法。該細胞系保藏于CGMCC,其保藏編號為CGMCC NO.12675。該細胞系具有易于被PEDV病毒的侵染,促進PEDV在宿主細胞內復制的作用,使用該細胞系培養PEDV能夠獲得病毒拷貝數度和滴度更高的病毒。本細胞系既可用于實驗室PEDV病毒的培養、致病機理的研究等,也可用于工業化中PEDV疫苗的高效生產。
生物保藏說明
非洲綠猴腎細胞系vero-Apclone 11:分類命名:非洲綠猴腎細胞系,于2016年06月28日保藏在中國微生物菌種保藏管理委員會普通微生物中心(CGMCC),保藏中心地址為:北京市朝陽區北辰西路1號院3號,保藏編號為CGMCC NO.12675。
附圖說明
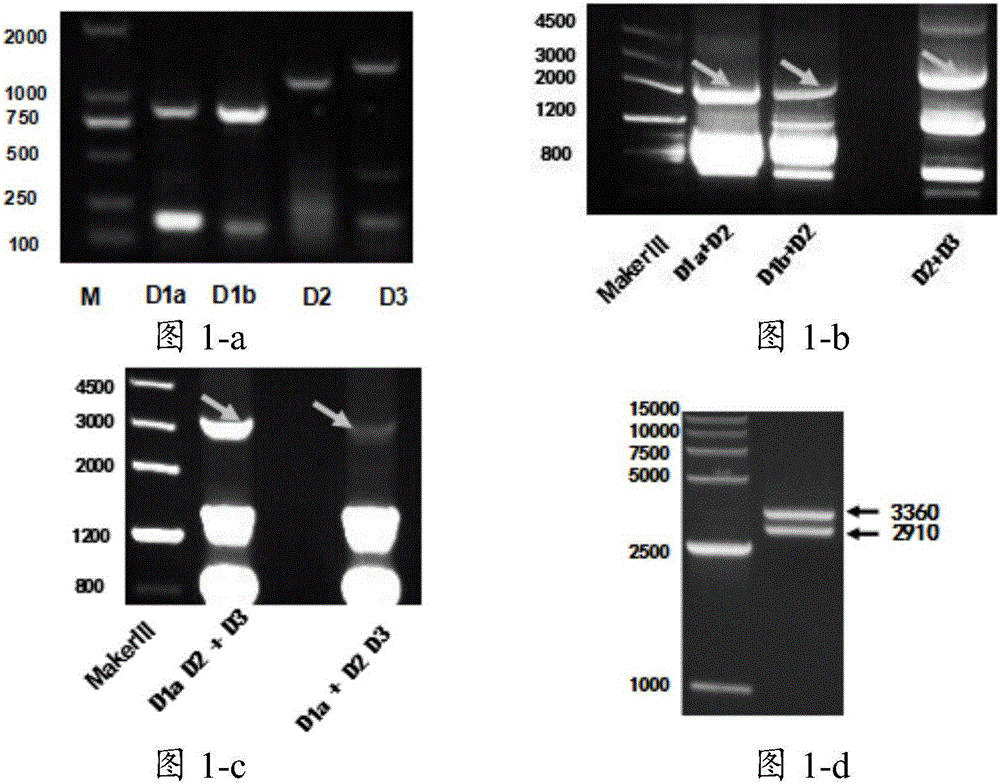
圖1示pAPN分段擴增、拼接、連接到pLB載體上的過程;其中,圖1-a示pAPN分成三段PCR;圖1-b示三段PCR產物兩段之間分別連接;圖1-c示最后兩段拼接后得到的目的片段;圖1-d示連接完成后酶切鑒定;
圖2示pcDNA3.1(+)-puro-pAPN-flag-N以Hind III和BamH I酶切鑒定
圖3示pAPN蛋白的表達效果;其中,圖3-a示western blot檢測細胞蛋白表達結果;圖3-b示免疫熒光檢測轉化pcDNA3.1(+)-puro的293T細胞蛋白中pAPN表達情況;圖3-c示免疫熒光檢測轉化pcDNA3.1(+)-puro-pAPN-flag-N的293T細胞中pAPN蛋白表達情況;
圖4示pcDNA3.1(+)-puro-pAPN-flag-N質粒圖譜;
圖5示PCR鑒定細胞系基因型;
圖6示western blot檢測各細胞系蛋白表達;
圖7示細胞病變;其中,圖7-a示vero細胞的病變;圖7-b示11號細胞系的病變;
圖8示細胞中PEDV病毒拷貝數;其中,圖8-a示細胞內PEDV病毒拷貝數;圖8-b示培養上清PEDV病毒拷貝數;**示存在顯著性差異,p<0.01。
具體實施方式
本發明提供了一種表達載體及表達豬氨肽酶N的Vero細胞系,本領域技術人員可以借鑒本文內容,適當改進工藝參數實現。特別需要指出的是,所有類似的替換和改動對本領域技術人員來說是顯而易見的,它們都被視為包括在本發明。本發明的方法及應用已經通過較佳實施例進行了描述,相關人員明顯能在不脫離本發明內容、精神和范圍內對本文的方法和應用進行改動 或適當變更與組合,來實現和應用本發明技術。
本發明采用的儀器皆為普通市售品,皆可于市場購得。
下面結合實施例,進一步闡述本發明:
實施例1 pAPN真核過表達質粒的構建
pAPN的真核過表達質粒的以pcDNA3.1(+)-puro為載體質粒,為便于后期在蛋白水平上檢測pAPN的過表達,通過引物在其N端添加flag-tag標簽。構建過程如下:
1材料
豬小腸組織、pcDNA3.1(+)質粒為本實驗室留存
2試驗過程
1、構建pcDNA3.1(+)-puro質粒
獲得puro抗性基因,所述puro抗性基因的序列如SEQ ID NO:2所示,將puro抗性基因片段以酶切位點Sma I和Sal I,連接入pcDNA3.1(+)質粒構建pcDNA3.1(+)-puro質粒。
2、pAPN基因的CDS序列(SEQ ID NO:1)的獲取
由于編碼pAPN的mRNA全長為3387bp,完整的豬的氨肽酶N的CDS序列長度為2892bp,長度較長,且在小腸組織提取RNA反轉的cDNA中含量相對較低,前期預實驗直接針對擴增完整的CDS區設計的引物并不能擴增出完整的pAPN的CDS片段。所以本試驗將采用分段法擴增,將接近3000bp的CDS區分為三段擴增,設計分段引物時相鄰兩個片段之間有50~100bp的重疊區間,然后將相鄰兩個片段兩兩相連最終拼接成完整pAPN的CDS片段。分段法擴增pAPN的CDS序列引物如下:
第一段:
pANP-D1-F:5’-CGAGCTCCCTTCTCACCCTCAC-3’(SEQ ID NO:3)
pANP-D1-R:5’-CATTTTGGGCCGTTTCATTCAC-3’(SEQ ID NO:4)
第二段:
pANP-D2-F:5’-TACATCGTGAGCGAGTTCCAGAGC-3’(SEQ ID NO:5)
pANP-D2-R:5’-GAAGAGGGTGTTGTCCAGAGCCAG-3’(SEQ ID NO:6)
第三段:
pANP-D3-F:5’-TACGACGAGGACAACTGGAGGATG-3’(SEQ ID NO:7)
pANP-D3-R:5’-TCTGATGCCCTGTTGATTCTCAGG-3’(SEQ ID NO:8)
將三段片段兩兩相連(第一次PCR的模板是小腸組織cDNA,擴增結果是獲得三段pAPN片段,第二次PCR的模板是兩條具有50-100bp重疊區的pAPN片段(第一次PCR的產物),第三次pcr的模板為第二次pcr產物(較長片段)和第一次pcr產物的一個片段),拼接完整后連接到pLB載體上構建pLB-pAPN質粒,測序后凍存備用。pAPN分段擴增、拼接、連接到pLB載體上的過程如圖1所示。
3、添加酶切位點和flag-tag標簽
為了便于將pAPN的CDS序列連接到pcDNA3.1(+)-puro上,通過引物在該序列的兩段分別添加雙酶切位點。所設計的引物在pAPN的CDS序列的5,端添加Hind III酶切位點和flag-tag標簽序列、3,端添加BamH I酶切位點。引物的序列如下:
pAPN-CDS-F:(SEQ ID NO:9)
5’-CGAAGCTTATGGATTACAAGGATGACGACGATAAGGCCAAGGGATTCTACATTTCC-3’ (Hind III)
pAPN-CDS-R:(SEQ ID NO:10)
5’-CGGGATCCTCCATCATCCATCAAGGGCTTCTGCTCATC-3’ (BamH I)
(其中斜體加粗序列為酶切位點,加框的堿基為起始密碼子,有下劃線的堿基序列編碼的是flag-tag氨基酸序列。)
以pLB-pAPN質粒為模板,擴增pAPN的CDS序列。
1)、pcDNA3.1(+)-puro-pAPN-flag-N的構建
通過Hind III和BamH I雙酶切反應酶切2)中擴增獲得的pAPN的CDS序列和pcDNA3.1(+)-puro,使用T4DNA連接酶將具有粘性末端的pAPN的CDS序列和pcDNA3.1(+)-puro連接過夜。獲得的質粒結果酶切鑒定和測序正確后,轉化DH5α,大提質粒后備用。所獲得的pcDNA3.1(+)-puro-pAPN-flag-N經過酶切鑒定如圖2。
2)、瞬轉293T細胞驗證pAPN真核表達質粒的效果
把pcDNA3.1(+)-puro-pAPN-flag-N質粒經過乙醇沉淀后,使用 3000試劑瞬時轉染293T細胞系,培養48h后,分別進行western blot和細胞免疫熒光試驗鑒定pAPN蛋白的表達效果,結果如圖3所示。
3結果
本試驗通過分段法擴增獲得了pAPN的CDS序列,并構建出了pAPN的真核表達質粒pcDNA3.1(+)-puro-pAPN-flag-N(質粒圖譜如圖4),該質粒通過酶切鑒定和測序鑒定均正確。脂質體瞬時轉染293T細胞,能在蛋白水平上檢測到pAPN的顯著過表達。說明成功構建了pAPN的真核過表達質粒,可用于下一步構建穩定表達pAPN的Vero細胞系。
實施例2穩定表達pAPN的Vero細胞系的篩選
1材料
實施例1構建的pcDNA3.1(+)-puro-pAPN-flag-N質粒,Vero細胞系購于中國科學院典型培養物保藏委員會細胞庫;
2試驗過程
1)、質粒線性化
使用pvu I對pcDNA3.1(+)-puro-pAPN-flag-N進行酶切,將質粒線性化的同時不影響pAPN的表達。將獲得的線性化質粒進行乙醇沉淀后用高壓滅菌的ddH2O溶解后,測濃度備用。質粒線性化的結果如圖2所示。
2)、脂質體轉染
將上一步獲得的線性化的表達質粒,使用3000試劑轉染Vero細胞系,步驟參考InvitrogenTM公司的3000試劑盒。轉染后,置于37℃,5%CO2培養48h,分板篩克隆。
3)、puromycin篩選
根據之前的預實驗得出,篩選Vero細胞中陽性克隆時,puromycin的最佳濃度為2.0μg/mL,在分板后24h后,加入含有2.0μg/mLpuromycin的10%DMEM培養液,每天更換培養液及時清除死亡的細胞,8~10天時,10cm皿上單克隆的細胞團的大小剛好最合適。使用克隆環小心挑取單細胞簇,將獲得的每個克隆置于24孔板中繼續培養,并編號。
4)、細胞基因型的鑒定
當24孔板中挑取的克隆細胞長滿時,用0.5%胰酶將細胞消化下來,取一半的細胞繼續置于24孔板中培養,另一半細胞置于離心管中,3000r/min,離 心10min,棄去上清,將得到的細胞用NP40工作液裂解,并與PCR儀中,56℃、1h,95℃、10min處理,獲得該克隆的基因組。以每個克隆的基因組為模板,以針對pAPN基因設計的引物為鑒定引物,鑒定獲得的克隆基因組是否有外源pAPN的插入。鑒定引物的序列如下:
Vero-apclone-JD-F:5’-CCCACTGCTTACTGGCTTATCG-3’(SEQ ID NO:11)
Vero-apclone-JD-R:5’-CGGCATTCTTGTTCTTCTCCTG-3’(SEQ ID NO:12)
基因型的鑒定結果如圖5所示。
5)、基因型陽性的細胞pAPN蛋白水平的表達
將上一步中鑒定得到的基因型為陽性的克隆擴大培養,將它們分別鋪到6孔板上,待細胞長滿時,收蛋白,并做western blot,用anti-Flag一抗鑒定每個克隆中pAPN蛋白水平的表達情況。
擴大培養采用的培養基為10%DMEM培養液;
擴大培養的培養條件為 37℃,5%CO2。
3結果
通過puromycin篩選出45個克隆,記為apclone 1~45。采用鑒定引物(SEQ ID NO:11和SEQ ID NO:12),鑒定他們的基因型,有部分克隆的基因組中插入了外源pAPN的基因片段,分別是9、11、14、17、21、22、25、28、32、35、36、43,鑒定結果如圖5所示。將這些基因型為陽性的克隆擴大培養到六孔板中,待細胞長滿后收取各組蛋白,進行western blot試驗,可以看出,克隆9和11在150kDa的目的條帶區有一條明顯的條帶,其余克隆在該位置條帶不明顯,鑒定結果如圖6所示。將獲得蛋白量更大的11號細胞系保藏于CGMCC,保藏編號為CGMCC NO.12675。
實施例3:PEDV攻毒試驗驗證過表達pAPN的Vero細胞系對PEDV的增殖效果
1材料
Vero細胞系購于中國科學院典型培養物保藏委員會細胞庫;Vero-11為實施例2篩選得到的能夠穩定過表達pAPN的Vero細胞系;PEDV疫苗毒為吉林正業生化科技公司贈送;
2試驗過程
將Vero空白對照細胞和鑒定得到的pAPN過表達陽性克隆細胞系Vero-11,分別按照1.5×106個/孔的密度鋪在6cm板中,8h后細胞匯合率大約是70%~80%左右,將PEDV病毒按照MOI為0.1的接種量接種到對應的細胞中,48h后分別收接毒細胞和上清中的RNA,并反轉為cDNA。細胞中的RNA直接使用TRNzol A+試劑提取。上清中的RNA提取,將混勻后的上清吸取200μL,在其中加入等量的未接毒處理的Vero細胞,細胞的個數控制在2×106個左右最宜,然后加入TRNzol A+試劑,其余步驟和細胞提RNA步驟相同。采用本研究建立的實時熒光定量的方法檢測樣品中病毒拷貝數,并把實驗組Vero-11和對照組Vero細胞的細胞內和上清中病毒的拷貝數進行對比。為保證實驗數據的可信度,實驗組和對照組均設有三個重復。
用于熒光定量檢測的為PEDV基因組中保守性較高的M基因;引物為:
PEDV-DL-F:5’-TCTCACTACTTCTGTGATGGGC-3’(SEQ ID NO:13)
PEDV-DL-R:5’-GATGAAGCATTGACTGAACGAC-3’(SEQ ID NO:14)
3結果
本實驗以未經改造的Vero細胞為對照組,以篩選出的pAPN表達相對較高的11號細胞系為試驗組,分別進行PEDV接毒培養試驗,在48h后分別收取細胞和上清培養液里的總RNA,測定其中病毒拷貝數的含量。在收毒之前,觀察兩種細胞系形成的細胞病變CPE,如圖7所示,可以明顯看出,11形成的CPE較Vero-con相比較多,細胞多核體和空泡比較多。對細胞內以及上清中病毒的拷貝數進行測定,結果如圖8所示,可以看出,11在細胞中PEDV的病毒拷貝數約是Vero-con的兩倍,在上清中病毒的拷貝數約是對照組的十倍。結果說明本發明構建的過表達pAPN的Vero細胞系能夠有效地促進PEDV在Vero細胞中的增殖。
以上僅是本發明的優選實施方式,應當指出,對于本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!