具有增加的脂肪酶活性的兩親性肽?脂肪酶綴合物及其用途的制作方法
技術領域
本發明涉及具有增加的脂肪酶活性的兩親性肽-脂肪酶綴合物,編碼所述綴合物的多核苷酸,包含所述多核苷酸的表達載體,其中錨定了所述表達載體的轉化體,構建所述綴合物的方法,使用所述綴合物的脂解方法,和使用所述脂肪酶制備生物柴油的方法。
背景技術:
脂肪酶(三酰基甘油酰基水解酶,EC3.1.1.3)是催化甘油三酯水解為脂肪酸和甘油酯或甘油并且作為消化食物的三種消化酶之一與淀粉酶和蛋白酶一起具有重要作用的酶。脂肪酶天然地來源于廣泛范圍的生物體,包括動物、植物和微生物。
除了在體內脂類(lipid)代謝中具有重要作用,脂肪酶還可用于提高奶酪的風味,在蔬菜發酵時增加游離脂肪酸,在肉發酵時使風味變濃,以及脂解魚肉。此外,脂肪酶的利用目前已經擴展到合成昂貴的、光學純的異構體。而且,脂肪酶還應用于多種工業中。作為其一些實例,脂肪酶在乳品工業中的應用包括經由乳脂(milk fats)的水解和牛脂(butterfat)或奶油(crease)的裂解制備奶酪。在洗滌劑工業中,脂肪酶可以用來制備洗衣劑或洗衣機洗滌劑。該酶可以減小洗滌劑產品的環境載荷,因為它們通過使得待使用的洗滌溫度更低而節約能量。脂肪酶在油脂化工中的應用范圍是巨大的,包括制造不飽和脂肪酸和肥皂以及從廉價的棕櫚油生產可可脂。在造紙工業中,脂肪酶被用來從木材中移除樹脂或松香和從廢紙中移除墨。轉到制藥工業,脂肪酶的利用包括合成單獨的R-和S-光學異構體,分離外消旋體和制造藥物。化妝品工業應用脂肪酶來生產皮膚化妝品,包括蠟、防曬霜和沐浴產品。此外,脂肪酶可在能源工業中用作從植物油中生產生物柴油的手段。
目前,生物柴油,作為新的可再生能源出現,在全世界已經使用基于化學催化劑的方法而進行生產。然而,因為大量有機溶劑的使用,環境處置的高昂費用,以及歸因于高反應溫度引起的高能耗,它們的商業化還沒有成功。出于這些原因,采用脂肪酶作為催化劑的工藝得到了廣泛的關注。這些工藝所享有的優點是由于低反應溫度而節省了能量,通過從副產物甘油形成收益而減小了生產成本,并且幾乎沒有環境污染。然而,就穩定性和效率相對于成本而言,該酶是不佳的。已經提議將該酶固定化作為克服所述缺點的方式,但作為解決如何提高酶性質的問題的方案還很遙遠。因此,正在進行積極的研究以通過增加該酶的酶活性來提高該酶的工業實用性。
例如,不是開發廉價的和強力的脂肪酶,而是已經使用間接的替代方式,諸如改良的用于脂肪酶和酶固定化的反應條件,來解決與脂肪酶相關的問題。可選地,已經使用宏基因組學來搜索新的脂肪酶,但還沒有得到值得注意的成就。為了提高脂肪酶的活性以及它們的底物特異性、耐熱性和熱穩定性,已經進行了廣泛的研究,其中已經收集了各種脂肪酶的X-線結晶學數據,并且已經通過下面的方式對脂肪酶進行修飾:使用蛋白質工程技術諸如定向誘變,置換活性位點和周圍區域的氨基酸殘基。盡管這帶來了脂肪酶活性的提高,但提高僅是部分的。
技術實現要素:
技術問題
鑒于此技術背景,本發明人想到造成脂肪酶與其底物的低可接近性的原因是底物的溶解度差,并且發現當與兩親性肽——即,具有親水和疏水部分兩者的肽——締合時,脂肪酶與其底物的可接近性、結合性和反應性均提高,由此得到本發明。
解決問題的技術方案
因此本發明的目的是提供兩親性肽-脂肪酶綴合物,其表現出與單獨脂肪酶相比更高的脂肪酶活性。
本發明的另一目的是提供編碼所述綴合物的多核苷酸,包含所述多核苷酸的表達載體,以及其中包含所述表達載體的轉化體。
本發明的又一目的是提供制備所述兩親性肽-脂肪酶綴合物的方法。
本發明的再又一目的是提供使用所述兩親性肽-脂肪酶綴合物的脂解方法。
本發明的再另一目的是提供使用所述兩親性肽-脂肪酶綴合物生產生物柴油的方法。
發明的有益效果
由于顯著地提高了對脂類底物的反應性并且因此提高了酶活性,根據本發明的與兩親性肽綴合的脂肪酶,即使以小量使用,也能在需要脂肪酶的領域,諸如生物柴油生產中保證足夠的脂類轉化率。另外,本發明的脂肪酶綴合物不需要使用額外的表面活性劑,因此提供了經濟效益。
附圖說明
從下面結合附圖的詳述中,將更清晰地理解本發明的上述和其他目的、特征和其他優勢,在附圖中:
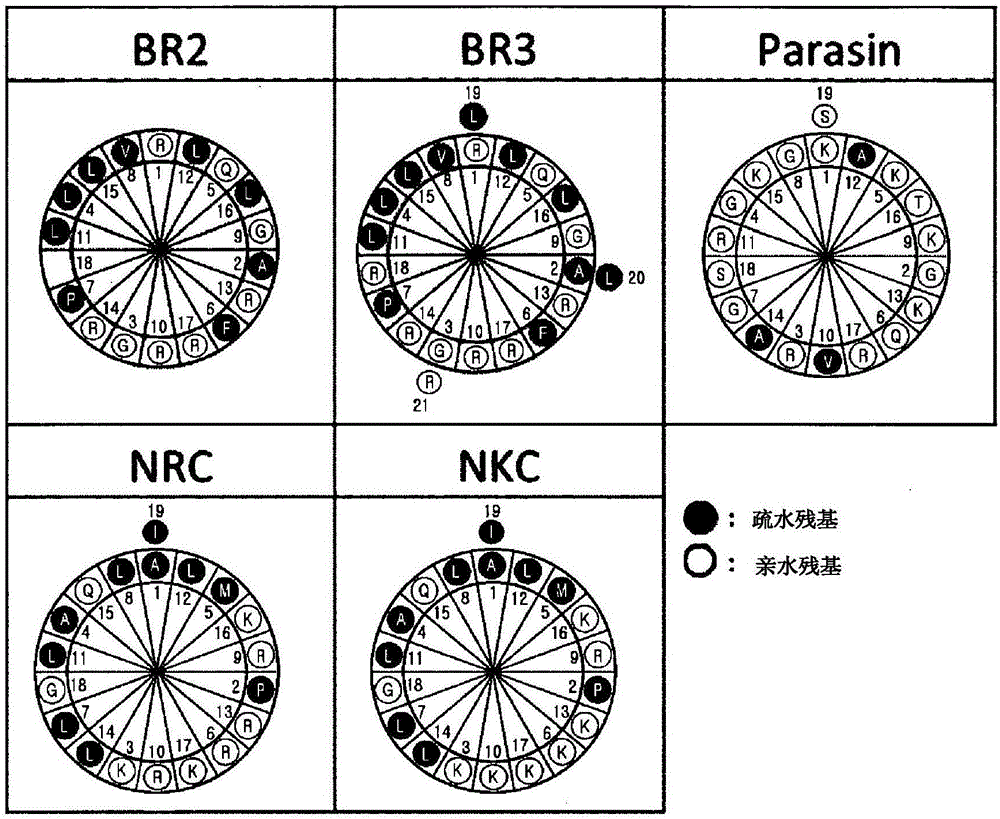
圖1示出兩親性肽的Schiffer-Edmundson輪投影(wheel projection)的圖,其中號碼1表示肽的殘基1,并且實心圓和空心圓分別指示疏水和親水氨基酸;
圖2是示出用于表達活性增強的脂肪酶的載體的基因結構的示意圖;
圖3是示出肽-脂肪酶TliA綴合物的表達的SDS-PAGE照片;
圖4是示出根據本發明的與兩親性肽融合的TliA脂肪酶使用棕櫚酸對硝基苯酯通過比色測定法所測量的脂解活性的圖,棕櫚酸對硝基苯酯在與脂肪酶反應時顯色;
圖5是示出根據本發明制備的TliA脂肪酶通過pH-STAT法測量的脂解活性的圖;
圖6是示出根據本發明的與兩親性肽融合的M37脂肪酶使用棕櫚酸對硝基苯酯通過比色測定法測量的脂解活性的圖;
圖7是示出根據本發明制備的M37脂肪酶通過pH-STAT法測量的脂解活性的圖;
圖8示出使用熒光顯微鏡的NKC-融合的M37脂肪酶對脂類顆粒的定位;
圖9示出南極假絲酵母(Candida antarctica)脂肪酶B(A),野生型M37脂肪酶(B)和NKC-融合的M37脂肪酶(C)在40℃溫育12h的預定時間測量的酶活性。南極假絲酵母脂肪酶B、野生型M37和NKC-融合的M37脂肪酶的水解活性在0%、3.3%、5%和10%甲醇水溶液中測量;和
圖10示出使用野生型M37脂肪酶和NKC-M37脂肪酶采用橄欖油進行生物柴油生產。生物柴油通過氣相色譜定量分析和通過薄層色譜定性分析。(A)使用野生型M37脂肪酶(空心圓)和NKC-融合的M37脂肪酶(實心圓)的橄欖油三步酯交換的時程。此外,對使用野生型M37脂肪酶(左)和NKC-融合的M37脂肪酶(右)的酯交換反應期間的反應混合物進行TLC分析。箭頭指示向反應混合物中添加甲醇。(B)使用野生型M37脂肪酶和NKC-融合的M37脂肪酶的橄欖油兩步酯交換的時程。(C)使用野生型M37脂肪酶和NKC-融合的M37脂肪酶的橄欖油一步酯交換的時程。
具體實施方式
根據其一個方面,本發明提供了兩親性肽-脂肪酶綴合物,其中脂肪酶與兩親性肽綴合。
術語“兩親性肽”,當在本文中使用時,是指在極性面上包含極性氨基酸且在非極性面上包含非極性氨基酸的肽。極性氨基酸殘基包括半胱氨酸、谷氨酰胺、蘇氨酸、酪氨酸、絲氨酸和天冬酰胺,而非極性氨基酸殘基的實例包括苯丙氨酸、色氨酸、甲硫氨酸、脯氨酸、纈氨酸、異亮氨酸、亮氨酸、甘氨酸和丙氨酸。在本發明中,兩親性肽充當用于增強脂肪酶與其底物脂類的結合和反應性的介質。在兩親性肽中,極性氨基酸殘基或非極性氨基酸殘基可以在氨基酸序列中緊靠著存在。可選地,氨基酸殘基可以隨機地分布,而無論其在氨基酸序列上的極性如何,但由于極性對三維結構的影響而在空間上彼此接近地定位,形成極性面和非極性面。
只要其可以綴合脂肪酶并且提高該酶與底物的可接近性或反應性,可以將任何兩親性肽用于本發明的目的。兩親性肽的實例包括Buforin IIb(SEQ ID NO:1)、B0(SEQ ID NO:2)、Paracin I(SEQ ID NO:3)、NKC(SEQ ID NO:4)、和NRC(SEQ ID NO:5),但不限于這些。另外,如果兩親性肽可以發揮作用以增強與其綴合的脂肪酶對底物的可接近性和反應性,則對其長度沒有特殊的限制。在優選的實施方式中,采用buforin IIb、B0、paracin I、NKC和NRC。
如上所提到的,可用于本發明中的兩親性肽可以是包含選自SEQ ID NO:1至5的氨基酸序列的肽。另外,可以采用包含與具有SEQ ID NO:1至5的氨基酸序列至少70%,優選至少80%,更優選至少90%,更優選至少95%,和最優選至少98%同源性的肽作為本發明中的兩親性肽,條件是它們保留了實質上增強脂肪酶活性的生物學功能。要認識到肽變體,即使部分通過缺失、修飾、置換或添加而被突變,均落入本發明的范圍內,只要它們表現出與兩親性肽相同或對應的生物活性即可。
當在本文中使用時,術語“脂肪酶”是指催化脂肪水解的酶。詳細地,當作用于中性脂肪時,脂肪酶負責將三酰基甘油酯降解成二酰基甘油酯以及將一酰基甘油酯降解成脂肪酸和甘油。總體來說,脂肪酶在動物的胰瘺中豐富地存在,而植物在種子諸如小麥、蓖麻子、豆等中含有脂肪酶。如果其具有水解脂類的生物活性,則在本發明中可以使用任何類型的脂肪酶而沒有限制。例如,可以使用來源于熒光假單胞菌(Pseudomonas fluorescens)的脂肪酶TliA(熱穩定脂肪酶),或來源于溶脂發光桿菌(Photobacterium lipolyticum)的脂肪酶M37。關于脂肪酶的信息可以獲自已知的數據庫,諸如GenBank,NIH。例如,TliA和M37可以分別以AAD09856和AAS78630的登錄號被搜索到。TliA和M37可以是分別包含,但不限于SEQ ID NO:6和7的氨基酸序列的脂肪酶。還可用于本發明中的有,如上所述,與具有SEQ ID NO:6或7的氨基酸序列至少70%,優選至少80%,更優選至少90%,還更優選至少95%,和最優選至少98%同源性的蛋白,條件是它們具有降解脂類的實質生物活性。此外,要理解的是肽變體,即使部分通過缺失、修飾、置換或添加而被突變,均落入本發明的范圍內,只要它們表現出與兩親性肽相同或對應的生物活性即可。
當在本文中使用時,術語“兩親性肽-脂肪酶綴合物”是指以不損害脂肪酶的生物活性的方式與脂肪酶連接的兩親性肽。在兩親性肽-脂肪酶綴合物中,兩親性肽以化學方式、酶學方式或通過基因操作而與脂肪酶連接,以形成融合蛋白。
兩親性肽可以與脂肪酶直接連接或經由接頭與脂肪酶連接。
當在本文中使用時,術語“接頭”是指利用氫鍵、靜電相互作用、范德華力、二硫鍵、鹽橋、疏水相互作用、共價鍵等連接兩個不同的融合伴侶(例如,生物聚合物)的任何部分。在優選的實施方式中,接頭具有至少一個半胱氨酸殘基,該半胱氨酸殘基可以在生理條件下或其他標準肽條件(例如,用于純化或保存肽的條件)下參與至少一個二硫鍵。除了連接融合伴侶,接頭還可以充當間隔物并在融合伴侶之間提供空間或充當鉸鏈以為綴合物提供柔性或剛度。接頭可以是肽基接頭或非肽基接頭。經由肽鍵或二硫鍵在融合伴侶之間的直接連接包括在接頭的作用范圍內。
術語“非肽基接頭”,當在本文中使用時,是指由至少兩個重復單位組成的生物相容性接頭,其中在重復單位之間具有非肽基共價鍵。
可用于本發明中的非肽基接頭的實例包括聚乙二醇(PEG)均聚物、聚丙二醇均聚物、乙二醇-丙二醇共聚物、聚氧乙烯多元醇、聚乙烯醇、多糖、右旋糖酐、聚乙烯基乙醚、生物可降解聚合物、脂類聚合物、殼多糖、透明質酸和它們的組合,優選聚乙二醇均聚物。在本領域中已知曉或可以在現有技術水平上容易制備的它們的衍生物包括在本發明的范圍內。更優選地,聚乙二醇均聚物為雙官能醛形式,分子量為1-5kDa且最優選具有3.4kDa的分子量,使得在相對的端部處的醛基可以與兩個多肽的末端氨基形成共價鍵,由此連接兩親性肽與脂肪酶。特別地,在相對的端部處的醛官能團有效地允許將非特異性反應保持到最小。
另外,對兩親性肽和脂肪酶之間的綴合狀態沒有特別的限制。在此上下文中,兩親性肽可以連接到脂肪酶的N-或C-末端,或兩個兩親性肽分別連接到脂肪酶的N-和C-末端兩端。例如,buforin IIb、B0、paracin I、NKC或NRC可以融合到脂肪酶TliA的N-末端(SEQ ID NO:8-12),脂肪酶M37的N-末端(SEQ ID NO:13-17),脂肪酶TliA的C-末端(SEQ ID NO:18-22),脂肪酶M37的C-末端(SEQ ID NO:23-27),脂肪酶TliA端的N-和C-末端兩端(SEQ ID NO:28-32),或脂肪酶M37的N-和C-末端兩端(SEQ ID NO:33-37)。
在本發明的一個實施方式中,buforin IIb、B0、paracin I、NKC或NRC用作兩親性肽,而TliA或M37充當脂肪酶。兩親性肽連接到脂肪酶的N-末端以構建兩親性肽-脂肪酶,發現該兩親性肽-脂肪酶具有比野生型脂肪酶本身高多達10倍的脂解活性(圖4-7)。因此,當與兩親性肽綴合時,脂肪酶的脂解活性增加使得其可以在需要脂解的多種領域中使用,具有極大的經濟效益。還觀察到該兩親性肽-脂肪酶具有提高的對脂類顆粒的可接近性(圖8)。另外,該兩親性肽-脂肪酶綴合物,NKC-M37脂肪酶,與野生型脂肪酶M37相比,甚至在甲醇——在制備生物柴油中使用的成分之一——的存在下,表現出更高的穩定性和脂解活性(圖9和10),這提示本發明的兩親性肽-脂肪酶綴合物可用于生產生物柴油。
根據其另一個方面,本發明提供了編碼綴合物的多核苷酸,包含該多核苷酸的表達載體,和其中包含該表達載體的轉化體。
當在本文中使用時,術語“多核苷酸”是指由在鏈中共價鍵合的許多核苷酸單體構成的聚合物分子。DNA(脫氧核糖核酸)和RNA(核糖核酸)是具有不同的生物學功能的多核苷酸的實例。因此,本發明的多核苷酸可以是編碼綴合物的DNA或RNA形式。
根據本發明的多核苷酸可以編碼,但不限于,其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶TliA的N-末端的綴合物(SEQ ID NO:45-49),其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶M37的N-末端的綴合物(SEQ ID NO:50-54),其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶TliA的C-末端的綴合物(SEQ ID NO:55-59),其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶M37的C-末端的綴合物(SEQ ID NO:60-64),其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶TliA的N-和C-末端兩端的綴合物(SEQ ID NO:65-69),或其中buforin IIb、B0、paracin I、NKC或NRC融合到脂肪酶M37的N-和C-末端兩端的綴合物(SEQ ID NO:70-74)。
在本發明的編碼綴合物的多核苷酸中,由于密碼子簡并性或考慮到要表達它們的生物體優先使用的密碼子,可以在編碼區中做出許多修飾,條件是它們不改變在編碼區中表達的多肽的氨基酸序列,并且甚至可以在編碼區以外的區域中引入各種修飾或改變,只要它們對基因的表達沒有影響即可。本領域技術人員充分理解的是,這些修飾和改變包括在本發明的范圍內。也就是說,本發明的多核苷酸可以在一個或多個核酸堿基處通過置換、缺失、插入或其組合被修飾,只要得到的多核苷酸編碼功能上等同的多肽即可,并且它們也包括在本發明的范圍內。
根據本發明包含編碼綴合物的多核苷酸的表達載體可以是允許多核苷酸在真核細胞或原核細胞中復制和/或表達的載體,所述真核細胞或原核細胞包括,但不限于,哺乳動物細胞(例如,人細胞,猴細胞,兔細胞,大鼠細胞,倉鼠細胞,鼠科動物細胞,等),植物細胞,酵母,昆蟲細胞或細菌細胞(例如,大腸桿菌,等)。在表達載體中,優選地,核苷酸可操作地連接至適宜的啟動子,使得其在宿主細胞中表達。此外,該表達載體可以含有至少一個選擇標志。例如,多核苷酸可以被引入至噬菌體、粘粒、微型染色體,或病毒或逆轉錄病毒載體。
轉化體可以通過將表達載體引入至宿主細胞中來進行制備。可用于本發明中的宿主細胞的實例包括,但不限于,細菌細胞,諸如大腸桿菌,鏈霉菌屬(Streptomyces),鼠傷寒沙門氏菌(Salmonella typhimurium),等;酵母;真菌,諸如畢赤酵母(Pichia pastoris);昆蟲細胞,諸如果蠅(Drosophila),甜菜夜蛾(Spodoptera),和Sf9細胞;動物細胞,諸如CHO(中國倉鼠卵巢細胞),SP2/0(小鼠骨髓瘤),人淋巴母細胞,COS,NSO(小鼠骨髓瘤),293T,Bowes黑色素瘤細胞,HT-1080,BHK(幼倉鼠腎細胞),HEK(人胚腎細胞),和PERC.6(人視網膜細胞);和植物細胞。在本發明的一個實施方式中,大腸桿菌用作宿主細胞(實施例2)。
術語“引入”,當在本文中使用時,是指將包含編碼綴合物的多核苷酸的載體遞送至宿主細胞中。引入可以通過本領域中已知的多種方式實現,包括磷酸鈣-DNA共沉淀,DEAE-右旋糖酐-介導的轉染,聚凝胺介導的轉染,電擊,微注射,脂類體融合,脂類體轉染和原生質體融合。轉染是指將感興趣的核酸材料通過使用病毒顆粒感染的方式轉移到細胞中。另外,可以使用基因轟擊來實現對表達載體的細胞攝取。在本文中,術語“引入”可以與術語“轉化”互換使用。
根據其進一步的方面,本發明提供了制備兩親性肽-脂肪酶綴合物的方法。
優選地,該方法包括(a)培養包含攜帶編碼兩親性肽-脂肪酶綴合物的多核苷酸的表達載體的轉化體;和(b)從細胞培養物或培養基中回收兩親性肽-脂肪酶綴合物。
回收步驟可以在破壞來自細胞培養物或上清液的細胞團后使用純化方法來進行,所述純化方法諸如萃取,親和色譜,離子交換色譜,凝膠過濾色譜,疏水色譜,蛋白沉淀,透析或其組合。回收的感興趣蛋白可以使用本領域中熟知的方法確認,諸如SDS-PAGE,Western印跡,等。
在本發明的一個實施方式中,制備編碼兩親性肽-脂肪酶綴合物,paracin I-TliA脂肪酶,buforin IIb-TliA脂肪酶,B0-TliA脂肪酶,paracin I-M37脂肪酶,buforin IIb-M37脂肪酶,B0-M37脂肪酶,NKC-M37脂肪酶和NRC-M37脂肪酶的基因并使用它們來構建攜帶它們的各個表達載體(pET-Par-TliA,pET-Buf-TliA,pET-B0-TliA,pET-Par-M37,pET-Buf-M37,pET-B0-M37,pET-NKC-M37和pET-NRC-M37)。將這些表達載體引入至大腸桿菌中以獲得各個轉化體,然后進行培養。從培養物中回收為兩親性肽-脂肪酶綴合物形式的融合多肽(實施例1和2,圖2和3)。
根據其又一方面,本發明提供了使用兩親性肽-脂肪酶綴合物的脂解方法。該方法包括使兩親性肽-脂肪酶綴合物與脂類反應。
兩親性肽、脂肪酶和兩親性肽-脂肪酶綴合物如上所述。表現出提高的對脂類底物的可接近性和反應性歸因于兩親性肽(圖4-8),兩親性肽-脂肪酶綴合物在脂解中可以是有效的。兩親性肽的存在消除了使用額外的表面活性劑的必要性,并且減少了脂肪酶的量,使得兩親性肽-脂肪酶綴合物可以以經濟上有效益的方式水解脂類。
只要其充當脂肪酶的底物,可以采用任何脂類而沒有特殊限制。
在本發明的一個實施方式中,綴合物的脂解活性與野生型脂肪酶進行比較,野生型脂肪酶不含兩親性肽。為了進行比較,使用棕櫚酸對硝基苯酯和橄欖油作為底物。關于作為底物的棕櫚酸對硝基苯酯,發現當脂肪酶TliA以綴合物的形式時與野生型脂肪酶相比其活性增加大約10%(圖4)。與野生型相比,包含脂肪酶M37的綴合物的活性增加1.2-至4.2-倍(圖6)。當在橄欖油上使用時,發現與脂肪酶TliA本身相比,當與兩親性肽融合時脂肪酶TliA的活性增加大約35.5-至78-倍(圖5)。在脂肪酶M37的情況下,與野生型相比,當其為綴合物的形式時其對橄欖油的脂解活性增加大約2.2至10.2倍(圖7)。這些數據支持了下面的結論:本發明的綴合物可以有效地水解脂類。
根據其又另一方面,本發明提供了使用兩親性肽-脂肪酶綴合物生產生物柴油的方法。
優選地,此方法包括,但不限于,使兩親性肽-脂肪酶綴合物與油和/或脂肪和醇反應。
可選地,用于生產生物柴油的方法可以包括,但不限于,(a)將表達載體引入至宿主細胞中以形成轉化體;(b)培養轉化體并從細胞培養物或培養基中回收脂肪酶;和(c)在脂肪酶的存在下使油和/或脂肪與醇反應以生產生物柴油。
根據本發明可用于生產生物柴油的脂肪酶可以是游離形式或是固定化形式。脂肪酶的固定化可以使用本領域中熟知的多種方法來實現,包括,但不限于,物理方法諸如吸附和包封以及化學方法諸如共價鍵合和交聯。
可用于本發明中的油和脂肪有天然的油和脂肪,經加工的油和脂肪以及廢棄的油和脂肪。更優選的是大豆油,菜籽油和棕櫚油。在本發明中可用于制備生物柴油的醇優選含有2-8個碳原子,且更優選2-4個碳原子。醇的實例包括乙醇、甲醇、1-丙醇、異丙醇、1-丁醇、2-丁醇、異丁醇和叔丁醇。醇的進料可以使用本領域中已知的多種進料方法來實現。例如,醇可以以多步進料的方式或以連續的方式進料。
在本發明的一個實施方式中,橄欖油或廢油以及甲醇被用作用于生產生物柴油的起始物料(實施例5)。典型的脂肪酶,諸如CalB脂肪酶,在具有高甲醇含量的介質中是不穩定的,而本發明的脂肪酶在3.3%,5%和甚至10%甲醇溶液中維持高活性(圖9)。另外,在3步甲醇進料法(1摩爾當量)中,本發明的NKC-M37脂肪酶確保從橄欖油獲得生物柴油的高生產產率。事實上,其允許達到該生產產率比野生型M37脂肪酶快95%(節省21小時)(圖10a)。在2步甲醇進料法中(其比3步甲醇進料法更有經濟效益),本發明的綴合物達到最大轉化產率比野生型M37脂肪酶快27小時(圖10b)。在1步甲醇進料法中,本發明的脂肪酶綴合物與野生型脂肪酶相比在更短的時間內也達到了最大轉化率(圖10c)。
另外,由于其中的雜質、游離脂肪酸和含水量,廢油已知難以應用于生物柴油生產。此外,其雜質對脂肪酶有負面影響,盡管它們非常廉價。然而,發現本發明的NKC-M37脂肪酶從廢油生產生物柴油所達到的程度與從橄欖油或棕櫚油相似,這證明了本發明的綴合物在生物柴油生產中是經濟上有效益的(實施例5)。
實施本發明的方式
下面的非限制性實施例用于舉例說明本發明的選擇的實施方式。要理解的是所示的各組分的比例變化和要素備選方式對于本領域技術人員將是明顯的并且包括在本發明的實施方式的范圍內。
實施例1:開發其中脂肪酶與各種兩親性肽融合的融合脂肪酶
實施例1-1:肽衍生物的制備
許多不同的具有強力抗菌活性的肽形成由疏水和親水氨基酸殘基組成的兩親性α-螺旋結構。具有優異的兩親性的抗菌肽,包含SEQ ID NO:1的氨基酸序列的buforin IIb(韓國專利第10-314721號),由buforin IIb修飾的包含SEQ ID NO:2的氨基酸序列的B0,包含SEQ ID NO:3的氨基酸序列的Paracin I(韓國專利第10-330136號),包含SEQ ID NO:4的氨基酸序列的NKC,和包含SEQ ID NO:5的氨基酸序列的NRC(韓國專利第10-836596號)(表1)由本發明人制備并且用來構建具有增強的脂解活性的融合多肽。
【表1】
5種兩親性肽的α-螺旋結構可以通過使用Schiffer和Edmundson輪投影來示意性地可視化,如圖1中所示。在此輪中,連續氨基酸中的每一個對應于100°的圈(turn),使得螺旋每圈具有3.6個殘基。
實施例1-2:編碼肽-脂肪酶綴合物的基因的構建
對質粒pHOPE(Eom,GT,等人,Applied Environ.Microbiol.,71:3468-3474,2005)和pEML37(Yang KS,等人,J.Biosci.Bioeng.,107:599-604,2009)進行PCR(聚合酶鏈式反應)以擴增脂肪酶基因,然后將其與編碼所選的兩親性肽的基因融合,上述兩個質粒分別攜帶熒光假單胞菌來源的編碼脂肪酶TliA的基因,已知具有強力的酶活性并且確保生物柴油生產的高轉化率,以及溶脂發光桿菌來源的編碼脂肪酶M37的基因,已知對甲醇高度耐受。在PCR中使用的引物的信息顯示在表2中。
【表2】
實施例1-2-1:編碼paracin I/脂肪酶TliA綴合物的基因的構建
為了構建編碼paracin I/TliA脂肪酶融合蛋白的基因,首先,使用一對引物pET16-L和pET-R(Par)通過PCR擴增在pET16b(Merck biosciences)中與T7啟動子-核糖體結合位點-His標簽連接的基因片段。
單獨地,使用引物TliA-rev(Par)和Nde-TliA-for對pHOPE進行PCR以合成DNA片段,在該DNA片段中脂肪酶基因與一部分paracin融合。
在兩個擴增的DNA片段用作底物的同時,使用引物pET16-L和Nde-TliA-for通過PCR擴增T7啟動子-核糖體結合位點-His標簽-paracin I肽-脂肪酶基因。
實施例1-2-2:編碼buforin IIb/脂肪酶TliA綴合物的基因的構建
為了構建編碼buforin IIb/TliA脂肪酶融合蛋白的基因,首先,使用一對引物pET16-L和pET-R(Buf)通過PCR擴增在pET16b中與T7啟動子-核糖體結合位點-His標簽連接的基因片段。
單獨地,使用引物TliA-rev(Buf)和Nde-TliA-for對pHOPE進行PCR以合成DNA片段,在該DNA片段中脂肪酶基因與一部分buforin基因融合。
在兩個擴增的DNA片段用作底物的同時,使用引物pET16-L和Nde-TliA-for通過PCR擴增T7啟動子-核糖體結合位點-His標簽-buforin IIb肽-脂肪酶基因。
實施例1-2-3:編碼B0/脂肪酶TliA綴合物的基因的構建
為了構建編碼B0/TliA脂肪酶融合蛋白的基因,首先,使用一對引物pET16-L和pET-R(B0)通過PCR擴增在pET16b中與T7啟動子-核糖體結合位點-His標簽連接的基因片段。
單獨地,使用引物TliA-rev(B0)和Nde-TliA-for對pHOPE進行PCR以合成DNA片段,在該DNA片段中脂肪酶基因與一部分buforin基因融合。
在兩個擴增的DNA片段用作底物的同時,使用引物pET16-L和Nde-TliA-for通過PCR擴增T7啟動子-核糖體結合位點-His標簽-B0肽-脂肪酶基因。
實施例1-2-4:包含脂肪酶TliA的對照基因的構建
擴增不含任何兩親性肽的對照DNA(T7啟動子-核糖體結合位點-His標簽-脂肪酶TliA)。為此,首先,使用DNA引物pET16-L和pET-R(con)對pET16b進行PCR以合成T7啟動子-核糖體結合位點-His標簽基因片段。
單獨地,在引物TliA-rev(con)和Nde-TliA-for的存在下進行PCR,以pHOPE充當底物,擴增包含脂肪酶基因的DNA片段。
在兩個擴增的DNA片段用作底物的同時,使用引物pET16-L和Nde-TliA-for通過PCR擴增T7啟動子-核糖體結合位點-His標簽-脂肪酶基因。
實施例1-2-5:編碼buforin IIb/脂肪酶M37綴合物的基因的構建
構建編碼buforin IIb/M37脂肪酶融合蛋白的基因。就此而言,首先,使用一對引物pET16-L和pET-R(Buf)通過PCR擴增在pET16b中與T7啟動子-核糖體結合位點-His標簽連接的基因片段。單獨地,使用引物M37-rev(Buf)和Nde-M37-for對pEML37進行PCR以合成DNA片段,在該DNA片段中脂肪酶基因與一部分兩親性肽基因融合。在兩個擴增的DNA片段用作底物的同時,使用引物pET16-L和Nde-M37-for通過PCR擴增T7啟動子-核糖體結合位點-His標簽-buforin IIb-脂肪酶基因。
實施例1-2-6:編碼paracin I/脂肪酶M37綴合物的基因的構建
構建編碼paracin I/M37脂肪酶融合蛋白的基因。就此而言,首先,使用一對引物pET16-L和pET-R(Par)通過PCR擴增在pET16b中與T7啟動子-核糖體結合位點-His標簽連接的基因片段。單獨地,使用引物M37-rev(Par)和Nde-M37-for對pEML37進行PCR以合成DNA片段,在該DNA片段中脂肪酶基因與一部分兩親性肽基因融合。在兩個擴增的DNA片段用作底物的同時,使用引物pET16-L和Nde-M37-for通過PCR擴增T7啟動子-核糖體結合位點-His標簽-paracin I-脂肪酶基因。
實施例1-2-7:編碼B0/脂肪酶M37綴合物的基因的構建
構建編碼B0/M37脂肪酶融合蛋白的基因。就此而言,首先,使用一對DNA引物pET16-L和pET-R(B0)通過PCR擴增在pET16b中與T7啟動子-核糖體結合位點-His標簽連接的基因片段。單獨地,使用引物M37-rev(B0)和Nde-M37-for對pEML37進行PCR以合成DNA片段,在該DNA片段中脂肪酶基因與一部分兩親性肽基因融合。在兩個擴增的DNA片段用作底物的同時,使用引物pET16-L和Nde-M37-for通過PCR擴增T7啟動子-核糖體結合位點-His標簽-B0脂肪酶基因。
實施例1-2-8:編碼NKC/脂肪酶M37綴合物的基因的構建
構建編碼NKC/M37脂肪酶融合蛋白的基因。就此而言,首先,使用一對引物pET16-L和pET-R(NKC)通過PCR擴增在pET16b中與T7啟動子-核糖體結合位點-His標簽連接的基因片段。單獨地,使用引物M37-rev(NKC)和Nde-M37-for對pEML37進行PCR以合成DNA片段,在該DNA片段中脂肪酶基因與一部分兩親性肽基因融合。在兩個擴增的DNA片段用作底物的同時,使用引物pET16-L和Nde-M37-for通過PCR擴增T7啟動子-核糖體結合位點-His標簽-NKC-脂肪酶基因。
實施例1-2-9:編碼NRC/脂肪酶M37綴合物的基因的構建
構建編碼NRC/M37脂肪酶融合蛋白的基因。為此,使用一對引物pET16-L和pET-R(NRC)通過PCR擴增在pET16b中與T7啟動子-核糖體結合位點-His標簽連接的基因片段。單獨地,使用引物M37-rev(NKC)和Nde-M37-for對pEML37進行PCR以合成DNA片段,在該DNA片段中脂肪酶基因與一部分兩親性肽基因融合。在兩個擴增的DNA片段用作底物的同時,使用引物pET16-L和Nde-M37-for通過PCR擴增T7啟動子-核糖體結合位點-His標簽-NRC-脂肪酶基因。
實施例1-2-10:包含脂肪酶M37的對照基因的構建
擴增不含任何兩親性肽的對照DNA(T7啟動子-核糖體結合位點-His標簽-脂肪酶M37)。為此,使用DNA引物pET16-L和pET-R(NRC)對pET16b進行PCR以合成T7啟動子-核糖體結合位點-His標簽基因片段。單獨地,在引物M37-rev(con)和Nde-M37-for的存在下進行PCR,以pEML37充當底物,擴增包含脂肪酶基因的DNA片段。然后,在兩個擴增的DNA片段用作底物的同時,使用引物pET16-L和Nde-M37-for通過PCR擴增T7啟動子-核糖體結合位點-His標簽-M37脂肪酶基因。
實施例1-3:包含兩親性肽/脂肪酶融合蛋白基因的表達載體的構建
在實施例1-2中構建的T7啟動子-核糖體結合位點-His標簽-肽-脂肪酶綴合物DNA用限制性酶BglII和NdeI消化并克隆進各自的pET16b載體中,所述pET16b載體先前用相同的限制性酶消化(圖2)。圖2是示出用于表達活性增強的脂肪酶的載體的基因結構的示意圖。在該載體中,兩親性肽基因位于條件性啟動子的下游,其與脂肪酶基因的N-末端融合。另外,提供了組氨酸-標簽,在兩親性肽之前,用于蛋白純化,而蛋白酶Xa因子的識別位點插入在組氨酸標簽和肽基因之間,目的是在表達和純化后去除組氨酸標簽。表達后,組氨酸標簽-肽-脂肪酶綴合物使用Ni-柱分離并用酶Xa因子處理以分離期望的兩親性肽-脂肪酶結構。如上所述,所述基因位于條件性啟動子的下游使得因為與兩親性肽融合而具有增強的活性的脂肪酶可以在期望的條件下表達。
將克隆的質粒轉化進大腸桿菌XL1-Blue(Invitrogen)中,然后在含有氨芐青霉素的LB平板上選擇。為了評價質粒是否被正確構建,它們從平板上生長的集落制備并用限制性酶BglII和NdeI消化。將DNA消化產物在瓊脂糖凝膠上泳動以測量其尺寸并進行DNA堿基測序。
結果,將攜帶TliA脂肪酶(對照),paracin I-TliA脂肪酶,buforin IIb-TliA脂肪酶,B0-TliA脂肪酶,M37脂肪酶(對照),paracin I-M37脂肪酶,buforin IIb-M37脂肪酶,B0-M37脂肪酶,NKC-M37脂肪酶,和NRC-M37脂肪酶的重組表達質粒分別命名為pET-TliA,pET-Par-TliA,pET-Buf-TliA,pET-B0-TliA,pET-M37,pET-Par-M37,pET-Buf-M37,pET-B0-M37,pET-NKC-M37和pET-NRC-M37。
實施例2:肽-脂肪酶綴合物的分離和酶活性的測定
實施例2-1:肽-脂肪酶融合蛋白的表達
表達肽-脂肪酶融合蛋白。為此,將之前構建的質粒電穿孔至大腸桿菌BL21(DE3)(Merck biosciences)中,然后將其鋪至平板上。選擇由此生長的單一集落并將其接種至LB肉湯中。在37℃,將細胞培養至在600nm為0.4的光密度。在1mM IPTG(異丙基-1-硫代-β-D-半乳糖吡喃糖苷)的存在下誘導肽-脂肪酶綴合物的表達。誘導后4小時收獲大腸桿菌細胞。通過10%SDS-PAGE檢查感興趣的肽-脂肪酶綴合物的表達。使用Bradford測定法測定蛋白水平。
結果,觀察到肽-脂肪酶融合蛋白在大腸桿菌中作為包涵體表達(圖3)。參照圖3,提供了顯示肽-脂肪酶TliA融合蛋白表達的SDS-PAGE照片,其中尺寸標記在M道泳動,未用IPTG誘導的細胞溶胞產物在1道上,用IPTG誘導的細胞溶胞產物在2道上,用IPTG誘導的細胞溶胞產物的可溶性上清液在3道上,且用IPTG誘導的包涵體在4道上,并且Par代表paracin I,Buf代表buforin IIb。
實施例2-2:肽-脂肪酶融合蛋白的分離
為了分離重組蛋白,將大腸桿菌細胞懸浮在裂解緩沖液(50mM NaH2PO4,300mM NaCl,pH 8.0)中,并通過超聲處理(520秒,0.5周期,50%振幅)破壞。超聲處理后,由此獲得的細胞溶胞產物在4℃以12,000rpm離心20min,將可溶性上清液與包括包涵體的不溶部分分開。將在不溶部分中的肽-脂肪酶融合蛋白溶解于洗滌緩沖液(100mM NaH2PO4,10mM Tris-Cl,8M尿素,pH 6.3)中,然后通過離心去除細胞碎片。此后,將上清液上樣至NTA(Ni2+次氮基三乙酸)瓊脂糖柱(Qiagen,Hilden,Germany)以捕獲肽-脂肪酶融合蛋白并將其與柱分離,然后通過膜透析以去除剩余的雜質。為了去除用于分離融合蛋白的His標簽,將它們用Xa因子(New England Biolab,USA)處理。純化蛋白的確認通過10%SDS-PAGE和N-端氨基酸測序來實現。
實施例2-3:對肽-脂肪酶融合蛋白的脂肪酶活性的測定
實施例2-3-1:使用棕櫚酸對硝基苯酯測量脂肪酶活性
使用棕櫚酸對硝基苯酯通過比色測定法測量脂肪酶活性。10mM棕櫚酸對硝基苯酯在乙腈中的溶液、乙醇和50mM Tris-HCl溶液(pH 8.5)以1:4:95的比率混合。向0.8mL棕櫚酸對硝基苯酯混合物加入0.2mL融合蛋白溶液,接著在45℃溫育10min,然后測量在405nm的吸光度。結果顯示在圖4和6中。圖4是示出根據本發明的與兩親性肽融合的TliA脂肪酶使用棕櫚酸對硝基苯酯通過比色測定法測量的脂解活性的圖,棕櫚酸對硝基苯酯在與脂肪酶反應時顯色。圖6是示出根據本發明的與兩親性肽融合的M37脂肪酶使用棕櫚酸對硝基苯酯通過比色測定法測量的脂解活性的圖。
即使在室溫下,如可從圖4的數據看到的,paracin-TliA融合脂肪酶(Par-lip)表現出與在45℃的最適反應溫度下野生型脂肪酶(對照)相似的酶活性。TliA,當與paracin I或B0融合時,發現與對照相比在45℃的活性增加大約10%。在圖6中理解,B0/M37脂肪酶融合蛋白(B0-M37)、buforin IIb/M37脂肪酶融合蛋白(Buf-M37)、NKC/M37脂肪酶融合蛋白(NKC-M37)、NRC/M37脂肪酶融合蛋白(NRC-M37)和paracin I/M37脂肪酶融合蛋白(Par-M37)與對照相比活性分別增加4.2-,2.7-,6.3-,1.3-和1.2-倍。這些數據表明兩親性肽當與脂肪酶融合時,顯著地增強了脂肪酶的活性。.
實施例2-3-2:使用橄欖油水解測量脂肪酶活性
為了更精確地定量分析,通過滴定由橄欖油的水解釋放的游離脂肪酸來測量脂肪酶活性。通過在Waring搗碎機(Waring blender)中以最大速度在450mL 20mM NaCl,1mM CaCl2,0.5%(w/v)阿拉伯樹膠溶液中乳化5mL橄欖油2min來制備橄欖油乳液。在通過添加10mM NaOH溶液將底物乳液的pH調整至8.0后,向其中加入酶溶液。脂肪酸釋放的速率用pH滴定儀(718Stat Titrino,Metrohm)在50℃測量5min。結果顯示在圖5和7中。圖5是示出根據本發明制備的TliA脂肪酶通過pH-STAT法測量的脂解活性的圖。圖7是示出根據本發明制備的M37脂肪酶通過pH-STAT法測量的脂解活性的圖。
從圖5的數據中很顯然,發現B0-TliA,Par-TliA,Buf-TliA融合蛋白的活性分別是TliA本身的78±11.3,68.5±2.1和35.5±19.1倍大。另外,如圖7中所示,與M37本身相比,B0-M37,Buf-M37,NKC-M37,NRC-M37和Par-M37的活性分別增加2.8-,4.2-,10.2-,4.1-和2.2-倍。
這些數據表明與兩親性肽締合的脂肪酶與單獨脂肪酶相比具有優異的脂解活性。
實施例3:NKC-融合的M37脂肪酶(NKC-M37)對脂類底物的增加的可接近性的測定
M37脂肪酶的活性位點被蓋子螺旋(lid helix)(α3)覆蓋。大多數在M37脂肪酶的蓋子附近存在的疏水殘基(Ile97,Trp100,Leu101和Phe102)被包埋并且分布在活性位點上,提示底物結合可能導致這些殘基暴露并且形成寬的疏水表面。因此,需要一些構象改變以便疏水底物接近M37脂肪酶的活性位點。
將兩親性肽NKC與M37脂肪酶綴合,建立了疏水底物接近脂肪酶活性位點的較好狀態并增加酶和底物之間的親和性。為了在此背景下的進一步評價,構建了與野生型M37或與NKC-融合的M37脂肪酶的GFP雜合體,并且測定了這些脂肪酶在脂類顆粒內的定位(圖8)。熒光顯微鏡檢查證明,與野生型M37脂肪酶相比,NKC-融合的M37脂肪酶更多地定位于脂類顆粒,表明這些兩親性肽必定形成功能復合體。
實施例4:兩親性肽對M37脂肪酶針對甲醇的穩定性的作用的測定
在生物柴油生產的過程中甲醇的作用是溶劑以及酶底物。然而,因為通常的脂肪酶在具有高甲醇濃度的介質中是不穩定的,因此生物柴油生產的產率相當受限制。為了將1摩爾當量的三酰基甘油完全轉變成其相應的甲酯,需要至少3摩爾當量的甲醇。然而,與油相比,通常的脂肪酶在含有超過1摩爾當量(3.3%v/v)甲醇的介質中是失活的。因此,生物柴油生產反應通過多步地添加甲醇以避免脂肪酶失活來進行。
據以前報道,M37脂肪酶即使在高甲醇濃度中也明顯地顯示高穩定性。當采用1步甲醇進料(3摩爾當量)法時,M37脂肪酶導致70%轉化產率,而CalB脂肪酶(南極假絲酵母脂肪酶B)僅能使少量的油轉化為生物柴油。
進行下面的實驗以評價當與兩親性肽締合時M37脂肪酶(其甚至在高甲醇濃度中也是穩定的)的轉化產率是否增加。
測定NKC-融合的M37脂肪酶針對高甲醇濃度的穩定性。為此,測量甲醇處理后剩余的殘留活性以評價酶穩定性。在0%、3.3%、5%和10%甲醇溶液中在4℃和40℃測量CalB脂肪酶、野生型M37脂肪酶和NKC-M37脂肪酶的穩定性12h。
結果,在4℃在3.3%、5%和10%甲醇溶液中野生型M37脂肪酶和NKC-融合的M37脂肪酶保持其活性。當在酯交換反應的實際溫度(40℃)下測量時,在10%甲醇溶液中,NKC-M37脂肪酶對甲醇的穩定性稍稍低于野生型M37脂肪酶,而CalB脂肪酶在40℃在10%甲醇溶液中快速失活(圖9)。因此,NKC-M37脂肪酶與野生型M37脂肪酶一樣在甲醇中十分穩定,表明本發明的綴合物可以有效地生產生物柴油。
實施例5:使用NKC-融合的M37脂肪酶制備生物柴油
如圖7中所示,與野生型M37脂肪酶相比,NKC-M37脂肪酶顯示10-倍高的催化活性,表明兩親性肽諸如NKC通過增加脂肪酶和脂類底物之間的可接近性而高度有效地提高M37脂肪酶的催化活性。在此背景下,使用具有提高的催化活性的NKC-M37脂肪酶進行生物柴油生產反應過程,和橄欖油的酯交換。
對于生物柴油生產,將化學計量摩爾比的油/甲醇置于反應燒瓶中并加熱至反應溫度,并同時攪拌。總體上,與油相比,當脂肪酶經受包含多于1摩爾當量甲醇的混合物時失活。因此,通過以多步方式添加甲醇來進行生物柴油生產反應。然而,如實施例4中所證明,甚至在3摩爾當量甲醇的存在下野生型M37脂肪酶和NKC-M37脂肪酶均是穩定的。
首先,采用3步甲醇進料(1摩爾當量)法。使用氣相色譜和薄層色譜兩者分析生產的生物柴油的量(圖10a)。
薄層色譜分析顯示,發現大多數的橄欖油轉化為生物柴油。圖10顯示對于野生型M37脂肪酶和NKC-M37脂肪酶達到95%轉化所花費的時間。氣相色譜分析證明,使用野生型M37脂肪酶的生物柴油工藝在36小時反應后導致95%的轉化產率。然而,NKC-M37脂肪酶僅需15小時來達到95%的轉化產率(圖10a)。此數據提示根據本發明的兩親性肽-融合的脂肪酶可用于經濟和有效的生產生物柴油。
如前所提到,由于對甲醇的低耐受性,酶法生物柴油生產工藝目前利用3步甲醇進料法。因此,為了生產經濟和可行的生物柴油,做出嘗試以開發可以利用2步甲醇加料法的酶法生物柴油生產工藝。當使用2步甲醇進料(2摩爾當量)法時,根據本發明的具有高度提高的催化活性的NKC-M37脂肪酶在21小時的反應內達到至少90%的轉化率,而野生型M37脂肪酶則需要長達48小時達到相同的轉化率(圖10b),這證明根據本發明的兩親性肽-融合的脂肪酶與野生型脂肪酶相比是非常有效的催化劑。單獨地,在1步甲醇進料法下,發現NKC-M37脂肪酶達到最大轉化率比野生型M37快得多(圖10c)。
另外,生物柴油成本的變化極大地取決于原料的成本。已有報道,原料的成本占生物柴油生產成本的70%以上。較高的生產成本可能引起較少的商業用途。為了使生物柴油成本比石化柴油更有競爭性,低成本原料諸如廢食用油、牛油、豬油和黃牛油正在研究中。然而,廢油中的雜質、游離脂肪酸和高含水量極大地降低了生物柴油的生產產率。以前的報道公開了,M37脂肪酶不受廢油中的游離脂肪酸和水組分影響。當使用NKC-M37脂肪酶來利用廢油時,以與橄欖油和棕櫚油相似的程度生產生物柴油。總之,結果表明本發明的NKC-M37脂肪酶可以用來以極高的效率生產生物柴油。
盡管已經參照前面優選的和可選的實施方式具體地顯示和描述了本發明,但本領域技術人員應當理解在不背離如由下面權利要求所限定的本發明的精神和范圍的前提下,在實施本發明時可以采用對本文所述的本發明的實施方式的各種替代方式。意圖下面的權利要求限定本發明的范圍,并且由此而涵蓋在這些權利要求范圍內的方法和設備以及它們的等同物。本發明的這種描述應當被理解為包括本文所述的要素的所有新的和非顯而易見的組合,并且在本申請或以后的申請中可以對這些要素的任意新的和非顯而易見的組合提出多個權利要求。
- 還沒有人留言評論。精彩留言會獲得點贊!